É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Processo para o Adaptive Laboratório Evolução de microrganismos utilizando um quimiostato
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para obter a evolução adaptativa laboratório de microrganismos em condições usando cultura quemostato. Além disso, é discutida análise genômica da estirpe evoluiu.
Resumo
Natural evolution involves genetic diversity such as environmental change and a selection between small populations. Adaptive laboratory evolution (ALE) refers to the experimental situation in which evolution is observed using living organisms under controlled conditions and stressors; organisms are thereby artificially forced to make evolutionary changes. Microorganisms are subject to a variety of stressors in the environment and are capable of regulating certain stress-inducible proteins to increase their chances of survival. Naturally occurring spontaneous mutations bring about changes in a microorganism's genome that affect its chances of survival. Long-term exposure to chemostat culture provokes an accumulation of spontaneous mutations and renders the most adaptable strain dominant. Compared to the colony transfer and serial transfer methods, chemostat culture entails the highest number of cell divisions and, therefore, the highest number of diverse populations. Although chemostat culture for ALE requires more complicated culture devices, it is less labor intensive once the operation begins. Comparative genomic and transcriptome analyses of the adapted strain provide evolutionary clues as to how the stressors contribute to mutations that overcome the stress. The goal of the current paper is to bring about accelerated evolution of microorganisms under controlled laboratory conditions.
Introdução
Os microrganismos podem sobreviver e se adaptar a diversos ambientes. Sob forte estresse, a adaptação pode ocorrer por meio de aquisição de fenótipos benéficos por mutações genómicas aleatórias e posterior selecção positiva 1-3. Portanto, as células microbianas podem se adaptar mudando metabólica ou redes de regulação para o crescimento ideal, que é chamado de "evolução adaptativa". tendências microbianas importantes recentes, como surtos de superbactérias e a ocorrência de cepas microbianas robustos, estão intimamente relacionadas com adaptativa evolução sob condições estressantes. Em condições de laboratório definidos, somos capazes de estudar os mecanismos de evolução molecular e até mesmo controlar a direção da evolução microbiana para várias aplicações. Ao contrário de organismos multicelulares, organismos unicelulares estão bem adaptados à evolução laboratório adaptativo (ALE), pelas seguintes razões: eles regeneram rapidamente, eles manter grandes populações, e é fácil de criar e manter homambientes ogeneous. Combinado com os recentes avanços em técnicas de sequenciação de ADN e tecnologias de alto rendimento, ALE permite a observação direta de alterações genômicas que levam a mudanças regulatórias sistémicos. dinâmica de mutação e uma diversidade da população também são observáveis. Estratégias de engenharia genética pode ser determinado a partir da análise de estirpes de AEA 4,5.
Cultura em quimiostato é um método usado para obter as células em estado estacionário e aumentar a produtividade em processos de fermentação 6. Adiciona- se meio fresco e caldo de cultura é colhida durante o processo (este último inclui médio e de biomassa). Quimiostato cultura de longo prazo, no entanto, muda a produtividade de estado estacionário da cultura e provoca a acumulação de mutações espontâneas e selecção durante a cultura (Figura 1a). Sob várias pressões de seleção (estressores), o acúmulo de mutações é reforçada. Um aumento gradual de estresse em um longo prazo quimiostato prevê uma selecção contínua de mutações que trabalham contra os factores de stress dadas, tais como temperatura, pH, pressão osmótica, inanição nutriente, oxidação, produtos finais tóxicos, etc. Colony transferência a partir de um meio sólido e de transferência em série de um meio líquido (repetido cultura lote) também permitirá aos investigadores obter microorganismos evoluídos (Figura 1B e 1C). Embora a cultura em quimiostato requer métodos complicados, a piscina de diversidade (número de repetições, e o tamanho da população) é maior do que a obtida por técnicas de transferência em série de transferência de colónia e. A exposição ao estresse estável para células individuais e diminuição da variação no estado celular durante a cultura em quimiostato (estado estacionário) são outros benefícios do ALE em comparação com técnicas baseadas em culturas de diluição. ALE induzida pelo estresse de Escherichia coli submetida a altas condições succinato é introduzido neste artigo.
iles / ftp_upload / 54446 / 54446fig1.jpg "/>
Figura 1: Métodos de laboratório evolução adaptativa (A) quimiostato;. (B) a transferência de série; (C) a transferência de colónia. As figuras de topo ilustrar o conceito dos métodos para ALE, e as figuras de fundo ilustrar o número de células que cresceram durante a ALE. Por favor clique aqui para ver uma versão maior desta figura.
Protocolo
1. Preparação Equipamento
- Obter um frasco quimiostato (150-250 ml) ou num balão de Erlenmeyer (250 ml) contendo uma abertura de entrada e uma porta de saída. Ligue as portas com tubo de silicone que permite taxas de fluxo de 10-100 ml / hr. Opcionalmente, usar um respiradouro de ar, uma porta de saída de ar, e portas de entrada e saída de água de temperatura controlada.
- Obter um dispositivo adequado para o frasco quimiostato que fornece para agitação e controlo da temperatura (ou usar um incubador com agitação rotativa).
- Obter duas bombas peristálticas de modo a fornecer meio fresco e recolher a cultura.
- Obter um frasco reservatório (10-20 L) contendo um orifício de saída médio e uma porta de entrada de ar.
- Obter tubo de silicone adequado para a taxa de diluição (isto é, identificação de 0,8 milímetros, a gama de fluxo 0,06-36 mL / min; L / S 13 tubos).
2. Médio Preparação e Esterilização
- meio inicial
- Dissolve-se 0,3 g de glucose, 0,08 g de NH 4Cl, 0,05 g de NaCl, 0,75 g de Na 2 HPO 4 · 2H 2 O, e 0,3 g de KH 2 PO 4 em 90 ml de água destilada (DW) em um frasco de quimiostato.
- Selar o frasco quemostato junto com a tubulação usando grampos. Não selar a abertura de ar.
- Esteriliza-se o frasco quimiostato numa autoclave a 121 ° C durante 15 min. Após a esterilização, armazenar o frasco quimiostato à temperatura ambiente.
- Dissolve-se 0,02 g de MgSO 4 · 7H 2 O, 0,01 g de CaCl2, e 0,1 mg de tiamina em 10 ml de DW (solução A).
- Filtrar a solução A, utilizando uma seringa e um filtro de seringa pré-esterilizados (um filtro de 0,45 um de poro).
- Adicionar a solução A filtrados para o frasco quemostato.
- Média Tensão
- Dissolve-se 30 g de glucose, 8 g de NH 4 Cl, 5 g de NaCl, 75 g de Na 2 HPO 4 · 2H 2 O, 30 g de KH 2 PO 4, e 300 g de succinato dissódico hexa-hidratado (Na 2 · · succinato 6H 2 O; o estressor utilizado neste experimento) em 9,9 L DW em um frasco reservatório.
- Selar o frasco reservatório junto com a tubulação usando grampos. Não selar a abertura de ar.
- Esteriliza-se o frasco reservatório em autoclave a 121 ° C durante 15 min. Após a esterilização, armazenar o frasco à temperatura ambiente.
- Dissolve-se 2 g de MgSO 4 7H 2 O ·, 1 g de CaCl2, e 10 mg de tiamina em 100 ml de DW (solução A).
- Filtrar a solução A com uma seringa e um filtro de seringa pré-esterilizados (um filtro de 0,45 um de poro).
- Adicionar a solução A filtrados para o frasco reservatório.
- Assepticamente conectar o tubo de silicone esterilizados para o frasco reservatório e anexar as bombas peristálticas.
- Médio-Alto estresse
- Prepare o meio como na secção 2.2, mas com uma maior concentração de estressor (ou seja, 3-5 g / L maior na adaptação succinato).
Nota: Este protocolo é para adaptação a um estresse thno pode ser entregue através do meio. No caso de factores de stress físicos, tais como a temperatura, agitação, ou iluminação, o cultivo deve ser concebido em conformidade.
- Prepare o meio como na secção 2.2, mas com uma maior concentração de estressor (ou seja, 3-5 g / L maior na adaptação succinato).
3. cultivo inicial
- Inocular uma única colônia de tipo selvagem E. coli em um tubo de ensaio de 15 mL contendo 4 mL de meio inicial.
- Incubar o tubo de ensaio num incubador com agitação durante 12 h a 37 ° C e 220 rpm.
- Transfira assepticamente 1 ml de pré-cultura para o frasco quemostato.
- Incubar o frasco quimiostato, fornecendo para arejamento (ar de 50 ml / min) e agitação (200 rpm), a 37 ° C durante 6 h.
Adaptação 4. Estresse
- Assepticamente ligue a extremidade do tubo de silicone das bombas para o frasco quemostato.
- Inicie a bomba de saída (10 ml / h ou superior) e recolher a cultura.
Nota: A cultura deve estar na fase exponencial, tipicamente 4-8 horas após o cultivo inicial. - CHeck a densidade óptica (600 nm) da cultura a partir do tubo de saída.
- Iniciar a bomba de entrada (10 ml / h, correspondendo a uma taxa de diluição de 0,1 hr -1).
- Verifique a densidade óptica da cultura a 600 nm da tomada da tubagem a cada 24 h.
- Operar o quimiostato durante 96 horas (volume 9,6 vezes) ou mais. Se a densidade óptica é estável, trocar o reservatório que contém o meio de alta tensão. Se a densidade óptica é inferior a 0,2, parar a bomba de entrada alimenta durante 6 h. Reinicie a bomba de entrada e verifique se a densidade óptica é superior a 0,2.
- Aumentar gradualmente a concentração do estressor alterando a um reservatório que contém uma concentração mais elevada estressor.
- Retirar amostras da cultura adaptada quando ela atinge um marco (por exemplo, uma estirpe adaptada a 100 g / L de stress succinato), e armazenamento para posterior análise genómica.
- Para o armazenamento da amostra, misturar a amostra de cultura (0,5 ml) com um soluti esterilizado glicerol 80%na (0,5 ml) e armazená-lo a -80 ° C.
Nota: Se o microorganismo adquire a capacidade de degradar o estressor durante o processo de ALE, a concentração estressor no frasco de fermentação não é a mesma que no reservatório fresco.
5.-colônia Único isolamento da estirpe adaptada-Stress
- Preparar o meio da placa de agar (1,6% de agar) contendo a mesma estressor e na mesma concentração do meio.
- Placa da cultura de saída (0,1 ml) a partir do quimiostato, e incuba-se a 37 ° C durante 16 horas.
- Escolha colónias isoladas da placa utilizando um palito esterilizado e inocular-los em 15 ml de tubos de ensaio que contêm o mesmo estressor e na mesma concentração forma como no quimiostato, e incuba-se durante 6 h.
- Transferir 1 ml do caldo de cultura num balão de Erlenmeyer de 250 mL contendo 50 mL de meio. Colheita de 0,5 ml do caldo de cultura a cada um de RH, e medir a DO a 600 nm. Compare a taxa de crescimento do strai adaptadaN ao da estirpe de tipo selvagem dado o estressor.
Resultados
Para adaptação ao estresse de alta succinato, o tipo selvagem E. coli W3110 estirpe foi cultivada num quimiostato em D = 0,1 h -1 durante 270 dias (Figura 2).
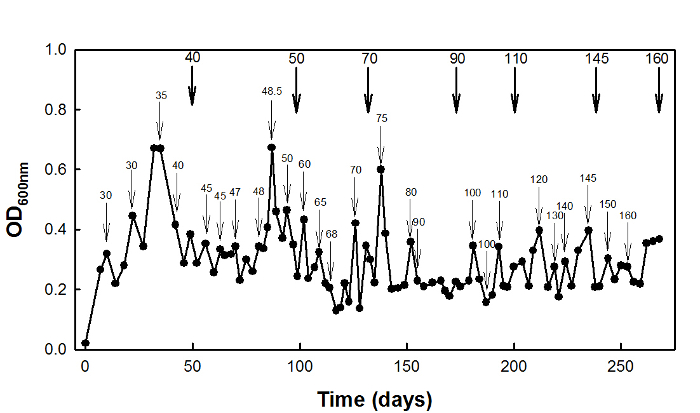
Figura 2: adaptação ao estresse de alta succinato de E. coli W3110 usando cultura quemostato. setas finas indicam os tempos em que a concentração de estressor foi ...
Discussão
Os microrganismos são capazes de se adaptar a quase todos os ambientes, devido à sua rápida taxa de crescimento e diversidade genética. evolução laboratório adaptável permite microorganismos a evoluir em condições destinadas, que fornece uma maneira de selecionar organismos individuais que abrigam mutações espontâneas que são benéficos nas condições dadas.
A técnica quimiostato é mais robusto para a realização evolução de forma artificial do que as técnicas de transfe...
Divulgações
The authors have nothing to disclose.
Agradecimentos
This study was financially supported by the Korean Ministry of Science, ICT and Future Planning (Intelligent Synthetic Biology Center program 2012M3A6A8054887). P. Kim was supported by a fellowship from the Catholic University of Korea (2015).
Materiais
| Name | Company | Catalog Number | Comments |
| Mini-chemostat fermentor | Biotron Inc. | - | manufactured by special order |
| silicon tubing | Cole-Parmer | Masterflex L/S 13 | tubing size can be varied depending on the dilution rate and the size of fermentor jar. |
| reservoir jar | Bellco | Media storage bottle | 20 L |
| chemicals | Sigma-Aldrich | - | reagent grade |
| glucose | Sigma-Aldrich | G5767 | ACS reagent |
| NH4Cl | Sigma-Aldrich | A9434 | for molecular biology, suitable for cell culture, ≥99.5% |
| NaCl | Sigma-Aldrich | 746398 | ACS reagent, ≥99% |
| Na2HPO4·2H2O | Sigma-Aldrich | 4272 | 98.5-101% |
| KH2PO4 | Sigma-Aldrich | 795488 | ACS reagent, ≥99% |
| MgSO4·7H2O | Sigma-Aldrich | 230391 | ACS reagent, ≥98% |
| CaCl2 | Sigma-Aldrich | 793639 | ACS reagent, ≥96% |
| thiamine·HCl | Sigma-Aldrich | T4625 | reagent grade, ≥99% |
| Na2·succinate·6H2O | Sigma-Aldrich | S2378 | ReagentPlus, ≥99% |
Referências
- Rando, O. J., Verstrepen, K. J. Timescales of genetic and epigenetic inheritance. Cell. 128, 655-668 (2007).
- Kim, H. J., et al. Short-term differential adaptation to anaerobic stress via genomic mutations by Escherichia coli strains K-12 and B lacking alcohol dehydrogenase. Front Microbiol. 5, 476 (2014).
- Mendizabal, I., Keller, T. E., Zeng, J., Yi, S. V. Epigenetics and evolution. Integr Comp Biol. 54, 31-42 (2014).
- Lee, J. Y., Seo, J., Kim, E. S., Lee, H. S., Kim, P. Adaptive evolution of Corynebacterium glutamicum resistant to oxidative stress and its global gene expression profiling. Biotechnol Lett. 35, 709-717 (2013).
- Lee, J. Y., et al. Artificial oxidative stress-tolerant Corynebacterium glutamicum. AMB Express. 4, 15 (2014).
- Narang, A. The steady states of microbial growth on mixtures of substitutable substrates in a chemostat. J Theor Biol. 190, 241-261 (1998).
- Kwon, Y. D., Kim, S., Lee, S. Y., Kim, P. Long-term continuous adaptation of Escherichia coli to high succinate stress and transcriptome analysis of the tolerant strain. J Biosci Bioeng. 111, 26-30 (2011).
- Barrick, J. E., Lenski, R. E. Genome dynamics during experimental evolution. Nat Rev Genet. 14, 827-839 (2013).
- Li, H., et al. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25, 2078-2079 (2009).
- McKenna, A., et al. The Genome Analysis Toolkit: a MapReduce framework for analyzing next-generation DNA sequencing data. Genome Res. 20, 1297-1303 (2010).
- Deatherage, D. E., Barrick, J. E. Identification of mutations in laboratory-evolved microbes from next-generation sequencing data using breseq. Methods Mol Biol. 1151, 165-188 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados