Method Article
Manipulação funcional do gene materno produtos Usando
Neste Artigo
Resumo
Um protocolo optimizado para a maturação in vitro de oócitos de peixe-zebra utilizados para a manipulação dos produtos dos genes maternos é aqui apresentada.
Resumo
eventos celulares que ocorrem durante as fases iniciais do desenvolvimento embrionário dos animais são conduzidos por produtos génicos maternos depositados no oócito em desenvolvimento. Por causa destes acontecimentos confiar nos produtos maternos que tipicamente actuam muito rapidamente após a fertilização-que pré-existia no interior do ovo, as abordagens convencionais para a expressão e redução funcional envolvendo a injecção dos reagentes para dentro do ovo fecundado estão normalmente ineficaz. Em vez disso, tais manipulações devem ser executadas durante a oogese, antes ou durante a acumulação dos produtos maternos. Este artigo descreve em pormenor um protocolo para a maturação in vitro de oócitos imaturos de peixe-zebra e a sua subsequente fertilização in vitro, dando origem a embriões viáveis que sobrevivem à idade adulta. Este método permite a manipulação de produtos funcional maternas durante a oogese, tais como a expressão de produtos de salvamento fenotípica e visualização construo com etiquetas, bem como umé a redução da função do gene através de agentes reversa genética.
Introdução
Durante o desenvolvimento dos animais, os produtos do gene de depósitos de matriz (por exemplo, ARNs, proteínas, e outras biomoléculas) para dentro do ovo; estes produtos são importantes para os processos celulares início imediatamente após a fertilização 1, 2. A manipulação da expressão e da função de produtos maternos é normalmente ineficaz quando se usa um método standard para a injecção dos reagentes em ovos fertilizados 3. Isto é porque a maioria dos ARN e proteínas são produzidas pelo oócito durante a oogese, assim que os produtos pré-carregado maternos já estão presentes no óvulo maduro. Tais produtos preexistentes são impermeáveis à knockdown funcional com agentes de direccionamento de genes, tais como os oligos anti-sentido de morfolino (MOS), porque OMs alvo o ARNm, não a proteína pré-existente já presente no ovo no momento da fertilização. Além disso, muitos processos embrionárias precoces acontecer muito em breve após a fertilização de ser influenzaeced por produtos proteicos derivados a partir de ARN injectado para dentro do ovo fertilizado, que o ARN não pode ser produzida suficientemente rápido para influenciar os primeiros eventos de embriogénese. Pela mesma razão, com etiquetas de fusões de proteínas expressas por meio de uma injecção de ARNm no ovo fertilizado não podem ser produzidos em tempo para a visualização durante o seu papel activo no embrião inicial. Injecção em oócitos maduros extrudidas antes da activação do ovo é possível, mas está associada a questões técnicas semelhantes: tais ovos maduros estão já pré-carregado com a proteína materna, e que não se tornará traducionalmente activo (ou seja, produzem a proteína a partir de transcritos exógenos) até depois de ovo ativação. Por estas razões, a manipulação dos produtos dos genes maternos que actuam na embriogénese precoce necessita tipicamente de ser realizado durante a oogese no oócito em maturação.
Como uma abordagem para superar estes obstáculos, em métodos de maturação in vitro, que permitam a maturação de oocytes do estágio IV para a formação do ovo, foram estabelecidos no peixe-zebra. Métodos primeiros permitido maturação in vitro, mas os ovos maduros resultantes não eram competentes para a fertilização 4. Subsequentemente, a manipulação de condições de cultura de neutro a pH 9,0, mimetizando o pH alcalino do fluido do ovário encontrados em espécies de peixes 5, 6, permitido para a fertilização in vitro de confiança (FIV) após a maturação in vitro 7, 8. Com efeito, in vitro oócitos -matured pode produzir embriões viáveis que sobrevivem à idade adulta, e que são férteis 3, 8. Este método melhorado foi ainda adaptado para incluir a manipulação funcional de genes maternos, a expressão de proteínas marcadas durante a oogese peixe-zebra, através da expressão exógena, e MO-funcional mediada derrubar em esteirafase urante IV oócitos 3 (Figura 1).
Oogese Zebrafish exibe um número de etapas características que levam à formação de oócitos maduros 9 (ver Tabela 1 para uma guia rápido para os vários estágios no oogese). Resumidamente, o desenvolvimento do oócito é iniciada por I oócitos no estágio e é preso na fase diplóteno da prófase I da meiose. Estes oócitos sofrer crescimento através de transcrição activa (durante as fases iniciada IA e IB), a formação de alvéolos corticais (também conhecidos como grânulos corticais, iniciada durante a fase II), e vitelogênese (iniciado durante a fase III). crescimento de oócitos é completada durante a fase IV, quando a meiose é retomada I, resultando na desmontagem do núcleo do oócito, referido como vesícula germinal (GV). Subsequentemente, a meiose é preso novamente na metafase II. A conclusão de crescimento de oócitos e paragem meiótica durante a fase IV leva a um estágio maduro por exemplo Vg 9. A remoção da membrana folicular ocorre durante a libertação do oócito para o lúmen do ovário 10 e é essencial para a fertilização e a activação do ovo adequado. Uma vez que os ovos são extrudidas a partir da mãe durante o acasalamento natural, eles tornam-se activados. No peixe-zebra, a exposição a água é suficiente para a activação do ovo completo, independentemente da presença de esperma 11.
Em condições in vitro permite actualmente para a maturação de oócitos de fase precoce IV-que podem ser reconhecidos pelo seu tamanho (690-730 pm), a presença de um grande GV numa posição assimétrica, e uma aparência opaca totalmente devido à acumulação de proteínas da gema (Figura 2B) -para o ovo madura fase V, caracterizado por um GV totalmente desmontada e uma aparência translúcida devido a gema de processamento de proteínas 12 (Figura 2C). Nesta abordagem, os ovários inteiros containing oócitos em diferentes fases de desenvolvimento são removidos das fêmeas. Os oócitos são deixados desenvolver em 17α-20β-di-hidroxi-4-pregnen-3-ona (DHP), uma hormona de indução de maturação eficaz 8. Durante este período, os oócitos de maturação pode ser manipulado através da injecção de expressão (por exemplo, tampado, in vitro -transcribed ARNm) ou agentes inverter-genética (por exemplo, meses). A camada folicular não espontaneamente derramado para o fim do período de maturação, de modo que deve ser removida manualmente. Após defolliculation, fertilização in vitro é conseguido por desencadeamento da activação do ovo através da exposição dos ovos para água (presente na forma embrionária (E3)) 13 e uma solução de esperma. Os zigotos resultantes submetidos a um desenvolvimento embrionário e para permitir a avaliação da capacidade de tratamentos para manipular a função do gene materno e para a visualização e análise de produtos maternos tag ( A Figura 3).
Protocolo
Todos os peixes-zebra foram tratados em estrita conformidade com as boas práticas animal, conforme definido por organismos de carácter nacional e / ou local animal pertinentes, e todo o trabalho animal foi aprovada pela comissão competente (University of Wisconsin-Madison número garantia A3368-01). Os animais foram mantidos sob condições convencionais a 26,5 ° C.
1. Pré-selecção de Mulheres
NOTA: Os oócitos nas fêmeas adultas normalmente abrangem uma gama de fases de desenvolvimento, a partir da fase I a V (Figura 2). Purga as fêmeas de oócitos pré-existentes através de um acasalamento natural bem sucedido aumenta a sincronização de estadiamento oócito, como oócitos recentemente em desenvolvimento aparecem como um grupo 3, 14. Dentro de cerca de 8 dias pós-purga, a maioria dos oócitos estão em fase IV precoce, o que é óptimo para a iniciação da maturação in vitro. Tal sincronização aumenta o rendimento de oócitos that pode passar por todo o processo de maturação in vitro, o que facilita a manipulação experimental. Ver descrições anteriores 13 para mais detalhes sobre a criação de peixes em acasalamentos emparelhados e na composição de água de peixe (aqui, 14 g de sal marinho e 150 g de NaHCO3 por 1000 L de água por osmose inversa, de pH 6,5-8,5 (intervalo preferido: 6,8 -7,5) e uma condutividade de 180-360 pS). Ver Brand et al. 13 para receitas adicionais.
- Oito a dez dias antes da cultura in vitro manipulação, utilizar uma rede de pesca para transferir um único macho e um único peixe fêmea da estirpe desejada para um tanque de acasalamento. Par vários conjuntos. Deixá-los na noite tanque de acasalamento. Permita-lhes para acasalar durante a noite e durante a tarde do dia seguinte.
- Usar uma rede de pesca para separar as fêmeas que produzem ovos durante o acasalamento e colocá-los dentro de um tanque separado. Alimentar estes fêmeas duas vezes por dia com uma mistura de alimentos containing aproximadamente uma quantidade igual de artémia e peixes flocos de alimentos. A quantidade de alimento deve ser suficiente para fornecer cerca de 20 minutos, mas não mais, de tempo de alimentação.
2. Preparação do meio de maturação
NOTA: Preparar meio de maturação no dia da experiência de maturação in vitro, no prazo de 1 h de remoção dos oócitos do sexo feminino (ver secção 3).
- Adicionar 20 mL de meio de Leibovitz L-15 com L-glutamina, pH 7,0, para um tubo cónico de 50 mL em condições estéreis. Trazê-lo para pH 9,0 com NaOH 10 N.
- Adicionar 9 mL de meio L-15 de Leibovitz, de pH 9,0, a 2 50 tubos separados cónicas mL. Etiqueta de um tubo "+ DHP" e o outro "-DHP."
- No tubo de + DHP, adicionar 10 ul de 17α-20β-di-hidroxi-4-pregnen-3-ona (DHP), 490 mL de dH2O, e 500 mL de 10% de albumina de soro bovino (BSA).
- No tubo -DHP, adiciona-se 100 uL de 10 mg / mL de gentamicina, 40081; L de dH2O, e 500 uL de BSA a 10%.
3. Dissecção dos oócitos e Iniciação da Cultura Vitro Em
NOTA: O experimento cultura in vitro é levada a cabo com as fêmeas pré-seleccionado 8-10 dias depois de eles libertam ovos através do acasalamento natural. Use meio de maturação feito no mesmo dia (ver secção 2). Os oócitos maduros apropriadamente se a dissecção é iniciada perto do fim do ciclo diurno de peixe (determinado no laboratório pela iluminação artificial pré-definido na instalação de peixe) 13, possivelmente imitando processos que ocorrem através do acasalamento natural. Isto implica que a maioria das etapas do protocolo deve ser realizada à noite se os peixes estão alojados numa instalação com um ciclo de luz normal (por exemplo, começando passo 3.2 a 6:00 numa instalação com um período de luz 8:00-22:00), embora outros períodos de tempo de trabalho são possíveis com um ciclo de luz adequadamente deslocado no tempo.
- Prepara-se uma solução estoque tricaina 0,2% em dH2O, tamponada a pH 7,0 com 1 M de Tris, pH 9,0, e manter esta solução, a 4 ° C. Isto pode ser preparado com antecedência.
- Iniciar o experimento 0-4 h antes do fim do ciclo de luz diariamente na instalação. Em um copo de 250 ml, adicionar 20 ml de solução de estoque tricaina 0,2%, pH 7,0, a 80 mL de água de peixe e misturar.
- Transferir as fêmeas pré-selecionado para solução tricaina e eutanásia-los por exposição excessiva. Deixar as fêmeas na solução tricaina durante 15 min após a cessação do movimento branquial.
- Usando uma colher, recolher o peixe sacrificados a partir da solução tricaina e lavá-los rapidamente na água de peixe. Coloque o peixe para uma toalha de papel para absorver o excesso de água.
- Utilizar uma lâmina de barbear limpo para decapitar os peixes mortos ao nível da barbatana peitoral. Com uma tesoura de dissecação, fazer uma incisão longitudinal sobre o lado ventral do peixe, que se estende a partir da extremidade anterior à área anal.
- Coloque o peixe em uma placa de Petri sob um microscópio de dissecação com luz incidente. Utilizando um par do fórceps de dissecação, transferir porções de ovário de uma placa de cultura de 35 mm x 10 contendo 4 mL de meio L-15 de Leibovitz + DHP.
NOTA: Os ovários, que contêm oócitos em desenvolvimento, aparece como estruturas opacas e aglomerada dentro da cavidade interna do corpo. - Utilizando uma pinça de dissecação, gentilmente dissociar os ovócitos das massas foliculares. Ordenar as fase inicial IV oócitos (Figura 2B; anteriores à avaria GV, em tamanho próximo do máximo e caracterizado por, um citoplasma opaco escuro e um prontamente aparente GV localizado assimetricamente no interior do oócito). Descartar oócitos em fases anteriores (Figura 2a) e, ovos fase V maduros translúcidos (semelhantes aos da Figura 2C mas presentes nos ovários antes do tratamento DHP).
NOTA: Os oócitos são seleccionados para a maturação precoce na fase IV, a fase mais precoce que resulta em madura, fase V oocytes após condições de cultura in vitro (Figura 2C e D) 3. Porque fase IV oócitos estão a produzir activamente produtos, manipulação nesta fase permite a expressão de produtos exógenos através de injecção de ARN ou para a redução da função do gene através OMs introduzidas. - Usar uma pipeta de Pasteur de vidro para transferir os oitos primeiros fase IV para uma segunda placa de cultura de 35 mm de plástico de 10 x contendo 4 mL de meio L-15 de Leibovitz + DHP. Transferir quantidades mínimas de forma -DHP para o prato que contém a solução + DHP.
4. Microinjeções de ovócitos
NOTA: Isolado fase IV oócitos em maturação in vitro pode ser micro-injectado para introduzir reagentes para a manipulação ou expressão funcional da proteína etiquetada. A micro-injeco de reagentes, tais como ARNm e OMs (ver a secção 4), é tipicamente realizada quando os oócitos estão a sofrer in vitro maturação em meio + DHP, antes de defolliculation. Se desejado, a fim de permitir mais tempo para realizar manipulações anteriores para a maturação do oócito, as injecções podem também ser levada a cabo em meio -DHP, antes da maturação, durante pelo menos 2 h. Eles podem, subsequentemente, ser transferido para meio + DHP.
- Preparar ARNm usando um kit de expressão padrão. Mantê-las a -80 ° C como um estoque / mL 100-500 pg para injecção a uma concentração final de 50-500 pg / mL (200 pg / mL, recomenda) em água ARN-grau. Prepare OMs a uma concentração de 4 ng / mL em água de acordo com as instruções do fabricante. Injectar-los em concentrações finais de 2 ng / ul (ou tal como determinado empiricamente).
NOTA: As injecções são tipicamente levada a cabo em meio + DHP antes defolliculation (ver a nota no ponto 5). - Se a injecção de ARNm, imediatamente antes da injecção, dilui-se o ARNm utilizando ARN de grau água de osmose reversa e 0,2 M de KCl para alcançar uma solução final de 0,1 M de KCl.
- Se a injecção OMs, imediatamente antes da injecção, dilui-se os OMs para a concentração desejada com água de osmose reversa e 0,2 M de KCl para alcançar uma solução final de 0,1 M de KCl.
- Segurar manualmente oócitos com uma pinça fina e injectar cerca de 1 nL de tipo selvagem em oócitos de fase IV, utilizando uma agulha feita com uma pipeta capilar de vidro puxado.
- Preparar as agulhas de vidro, puxando tubos capilares de vidro aquecidas, o carregamento da solução a ser injectada, e quebrando a ponta da agulha com uma pinça, como anteriormente descrito em protocolos padrão para injecção em embriões de peixe-zebra primeiros 15.
NOTA: É útil se a agulha tem um afilamento gradual ao invés de uma abrupta um; isto permite maior flexibilidade em termos da localização da interrupção na ponta da agulha e também ajuda a evitar danos para o embrião injectado. Usando a mesma agulha e solução como para as injecções de embrião, ajustar o volume injectado por pré-determinar oajustes de pressão de microinjector que produzem o volume desejado. Estas configurações podem ser determinadas por mock-injectar uma gota de óleo mineral sobre uma lâmina de microscópio de fase de calibração (0,01 mm) e ajustando as configurações microinjector para obter o diâmetro desejado no bolus de solução injectada, tal como foi previamente descrito 15.
- Preparar as agulhas de vidro, puxando tubos capilares de vidro aquecidas, o carregamento da solução a ser injectada, e quebrando a ponta da agulha com uma pinça, como anteriormente descrito em protocolos padrão para injecção em embriões de peixe-zebra primeiros 15.
5. maturação de oócitos e Defolliculation
NOTA: Durante a maturação do oócito, os oócitos se tornará progressivamente translúcido, que permite a avaliação das condições de cultura de sucesso.
- Continuar a incubação a imaturo (e, se apropriado, injectadas) oócitos em meio + DHP a 26,5 ° C, verificando periodicamente (cada 30 minutos) para assegurar que os oócitos permanecem intactos e são submetidos a maturação adequada, tornando-se progressivamente translúcido (ver Figura 2C) .
- Remova todos os oócitos lise com uma pipeta Pasteur e descartá-lasem um copo de resíduos de laboratório para manter a qualidade do meio. Trocar o meio de cultura com cerca de uma metade do volume de meio fresco + DHP para manter uma solução límpida, dependendo da quantidade de lise de oócitos.
- Permitir que a maturação in vitro para prosseguir até que a maioria dos oócitos se tornar translúcida e tem uma GV que não é mais aparente (cerca de 2 h de tratamento DHP, ver Figura 2C, em comparação com D). Visualizá-los sob um microscópio de dissecação com óptica de luz transmitida.
- Remover a membrana folicular mais exterior de cada um dos oócitos maturados. Use uma pinça extra-finas para fazer um rasgo na membrana folicular em uma região com maior espaço entre o oócito e da membrana. Descolar uma parte da membrana e rolar o oócito para fora da membrana, mantendo-se a parte descascada.
NOTA: A membrana coriónica subjacente vai tipicamente permanecem em estreita associação com o ovo durante este processo; após ato de ovoivation, expande-se para formar uma camada protectora para o embrião. - Transferir os oócitos desfoliculados num volume mimo de meio (tipicamente, transferir cerca de 5-10 oócitos maduros em menos de 20 uL) para uma placa de Petri com algumas gotas de meio de cultura (+ DHP) e proceder à fertilização.
6. Fertilização in vitro cultivadas Oócitos
NOTA: A solução de esperma em gelo, preparado a seguir, irá manter a sua potência durante cerca de 2 h.
- Prepara-se uma solução de esperma, perto do final do passo de maturação de oócitos e antes da defolliculation usando testículos de cinco machos em 500 uL de solução de Hanks, como descrito anteriormente 16, 17.
- Adicionar 10-50 mL de solução de esperma aos oócitos desfoliculados em meio de cultura + DHP. Esperar 10 s.
- Usando uma pipeta, adicionar algumas gotas de médio embrionário (E3) para os oócitos. Esperar um minuto e, em seguida, inundar o plcomeu com meio E3.
NOTA: A composição do meio de E3 é como se segue: NaCl a 5 mM, KCl 0,17 mM, 0,33 mM CaCl2, 0,33 mM MgSO4, e 1-5% de azul de metileno 13. - Repita os passos 5.3, 6.2 e 6.3 para obter um maior número de embriões fertilizados.
- Permitir que os embriões fertilizados para se desenvolver. Usar um microscópio de dissecação com ópticas de luz transmitidos para observar a progressão através dos estágios iniciais de clivagem para garantir a fertilização bem sucedida, tal como anteriormente descrito para a fertilização 17 e estadiamento 18.
Resultados
Para determinar se o procedimento acima descrito é bem sucedido, os embriões podem ser observados durante os estágios iniciais de clivagem para confirmar a aparência do padrão de clivagem antecipada-embrionário estereotipada 18, bem como às 24 horas pós-fertilização (HPF) para confirmar o desenvolvimento adequado do plano corpo básico. Este procedimento permite a manipulação de produtos maternas para estudos funcionais através da injecção de reagentes, tais como ARNm e OMs, durante o desenvolvimento dos oócitos.
Manipulação de produtos maternos para estudos funcionais:
codificação de mRNA para o tipo selvagem e mutados produtos podem ser injectadas em oócitos in vitro de maturação para testar o efeito da manipulação da função do gene materna durante a meiose e os primeiros estádios embrionários. Por exemplo, os embriões de tipo selvagem podem ser injectados com wiARNm-tipo ld para testar o efeito de sobre-express do produto, ou com ARN mutante para testar potenciais (por exemplo, o ganho-de-função e antimorphic) efeitos dominante nestes processos. Os oócitos em cultura in vitro, são capazes de produzir a proteína a partir de ARNm exógeno durante todo o desenvolvimento dos oócitos, tal como mostrado pela express de GFP a partir do ARNm injectado, apesar de apenas os oócitos que iniciam condições de cultura na fase IV da oogese pode desenvolver em oócitos de fase V maduros (Figura 2B -2D, ver também Nair et al. 3). A expressão do tipo selvagem produto através de ARNm injectado também é instrumental para o salvamento de mutações de efeito materno para confirmar a identidade do gene durante a clonagem posicional 3, 24. Neste caso, o ARNm de tipo selvagem é injectado em oócitos de fêmeas homozigóticos mutantes para testar se os produtos de tipo selvagem pode resgatar o fenótipo mutante. Este salvamento genética é ilustrada em Figura 3A-3C, onde injectado ARNm AurB é mostrado para resgatar os efeitos fenotípicos de uma mutação no seu gene correspondente, ilha celular (CEI) (Figura 3A-3C). Os embriões a partir de um grupo de controlo também são deixados desenvolver para exibir o fenótipo mutante correspondente 3. ARN mutante pode também ser injectado em oócitos mutantes para testar se o produto mutada mantém função parcial através da comparação da medida de salvamento ao causado pelo produto de tipo selvagem.
A expressão proteica a partir de ARNm injectado em oócitos em desenvolvimento parece ocorrer com pouco ou nenhum atraso. Expressão da GFP forte é observado dentro de 2 horas da injecção do ARNm correspondente, independentemente do estádio de desenvolvimento do oócito 3 (Figura 2B-2D; ver também Nair et al. 3). Produtos como mCherry:SAS6 e Birc5b (heterogéneo): GFP pode ser observado imediatamente após a fertilização e durante o primeiro ciclo celular embrionário 3, 25. A injecção de mRNA durante a oogese, também conduz à produção de proteína que, independentemente da porção com a etiqueta fundida, é funcional imediatamente após a fertilização, tal como mostrado no caso de produtos maternas para celular ilha / aurB 3, ciclo fútil / LRMP 24, e heterogéneo / bir5b 25. Tradução de bloqueio OMs também ter um efeito imediatamente após a fertilização, como mostrado para o ciclo fútil / LRMP 3 e em fases posteriores do desenvolvimento embrionário, como no caso de missão impossível / dhx16 3. Splice-bloqueio OMs, quando injectados em oócitos de maturação, não pode ter um efeito sobre a função materna, provavelmente devido à já presentes transcritos maternos em oócitos maduros fase IV 3.
Geração de morphants:
Quando se utiliza um MO correspondente a um gene com uma mutao já identificado, o fenótipo morphant é esperado para imitar o fenótipo mutante. Morphants são comparados com embriões não injectados e para aqueles injectados com um padrão, controlar MO. A injecção de um morfolino-tradução de bloqueio pode com sucesso fenocópia o fenótipo mutante conhecido 3, como mostrado pela injecção de LRMP MO em oócitos, que imita o fenipo mutante da mutação correspondente, ciclo fútil (Figura 3D-F). A especificidade de OMs pode ser determinada através das mesmas abordagens utilizadas quando se injecta OMs em embriões (revisto anteriormente) 19, 20.
Expressão de proteínas de fusão marcadas fluorescentemente:
ARNm codificando para produtos génicos de interesse fundida com proteínas fluorescentes (por exemplo, GFP e mCherry) também pode ser injectado, quer de tipo selvagem ou oócitos mutantes para visualizar os produtos correspondentes dentro do embrião inicial (isto é, o que reflecte um padrão de localização subcelular; Figura 3G e 3H). mRNAs que codificam para as fusões semelhantes mas envolvendo o alelo mutante pode ser expresso de modo semelhante para testar se a mutação afecta quaisquer localizações subcelulares potenciais.
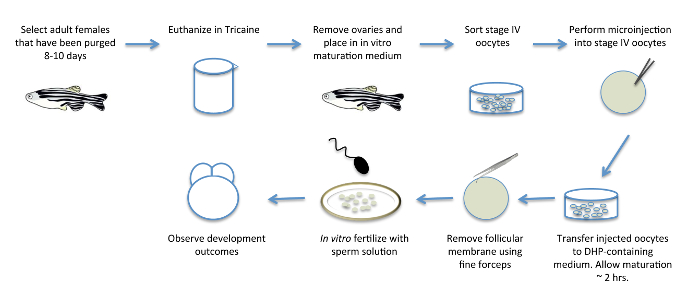
Figura 1: In vitro a maturação do oócito. Diagrama esquemático, mostrando os vários passos envolvidos na maturação in vitro de oócitos. As fêmeas adultas são pré-selecionados para postura de ovos 8 dias antes do procedimento, para eliminá-los de ovos que já amadureceram e para promote novo desenvolvimento do oócito. Os ovários, contendo oócitos em desenvolvimento, são removidas a partir de fêmeas e transferidos para um meio contendo a DHP hormonal para induzir a maturação do oócito in vitro. Após remoção a partir de fêmeas e imediatamente antes ou durante a maturação do oócito, os oócitos podem ser injectados com produtos de ARN e os outros reagentes para a manipulação funcional de factores maternos. Oócitos maduros são desfoliculados manualmente e fertilizados in vitro com uma solução de esperma para produzir fertilizados, embriões viáveis. Por favor clique aqui para ver uma versão maior desta figura.
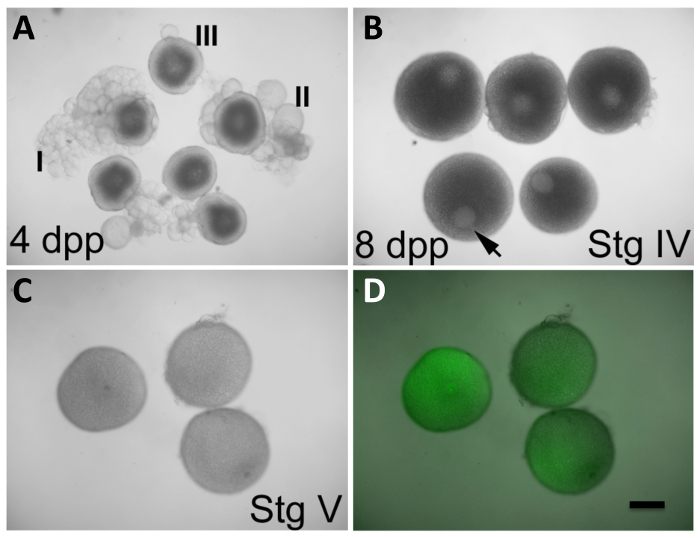
Figura 2: In Vitro maturação de oócitos e expressão de produtos a partir de ARNm injectado. (A) oócitos nos estádios I-III, observados em ováriosfêmeas 4 dias pós-purga (DPP). (B) oócitos no estádio IV, observado nos ovários das fêmeas 8 dpp. A vesícula germinal (GV, seta) é claramente visível e ocupa uma posição excêntrica. Os oitos de fase III em (a) exibem também um GV prontamente aparente, mas encontra-se centrado no oócito. Fase IV oócitos em (B) têm um tamanho que é quase máxima em comparação com a de oócitos maduros em (C). (C e D) oócitos no estádio V (amadurecer oócitos) depois de 2 h in vitro em condições de maturação iniciados na fase IV, tal como em (B), e injectados durante a maturação com GFP que codifica, transcrito in vitro, de ARNm (C, luz visível única; D, sobreposição de luz visível e fluorescência da GFP). O GV não é mais aparente em oócitos V etapa, que também são menos opaca do que os oócitos fase IV. Oócitos injectados expressar a proteína GFP (D). Defolliculation de oócitos maduros fase IV é described na secção protocolo. Barra de escala = 300 pm. Todos os painéis foram reproduzidas, com permissão, de Nair et al 3. Por favor clique aqui para ver uma versão maior desta figura.
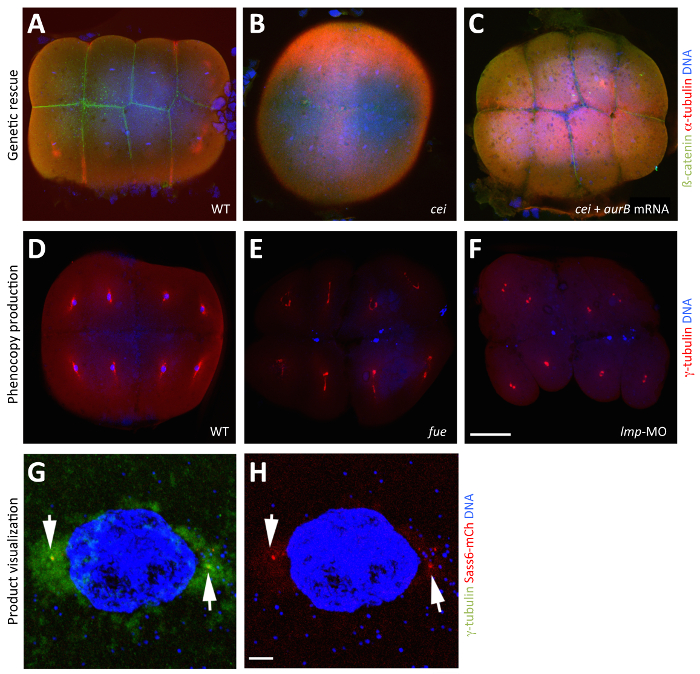
Figura 3: Manipulação e visualização de produtos maternos através In Vitro a maturação do oócito. (A - C) salvamento do fenótipo-efeito materno causada por uma mutação na ilha celular / Aurora B através da injecção de ARNm de tipo selvagem aurB em fase IV CEI oócitos / aurB. imagens fundidas que mostram vistas em animais de 65 blastodiscs fixos MPF, visualizadas com anticorpos anti-beta-catenina para destacar as membranas (verde), anticorpos anti-alfa tubulina para indicar microtúbulos (vermelho), e DAPI para designar ADN (azul). (A) acumulação β-catenina em embriões de tipo selvagem, indicativo de maturação sulco normal. (B) Um cei / aurB embrião a partir de um óvulo não injectados fase IV cei / aurB mostra, sulcos parciais rudimentares que não se acumulam β-catenina. (C) Um cei resgatado / aurB embrião a partir de um CEI / oócito injectado com aurB de tipo selvagem aurB ARNm que mostra a acumulação de β-catenina robusto aos sulcos. (D - F) fenocópia do efeito materno causada por uma mutação no ciclo fútil / LRMP a partir da injecção de LRMP morfolino em fase IV oócitos. imagens fundidas que mostram vistas em animais de 70 blastodiscs fixos MPF, visualizadas com anticorpos anti-tubulina-y para indicar centrossomas (vermelho) e DAPI para designar ADN (azul). (D) Em embriões de tipo selvagem, cada um dos núcleos associados com γ-tubulina, um marcador para o material centrosomal. (E) Na mutantes fue-efeito materno, fusão pronuclear falhar, resultando em duas a três porções de etiquetas de ADN correspondentes a não fundidas pró-núcleos parentais e o corpo polar para a meiose II. (F) Em morphants LRMP, onde função LRMP materno é inibida, os núcleos de forma semelhante não conseguem dividir-se e, além disso, não associam com γ-tubulina. (G e H) Visualização de produto maternalmente produzido no embrião inicial. proteína Sass6-mCherry a partir de ARNm exógeno injectado na fase IV oócitos localiza no centrioles. imagens fundidas que mostram vistas em animais de 40 blastodiscs fixos MPF, visualizadas com anticorpos anti-tubulina-y para destacar centrossomas (verde), mCherry fluorescência para indicar Sass6 (vermelho), e DAPI para designar ADN (azul). (L), expressa a proteína Sass6-mCherry localiza a focos marcada pelo marcador centrossoma γ-tubulina nos locais que ladeiam o núcleo (setas). (H ) A mesma imagem, mostrando apenas Sass6-mCherry e DAPI para maior clareza. Os embriões em (G e H) são fixos, mas a fluorescência de produtos expressos, tais como fusões mCherry, também pode ser observado em embriões vivos (não mostrado). Barra de escala = 100 pm em AF e 10? M em G e H. Todos os painéis foram reproduzidas, com permissão, de Nair et al 3. Por favor clique aqui para ver uma versão maior desta figura.
| Estágios de Oogenesis | Diâmetro do oócito (m) | Marco chave (s) |
| 1A - Prefollicle | 7-20 | Iniciação da transcrição activo, acumulação de nucléolos |
| 1B - Folículo | 20-140 | Descondensação de cromossomas |
| II - alvéolo Cortical | 140-340 | produção alvéolos cortical |
| III - Vitelogênese | 340-690 | Escurecimento da ooplasma por acumulação de gema de proteína precursora e lípidos |
| IV cedo - maturação do oócito | 690-730 (faixa inferior) | localização assimétrica de vesícula germinal |
| IV cedo - maturação do oócito | 690-730 (faixa superior) | vesícula Germinal desaparece, parada na metáfase II |
| V - oócito maduro | ~ 750 | Ooplasma / gema torna-se translúcido |
Tabela 1: Marcos de Desenvolvimento de oócitos em Zebrapeixe.
Discussão
O protocolo anterior é para a manipulação dos produtos dos genes antes da fertilização, permitindo, assim, para o estudo dos produtos dos genes maternais no embrião do peixe-zebra. Estudos anteriores têm sido capazes de amadurecer oócitos in vitro 4; este protocolo foi modificado para permitir a subsequente fertilização in vitro oócitos maturados 8. Isto por sua vez permite para a injecção dos reagentes para manipulação funcional e visualização dos produtos herdados maternalmente no embrião inicial 3. Os embriões resultantes da presente método pode ser viável e pode sobreviver a tornar-se adultos férteis. Em experiências preliminares, cerca de metade dos embriões fertilizados derivados deste procedimento foram viáveis no dia 5 de desenvolvimento, tal como avaliado por inflação bexiga natatória nessa fase, cerca de metade dos quais se tornou, adultos férteis (observações não publicadas) saudáveis.
Há um númeroetapas de críticos a serem considerados no protocolo. Os oócitos no estádio apropriado para iniciar a maturação (início do estágio IV) pode ser enriquecida se a fêmea foi acoplado recentemente, mas não antes de 8 dpp. Usando peixe que não acasalaram recentemente pode resultar em degenerando ovos 14, que não serão submetidos a maturação. As fêmeas acasaladas dentro de menos do que 8 dias terá uma maioria dos ovos em fase III ou menos, e, assim, os ovos não irá amadurecer adequadamente in vitro. Ovários nas fêmeas que acasalaram 8 dias antes terão uma fracção óptima de oócitos no estádio IV precoce. Estes podem ser reconhecidos pela sua opacidade e a presença de GV em uma posição excêntrica (Figura 2B). Determinação fase oócito também pode ser auxiliada pela medição de tamanho, com os oócitos colocadas sobre uma lâmina de micrómetro formou sob um microscópio e em comparação com as orientações de paragem padrão (Tabela 1). No entanto, na fase inicial IV oócitos tem tamanho quase máxima em comparação a amadureceroócitos (reconhecidas pela sua relativa transparência e falta de uma GV; Figura 2C) e são facilmente reconhecidos, como descrito acima, o qual geralmente evita a necessidade de uma medição do tamanho dos oócitos directa.
Em maturação in vitro tem de começar dentro de várias horas após o final do ciclo de luz do dia em que os doadores de oócitos fêmeas são aclimatados. Oócitos não irá amadurecer adequadamente, que se reflecte em taxas de fertilização pobres, se cultivadas durante o período da manhã do ciclo de luz. A razão para a dependência circadiano do método in vitro a maturação do oócito não é compreendido, mas provavelmente reflecte polarizações circadianos subjacentes na maturação in vivo envolvendo ovo ciclismo expressão do gene durante a oogese 21. Uma causa comum para oócitos falhando a sofrer maturação in vitro bem sucedida, apesar de estadiamento oócito adequada é que a DHP expirou. hormonal DHP geralmente expira após um ano, e para segurar o efeitomaturação ive, o lote de trabalho deve ser substituído dentro de 9 meses de uso.
A injecção de oócitos é um passo crítico quando o objectivo do método é a manipulação de produtos funcional maternos. Este procedimento tem exigências diferentes daqueles para injecções padrão no ovo fertilizado em 0-30 mpf. Um factor essencial para a injecção de oócitos, é a necessidade de realizar as injecções sob condições que não conduzem à activação prematura de ovo, tais como em meio L-15 de Leibovitz 22, 23. Porque eles são incorporados em ovários, oócitos de maturação também desafios especiais para injecção. O protocolo acima sugere primeiro dissociando oócitos de ovários e, em seguida, segurando cada dissociado oócito separadamente com fórceps enquanto a injecção. Esta técnica tem funcionado bem e permite oócitos pré-classificação na fase apropriada com manipulação mínima. Métodos alternativos também podem ser usados, taiscomo: i) colocação de oócitos para injecção padrão de agarose calhas 15, em que as paredes verticais do suporte de calha do oócito durante a injecção (neste método alternativo, os oócitos necessitam de ser transferidos para placas de injecção enquanto mantido in vitro meio de maturação) e ii ) permitindo que os oócitos de permanecer ligado à massa do ovário, que pode ser realizada com uma pinça durante a injecção para evitar o contacto com o oócito injectado (nesta abordagem, os oócitos deverão ser dissociados após a injecção para ambas facilitar a exposição DHP e para permitir a sua defolliculation ,-se essencial para a fertilização in vitro). Apesar de este desafio específico, os oócitos estágio IV pode ser facilmente penetrada com uma agulha de injecção, provavelmente porque a membrana coriónica, nesta fase, não está totalmente desenvolvida 9.
Uma limitação do protocolo maturação actual é que, em condições de maturação in vitro de oócitos que promovem o desenvolvimento adequadonão pode ser criado quando a maturação dos oócitos é iniciada em fases anteriores de estádio IV. Oócitos tornar competentes para responder aos DHP por sofrer maturação quando atingem um diâmetro de 520 mm, que ocorre durante a fase III (vitelogênese, correspondente à gama de 340-a-690 mícrons) 9. No entanto, a cultura de fase III oócitos resultados em oócitos que não são competentes para a fertilização três. Apenas oócitos in vitro cuja cultura é iniciada a fase IV (Figura 2B) pode desenvolver-se, oócitos maduros fase V (Figura 2C e D). Isso pode estar relacionado ao fato de que a fase III é essencial para vitelogênese e oócito crescimento de 9. Assim, o procedimento in vitro, a maturação do oócito apresentada neste artigo deve ser utilizado apenas com uma população de partida da fase IV oócitos (B), e não com oócitos em fases anteriores (estágios I - III; e Figur 2A). Pela mesma razão, este processo é limitado a genes que são expressos na fase IV ou mais tarde. A manipulação funcional de genes cujos produtos são expressos anteriormente, pode em vez disso tem que confiar em métodos genéticos (ver abaixo). Melhorias nos métodos de cultura in vitro de maturação podem no futuro permitir a iniciação da cultura de oócitos em fases anteriores, expandindo assim a potência do vitro abordagem maturação in.
Uma outra limitação no método apresentado é que defolliculation, que é essencial para os passos subsequentes que envolvem a fertilização, é actualmente um passo limitante da velocidade no processo. A membrana folicular é uma camada transparente em torno do oócito em desenvolvimento, e a remoção pode ser tediosa. Se esta membrana não é completamente removido, o ovo não será totalmente activado e fertilizados. Isto é evidenciado pela falha do córion para expandir e o desenvolvimento de forma irregular colocado, sulco-like structures (pseudocleavages), característicos de embriões fertilizados 11. Métodos defolliculation enzimáticas tais como colagenase, como usado no Xenopus, têm sido tentadas. No entanto, em nossas mãos, esta técnica não foi bem sucedida, e que, portanto, dependem de defolliculation manual. Porque defolliculation manual é e demorado de trabalho intensivo, é difícil a obtenção de grandes lotes de ovos fertilizados in vitro após a maturação do oócito. Devido à limitação imposta pela defolliculation manual, nós atualmente fertilizar alguns ovos desfoliculados, maduros de cada vez, em pequenos lotes de 5-10 ovos. A incorporação de defolliculation enzimática com este procedimento seria provável aumentar significativamente o seu rendimento e facilidade de utilização global.
Embora embriões produzidos após a fertilização in vitro de oócitos -matured adultos podem tornar-se viáveis, nota-se que após a fertilização in vitro, uma fracção de embriões fazer não dividir normalmente ou em tempo hábil. Estamos actualmente a seleco de linhas cuja propagação inclui rodadas de maturação in vitro de oócitos, o que pode resultar em padrões mais consistentes de desenvolvimento em embriões derivados por meio deste método.
O procedimento tem permitido para o salvamento clara ou visualização de localização de proteínas para um número de mutações 24, 25. No entanto, para alguns genes, a regulação da expressão do produto pode ser crucial, de modo que os produtos expressos por ARNm injectado pode levar a resultados variáveis 26. É também importante a ter em consideração todos os controlos (por exemplo, os embriões injectados com reagentes que têm propriedades semelhantes aos que foram utilizados na experiência ainda está previsto que não produzem um efeito, tal como OMs controlo ou ARN que codificam apenas para proteínas inertes, tais como GFP), como a variabilidade subjacente pode levar a conclusões inadequadas.
nt "> Uma abordagem envolve a manipulação in vitro seguido de fertilização é particularmente útil no caso de produtos maternalmente depositados, em que o método padrão de injecção de ARN, OMs, ou proteína para dentro do ovo fertilizado pode não reduzir eficazmente os produtos já acumulados no ovo. outros métodos recentemente desenvolvidos, tais como a geração de CRISPR-mutante, também são eficazes na criação de condições mutantes para os genes maternalmente expressas 26. no entanto, este método requer o crescimento de várias gerações de peixe. a técnica de maturação de oócitos in vitro permite a manipulação funcional rápida para estudar a função de genes expressos maternamente, incluindo o resgate e fenocópia de mutações de efeito materno, bem como a expressão de RNA e proteínas no embrião inicial.Divulgações
Os autores não têm interesses financeiros concorrentes.
Agradecimentos
Gostaríamos de agradecer aos membros do Pelegri laboratório e peixe facilidade quadros, que foram fundamentais para facilitar este projeto. Suporte para este projeto foi fornecido pelo NIH R56 GM065303 e NIH 2 T32 GM007133 a EBP, NIH 5 F31 GM108449-02 e NIH 2 T32 GM007133 para CCE, e NIH RO1 GM065303 para FP
Materiais
| Name | Company | Catalog Number | Comments |
| Zebrafish mating boxes | Aqua Schwarz | SpawningBox1 | |
| NaCl | Sigma | S5886 | |
| KCl | Sigma | P5405 | |
| Na2HPO4 | Sigma | S3264 | |
| KH2PO4 | Sigma | P9791 | |
| CaCl2 | Sigma | C7902 | |
| MgSO2-7H2O | Sigma | 63138 | |
| NaHCO2 | Sigma | S5761 | |
| Tricaine | Western Chemical | Tricaine-D (MS 222) | FDA approved (ANADA 200-226) |
| Tris base | Sigma | 77-86-1 | to prepare 1 M Tris pH 9.0 |
| HCl | Sigma | 920-1 | to prepare 1 M Tris pH 9.0 |
| Fish net (fine mesh) (4 - 5 in) | PennPlax | (ThatFishThatPlace # 212370) | available in ThatFishThatPlace |
| Plastic spoon | available in most standard stores | ||
| Dissecting scissors | Fine Science Tools | 14091-09 | |
| Dissecting forceps | Dumont | SS | available from Fine Science Tools |
| Dissecting stereoscope (with transmitted light source) | Nikon | SMZ645 | or equivalent |
| Reflective light source (LED arms) | Fostec | KL1600 LED | or equivalent |
| Petri plates 10 cm diameter | any maker | ||
| Eppendorf tubes 1.5 mL | any maker | ||
| Ice bucket | any maker | ||
| Narrow spatula | Fisher | 14-374 | |
| Depression glass plate | Corning Inc | 722085 (Fisher cat. No 13-748B) | available from Fisher Scientific |
| Paper towels | any maker | ||
| Kimwipes | Kimberly-Clark | 06-666-11 | available from Fisher Scientific |
| Timer stop watch | any maker | ||
| Wash bottle | Thermo Scientific | 24020500 | available from Fisher Scientific |
| beakers, 250 mL (2) | Corning Inc. | 1000250 | available from Fisher Scientific |
| Leibovitz'z L-15 medium | Thermofisher | 11415064 | |
| NaOH | Sigma | 221465 | for pH'ing |
| BSA | Sigma | A2058 | |
| 17alph-20beta-dihyroxy-4-pregnen-3-one (DHP) | Sigma | P6285 | |
| gentamicin | Sigma | G1272 | |
| Injection Apparatus | Eppendorf | FemtoJet | or equivalent |
| Capillary Tubing for injection needles | FHC | 30-30-1 | or equivalent, Borosil 1.0 mm OD x 0.5 mm ID with fiber, 100 mm |
| Needle puller | Sutter Instruments | Model P-87 | any maker |
| Micropipetor (1 - 20 µL range) with tips | any maker | ||
| Micropipetor (20 - 200 µL range) with tips | any maker | ||
| Micropipetor (100 - 1000 µL range) with tips | any maker | ||
| Conical tubes 15 mL | any maker | ||
| Conical tubes 50 mL | any maker | ||
| plastic pipette 10 mL with bulb | any maker | ||
| plastic pipette 20 mL with bulb | any maker | ||
| Microscope stage Calibration Slide 0.01 mm | AmScope | MR095 | or equivalent |
| Reagents for fish water: | |||
| Instant Ocean Salt | Drs. Foster & Smith | CD-116528 | |
| Sodium bicarbonate (cell culture tested) | Sigma | S5761-1KG | |
| Reagents for E3 medium: | |||
| NaCl | Sigma | S5886-1KG | |
| KCl | Sigma | P5405-500G | |
| CaCl2, dihydrate | Sigma | C7902-500G | |
| MgSO4, heptahydrate | Sigma | 63138-250G | |
| Methylene Blue | Sigma | M9140-25G | |
| Fish Food: | |||
| Frozen brine shrimp | Brine Shrimp Direct | FBSFKG50 | |
| Tetramin Flakes | Drs. Foster & Smith | 16623 |
Referências
- Lindeman, R., Pelegri, F. Vertebrate maternal-effect genes: insights into fertilization, early cleavage divisions, and germ cell determinant localization from studies in the zebrafish. Mol Rep Dev. 77 (4), 299-313 (2010).
- Abrams, E. W., Mullins, M. C. Early zebrafish development: it's in the maternal genes. Curr Opin Genet Dev. 19 (4), 396-403 (2009).
- Nair, S., Lindeman, R. E., Pelegri, F. In vitro oocyte culture-based manipulation of zebrafish maternal genes. Dev Dyn. 242 (1), 44-52 (2013).
- Selman, K., Petrino, T. R., Wallace, R. A. Experimental conditions for oocyte maturation in the zebrafish, Brachydanio rerio. J Exp Zool. 269 (6), 538-550 (1994).
- Fauvel, C., Omnes, M. H., Suquet, M., Normant, Y. Reliable assessment of overripening in turbot (Scophtalmus maximus) by a simple pH measurement. Aquaculture. 117 (1-2), 107-113 (1993).
- Lahnsteiner, F., Weismann, T., Patzner, R. A. Composition of the ovarian fluid in 4 salmonid speices: Onchorhynchus mykiss, Salmo trutta flacustris, Salvelinus alpinus and Husho hucho. Reprod Nutr Dev. 35 (5), 465-474 (1995).
- Patiño, R., Bolamba, D., Thomas, P., Kumakura, N. Effects of external pH on hormonally regulated ovarian follicle maturation and ovulation in Atlantic croaker. Gen Comp Endocrinol. 141 (2), 126-134 (2005).
- Seki, S., et al. Development of a reliable in vitro maturation system for zebrafish oocytes. Reproduction. 135 (3), 285-292 (2008).
- Selman, K., Wallace, R. A., Sarka, A., Qi, X. Stages of oocyte development in the zebrafish, Brachydanio rerio. J Morphol. 218 (2), 203-224 (1993).
- Clelland, E., Peng, C. Endocrine/paracrine control of zebrafish ovarian development. Mol Cell Endocrinol. 312 (1-2), 42-52 (2009).
- Kane, D. A., Kimmel, C. B. The zebrafish midblastula transition. Development. 119 (2), 447-456 (1993).
- Kanagaraj, P., et al. Souffle/Spastizin controls secretory vesicle maturation during zebrafish oogenesis. PLoS Genet. 10 (6), e1004449 (2014).
- Brand, M., Granato, M., Nüsslein-Volhard, C., Nüsslein-Volhard, C., Dahm, R. . Keeping and raising zebrafish,Zebrafish - A Practical Approach. , 7-37 (2002).
- Connoly, M. H., Dutkosky, R. M., Heah, T. P., Sayler, G. S., Henry, T. B. Temporal dynamics of oocyte growth and vitellogenin gene expression in zebrafish (Danio rerio). Zebrafish. 11 (2), 107-114 (2014).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. J Vis Exp. (25), e1115 (2009).
- Pelegri, F., Mullins, M. Genetic screens for mutations affecting adult traits and parental-effect genes. Meth Cell Biol. 104, 83-120 (2011).
- Baars, D. L., Takle, K. A., Heier, J., Pelegri, F. Ploidy manipulation of zebrafish embryos with Heat Shock 2 treatment. J Vis Exp. , (2016).
- Kimmel, C., Ballard, W. W., Kimmel, S. R., Ullman, B., Schilling, T. F. Stages of embryonic development in the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Eisen, J. S., Smith, J. C. Controlling morpholino experiments: don't stop making antisense. Development. 135 (10), 1735-1743 (2008).
- Schulte-Merker, S., Stainier, D. Y. R. Out with the old, in with the new: reassessing morpholino knockdowns in light of genome editing technology. Development. 141 (16), 3103-3104 (2014).
- Dekens, M. P. S., Santoriello, C., Vallone, D., Frassi, G., Whitmore, D., Foulkes, N. S. Light regulates the cell cycle in zebrafish. Curr Biol. 13 (23), 2051-2057 (2003).
- Sakai, N., Burgess, S., Hopkins, N. Delayed in vitro fertilization of zebrafish eggs in Hank's saline containing bovine serum albumin. Mol Mar Biotechnol. 6 (2), 84-87 (1997).
- Pelegri, F., Mullins, M. C. Genetic screens for mutations affecting adult traits and parental-effect genes. Meth Cell Biol. 135, (2016).
- Lindeman, R. E., Pelegri, F. Localized products of futile cycle/lrmp promote centrosome-nucleus attachment in the zebrafish zygote. Curr Biol. 22 (10), 843-851 (2012).
- Nair, S., Marlow, F., Abrams, E., Kapp, L., Mullins, M., Pelegri, F. The chromosomal passenger protein Birc5b organizes microfilaments and germ plasm in the zebrafish embryo. PLoS Genetics. 9 (4), e1003448 (2013).
- Eno, C., Solanki, B., Pelegri, F. aura (mid1ip1l) regulates the cytoskeleton at the zebrafish egg-to-embryo transition. Development. 143 (9), 1585-1599 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados