Method Article
Detectando a doença de Lyme espiroqueta, a Borrelia Burgdorferi, em carrapatos usando PCR aninhado
Neste Artigo
Resumo
PCR aninhado é uma técnica simples, sensível e específica que pode ser aplicada a escala que DNA extrai para sondar para Borrelia burgdorferi, o agente causador da doença de Lyme. A experiência inicial da PCR usa primeiras demão gene-específico para gerar amplicons longo, que em seguida tornar-se modelos para uma reação subsequente usando iniciadores internos.
Resumo
Doença de Lyme é uma infecção grave vetorial que é causada pela Borrelia burgdorferi sensu lato da família das espiroquetas, que são transmitidas aos seres humanos através da picada de carrapatos infectados Ixodes . O principal agente etiológico na América do Norte é Borrelia burgdorferi sensu stricto. Como expandem as regiões de risco geográfico, é prudente apoiar programas de vigilância robusto que podem medir as taxas de infecção de carrapato e comunicar as conclusões para os médicos, veterinários e público em geral. A técnica molecular de reação em cadeia da polimerase aninhada (nPCR) tem sido muito utilizada para esta finalidade, e continua a ser uma abordagem central, barata e robusta na detecção de Borrelia em carrapatos e animais selvagens.
Este artigo demonstra a aplicação do nPCR tiquetaquear extratos de DNA para identificar espécimes infectados. Independente de duas metas de b. burgdorferi , genes codificação Flagellin B (flacidez) e proteína de superfície exterior A (OspA), têm sido amplamente utilizados com esta técnica. O protocolo envolve coleta de carrapato, extração de DNA e então uma rodada inicial de PCR para detectar cada uma a dois Borrelia-loci específicos. Subsequente cadeia da polimerase (PCR) usa o produto da primeira reação como um novo modelo para gerar fragmentos menores, interno de amplificação. A abordagem aninhada melhora a especificidade e a sensibilidade do PCR convencional. Um carrapato é considerado positivo para o patógeno quando amplicons interna de ambos os genes de Borrelia pode ser detectada pela eletroforese em gel de agarose.
Introdução
Doença de Lyme (LD) é a infecção mais prevalente vetorial no hemisfério norte, e sua incidência continua a aumentar1. Esta doença debilitante é causada por patógenos spirocheteal do Lyme borreliose (LB) complexo (comumente referido como Borrelia burgdorferi sensu lato, ou s.l.), que compreende historicamente o patógeno norte-americana predominante, B. burgdorferi stricto sensu (s.e.), além de b. afzelii e b. garinii, que são difundidos em toda a Europa e Ásia e são espécies de emergentes relevância clínica2,3. Estas bactérias são transmitidas aos seres humanos através da picada de infectado Ixodes carrapatos2. Embora os principais vetores norte-americanos são I. scapularis e I. pacificus, várias espécies deste género foram encontrados para abrigar e transmitir a bactéria4. Em humanos, b. burgdorferi pode causar sintomas multisistêmica afetando a pele, articulações, coração, sistema nervoso, glândulas endócrinas, trato gastrointestinal e órgãos internos5,6,7, 8,9,10. O centro de controle e prevenção de doenças atualmente estima que mais de 300.000 novos casos humanos anualmente nos Estados Unidos11,12. Enquanto o prognóstico costuma ser favorável quando a doença é diagnosticada e tratada na fase inicial, estudos têm sugerido que, em qualquer lugar entre 10% e 60% dos pacientes que receberam o regime antibiótico recomendado continuado a experimentar sintomas após terapia cessação, em um fenômeno denominado síndrome de Lyme Doença de tratamento Post (PTLDS)13,14,15. Além disso, os atrasos na intervenção clínica podem surgir como resultado de falta de consciência de uma picada de carrapato, inespecíficas de apresentação da doença inicial e a baixa sensibilidade do diagnóstico tradicional baseado em sorologia quando usado no início da infecção. Falha para tratar rapidamente e de forma adequada permite a progressão de sintoma que pode se manifestar em cada vez mais debilitantes complicações16,17. Prevenção da doença de Lyme, portanto, é uma pedra angular da gestão de riscos. Estratégias para combater esta ameaça crescente incluem medidas de vigilância robustos para indicar a prevalência do patógeno em tiques e identificam as regiões geográficas de preocupação.
Este artigo demonstra a utilidade da reação em cadeia da polimerase aninhada (nPCR) como uma ferramenta de triagem molecular pelo qual identificar carrapatos infectados. Para aumentar a especificidade, dois genes de Borrelia são utilizados para amplificação paralela. B Flagellin (FlaB) codifica uma proteína grande filamento do flagelo18, e o gene está localizado no cromossomo linear único, enquanto o produto de lipoproteína da proteína de superfície exterior A (OspA) Medeia midgut carrapato colonização, e é codificado em plasmídeo19,20. O fluxo de trabalho consiste em coleção de carrapato, extração de DNA e em seguida uma rodada inicial de PCR para detectar Borrelia-loci específicos. PCR subsequente usa o produto da primeira reação como um novo modelo para gerar fragmentos menores, interno de amplificação. Um carrapato é considerado positivo para Borrelia burgdorferi quando amplicons interna de ambos os genes de Borrelia pode ser detectada pela eletroforese em gel de agarose.
A técnica do nPCR e a flacidez e alvos de gene OspA , têm sido amplamente utilizados para vigilância ecológica e detecção clínica da espiroqueta de Lyme desde o início da década de 199021,22,23 ,24,25. Antes do desenvolvimento de protocolos moleculares, carrapatos foram avaliados sujeitando o conteúdo do intestino de anti -Borrelia mancha da imunofluorescência (IF), cultura microbiana ou uma combinação destes26. Essas abordagens sofrem limitações inerentes, incluindo o crescimento lento e a natureza exigente de Borrelia27, problemas de desempenho do anticorpo e a exigência de tiques ao vivo para se processamento21. PCR foi posteriormente aprovado para fornecer a identificação rápida, sensível e específica de vetores infectados. Ele ofereceu melhorias marcadas sobre a metodologia tradicional, incluindo a cultura independente aplicação direta aos tipos de amostra diversos, tais como carrapatos mortos e arquivados que seriam inadequados para testes21,22 . Aninhados desenhos experimentais mais melhoram a especificidade e a sensibilidade do PCR clássica empregando dois conjuntos distintos de gene-específico primers em duas rodadas consecutivas de amplificação25,28.
Sucesso experimental é criticamente dependente de design amplicon e seleção de gene estratégica. Para estimar com precisão a presença de Borrelia burgdorferi, primeiras demão devem detectar os patógenos relevantes sem cross-reacting com febre relapsing espiroquetas também no gênero Borrelia . No caso de flacidez, essa especificidade é conseguida pela segmentação uma região variável interna de gene, ao invés de sequências flanqueando relativamente conservadas que são compartilhadas por diversas bactérias (Figura 1)24,29 , 30.
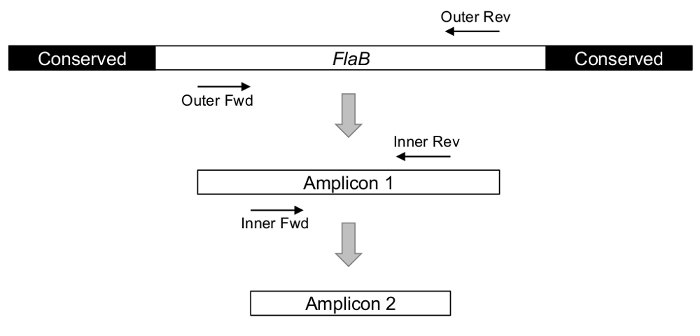
Figura 1: O conceito do nPCR, conforme ilustrado usando Borrelia FlaB gene como um alvo. A termini 5' e 3' do gene é comuns aos organismos além de Borrelia burgdorferi s.l., tornando essas regiões impróprias para a avaliação específica dos agentes patogénicos causadores de Lyme. Duas rodadas de PCR usando as sequências interiores menos-conservada como alvos da primeira demão, são executadas para detectar um amplicon final, interno. Clique aqui para ver uma versão maior desta figura.
Em um teste da sua capacidade discriminatória, interior FlaB primers foram avaliadas com mais de 80 diferentes isolados de Borrelia e encontrados para identificar apenas aqueles associados com a doença de Lyme24. Limite inferior de deteção do nPCR tem sido documentado em entre seis24 e dez31 bactérias de uma cultura pura, embora a sensibilidade pode ser melhorada pelo sul da mancha o amplicon e hybridizing um marcadas com radioisótopos ou sonda quimioluminescente. As técnicas de acoplamento reduz a deteccao de threshold para um único espiroqueta31. Por comparação directa, PCR convencional, unprobed de single-rodada foi encontrado para relatar a presença de um mínimo de 104 espiroquetas31. Convém, no entanto, que a sensibilidade do ensaio será inferior ao trabalhar com amostras ambientais e clínicas complexas, devido a presença esmagadora de ADN não relacionado e substâncias inibidoras potenciais. Esses desafios podem ser contornados em grande parte pelo uso do nPCR.
Apesar dos avanços em tecnologias moleculares nas últimas décadas, nPCR permanece uma técnica descontínuas em esforços de vigilância moderna. Se é tomado na concepção e execução do presente protocolo, é uma abordagem poderosa, adaptável e relativamente simples para captar a presença de agentes patogénicos em vetores de carrapato.
Protocolo
1. DNA isolamento de carrapatos
- Adquira carrapatos através de coleção de campo, ou vigilância passiva de veterinários e membros do público. Carrapatos devem ser mortos por congelamento, colocados em um saco selado e enviados à temperatura ambiente.
- Usando um formulário de submissão, reunir informações sobre a data e a localização geográfica do encontro, status de acessório de carrapato, espécies de hospedeiros e história de viagem recente do hospedeiro.
- Desde que o PCR aninhado é inerentemente vulnerável à contaminação, certifique-se de que o espaço de trabalho do laboratório é criado para minimizar a Cruz-exposição de amostras. Isso envolve a execução de diferentes elementos do protocolo em separado dedicados espaços bem isolados uns dos outros que são cuidadosamente limpos e esterilizados, e garantindo que todos os instrumentos estão livres de contaminantes.
- Após receber a amostra, fotografar o carrapato e determinar a espécie, grau de desenvolvimento, sexo e status de ingurgitamento em comparação a uma chave de identificação32 .
- Sob condições assépticas, dividem o carrapato usando uma lâmina de barbear estéril ou bisturi e colocar os fragmentos de dois carrapato tubos microcentrifuga separado.
- Para extrair o DNA total, use qualquer procedimento de isolamento que produz o modelo compatível com PCR; Este protocolo demonstra uma abordagem simples de quelação.
- Comece adicionando um volume adequado (geralmente entre 50-200 µ l) de um reagente lítica de quelação para o fragmento de carrapato. A quantidade específica dependerá o status tamanho e ingurgitamento do espécime; as orientações devem ser fornecidas pelo fabricante. Homogeneizar usando um microtubo pilão.
- Incube as amostras num banho de água a 60 ° C, durante 45 min e o vórtice brevemente.
- Centrifugar amostras para 4 min a 16.276 x g (13.300 rpm) em uma área de trabalho microcentrifuga.
- Transferi o sobrenadante para um fresco, etiquetado microtubo contendo 50 µ l isopropanol, mix por inversão e re-centrifugar como (1.2.3).
- Decante o sobrenadante e lavar o sedimento de DNA com 50 µ l de etanol 70%.
- Remover o excesso etanol com uma pipeta e permitir a pelota secar ao ar durante 15 minutos à temperatura ambiente.
- Resuspenda o DNA, adicionar 50 µ l de pH de 1 mM Tris 7.0 e incubar as amostras em banho-maria por 1h a 60 ° C. Agora, o DNA pode ser armazenado a-20 ° C para futura análise molecular.
2. detecção de PCR aninhado de Borrelia OspA e flacidez.
Nota: Uma panorâmica geral de práticas e princípios PCR é fornecida por Lorenz, 201233.
- Sintetizar, ou obter as primeiras demão do oligonucleotide interior e exterior de gene-específico de Borrelia . Consulte a tabela 1 para a primeira demão de moda, amplicon respectivos tamanhos e temperaturas de fusão.
| Nome da primeira demão | Gene alvo | Sequência (5' - 3') | Tamanho do amplicon | Temperatura do recozimento | |
| Flacidez fora Fw | Flacidez | gcatcactttcagggtctca | 503 bp | 55° C | |
| Flacidez fora Rv | Flacidez | tggggaacttgattagcctg | |||
| Flacidez em Fw | Flacidez | ctttaagagttcatgttggag | 447 bp | 58° C | |
| Flacidez em Rv | Flacidez | tcattgccattgcagattgt | |||
| OspA Out Fw | OspA | cttgaagttttcaaagaagat | 487 bp | 55° C | |
| OspA Out Rv | OspA | caactgctgacccctctaat | |||
| OspA em Fw | OspA | acaagagcagacggaaccag | 350 bp | 58° C | |
| OspA em Rv | OspA | ttggtgccatttgagtcgta | |||
Tabela 1: Interior e exterior primeiras demão para nPCR de Borrelia burgdorferiFlaB e OspA.
Na prática, as primeiras demão FlaB detectam s.s. da B. burgdorferi e outros intimamente relacionado Borrelia genospecies, enquanto as primeiras demão OspA captura somente de b. burgdorferi s.s. amplificação de ambos os loci indicaria B. burgdorferi. s.s.
- Pre-esterilize um gabinete PCR com UV luz e 70% de etanol.
Nota: Para minimizar o potencial de contaminação de amostra, este espaço de trabalho deve ser distinto do local de dissecação de carrapato, extração de DNA e electroforese do gel.- Para a execução inicial da PCR, use os primers exteriores em conjunto com o modelo de DNA recuperado na etapa 1.0 acima e configurar a mistura de reação, conforme descrito na tabela 2. Em paralelo, execute positivo controle executa consistindo de verificadas Borrelia ADN e controlo negativo executa incluindo reações não-modelo para detectar a contaminação do reagente e aerossol. Adicione o DNA no final para minimizar o potencial de contaminação dos reagentes. Certifique-se de que cada tubo é fechado em todos os momentos, quando os reagentes não estão sendo adicionados e fechem tubos imediatamente após a adição do DNA e antes de outros tubos são abertos.
- Programar um termociclador como segue: 95 ° C por 5 min; 40 ciclos de 95 ° C por 15 s, recozendo temperatura por 30 s, 72 ° C por 45 s; 72 ° C por 5 min; e mantenha a 4 ° C.
- Realize a segunda rodada do PCR semelhante a primeira reação, exceto o uso de cartilhas internas com 2 µ l do primeiro produto do PCR (produzido em 2.2.2).
Nota: Volumes de reação novamente são fornecidos na tabela 2. Deve ter cuidado para evitar contaminação cruzada de amplicons, garantindo que o ADN do molde é adicionado última e que apenas tubos correspondente a uma amostra são abertos ao mesmo tempo.
Tabela 2: Misturas de reação de PCR para amplificações de primeiras e segunda.Componente de Volumes PCR # 1 PCR # 2 Volumes Taq polimerase Master Mix 2 X 12,5 Μ l 12,5 Μ l Água livre de nuclease Μ l 8,5 Μ l 8,5 10 µM primers forward e Reverse Primers exterior de 1,0 µ l Primers interna de 1,0 µ l Modelo de DNA 2,0 µ l, de extração de amostra (1.2.7) 2,0 µ l, do 1º round do PCR (2.2.2)
- Programar o termociclador como antes, mas ajustar a temperatura do recozimento para acomodar os primers internos (veja tabela 1).
3. imagem e eletroforese em Gel de Agarose
Nota: Para obter instruções básicas sobre separação de DNA por electroforese, consulte Lee et al., 201234.
- Preparar um gel de agarose 1,2% usando buffer de SB X 20 (0.2 M NaOH, ácido bórico de 0,8 M pH 8), diluído a 1 X e adicionar aproximadamente 5 µ l de uma mancha de DNA, antes de derramar, se pre-coloração do gel é desejado.
- Carrega 10 µ l do produto da reação de PCR segundo (interna) de cada experimental e amostra de controle, ao lado de uma escada de bp 100 (5 µ l).
- Electrophorese por 1h no 107 V (5V/cm).
- Visualizar e documentar o gel usando um transiluminador e associado da câmera e software.
Resultados
nPCR é uma abordagem elegante para aumentar a especificidade e a sensibilidade de detecção do patógeno, particularmente quando amostras ambientais complexas estão sob investigação. Conforme representado na Figura 1, a duas rodadas de PCR como alvo uma região estratégica do locus FlaB Borrelia (e OspA, não na foto) podem relatar a presença da bactéria Borrelia burgdorferi através da geração de curto interno amplicons. Quando resolvida por eletroforese em gel, as flacidez e OspA produtos de reacção de cada carrapato podem ser visualmente marcou e comparados com controles. Na Figura 2, identificadores de espécime único são fornecidos na parte superior de cada gel e controles não-modelo e aerossóis são representados na extrema esquerda e direita, respectivamente, adjacente para as escadas.
Amplicon robusto bandas são claramente visíveis em selecionadas amostras experimentais, e são facilmente distinguidos de excedentes primários e DNA residual (Figura 2). Baseia-se nos princípios de desenho experimental estabelecidos, um carrapato é considerado positivo para Borrelia quando paralelo controles negativos demonstram sem amplificação e amplicons internas são produzidos a partir de primers tanto a flacidez e a OspA . Neste caso, espécimes T907, T604 e T606 preencheram critérios de vigilância para o patógeno de Lyme (Figura 2). By Contrast, T923 só foi positivo para OspA, um resultado para o qual existem várias explicações possíveis: A) o carrapato de origem foi negativo para Borrelia, mas a preparação de PCR OspA exterior ou interior spuriously foi contaminada com DNA de modelo (note que contaminação sistêmica dos reagentes foi descartada através de controles negativos), B) o carrapato carregava Lyme Borrelia, mas baixo modelo montantes ou erro experimental impediu a amplificação de flacidez, ou C) um organismo esteve presente que continha a sequência conservada da OspA , mas faltava Flagellin ou tinha identidade insuficiente na região alvo de flacidez para recozer para as primeiras demão. De facto, semelhanças de sequência OspA registaram-se em uma variedade de organismos, incluindo plantas e animais28. A situação de inverso, amplificação dos mais conservados Flagellin gene, mas não o gene da OspA , poderia indicar uma espécie Borrelia relacionada. Na prática, este protocolo produz resultados de single-positivo OspA mais do que as primeiras demão FlaB , sugerindo que o cenário 'A' é a explicação menos provável. Sem mais análise experimental da amostra contenciosa, no entanto, não é possível determinar a fonte do único-positivo resultado. Aumento do número de repetições técnicas realizadas em amostras equívocas pode ajudar a conciliar sua verdadeira condição, desde que quaisquer contaminantes que spuriously foram introduzidos para reações anteriores não estaria presentes no DNA arquivado. No entanto, se as reações subsequentes com estas primeiras demão não fornecem resultados conclusivos, outros loci de Borrelia poderia ser investigado pela PCR. Amplicons gerados a partir dessas reações também poderia ser sequenciados e comparados entre isolados para ajudar a atribuir identidade e estimar o grau de divergência de estirpe. SAPI e colegas fornecem um exemplo deste fluxo de trabalho usando amostras clínicas humana35.
Todos os fatores considerados, os critérios de protocolo e interpretação delineados foram estimados para produzir falsas positivas e falsas taxas negativas de 0,17% e 0.0063%, respectivamente.
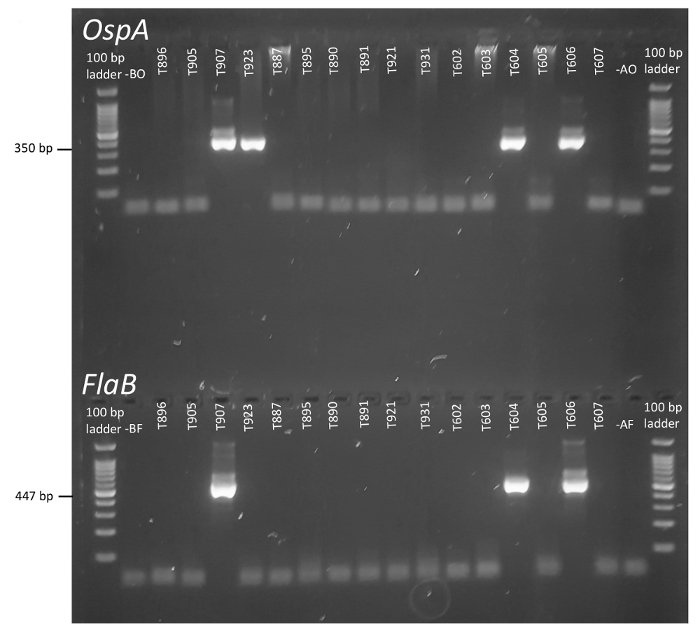
Figura 2 : Deteção de Borrelia burgdorferi em marcações individuais por nPCR de FlaB e OspA. Os códigos atribuídos a cada instante são representados no topo dos géis e identidades alinham verticalmente para relatar a detecção da OspA e flacidez em cada amostra. Faixas intitulado B à esquerda dos controles de modelo não representam a imagem, enquanto um (pistas de mão direita) são controles de aerossol para capturar a contaminação do ambiente laboratorial. Clique aqui para ver uma versão maior desta figura.
Discussão
Ao longo de décadas de uso, técnicas de PCR-baseados têm consistentemente provado o seu valor na detecção de Borrelia de espécimes de artrópodes e mamíferos, se Borrelia vêm de origens ambientais ou clínicas. PCR oferece muitas melhorias sobre abordagens pré-existentes para vigilância. Nomeadamente, não é dependente do desenvolvimento e desempenho dos reagentes de anticorpos e em vez disso pode ser facilmente adaptado para detectar novos destinos turísticos simplesmente modificando sequências da primeira demão. PCR também acomoda a avaliação dos loci múltiplos em paralelo, isoladamente ou através de uma reação de multiplex. Pode ser aplicado às entradas de diversas amostras, incluindo tiques fresco e arquivados22, animal ou humanos fluidos corporais e tecido ressecado25. PCR também produz amplicons que pode ser ulteriormente, por exemplo por digestão enzimática de restrição, hibridização da sonda ou sequenciamento, para fornecer maior introspecção identidade microbiana21.
Como uma ferramenta clínica, PCR é conceitualmente preferível o padrão diagnóstico serológico, pois fornece uma indicação direta da presença bacteriana, em vez de depender de resposta imune do hospedeiro como medida secundária da infecção. No entanto, borreliose de Lyme é associado com uma carga microbiana relativamente modesta (< 50 organismos/mL de urina ou plasma) e spirochetemia transitória, que pode dar origem a falso negativo resulta25. A sensibilidade desta técnica na clínica varia consideravelmente dependendo do tipo de tecido, estágio de infecção e condição de amostra, caindo entre 12,5% e 62% em estudos existentes de sangue, líquido cefalorraquidiano e uma biópsia do tecido36. Limitações de sensibilidade molecular não são uma preocupação se PCR é realizado na sequência de uma cultura bacteriana, porém a recuperação de espiroquetas viáveis de amostras clínicas tem provado da mesma forma desafiante. Só recentemente protocolos foram otimizados para maior rendimento35. Enquanto isso, o intestino de um carrapato adulto infectado pode abrigar em média em qualquer lugar de 2.000 para mais 50.000 Borrelia37,38,39, que está solidamente dentro do intervalo de detecção do nPCR. Assim, o protocolo é bem adequado para os esforços de vigilância do carrapato.
Apesar de suas muitas vantagens, nPCR representam certos desafios e a capacidade desta técnica para relatar com precisão a infecção de carrapato, portanto, depende da seleção estratégica de genes e amplicons, fluxos de trabalho meticulosos experimentais que recuperar o DNA de qualidade partir de amostras, minimizando a Cruz-exposição de amostras e a utilização de controlos adequados que pode relatar contaminantes no ambiente de laboratório e reagentes. Antes de qualquer experimentação, o escopo e as intenções do inquérito devem ser claramente definidas para que o locus genéticos apropriados e regiões, podem ser selecionado. Se o objetivo é fornecer uma tela imparcial para os causadores de Lyme Borrelia burgdorferi s.l. complexos, primeiras demão devem ser criadas para detectar todas as tensões associadas com afinidade semelhante e eficiência de amplificação, sem captura independentes organismos de25. Novas cartilhas podem ser projetadas e avaliados em silico usando ferramentas de software tais como Primer-BLAST40, embora eles também devem ser validados experimentalmente contra o padrão de referência isola antes de ser aplicado às amostras descaracterizadas. O objetivo do processo de extração de DNA é recuperar o modelo microbiano intacto de uma amostra ambiental misturada (homogeneizado de carrapato). Uma etapa opcional antes de prosseguir com a PCR é avaliar a integridade do DNA extraído. Além disso, reações paralelas poderiam ser criadas para atingir um gene de limpeza no carrapato. O último método também pode indicar a presença de inibidores na mistura reacional, proporcionando o aumento da confiança que reações negativas Borrelia são devido à ausência do organismo e não à presença de um contaminante inibitório.
O aumento da sensibilidade da abordagem do PCR aninhado vem à custa de potencial contaminação que gera resultados falso-positivos. Modelo exógeno poderia ser introduzido a uma amostra durante a dissecção de carrapato e recuperação do DNA, ou no processo de criação as reações de amplificação externa e interna. Portanto, é especialmente importante seguir protocolos de prática melhores para PCR evitar modelo ou amplicon contaminação cruzada. Estes incluem o uso separado de estações de trabalho com fluxos de ar independentes, contenção em PCR e armários de segurança biológica, se for caso disso, minuciosa e químicas físicas limpeza e esterilização de superfícies e reagentes e cautelosa manipulação de DNA 41. controles não-modelo também são vitais na identificação de contaminação de reagentes de estoque. Uma vulnerabilidade específica do nPCR é o amplicon manipulação que ocorre quando transferir os produtos da reação primeiro para o segundo recipiente PCR. Desde que o alvo do DNA já sofreu exponencial enriquecimento em amostras positivas, este passo é especialmente propenso a contaminação cruzada, e um protocolo único-tubo nPCR foi desenvolvido para contornar esta limitação. Nesta abordagem, os dois conjuntos de primers para um determinado gene são adicionados juntos para um tubo de reação que permanecerá fechado para as duas rodadas de PCR31. Os pares de interior e exterior da primeira demão devem ser termodinamicamente distintos, tal que o casal exterior amplifica o modelo em uma alta temperatura de recozimento que é proibitivo para os primers internos. Na segunda rodada, a temperatura do recozimento é abaixada para acomodar o par interno. Não só isto faz ignorar uma etapa potencialmente confundimento, também permite o uso de adicionais anticontaminação mede31,,42. No entanto, essa modificação pode sacrificar alguma sensibilidade do ensaio. Independentemente da abordagem, aumentando o número de repetições técnicas executada independentemente numa amostra ajudará a identificar a contaminação espúria.
Técnicas moleculares têm continuado a evoluir desde a introdução do nPCR, e esses novos enfoques oferecem vantagens selecionadas sobre os desenhos originais, embora em aumento da despesa financeira. Como o nome sugere, PCR quantitativo (tempo qPCR ou real (RT)-PCR) permite a enumeração de patógenos em uma amostra, enquanto técnicas convencionais são qualitativas na natureza43. A sensibilidade do qPCR é supostamente semelhante do nPCR38, embora isto pode variar dependendo da primeira demão características28. Uma variação de qPCR que usa balizas moleculares (MB) no lugar do convencionais sondas TaqMan também se mostrou promissor na detecção de Borrelia em amostras clínicas44,,45,46. Devido à sua original estrutura secundária, balizas moleculares declaradamente produzem fluorescência de fundo inferior e superiores sinais legítimos, proporcionando sensibilidade superior47. Avaliações pré-clínicas sugerem um potencial limite de deteção de entre um e dez espiroquetas44,45. Além disso, a técnica tem sido aplicada com sucesso em multiplex reações simultaneamente detectar um gene de mamífero hospedeiro44 e outros patógenos tick-borne45, que não é tão facilmente alcançável com nPCR. Outras modificações de projeto incluem a tecnologia digital da gota do PCR (ddPCR), que pode quantificar o DNA sem a utilização de uma curva padrão39,48. O limite inferior de deteção desta técnica para Borrelia é igualmente cerca de dez espiroquetas/amostra39. Em comparação com nPCR, essas abordagens também têm a vantagem de reduzido potencial de contaminação, como eles só exigem um protocolo único de amplificação.
Se o objectivo da vigilância é, ao invés de perfil variado conteúdo bacteriano de um carrapato, triagem de metagenomic do 16S rRNA é uma opção atraente de49. Embora essa abordagem é mais cara, requer especializadas sequenciadores de DNA não foi encontrados em todos os laboratórios de biologia molecular e exige mais sofisticado de interpretação baseada em bioinformática, ele pode capturar com precisão de um amplo espectro de micróbios a mais representam a carga do agente patogénico do vetor.
Enquanto qPCR e seus derivados são métodos de escolha para aplicações quantitativas e telas metagenomics fornecem amplos inventários de microbiome o carrapato, os esforços de vigilância orientada frequentemente estão preocupados com a comunicação binária da presença ou ausência de um ou alguns patógenos em um vetor. Sob tais circunstâncias, essas abordagens mais novas, mais elaboradas podem introduzir complexidade desnecessária e encargos financeiros do processo. Por estas razões, nPCR tem resistido ao teste do tempo como uma técnica fundamental em testes de carrapato.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores desejam agradecer a Kami Harris para o projeto da primeira demão, Ashley McKibbon Jessica Thomas-Eliakim para filmar e John Blakely, Alexandra Foley-Eby, Chris Langley, Julie Lewis, Kelsey McIntyre, Ashley McKibbon, Chris Zinck e Rosie o cão por aparecer na vídeo. A. M. K. foi apoiada pela Fundação Canadense para a pesquisa de doença de Lyme, e financiamento do projeto foi fornecido pelas ciências naturais e engenharia pesquisa Conselho de Canadá (NSERC). M. K. B. W. recebido salário financiamento da Fundação de inovação a Nova Brunswick (NBIF).
Materiais
| Name | Company | Catalog Number | Comments |
| LabGard Class II, Type A2 biological safety cabinet | Nuaire | ES AIR NU-543 | |
| Razor blades | VWR | 55411-050 | 0.22 mm thickness |
| Microfuge Tubes (Microtubes 1.5 mL) | Axygen | 311-08-051 | |
| AquaGenomic | MultiTarget Pharmaceuticals | 2030 | DNA extraction reagent |
| Microtube Pestle | Diamed | DIATEC610-1551 | Designed for 1.5 ml tubes |
| Water bath - Isotemp 202 | Fishse Scientific | 15-462-2 | |
| Vortex | Labnet | S0100 CAN | |
| Spectrafuge 24D Digital Microcentrifuge | Labnet | C2400 | |
| Isopropanol | Sigma-Aldrich | 190764 | |
| BIS-TRIS | Sigma-Aldrich | B9754 | |
| Primer Synthesis | Sigma-Aldrich | OLIGO | |
| PCR Cabinet | Misonix | PCR6-482 | |
| PCR tube with attached flat caps 0.2mL | VWR | 20170-012 | |
| GoTaq Green Master Mix 2x | Promega | M7123 | |
| Nuclease-free water | Promega | M7123 | The water comes with the GTG |
| Spectrafuge Mini | Labnet | C1301 | |
| SYBR Safe DNA Stain 10,000X Concentration | EDVOTEK | 608 | |
| Froggarose LE (Molecular Biology Grade Agarose) | FroggaBio | A87-500G | |
| GD 100 bp DNA Ladder | FroggaBio | DM001-R500 | |
| Electrophoresis power pack | VWR | VWR 105 | EC Apparatus Corporation |
| Fluor-S MultiImager | BioRad | 170-7700 (Serial number 433B0154) | |
| Quantity One 1-D Analysis Software (V. 4.5.2) | BioRad | 1709600 |
Referências
- Schotthoefer, A. M., Frost, H. M. Ecology and epidemiology of Lyme borreliosis. Clin. Lab. Med. 35 (4), 723-743 (2015).
- Franke, J., Hildebrandt, A., Dorn, W. Exploring gaps in our knowledge on Lyme borreliosis spirochaetes - Updates on complex heterogeneity, ecology, and pathogenicity. Ticks Tick Borne Dis. 4 (1-2), 11-25 (2013).
- Rudenko, N., Golovchenko, M., Vancova, M., Clark, K., Grubhoffer, L., Oliver, J. H. Isolation of live Borrelia burgdorferi sensu lato spirochaetes from patients with undefined disorders and symptoms not typical for Lyme borreliosis. Clin. Microbiol. Infect. 22 (3), 267.e9-267.e15 (2016).
- Scott, J. D., Clark, K. L., Anderson, J. F., Foley, J. E., Young, M. R., Durden, L. A. Lyme Disease Bacterium, Borrelia burgdorferi Sensu Lato, Detected in Multiple Tick Species at Species at Kenora, Ontario, Canada. J Bacteriol Parasitol. 08 (01), 1-10 (2017).
- Sperling, J., Middelveen, M., Klein, D., Sperling, F. Evolving perspectives on lyme borreliosis in Canada. Open Neurol J. 6, 94-103 (2012).
- Pachner, A. R. Early disseminated Lyme disease: Lyme meningitis. Am. J. Med. 98 (Supplement 1), 30S-43S (1995).
- Mikkilä, H. O., Seppälä, I. J., Viljanen, M. K., Peltomaa, M. P., Karma, A. The expanding clinical spectrum of ocular lyme borreliosis. Ophthalmology. 107 (3), 581-587 (2000).
- Mc Causland, F. R., Niedermaier, S., Bijol, V., Rennke, H. G., Choi, M. E., Forman, J. P. Lyme disease-associated glomerulonephritis. Nephrol. Dial. Transplant. 26 (9), 3054-3056 (2011).
- Tunev, S. S., Hastey, C. J., Hodzic, E., Feng, S., Barthold, S. W., Baumgarth, N. Lymphoadenopathy during Lyme Borreliosis Is Caused by Spirochete Migration-Induced Specific B Cell Activation. PLoS Pathog. 7 (5), e1002066-e1002014 (2011).
- Kostić, T., et al. Manifestations of Lyme carditis. Int. J. Cardiol. 232, 24-32 (2017).
- Hinckley, A. F., et al. Lyme Disease Testing by Large Commercial Laboratories in the United States. Clin. Infect. Dis. 59 (5), 676-681 (2014).
- Nelson, C. A., et al. Incidence of Clinician-Diagnosed Lyme Disease, United States 2005-2010. Emerg. Infect. Dis. 21 (9), 1625-1631 (2015).
- Aucott, J. N., Rebman, A. W., Crowder, L. A., Kortte, K. B. Post-treatment Lyme disease syndrome symptomatology and the impact on life functioning: is there something here?. Qual Life Res. 22 (1), 75-84 (2012).
- Aucott, J. N., Crowder, L. A., Kortte, K. B. Development of a foundation for a case definition of post-treatment Lyme disease syndrome. Int. J. Infect. Dis. 17 (6), e443-e449 (2013).
- Adrion, E. R., Aucott, J., Lemke, K. W., Weiner, J. P. Health care costs, utilization and patterns of care following Lyme disease. PLoS ONE. , (2015).
- Cameron, D. J. Consequences of treatment delay in Lyme disease. Journal of Evaluation in Clinical Practice. 13 (3), 470-472 (2007).
- Johnson, L., Aylward, A., Stricker, R. B. Healthcare access and burden of care for patients with Lyme disease: a large United States survey. Health policy. 102 (1), 64-71 (2011).
- Motaleb, M. A., et al. Borrelia burgdorferi periplasmic flagella have both skeletal and motility functions. Proc. Natl. Acad. Sci. U.S.A. 97 (20), 10899-10904 (2000).
- Rosa, P. A., Tilly, K., Stewart, P. E. The burgeoning molecular genetics of the Lyme disease spirochaete. Nat. Rev. Microbiol. 3 (2), 129-143 (2005).
- Kenedy, M. R., Lenhart, T. R., Akins, D. R. The role of Borrelia burgdorferi outer surface proteins. FEMS Immunol. Med. Microbiol. 66 (1), 1-19 (2012).
- Persing, D. H., Telford, S. R., Spielman, A., Barthold, S. W. Detection of Borrelia burgdorferi infection in Ixodes dammini ticks with the polymerase chain reaction. J. Clin. Microbiol. 28 (3), 566-572 (1990).
- Persing, D. H., et al. Detection of Borrelia burgdorferi DNA in museum specimens of Ixodes dammini ticks. Science. 249 (4975), 1420-1423 (1990).
- Wise, D. J., Weaver, T. L. Detection of the Lyme disease bacterium, Borrelia burgdorferi, by using the polymerase chain reaction and a nonradioisotopic gene probe. J. Clin. Microbiol. 29 (7), 1523-1526 (1991).
- Johnson, B. J., Happ, C. M., Mayer, L. W., Piesman, J. Detection of Borrelia burgdorferi in ticks by species-specific amplification of the flagellin gene. Am. J. Trop. Med. Hyg. 47 (6), 730-741 (1992).
- Schmidt, B. L. PCR in laboratory diagnosis of human Borrelia burgdorferi infections. Clin. Microbiol. Rev. 10 (1), 185-201 (1997).
- Ogden, N. H., et al. Ixodes scapularis ticks collected by passive surveillance in Canada: analysis of geographic distribution and infection with Lyme borreliosis agent Borrelia burgdorferi. J. Med. Entomol. 43 (3), 600-609 (2006).
- Doern, G. V. Detection of selected fastidious bacteria. Clin. Infect. Dis. 30 (1), 166-173 (2000).
- Nolte, O. Nucleic Acid Amplification Based Diagnostic of Lyme (Neuro-)borreliosis - Lost in the Jungle of Methods, Targets, and Assays?. Open Neurol J. 6 (1), 129-139 (2012).
- Wallich, R., Moter, S. E., Simon, M. M., Ebnet, K., Heiberger, A., Kramer, M. D. The Borrelia burgdorferi flagellum-associated 41-kilodalton antigen (flagellin): molecular cloning, expression, and amplification of the gene. Infect. Immun. 58 (6), 1711-1719 (1990).
- Picken, R. N. Polymerase chain reaction primers and probes derived from flagellin gene sequences for specific detection of the agents of Lyme disease and North American relapsing fever. J. Clin. Microbiol. 30 (1), 99-114 (1992).
- Picken, M. M., Picken, R. N., Han, D., Cheng, Y., Strle, F. Single-tube nested polymerase chain reaction assay based on flagellin gene sequences for detection ofBorrelia burgdorferi sensu lato. Eur. J. Clin. Microbiol. Infect. Dis. 15 (6), 489-498 (1996).
- Keirans, J. E., Litwak, T. R. Pictorial key to the adults of hard ticks, family Ixodidae (Ixodida: Ixodoidea), east of the Mississippi River. J. Med. Entomol. 26 (5), 435-448 (1989).
- Lorenz, T. C. Polymerase Chain Reaction: Basic Protocol Plus Troubleshooting and Optimization Strategies. J Vis Exp. (63), e3998 (2012).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose Gel Electrophoresis for the Separation of DNA Fragments. J Vis Exp. (62), e3923 (2012).
- Sapi, E., Pabbati, N., Datar, A., Davies, E. M., Rattelle, A., Kuo, B. A. Improved culture conditions for the growth and detection of Borrelia from human serum. Int J Med Sci. 10 (4), 362-376 (2013).
- Waddell, L. A., Greig, J., Mascarenhas, M., Harding, S., Lindsay, R., Ogden, N. The Accuracy of Diagnostic Tests for Lyme Disease in Humans, A Systematic Review and Meta-Analysis of North American Research. PLoS ONE. 11 (12), e0168613-e0168623 (2016).
- Brunet, L. R., Spielman, A., Telford, S. R. Density of Lyme disease spirochetes within deer ticks collected from zoonotic sites. Am. J. Trop. Med. Hyg. 53 (3), 300-302 (1995).
- Wang, G., et al. Real-time PCR for simultaneous detection and quantification of Borrelia burgdorferi in field-collected Ixodes scapularis ticks from the Northeastern United States. Appl. Environ. Microbiol. 69 (8), 4561-4565 (2003).
- King, J. L., Smith, A. D., Mitchell, E. A., Allen, M. S. Validation of droplet digital PCR for the detection and absolute quantification of Borrelia DNA in Ixodes scapularis ticks. Parasitology. 144 (4), 359-367 (2017).
- Ye, J., Coulouris, G., Zaretskaya, I., Cutcutache, I., Rozen, S., Madden, T. L. Primer-BLAST: a tool to design target-specific primers for polymerase chain reaction. BMC Bioinformatics. 13 (1), 134 (2012).
- Kwok, S., Higuchi, R. Avoiding false positives with PCR. Nature. 339 (6221), 237-238 (1989).
- Rys, P. N., Persing, D. H. Preventing false positives: quantitative evaluation of three protocols for inactivation of polymerase chain reaction amplification products. J. Clin. Microbiol. 31 (9), 2356-2360 (1993).
- Pahl, A., Kühlbrandt, U., Brune, K., Röllinghoff, M., Gessner, A. Quantitative detection of Borrelia burgdorferi by real-time PCR. J. Clin. Microbiol. 37 (6), 1958-1963 (1999).
- Saidac, D. S., Marras, S. A. E., Parveen, N. Detection and quantification of Lyme spirochetes using sensitive and specific molecular beacon probes. BMC Microbiol. 9 (1), 43 (2009).
- Chan, K., Marras, S. A. E., Parveen, N. Sensitive multiplex PCR assay to differentiate Lyme spirochetes and emerging pathogens Anaplasma phagocytophilum and Babesia microti. BMC Microbiol. 13 (1), 295 (2013).
- Schlachter, S., Chan, K., Marras, S. A. E., Parveen, N. Detection and Differentiation of Lyme Spirochetes and Other Tick-Borne Pathogens from Blood Using Real-Time PCR with Molecular Beacons. Methods Mol. Biol. 1616, 155-170 (2017).
- Wang, L., Blasic, J. R., Holden, M. J., Pires, R. Sensitivity comparison of real-time PCR probe designs on a model DNA plasmid. Anal. Biochem. 344 (2), 257-265 (2005).
- Sze, M. A., Abbasi, M., Hogg, J. C., Sin, D. D. A Comparison between Droplet Digital and Quantitative PCR in the Analysis of Bacterial 16S Load in Lung Tissue Samples from Control and COPD GOLD 2. PLos ONE. 9 (10), e110351-e110356 (2014).
- Sperling, J. L., et al. Comparison of bacterial 16S rRNA variable regions for microbiome surveys of ticks. Ticks Tick Borne Dis. , 1-9 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados