É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Investigando os prejudiciais efeitos de baixa pressão Plasma esterilização na sobrevivência de esporos de Bacillus subtilis usando Live celular microscopia
Neste Artigo
Resumo
Este protocolo ilustra as etapas consecutivas importantes, necessárias para avaliar a pertinência de monitoramento parâmetro de vitalidade e os processos de reparação do DNA em reviving esporos de Bacillus subtilis após o tratamento com plasma de baixa pressão de tracking proteínas através do tempo-resolvido microscopia confocal e microscopia eletrônica de reparo de DNA marcado com fluorescência.
Resumo
Esterilização plasma é uma alternativa promissora para os métodos de esterilização convencionais para fins de exploração espacial e industrial, clínica. Descargas de baixa pressão plasma (LPP) contenham um amplo espectro de espécies ativas, que levam a inativação microbiana rápida. Para estudar a eficiência e a mecanismos de esterilização por LPP, usamos os esporos do Bacillus subtilis organismo teste por causa de sua extraordinária resistência contra procedimentos de esterilização convencionais. Descrevemos a produção de monocamadas de esporos de b. subtilis , o processo de esterilização por plasma de baixa pressão em um reator de plasma indutivo duplo, a caracterização da morfologia dos esporos usando microscopia eletrônica de varredura (MEV) e o análise da germinação e consequência de esporos por microscopia de células vivas. Um alvo principal das espécies de plasma é material genómico (DNA) e reparo de lesões de DNA induzida por plasma sobre avivamento esporo é crucial para a sobrevivência do organismo. Aqui, podemos estudar a capacidade de germinação dos esporos e o papel do DNA reparo durante a germinação dos esporos e consequência natural após o tratamento com LPP rastreando fluorescente etiquetado DNA reparo proteínas (RecA) com microscopia de fluorescência confocal tempo-resolvido. Tratados e monocamadas de esporos não tratados são ativadas para a germinação e visualizadas com um microscópio invertido confocal célula viva ao longo do tempo a seguir a reação dos esporos individuais. Nossas observações revelam que a fração de germinação e superando os esporos é dependente da duração do LPP-tratamento, atingindo um mínimo após 120 s. RecA-YFP fluorescência (proteína de fluorescência amarela) foi detectada apenas em alguns esporos e desenvolvida em toda a superando as células com uma ligeira elevação no LPP-tratados esporos. Além disso, algumas das bactérias vegetativas derivado LPP-tratados esporos mostrou um aumento no citoplasma e tendiam a lyse. Os métodos descritos para análise de esporos individuais podem ser exemplares para o estudo de outros aspectos da germinação de esporos e consequência.
Introdução
Dos principais objetivos da exploração espacial é a busca de assinaturas de formas de vida e biomoléculas em outros planetas e luas em nosso sistema solar. A transferência de microorganismos ou biomoléculas de origem terrestre, de áreas críticas de exploração é de risco especial para o impacto do desenvolvimento e integridade das missões de deteção de vida em planetas como Marte e Europa1. As diretrizes internacionais de proteção planetária, estabelecida pelo Comité de pesquisa espacial (sistema) em 1967, impor normas rigorosas em missões tripuladas e robóticas para outros planetas, suas luas, asteroides e outros corpos celestes e regular o limpeza e esterilização de uma nave espacial e componentes de hardware crítico prévios para lançar a fim de eliminar a contaminação de microorganismos terrestres e evitar contaminação cruzada de corpos celestes2. Na última década, a aplicação de plasmas não térmicos ganhou ampla atenção na pesquisa biomédica e nutricional, bem como em aplicações de voo espacial3,4,5. Esterilização plasma é uma alternativa promissora aos métodos convencionais de esterilização que oferece rápida e eficiente de inactivação microbiana6, sendo suave para sensíveis e materiais lábeis de calor. Descargas de plasma contêm uma mistura de agentes reativos como os radicais livres, partículas carregadas, neutro/excitado átomos fótons no ultravioleta (UV) e espectro ultravioleta de vácuo (VUV) que levam a inativação microbiana rápida3. Neste estudo, utilizamos o plasma de baixa pressão gerada pelo duplo plasma indutivo de baixa pressão (DICP) fonte7,8 para inactivar endósporos de Bacillus subtilis distribuídos na superfície de ensaio de vidro.
Bactérias gram-positivas da família bacilos são amplamente distribuídas em habitats naturais do solo, sedimentos e ar, bem como em ambientes incomuns, tais como instalações de sala limpa e a estação espacial internacional9,10 ,11. A característica mais distinta do gênero Bacillus é a capacidade de formar altamente resistentes endósporos dormentes (doravante referidos como esporos) para sobreviver a condições desfavoráveis, tais como esgotamento de nutrientes12. Os esporos são geralmente muito mais resistentes do que suas contrapartes de célula vegetativa de uma variedade de tratamentos e estresses ambientais, incluindo o calor, UV, radiação gama, dessecação, ruptura mecânica e produtos químicos tóxicos, tais como oxidantes fortes ou agentes de mudança de pH (revistos em referências13,14) e, portanto, são objetos ideais para testar a eficiência dos métodos de inativação microbiana. Desde que o DNA genômico é um alvo principal do tratamento de bactérias15,16, o reparo de lesões de DNA induzida por plasma plasma (por exemplo, quebras de dupla cadeia de DNA) em cima do esporo revival é crucial para a sobrevivência de bactérias13, 17.
Assim, estudamos a capacidade de germinação dos esporos e o papel do reparo de DNA durante a germinação dos esporos e consequência natural após ter tratado os esporos com plasma de argônio de baixa pressão por seguintes esporos individuais e reparar sua expressão de DNA marcado com fluorescência proteína RecA com microscopia de fluorescência confocal tempo-resolvido. Nós damos uma instrução passo a passo da preparação de esporos de b. subtilis em monocamadas para alcançar resultados reprodutíveis, o tratamento de monocamadas de esporo com plasma de baixa pressão para esterilização, a preparação de esporos de plasma Tratado para avaliação ultraestrutural usando microscopia eletrônica de varredura (MEV) e análise de microscopia célula viva ao nível dos esporos individuais em concerto com o monitoramento do DNA ativo reparar processos que ocorrem dentro da célula em resposta a um tratamento de plasma.
Protocolo
1. produção de esporos de bacillus subtilis e purificação
- Para a produção de esporos, transferir uma cultura da noite 5 mL das respectivas estirpe de b. subtilis , suplementada com antibióticos apropriados, para 200 mL dose dupla Schaeffer esporulação meio líquido (por litro caldo nutriente de 16G, KCl 2 g, 0,5 g de MgSO 4* 7 H2O, 2ml 1 M Ca (NO3)2, 2 mL 0,1 M MnCl2 * • 4 H2O, 2ml 1 mM Filipa4, 2 mL de glicose 50% (p/v)18) e cultivá-lo com aeração vigorosa a 37 ° C por 72 h ou até > 95% da cultura tem esporulada. Os esporos dos seguintes estirpes são utilizados: b. subtilis PY79 (tipo selvagem) b. subtilis PY79ΔrecA:: neo (deficiência de proteína de reparo do DNA RecA) PY79 de b. subtilis recA-yfp:: gato (RecA fundido com amarelo proteína fluorescente [YFP]19).
- Colheita de esporos por centrifugação por 15 min a 3.000 x g em tubos de 50 mL e purificar as amostras através de etapas de lavagem repetida (até 15 vezes) usando água destilada estéril H2O e cheque para o status de pureza e germinação por microscopia de contraste de fase. Garantir que as suspensões de esporos consistem fora de fase-brilhante esporos (> 99%) e são livres das células vegetativas (hastes), esporos germinados (aparência preto / cinza) e os restos celulares, caso contrário mais experimentos de microscopia podem ser perturbados. Lave a amostra até pureza desejada seja alcançada.
- Determinado o título de esporos por chapeamento fora 50 µ l de 10 vezes diluições em série na LB-ágar (ou seja: uso 30 µ l da amostra + 270 µ l água estéril para uma 01:10 diluição. Tome 30 µ l da diluição específica a 270 µ l H2O para uma diluição de 1: 100 e assim por diante) para calcular o UFC (unidades formadoras) e incubar as placas a 37 ° C durante a noite. Após a determinação do UFC, ajuste a amostra de 109 esporos por mL, concentrando ou diluindo com água estéril.
2. amostra preparação de aerossol-depositado Bacillus subtilis Spores
Nota: Acumulação e sobreposição de esporos podem levar a efeitos de sombreamento durante o tratamento, em última análise, resultando em cinética de inativação falsificados. Para minimizar esse problema, prepare amostras de esporos por uma técnica de deposição de aerossol20. Brevemente, controle o bocal do dois-substância de alta precisão com um temporizador elétrico que regula a taxa de transferência de líquidos em concerto com o fluxo de gás pressurizado portador (aqui N2). Disperse a amostra de líquido injetada através da saída do bocal usando o fluxo de gás nitrogênio.
- Coloque um portador de amostra em forma de slides microscópicos esterilizados (para cinética de sobrevivência) ou redondo lamelas de 25 mm (para o seguimento fluorescente de reparação do ADN processos/cLSM; laser confocal, microscopia eletrônica de varredura) dentro o aerossol accionado electricamente, unidade de pulverização em alinhamento com o bico. A concentração de esporos usado precisa corresponder a uma cem vezes da concentração final desejada.
- Transferir 1 mL da cultura de esporos para entrada de fluido do bocal e iniciar o processo de pulverização de 0.1 s a uma pressão de 1,3 bar. A suspensão de esporos pulverizado (1 x 107) forma uma película fina do slide microscópicas que seca rapidamente em segundos para formar uma monocamada de esporo uniformemente distribuídos. Armazene os portadores de amostra tratada em um recipiente estéril à temperatura ambiente.
3. baixa pressão tratamento de Plasma
- Preparar o sistema de plasma para o tratamento de amostras biológicas e operar o sistema em 5 Pa com plasma de argônio em 500 W por 5 min. Por isso, todas as superfícies do sistema são limpos e aquecidas. Isto reduz a degola de moléculas do ar ambiente, ou seja, nitrogênio, oxigênio e água, enquanto o sistema de ventilação. Após o pré-tratamento do sistema, a câmara de ventilação e coloque as amostras cuidadosamente no centro do vaso reator com a ajuda de prateleiras de vidro.
- Use pelo menos três repetições biológicas. Fechar a câmara e evacuar abaixo 2 pa. em seguida, preencher o gás de processo na câmara. Regular a pressão no sistema para 5 PA.
- Após o tempo definido de processo, desligue a alimentação de energia e gás e cuidadosamente desafogar o sistema para evitar soprando as amostras do porta-amostra. Após a ventilação, retirar as amostras e coloque as amostras para o próximo parâmetro no sistema. Para não-tratados com plasma controles expõem amostras a vácuo só (5 Pa) na presença do gás processo equivalente para o tempo mais longo de plasma aplicada.
4. recuperação e avaliação da sobrevivência de esporos
- Preparar uma solução de autoclavado 10% do acetato de polyvinyl (PVA) e cobrir o transportador de amostra cuidadosamente com aproximadamente 500 µ l e deixe-os secar ao ar por 4 h. tira a camada de PVA secas (agora contendo a amostra de esporos) usando Pinças esterilizadas e transferi-lo para um 2 mL tubo de reação. Adicionar 1 mL de água estéril para o tubo e dissolver a camada PVA via num Vortex. Este procedimento leva a > 95% de recuperação de esporos e não afeta sua capacidade de germinação21.
- Serialmente, dilua a amostra em 01:10 em água estéril em uma placa de 96 poços (ou seja, 270 µ l estéril H2O + diluição de amostra/ex 30 µ l). Placa de 50 µ l de cada diluição em ágar nutriente do caldo lisogenia (LB), incubar as placas a 37 ° C durante a noite e enumerar o número de colônias crescidas (CFU).
5. ao vivo celular microscopia e acompanhamento dos processos de reparação do DNA na germinação de esporos
- Para experimentos de germinação, preparar uma 1 mm espessura 1,5% LB-ágar almofada, fervendo a 700 µ l médio e pipeta-a em uma placa de Petri estéril de microscopia. Depois de 10 min, cortar um 8 x 8 mm x 1 almofada mm LB-ágar com um bisturi estéril e transferir o ágar cuidadosamente em cima de monocamadas de esporos que estão descansando em lamelas de vidro de 25mm.
Nota: Este passo é crucial para visualização de esporos individuais e permitir seguir sua reação, para a ativação de germinação induzida por agar nutriente. Assim, o LB-ágar serve dois propósitos, (1) para corrigir os esporos na superfície, que evita a relocalization ao longo da superfície e fora de foco ótico e (2) para ativar o esporo para a germinação. - Depois de cobrir a amostra com ágar-ágar, transferir a lamela de vidro rapidamente em uma câmara de imagens e microscópio as amostras com um microscópio confocal de varredura a laser automatizado com sistema ótico invertido usando um 63 X / 1.3 avião apocromático objectivo de imersão de óleo.
-
Realizar imagens de fluorescência (YFP) com uma excitação de 514 nm e emissão de comprimento de onda pode ser detectado entre 520 e 560 nm.
- Gravar imagens do brilhante-campo no modo usando um dos multiplicadores do foto (caminho de luz) de verificação.
- Gravar o lapso de tempo série com uma potência de laser de 2,6% e definir a abertura confocal para 5 unidades arejadas e com uma frequência de amostra de 1 frame por 30 s de 0 h às 5 h, dependendo da experiência. É de particular interesse que altas doses de monocromática a laser iluminação em 514 nm completamente inibir a germinação (Figura 1A, B).
- Mantenha as amostras a 37 ° C (umidade do ar ambiente) em uma fase de aquecimento durante todo o processo de geração de imagens. Use pelo menos três réplicas biológicas para cada condição. Em caso de agregação de esporos, distribuição de várias camadas de esporos ou a contaminação por partículas de poeira, bloqueio do tratamento plasma ("sombrear") pode ocorrer e permitir a germinação dos esporos sombreados (Figura 1C, D).
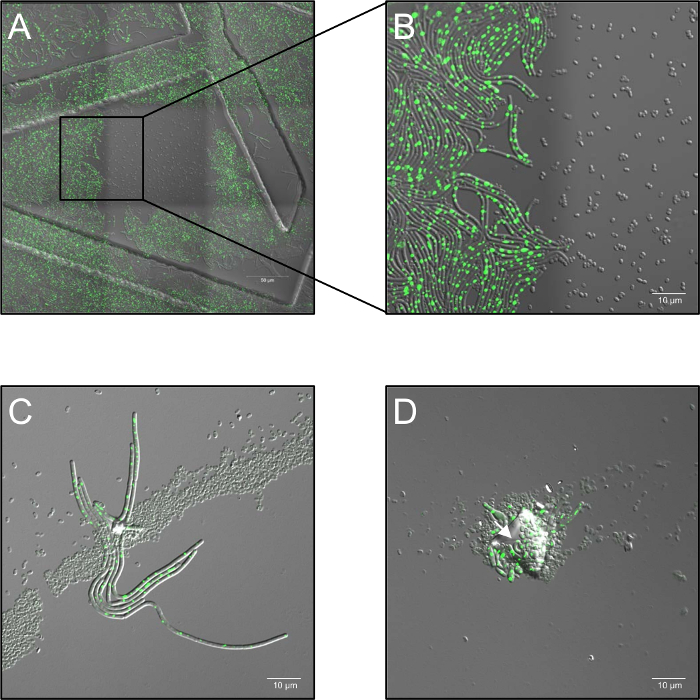
Figura 1: possíveis problemas observaram durante a microscopia de fluorescência confocal célula viva de plasma Tratado esporos. (A, B) Inibição da germinação dos esporos por altas doses de monocromático (514 nm) iluminação a laser. (A) visão geral (3 x 3 quadros costurados) de b. subtilis (LAS72, RecA-YFP) esporos 180 min após o início da germinação. O quadro no meio foi exposto em intervalos de 30 s a altas doses de luz de laser (514 nm, potência do laser 70%), Considerando que as regiões circundantes (= quadros) não foram iluminadas (imagem mesclada de campo claro canal e RecA-YFP fluorescência; ordenou estruturas foram causados pelo uso de 35 milímetros de imagens de pratos com uma grade impressa 500 µm). (B) demonstra um 4 X vista ampliada da fronteira entre a região iluminada e não-iluminado, mostrando que os esporos, que foram expostos a altas doses de iluminação laser monocromática não germinam e crescem, Considerando que esporos em regiões não-iluminado recuperar totalmente para bactérias vegetativas expressando fluorescência RecA-YFP (sinal verde). (C, D) Esporos coberto por partículas de contaminantes ou várias camadas de esporos (setas) parece proteger esporos subjacentes de inactivação pelo tratamento de plasma e permitir a sua germinação e a consequência ("efeito de sombreamento"). (C) esporos foram tratados por plasma para 60 s e imagem 180 min após o início da germinação ou em (D) para 120 s e fotografada após 240 min. clique aqui para ver uma versão maior desta figura.
6. microscopia eletrônica (SEM)
- Use microscopia eletrônica para fornecer informação ultraestrutural sobre a morfologia da superfície de esporos de plasma Tratado em comparação com controles não tratados. Casaco de monocamadas de esporos secos em lamelas com ouro-paládio (3 nm) usando uma camada por pulverização catódica. Use um microscópio eletrônico de varredura de emissão de campo de imagem as amostras, operadas na tensão de aceleração 5 kV incluindo um detector de elétrons de secundária na lente para revelar o contraste de topografia.
7. análise de dados
- Determine a sobrevivência de esporos do quociente N/N0, onde N é a média de UFC das amostras tratadas e N0 é a média CFU de controles de vácuo não tratadas. Plotar a inativação de esporos por tratamento de plasma de argônio em função do tempo (em segundos). Expressar todos os dados como médias e desvios-padrão (n = 3).
- Analise imagens obtidas por imagens de células vivas, usando o software de imagem. Quantificar a percentagem de germinação de esporos e superando após tratamento de plasma, contagem de esporos em quadros representativos no início do experimento, bem como após 4 h. Para determinação de significância em ensaios de sobrevivência de esporos, use ANOVA One-Way-testes (análise de variância) com software estatístico). Valores de P < 0.05 são considerados como estatisticamente significativo.
Resultados
Sobrevivência dos tratados com plasma b. subtilis esporos
Tratamento de plasma de esporos do b. subtilis utilizadas neste estudo show uma diminuição na sobrevivência com o aumento da duração do tratamento a plasma (Figura 2). Esporos da estirpe expressando o recA-gene fundido a YFP mostrou curvas de sobrevivência semelhante a esporos da estirpe selvagem tipo, indicando...
Discussão
Esterilização de superfícies utilizando baixa temperatura, baixa pressão plasma é uma alternativa promissora para procedimentos de esterilização bastante convencional, tais como o tratamento com radiação ionizante a radiação, produtos químicos (por exemplo, gases como H2O2 ou óxido de etileno) ou calor seco e úmido,23. Métodos de esterilização comum principalmente fornecem uma esterilização eficaz, mas eles são conhecidos por influenciar o materia...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores Andrea Schröder agradecer a excelente assistência técnica durante as partes deste trabalho e Nikea J. Ulrich pela sua assistência durante a gravação do vídeo. Gostaríamos também de agradecer a Lyle A. Simmons por sua generosa doação das estirpes de Bacillus subtilis : LAS72 e LAS24. Este trabalho foi financiado em partes por subsídios desde a Fundação de pesquisa alemã (DFG) Paketantrag (PlasmaDecon PAK 728) para PA (AW 7/3-1) e RM (MO 2023/2-1) e o DLR concedem vida de ISS DLR-FuW-Projekt, Programm RF-FuW, Teilprogramm 475 (F.M.F, M.R. e R.M.). F.M.F. foi apoiado por uma bolsa de doutoramento da escola de Helmholtz espaço Life Sciences Research (SpaceLife) no centro aeroespacial alemão (DLR), em Colónia, na Alemanha, que foi financiado pela Associação Helmholtz (Helmholtz-Gemeinschaft) durante um período de seis anos ( N º de Grant VH-ko-300) e recebeu fundos adicionais do DLR, incluindo o Conselho Executivo aeroespacial e o Instituto de Medicina Aeroespacial. Os resultados deste estudo serão incluídos na tese de doutorado de Felix M. Fuchs.
Materiais
| Name | Company | Catalog Number | Comments |
| Two substance nozzle (model 970-8) | Schlick | 14,404 | 230 V, 50 Hz, D 4.484/8, 0.8 mm bore diameter |
| Luria Bertani Medium | Sigma Aldrich | 70122-100G | |
| Tube connectors | Festo | n/a | G 1/8 |
| Magnetvalve DO35-3/2NC-G018-230AC | Bosch Rexroth | 820005100 | |
| PLN Polyamid tube | Festo | 558206 | d = 6 mm |
| Glass slides | VWR | 48300-026 | |
| Electric Timer 550-2-C | Gefran | F000074 | 220 V |
| attofluor cell chamber | Menzel, Fisher Ref. | 3406816 | d=25 mm, round |
| MgSO4*7 H2O | Sigma Aldrich | 13152 | |
| Ca(NO3)2 | Sigma Aldrich | 202967 | |
| MnCl2 * 4 H2O | Sigma Aldrich | 244589 | |
| FeSO4 * 7H2O | AppliChem | 13446-34-9 | |
| Glucose | Merck | 215422 | |
| KCl | Sigma Aldrich | P9541-500G | |
| Nutrient Broth (NB) | Merck | 105443 | |
| Luria-Bertani (LB) | Merck | 110283 | |
| 96-wellplate | ThermoFisher | 243656 | |
| Zeiss LSM 780, Axio Observer Z1 | Carl Zeiss Microscopy GmbH | n/a | |
| Leo 1530 Gemini | Carl Zeiss Microscopy GmbH | n/a | |
| ZEN 2 and ZEN lite 2012 (Software) | Carl Zeiss Microscopy GmbH | n/a | |
| SigmaPlot, version 13.0 (Statistic software) | Systat GmbH, Erkrath, Germany | n/a | |
| Attofluor cell chamber | Invitrogen | A7816 | |
| µ-Dish 35 mm, high Grid-500 Glass Bottom | ibidi | 81168 |
Referências
- Nicholson, W. L., Schuerger, A. C., Race, M. S. Migrating microbes and planetary protection. Trends Microbiol. 17, 389-392 (2009).
- COSPAR. COSPAR Planetery Protection Policy. Space Research Today, COSPAR's Information Bulletin. 193, 1-14 (2015).
- De Geyter, N., Morent, R. Nonthermal plasma sterilization of living and nonliving surfaces. Annu Rev Biomed Eng. 14, 255-274 (2012).
- Shimizu, S., et al. Cold atmospheric plasma - A new technology for spacecraft component decontamination. Planet. Space Sci. 90, 60-71 (2014).
- Lerouge, S., Fozza, A. C., Wertheimer, M. R., Marchand, R., Yahia, L. H. Sterilization by Low-Pressure Plasma: The Role of Vacuum-Ultraviolet Radiation. Plasma Polym. 5, 31-46 (2000).
- Rossi, F., Kylián, O., Rauscher, H., Gilliland, D., Sirghi, L. Use of a low-pressure plasma discharge for the decontamination and sterilization of medical devices. Pure Appl. Chem. 80, 1939-1951 (2008).
- Halfmann, H., Hauser, J., Awakowicz, P., Koller, M., Esenwein, S. A. A double inductively coupled low-pressure plasma for sterilization of medical implant materials. Biomed Tech (Berl). 53, 199-203 (2008).
- Halfmann, H., Denis, B., Bibinov, N., Wunderlich, J., Awakowicz, P. Identification of the most efficient VUV/UV radiation for plasma based inactivation of Bacillus atrophaeus spores. J. Phys. D: Appl. Phys. 40, 5907 (2007).
- Vaishampayan, P., et al. Bacillus horneckiae sp. nov., isolated from a spacecraft-assembly clean room. Int J Syst Evol Microbiol. 60, 1031-1037 (2010).
- Mandic-Mulec, I., Stefanic, P., van Elsas, J. D. Ecology of Bacillaceae. Microbiol Spectr. 3, (2015).
- Alekhova, T. A., et al. Diversity of bacteria of the genus Bacillus on board of international space station. Dokl Biochem Biophys. 465, 347-350 (2015).
- Claus, D., Bekerley, R. C. W., Sneath, P. A. Genus Bacillus Cohn 1872. Bergey's manual of systematic bacteriology. 2, 1105-1141 (1986).
- Setlow, P. Spore Resistance Properties. Microbiol Spectr. 2, (2014).
- Setlow, P. Spores of Bacillus subtilis: their resistance to and killing by radiation, heat and chemicals. J Appl Microbiol. 101, 514-525 (2006).
- Roth, S., Feichtinger, J., Hertel, C. Characterization of Bacillus subtilis spore inactivation in low-pressure, low-temperature gas plasma sterilization processes. J Appl Microbiol. 108, 521-531 (2010).
- Roth, S., Feichtinger, J., Hertel, C. Response of Deinococcus radiodurans to low-pressure low-temperature plasma sterilization processes. J Appl Microbiol. 109, 1521-1530 (2010).
- Setlow, B., Setlow, P. Role of DNA repair in Bacillus subtilis spore resistance. J Bacteriol. 178, 3486-3495 (1996).
- Schaeffer, P., Millet, J., Aubert, J. P. Catabolic repression of bacterial sporulation. Proc. Natl. Acad. Sci. 54, 704-711 (1965).
- Simmons, L. A., et al. Comparison of responses to double-strand breaks between Escherichia coli and Bacillus subtilis reveals different requirements for SOS induction. J Bacteriol. 191, 1152-1161 (2009).
- Raguse, M., et al. Improvement of Biological Indicators by Uniformly Distributing Bacillus subtilis Spores in Monolayers To Evaluate Enhanced Spore Decontamination Technologies. Appl Environ Microbiol. 82, 2031-2038 (2016).
- Horneck, G., et al. Protection of bacterial spores in space, a contribution to the discussion on Panspermia. Orig Life Evol Biosph. 31, 527-547 (2001).
- Opretzka, J., Benedikt, J., Awakowicz, P., Wunderlich, J., Keudell, A. v. The role of chemical sputtering during plasma sterilization of Bacillus atrophaeus. J. Phys. D: Appl. Phys. 40, 2826 (2007).
- Stapelmann, K., et al. Utilization of low-pressure plasma to inactivate bacterial spores on stainless steel screws. Int. J. Astrobiol. 13, 597-606 (2013).
- Raguse, M., et al. Understanding of the importance of the spore coat structure and pigmentation in the Bacillus subtilis spore resistance to low-pressure plasma sterilization. J. Phys. D: Appl. Phys. 49, 285401 (2016).
- Pandey, R., et al. Live cell imaging of germination and outgrowth of individual Bacillus subtilis spores; the effect of heat stress quantitatively analyzed with SporeTracker. PloS one. 8, e58972 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados