Method Article
Na Vivo Eletrofisiológica medição do potencial de ação muscular composto de membros dianteiros em modelos de Mouse de degeneração do neurônio Motor
Neste Artigo
Resumo
A medição da condução nervosa é uma ferramenta útil para avaliar modelos de rato de neurodegeneração, mas frequentemente é aplicado apenas para estimular o nervo ciático em membros traseiros. Aqui, descrevemos uma técnica para medir os compostos muscular potencial de ação (CMAP) na vivo dos músculos do membro anterior de rato inervados pelo plexo braquial.
Resumo
Avaliar a funcionalidade do axônio nervo fornece informações detalhadas sobre a progressão de doenças neuromusculares. Eletrofisiológicas gravações fornecem uma abordagem sensível para medir a condução nervosa em humanos e modelos de roedores. Para ampliar as possibilidades técnicas para Eletromiografia em camundongos, a medição de potenciais de ação muscular composto (CMAPs) do nervo do plexo braquial no membro anterior usando eletrodos de agulha é descrita aqui. Gravações de CMAP após estimulação do nervo ciático em membros traseiros têm sido descritas anteriormente. O método recém-introduzidos aqui permite avaliar a condutividade do nervo em um site adicional e, portanto, fornece uma visão mais profunda da funcionalidade neuromuscular. A técnica fornece informações sobre o número relativo de axônios funcionais tanto a nível de mielinização. Desse modo, esse método pode ser aplicado para avaliar tanto axonal doenças, bem como condições desmielinizantes. Este método minimamente invasivo não exige a extração do nervo e, portanto, é apropriado para medições repetidas para acompanhamento longitudinal no mesmo animal. Gravações semelhantes são realizadas na clínicas configurações para enfatizar a relevância translacional do método.
Introdução
Eletrofisiologia é usada como uma ferramenta de diagnóstico em doenças neuromusculares como miopatias, plexopatias, neuropatias, doenças da junção neuromuscular e doenças do neurônio motor. Em esclerose amiotrófica lateral (ALS), em que são afetados principalmente os neurônios motores, o dano axonal e de paralisia muscular1 são refletidas em amplitudes CMAP reduzidas na eletroneuromiografia (NCS). Na doença de Charcot-Marie-Tooth (CMT) ambos degeneração axonal e desmielinização podem ser estimados em nervos periféricos usando o NCS2. Esta técnica pode ser usada para confirmar o diagnóstico, bem como para avaliar a progressão de doença3,4. NCS permitem a estimativa da patologia axonal, que é deduzida a partir da magnitude do potencial de ação amplitude5, e a extensão da desmielinização - que resulta em velocidade de condução reduzida, prolongada latências distais, ou bloco de condução 6.
Medição de CMAP é um método rápido e sensível para avaliar a condução nervosa em humanos e ratos. Considerando que em pacientes NCS são realizadas rotineiramente em vários locais para gravar diferentes dos nervos e músculos, em camundongos, as medições CMAP normalmente são feitas apenas para o nervo ciático avaliar a funcionalidade do nervo dos membros posteriores. No entanto, em alguns estudos animais seria vantajoso para registro CMAP tanto no primeiro plano - e membros posteriores, por exemplo, a seguir a progressão da doença diferencial entre frente - e membros posteriores em modelos do rato ALS.
Aqui, apresentamos um método para gravação CMAPs partir os forelimbs de ratos utilizando eletrodos de agulha. Além disso, nós fornecemos uma abordagem para medir CMAPs de membros posteriores, da mesma forma com eletrodos de agulha. A medição do CMAPs de membros posteriores com eletrodos de anel foi apresentada anterior7,8. A gravação do CMAPs usando eletrodos de agulha é um método de medição rápido, não requer corte do pelo e o procedimento de medição hind - e patas dianteiras leva apenas 10 min por animal para um pesquisador experiente. Além disso, esta abordagem minimamente invasiva é viável para medidas repetidas permitir o acompanhamento longitudinal de múltiplos nervos em animais.
Protocolo
Todos os animais estavam alojados em condições normais de acordo com as diretrizes do KU Leuven - Universidade de Leuven e orientações europeias associadas (União Europeia Directiva 2010/63/CE relativamente a experiências em animais). Todos os experimentos com animais foram aprovados pelo Comitê de ético local do KU Leuven.
1. anestesia e preparação animal
- Induzi a anestesia no mouse com inalação de oxigênio/isoflurano. Usar 4% de isoflurano para a indução da anestesia e 2-3% para a manutenção em 2,5 L/min de fluxo de oxigênio. Ajustar a porcentagem de isoflurano para a manutenção da anestesia de acordo com a condição do mouse, ou seja, ratos pequenos e fracos exigem menos anestésicos. Confirme a anestesia adequada, por exemplo, aplicando pressão suave do membro posterior andando almofada para verificar a ausência de um reflexo de retirada de dor.
- Controle a temperatura do corpo de rato usando uma placa de aquecimento termostática a 37 ° C para evitar a diminuição da temperatura corporal durante a anestesia.
- Ajuste o mouse com o cone do nariz para a manutenção da anestesia. Certifique-se de que o animal tem entrega suficiente de oxigênio, verificando que o cone do nariz não bloquear vias aéreas e que o animal está respirando constantemente.
- Durante a gravação, verificar se o mouse é suficientemente anestesiado, observando a taxa de respiração (aproximadamente 1 Hz em anestesia) e a ausência de um reflexo de retirada na pressão suave. Aumente a concentração de isoflurano manualmente se a anestesia não é suficientemente forte.
- Após as medições, deixe o mouse para recuperar na chapa de aquecimento ou no calor de uma lâmpada infravermelha até que recuperou a consciência suficiente para manter a prostração esternal, para aproximadamente 2-5 min. Não deixe o mouse autônoma e na companhia de outros ratos até recuperou totalmente da anestesia.
2. medição de CMAP nos membros dianteiros e traseiros
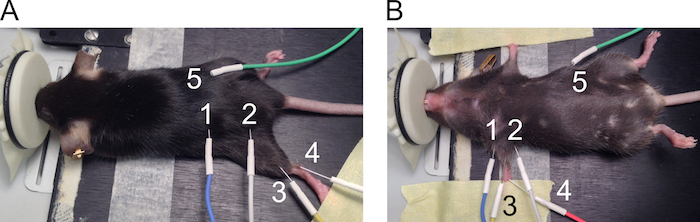
Figura 1. Posicionamento dos eletrodos para medições CMAP. A posição dos eléctrodos é apresentada para hind-(A) e membros dianteiros (B). Os eletrodos são numerados da seguinte forma: 1: ânodo e 2: cátodo estimulando eletrodos, 3: eletrodo gravação ativo, 4: eletrodo de referência e 5: eletrodo de aterramento. Clique aqui para ver uma versão maior desta figura.
- Use os eletrodos de agulha 27G para medições de CMAP membro posterior e membro anterior. Veja a Figura 1 para lugares recomendados de posicionamento do eletrodo.
- Coloca eletrodos sobre o membro posterior como segue.
- Coloque o mouse sobre a almofada de aquecimento na posição de bruços. Estender o membro posterior no joelho e anexar a pata sobre a superfície de trabalho usando fita adesiva (figura 1A).
- Colocar os eletrodos de estimulação por via subcutânea, em ambos os lados do entalhe sciatic com uma distância de aproximadamente 2 cm (1 = ânodo e 2 = cátodo) entre os eletrodos. Levante a pele para inserir a agulha perpendicularmente através da pele e empurrar aproximadamente 5 mm da agulha sob a pele sem perfurar a musculatura subjacente.
- Da mesma forma, coloque o eléctrodo de gravação (3) por via subcutânea, alinhando o músculo gastrocnêmio. Inserir o eléctrodo de referência (4) por via subcutânea, ao lado do tendão de Aquiles em um ângulo de 30 graus e deixe de 2 a 5 mm da agulha sob a pele. Coloque o eléctrodo de terra (5) por via subcutânea no lado do mouse em uma maneira similar como os eletrodos de estimulação, mas a posição deste eletrodo não é crítica para a medição.
- Coloca eletrodos sobre as patas dianteiras como segue.
- Posicione o mouse sobre a almofada de aquecimento na posição supina e usar fita adesiva para estender as duas patas dianteiras dos lados do corpo (figura 1B).
- Colocar os eletrodos de estimulação (1 = ânodo e 2 = cátodo) por via subcutânea em ambos os lados do membro anterior para alinhar com o nervo do plexo braquial. Levante a pele para inserir a agulha perpendicularmente através da pele e empurrar aproximadamente 5 mm da agulha sob a pele sem perfurar a musculatura subjacente.
- Coloque o eletrodo de gravação (3) por via subcutânea na parte superior do músculo bíceps braquial, levantando a pele. Coloque o eletrodo de referência (4) sobre as pastilhas ambulante na profundidade de 3 mm em um ângulo de 30 graus. Coloque o eléctrodo de terra (5) por via subcutânea no lado do mouse.
Nota: Eletrodos estão em estreita proximidade um do outro nesta configuração. Impedir a tocar uns aos outros como isto distorce a gravação de eletrodos.
3. aquisição de dados
- Começar a estimulação pressionando o botão de estímulo recorrente na unidade de controlador e rode o botão do controlador de intensidade para aumentar o estímulo. Estimule todos os axônios usando 1 pulso/s com duração de 0,1 ms estímulo. Selecione a frequência correta e a duração de menus suspensos no software.
- Para chegar a estímulos supramaximal (5-20 mA; em desmielinizantes condições até 60 mA), aplicar estímulos crescentes, girando o botão do controlador de intensidade até a amplitude da resposta CMAP cessa de aumentar. A partir daí, aumente ainda mais o estímulo de 20% para garantir que a amplitude do CMAP atingiu sua resposta máxima. Fim da estimulação pressionando o botão de estímulo recorrente novamente.
- Use a ferramenta de marcador para indicar os seguintes pontos na gravação: iniciação do estímulo, a iniciação da resposta, pico máximo positivo e máximo pico negativo (Figura 2).
- Determine a latência (em ms) como um atraso a partir do início do estímulo para a iniciação da resposta (Figura 2). Defina o início da resposta como o ponto mais antigo, onde a amplitude começa a aumentar. Use a latência para avaliar desmielinização nos axônios.
- Medir a amplitude (mV) do negativo máximo de pico positivo máximo (Figura 2). Use a magnitude da amplitude para correlacionar o número de axônios funcionais.
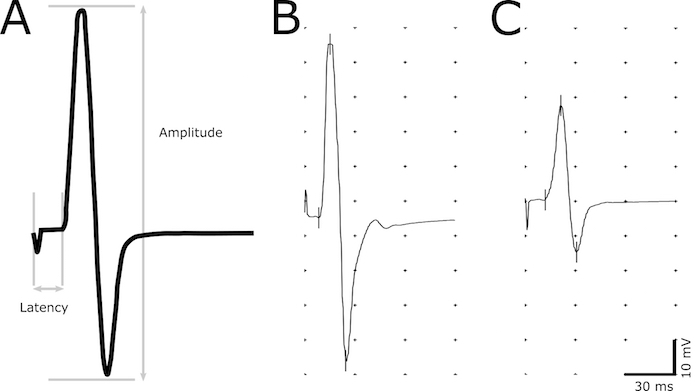
Figura 2. Imagem representativa da resposta CMAP. Uma resposta CMAP descritiva, indicando os locais utilizados para o cálculo da amplitude e latência (A). Latência é determinada pelo atraso a partir da estimulação para o início da resposta CMAP. Amplitude pico-a-pico é medido a partir do negativo máximo ao máximo pico positivo da onda bifásica. Gravações representativas de um animal não-transgênicas saudável (B) e um animal doente com latência prolongada e amplitude reduzida (C). Clique aqui para ver uma versão maior desta figura.
- Como o exato posicionamento dos eléctrodos pode afetar o valor do resultado da gravação, substituir os eléctrodos e medir a mesma coragem para três vezes usando supramaximal estímulo para garantir que a maior resposta é obtida. Use a média de gravações.
Resultados
Medidas eletrofisiológicas da CMAPs utilizando eletrodos de agulha é um método minimamente invasivo e muito sensível a seguir a função neuromuscular ao longo do tempo. A técnica descrita aqui, permite a avaliação da condução nervosa de membro anterior em ratos e assim, fornece insights sobre a funcionalidade do nervo.
O CMAP amplitudes e latências foram medidas de patas dianteiras e traseiras durante o curso da doença em dois modelos de rato de ALS, SOD1 G93A9 e PrP-hFUS-WT310 (Figura 3) e em um modelo do rato do CMT, C61-PMP2211,12 (Figura 4). Modelos de rato ALS foram criados pela superexpressão de genes humanos ALS-relacionadas, ou seja um mutante SOD1 ou selvagem tipo FUS. Em ambos os modelos, os ratos desenvolvem ALS assemelhando-se a degeneração progressiva dos neurônios motores, levando à paralisia. Em controles de littermate não-transgênicas, a amplitude CMAP de hind - e patas dianteiras não mudou ao longo do tempo (Figura 3A). Por outro lado, a amplitude CMAP do nervo ciático do membro posterior foi diminuída drasticamente nos ratos SOD1 G93A, mesmo antes do início do sintoma em torno da idade de 60 dias (Considerando que os primeiros sintomas de motor são geralmente observados com a idade de três meses)13 . A amplitude foi de 90 mV nessa idade na não-transgênicos (não-tg) littermates, Considerando que em camundongos SOD1 G93A era apenas 30 mV. Havia apenas mínima queda ainda maior na amplitude como a doença progrediu para fase tardia sintomática na idade de 150 dias. O declínio na amplitude CMAP, e, portanto, a degeneração dos axônios, atrasou-se no nervo do plexo braquial de membros dianteiros em comparação com o nervo ciático dos membros posteriores. Os membros dianteiros, a progressão da doença também foi mais perceptível como o CMAP amplitude diminuiu de 70 mV-30 mV quando medidos antes e após a manifestação dos défices motor nestes ratos.
No modelo do rato de PrP-hFUS-WT3 de ALS, o aparecimento de déficits motor começa aproximadamente na idade de 28 dias,10, que coincide com o início do declínio da amplitude do CMAP. Este é um modelo mais acelerado da doença como os ratos atingir o estágio final aproximadamente com a idade de 65 dias. O declínio na amplitude CMAP ocorrido mais rapidamente no nervo ciático do membro posterior em comparação com o nervo do plexo braquial no membro anterior, o que indica uma anteriormente degeneração axonal dos membros posteriores (Figura 3D). Esta observação suporta a observação clínica em ambos estes modelos do rato como os membros traseiros estão paralisados notavelmente mais cedo do que os membros dianteiros que permanecem funcionais até os estágios finais do processo de doença.
Em geral, a latência de estímulo à iniciação do potencial de ação foi menor nos membros dianteiros em comparação com os membros traseiros (Figura 3B, E). Isto é simplesmente devido a distância mais curta entre o estímulo e os eletrodos de gravação. A latência fornece uma indicação do nível de mielinização dos axônios. Nossa observação é que latências CMAP são prolongadas durante a progressão da doença em modelos do rato de ALS, embora ALS não é uma doença desmielinizante. Isto é provavelmente devido a perda do maior, mais rápido, realizando axónio motor.
Os ratos C61-PMP22 superexpressão de 3-4 cópias do humano PMP22 e os ratos de heterozigoto recapitular um fenótipo de doença CMT1A muito suave com desmielinização leve e CMAPs reduzidas, mas com nenhum fenótipo visível11,12. Em 1,5 a 2 anos de ratos de idade C61-PMP22, as amplitudes CMAP são reduzidas e latências prolongado tanto nos membros traseiros e patas dianteiras (Figura 4). Representante gravações exibindo amplitude diminuída e resposta atrasada em comparação com uma gravação de um indivíduo sadio são apresentadas na Figura 2B, respectivamente. As latências CMAP em membros anteriores não são afetadas tanto quanto em membros posteriores. Isto é consistente com pacientes CMT1A, quanto mais frequentemente pacientes severamente CMAPs reduzidos ou indetectáveis nos membros inferiores devido à natureza fisiopatológico da CMT como um transtorno dependente do comprimento de14. Além disso, o grau de severidade da doença está correlacionado com amplitude CMAP, ao invés de velocidade latência ou condução, como amplitudes se correlacionam com o grau de integridade axonal14,15. No entanto, os resultados indicam que este método é suficientemente sensível para a detecção desmielinizantes processo tais como aqueles observados em CMT1A.
Variação na amplitude e latência foi menor em grupos não-transgênicos (coeficiente de variação 2-15 e 1-13%, respectivamente). Em todos os casos de transgénicos, havia mais variação nas medições (coeficiente de variação, 8-51% de amplitude e latência % de 1-21), que provavelmente é causada por diferenças na progressão da doença entre os animais. Em todos os casos, a variação foi semelhante nos membros dianteiros e traseiros. A variação no uso de agulha e eletrodos de superfície foi relatada para ser semelhante16.
As intensidades de estímulo necessário não variam entre não-transgênicos e modelos ALS (Figura 3, F). Da mesma forma, o estímulo necessário para alcançar supramaximal estímulo nestes casos era semelhante para frente - e membros traseiros e variou entre 5-12 mA. No CMT, a exigência de intensidades de estímulo aumento tem sido reconhecido17 e o mesmo fenótipo foi visto em ratos C61-PMP22 (Figura 4). O fenômeno foi explicado por impedância elétrica aumentada de endoneurial hipertrófica alterações17.
Para confirmar que a amplitude CMAP gravada a partir de membros anteriores foi devido à estimulação do nervo e não estimulação muscular, realizamos axotomy parcial unilateral no nervo do plexo braquial em 5 meses de idade não-C57BL/6Jax ratos transgénicos (masculinos e femininos) ( Figura 5). Axotomy reduzido a amplitude CMAP de 90 mV a 20 mV, indicando que a maioria dos axônios foram desconectada na operação. Não houve alteração na amplitude do membro anterior contralateral ou dos membros posteriores. Este resultado fortemente indica que a resposta detectada no bíceps braquial foi devido à estimulação do nervo e não resultou da estimulação do músculo.
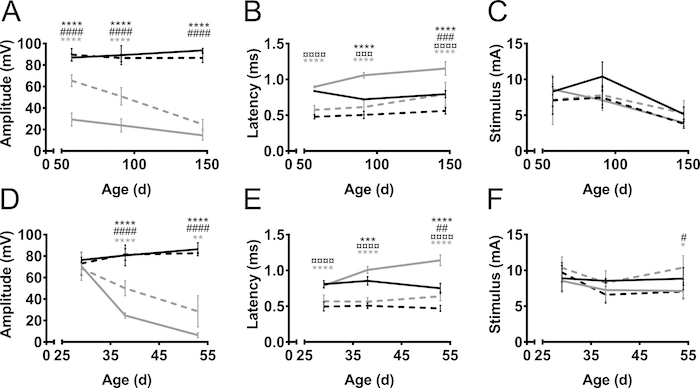
Figura 3. Amplitude do CMAP, latência e estímulo necessário durante o curso da doença no hind - e patas dianteiras em ALS mouse modelos. SOD1-G93A (A–C) e PrP-hFUS-WT3 (D–F) ratos transgénicos do (tg) e não-transgênicos (não-tg) littermates foram medidos no início dos sintomas motor, na fase sintomática e na fase final-sintomático da doença processar, em dias de idade 57, 91 e 147 (d) ou em 29, 38 e 53 dias para ratos SOD1 G93A e WT3-PrP-hFUS, respectivamente. Preta: Não-transgênicas membro posterior, preto tracejado: membro anterior não-transgênicos, cinza: transgénico membro posterior, cinza tracejada: forelimb transgénico. Os resultados são apresentados como média ± SD. Amplitudes (A, D) eram estáveis ao longo do tempo, os animais não-transgênicas, tanto nos membros dianteiros e traseiros. Em animais transgénicos, amplitudes diminuíram durante o processo da doença. Latências (B, E) foram menos afetadas pela doença e foram observadas diferenças importantes entre o hind - e membros anteriores, independentemente do genótipo. O estímulo necessário (C, F) variação foi mínima em todos os grupos. Para SOD1 G93A N = 4 em todos os grupos, exceto para tg 147 d, N = 3. Para PrP-hFUS-WT3 ratos em grupos de idade 29, 38 e 53, N é para não-tg 4, 5 e 4 e tg 7, 5 e 3, respectivamente. Símbolos indicam a diferença entre os grupos da seguinte maneira: *: membro posterior não-tg x tg membro posterior, #: tg não-membro anterior vs forelimb tg, ¤: membro posterior não-tg vs não-tg forelimb, cinza *: membro posterior tg vs membro anterior de tg. ANOVA de duas vias com Tukey o teste de comparações múltiplas, *: p < 0.05, * *: p < 0,01, * * *: p < 0,001, * * *: p < 0,0001. #: p < 0.05, # #: p < 0,01, # # #: p < 0,001, # # # : p < 0,0001. ¤: p < 0.05, ¤: p < 0,01, ¤¤¤: p < 0,001, ¤¤¤: p < 0,0001. Clique aqui para ver uma versão maior desta figura.
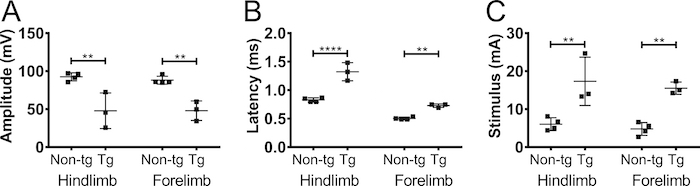
Figura 4. CMAP amplitude, latência e estímulo necessário no hind - e patas dianteiras em camundongos CMT1A. C61-PMP22 ratos transgénicos do (tg) e não-transgênicos (não-tg) littermates foram medidos em 1,5 a 2 anos de idade. Amplitude (A) foi diminuída em hind - e patas dianteiras em ratos transgénicos. Latência (B) prolongou-se em todos os membros em camundongos CMT e mesmo sutil mudança nas patas dianteiras foi detectada com esta medida. Requisito para a intensidade do estímulo (C) foi aumentado em camundongos C61-PMP22, que se assemelha o fenótipo detectado em pacientes CMT1A. Os resultados são apresentados como média ± DP, para não-tg N = 4 e tg N = 3. ANOVA de duas vias com Sidak o teste de comparações múltiplas, * *: p < 0,01, * * *: p < 0,0001. Clique aqui para ver uma versão maior desta figura.
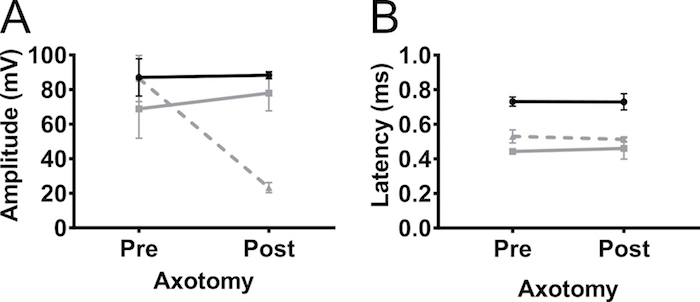
Figura 5. Membro anterior potenciais de ação são causados pela estimulação do nervo. Para excluir a possibilidade de que a resposta CMAP observada foi causada por estimulação muscular, axotomy (parcial) realizou-se no nervo do plexo braquial. CMAP amplitude (A) e a latência (B) foram gravadas antes (pré) e 4 dias depois (pós) a axotomy do plexo braquial em ratos adultos não-transgênicos. Axotomy diminui a amplitude CMAP indicando que a resposta foi devido à estimulação do nervo. Preto: membro posterior, cinza: forelimb contralateral, cinza tracejada: membro anterior ipsilateral. Os resultados são apresentados como média ± DP, N = 2. Clique aqui para ver uma versão maior desta figura.
Discussão
Métodos de gravação sensível são essenciais para avaliar a progressão da doença e especialmente a eficácia de uma terapia em modelos animais de doenças neuronais. Determinar os CMAPs é uma técnica minimamente invasiva eletrofisiológica, que rotineiramente é usada em clínicas e em instalações experimentais para avaliar a condução nervosa em desordens neuromusculares e neuropática3,18. Aqui, descrevemos um novo aplicativo para CMAP gravação em camundongos para medir a condução nervosa no nervo do plexo braquial do membro anterior. O método apresentado permite uma mais versátil e detalhada avaliação longitudinal da função neuronal no mouse modelos de neurodegeneração.
Os eletrodos de agulha são ligeiramente mais invasivos do que eletrodos de anel e especialmente em estudos longitudinais devem ter cuidado para minimizar os danos do tecido. Uma possível desvantagem do método é a lesão resultante da perfuração de um nervo ou músculo. No entanto, após cuidadosa subcutânea colocação dos eléctrodos, o prejuízo e o rompimento dos músculos e nervos podem ser prevenidas. Em contraste com o método utilizando eletrodos de anel, o método apresentado aqui não requer corte das peles de grandes partes do corpo. Como consequência, não há nenhum desconforto ou efeito sobre termorregulação para o animal.
O posicionamento dos eléctrodos é crítico para a gravação correta e consistente do CMAP amplitudes e latências. É aconselhável para reposicionar os eléctrodos e realizar duas ou três medições em cada local para confirmar que a estimulação máxima e respostas são alcançadas. Gravações corretas devem produzir curvas bifásico, como demonstrado na Figura 2. Para padronizar o método, ratos não-transgênicos sem lesões nervosas são os melhores modelos para estabelecer o eletrodo adequado e consistente de posicionamento para a estimulação ideal. Eletrodos agulha reutilizável são adequados para uso repetido se eles regularmente são esterilizados, por exemplo, com glutaraldeído por 20 minutos entre os animais e inspecionados para nitidez.
Em ratos adultos saudáveis, as amplitudes CMAP gravadas com o método apresentado são tipicamente 80-100 mV após estimulação do nervo ciático e o plexo braquial. Isto é notavelmente maior do que as respostas medidas com eletrodos de anel, porque há uma maior impedância causada pela pele para os eletrodos de anel que produz resultados de 20-40 mV8,19,20. Em modelos do rato ALS, as amplitudes CMAP após estimulação do nervo ciático ou plexo braquial em Membros paralisados diminuem para 10-30 mV. A magnitude da amplitude CMAP é menor em animais jovens, já que a amplitude do CMAP aumenta durante desenvolvimento21.
O método que descrevemos aqui é especialmente útil em modelos do rato de ALS, no qual denervação e subsequentes déficits motor, ocorrem no início dos membros posteriores do que nos membros dianteiros13. Além de denervação, o método pode detectar reinervação que é determinada como impedido ou retardado declínio na amplitude CMAP. A redução dramática na amplitude CMAP nos músculos dos membros posteriores, já na idade de aparecimento do sintoma dificulta o acompanhamento adicional de progressão da doença; como as amplitudes CMAP atingem valores muito baixos na fase inicial da doença, eles não diminuir ainda mais durante o processo da doença. Em contraste, perda axonal progride a um ritmo mais lento no nervo do plexo braquial dos membros dianteiros e apresenta uma opção mais sensível para medir a progressão da doença em uma duração mais longa da doença. Além disso, os membros dianteiros menos degenerados poderiam fornecer um site mais potente para avaliar abordagens terapêuticas que visam reforçar a função axonal.
É claro que a técnica apresentada fornece novas possibilidades para a caracterização do mouse modelos de desordens neuromusculares. CMAP recordings com eletrodos de agulha do nervo isquiático e do plexo braquial é um método rápido e reprodutível para avaliar a perda axonal e demyelination em posteriores-assim como nos membros dianteiros. A sensibilidade do método permite a detecção de déficits axonal mesmo antes de notável déficit motor pode ser gravado e, portanto, permite a quantificação precoce desses defeitos. Além disso, a possibilidade de testes repetidos reduz o número de animais necessários e fornece uma visão geral detalhada da progressão de doenças neuromusculares e neuropáticas em diferentes locais em um animal individual.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Esta pesquisa foi apoiada pela KU Leuven ('Abrindo o futuro' e C1), o fundo para científico pesquisa Flandres (FWO-Vlaanderen), a Fundação de Latran Thierry, a associação Belge contre les Maladies neuro-Musculaires (ABMM), a Distrofia Muscular Associação (MDA), o e ALS Association e Liga o ALS (Bélgica). PVD detém um investigatorship sênior de FWO-Vlaanderen. RP foi apoiada por doações da Irlanda clínica correctores Central (CRC) e é suportado atualmente a Universidade Nacional da Irlanda (NUI) e o FWO.
Materiais
| Name | Company | Catalog Number | Comments |
| Resuable subdermal needle electrode, Pl/Ir | Technomed | TE/S61-434 | The Needle is 13 mm (0.51") in length, 0.4 mm (27G) in diameter |
| Natus electrodiagnostic system | Natus Neurology | UltraPro S100 | EMG device |
| Synergy | Natus Neurology | version 20.1.0.100 | EMG software for UltraPro S100 |
| Physitem Controller | Rothacher-Medical GmbH | TCAT-2LV | Heating pad |
| combi-vet Base Anesthesia System Digital Flowmeter with TEC 3 Vaporize | Rothacher & Partner | CV 30-301-D | Isoflurane Vaporizer and flowmeter |
| Iso-Vet 1000 mg/g | Piramal Healthcare UK Limited | AP/DRUGS/220/96 | Isoflurane |
| SOD1-G93A mice | The Jackson Laboratory | #002726 | ALS tg and non-tg control littermates, only females |
| PrP-hFUS-WT3 mice | The Jackson Laboratory | #017916 | ALS tg and non-tg control littermates, all groups balanced for males and females |
| C57BL/6Jax mice | The Jackson Laboratory | #000664 | Non-tg mice for axotomy, male and female |
| C61-PMP22 mice | Mouse line was generously donated by Prof. M. Sereda (The Max Planck Institute of Experimental Medicine, Göttingen, Germany). | CMT tg and non-tg control littermates, all groups balanced for males and females |
Referências
- Brown, R. H., Al-Chalabi, A. Amyotrophic Lateral Sclerosis. N Engl J Med. 377 (2), 162-172 (2017).
- Prior, R., Van Helleputte, L., Benoy, V., Van Den Bosch, L. Defective axonal transport: A common pathological mechanism in inherited and acquired peripheral neuropathies. Neurobiol Dis. , 300-320 (2017).
- de Carvalho, M., et al. Electrodiagnostic criteria for diagnosis of ALS. Clin Neurophysiol. 119 (3), 497-503 (2008).
- Krajewski, K. M., et al. Neurological dysfunction and axonal degeneration in Charcot-Marie-Tooth disease type 1A. Brain. 123 (Pt 7), 1516-1527 (2000).
- Raynor, E. M., Ross, M. H., Shefner, J. M., Preston, D. C. Differentiation between axonal and demyelinating neuropathies: identical segments recorded from proximal and distal muscles. Muscle Nerve. 18 (4), 402-408 (1995).
- Zielasek, J., Martini, R., Toyka, K. V. Functional abnormalities in P0-deficient mice resemble human hereditary neuropathies linked to P0 gene mutations. Muscle Nerve. 19 (8), 946-952 (1996).
- Arnold, W. D., et al. Electrophysiological Motor Unit Number Estimation (MUNE) Measuring Compound Muscle Action Potential (CMAP) in Mouse Hindlimb Muscles. J Vis Exp. (103), (2015).
- Schulz, A., Walther, C., Morrison, H., Bauer, R. In vivo electrophysiological measurements on mouse sciatic nerves. J Vis Exp. (86), (2014).
- Gurney, M. E., et al. Motor neuron degeneration in mice that express a human Cu,Zn superoxide dismutase mutation. Science. 264 (5166), 1772-1775 (1994).
- Mitchell, J. C., et al. Overexpression of human wild-type FUS causes progressive motor neuron degeneration in an age- and dose-dependent fashion. Acta Neuropathol. 125 (2), 273-288 (2013).
- Robertson, A. M., et al. Comparison of a new pmp22 transgenic mouse line with other mouse models and human patients with CMT1A. J Anat. 200 (4), 377-390 (2002).
- Huxley, C., et al. Correlation between varying levels of PMP22 expression and the degree of demyelination and reduction in nerve conduction velocity in transgenic mice. Hum Mol Genet. 7 (3), 449-458 (1998).
- Turner, B. J., Talbot, K. Transgenics, toxicity and therapeutics in rodent models of mutant SOD1-mediated familial ALS. Prog Neurobiol. 85 (1), 94-134 (2008).
- Manganelli, F., et al. Nerve conduction velocity in CMT1A: what else can we tell. Eur J Neurol. 23 (10), 1566-1571 (2016).
- Cornett, K. M., et al. Phenotypic Variability of Childhood Charcot-Marie-Tooth Disease. JAMA Neurol. 73 (6), 645-651 (2016).
- Jacobson, W. C., Gabel, R. H., Brand, R. A. Surface vs. fine-wire electrode ensemble-averaged signals during gait. J Electromyogr Kinesiol. 5 (1), 37-44 (1995).
- Parker, V., Warman Chardon, J., Mills, J., Goldsmith, C., Bourque, P. R. Supramaximal Stimulus Intensity as a Diagnostic Tool in Chronic Demyelinating Neuropathy. Neurosci J. 2016, 6796270 (2016).
- Benoy, V., et al. Development of Improved HDAC6 Inhibitors as Pharmacological Therapy for Axonal Charcot-Marie-Tooth Disease. Neurotherapeutics. 14 (2), 417-428 (2017).
- Xia, R. H., Yosef, N., Ubogu, E. E. Dorsal caudal tail and sciatic motor nerve conduction studies in adult mice: technical aspects and normative data. Muscle Nerve. 41 (6), 850-856 (2010).
- Srivastava, A. K., et al. Mutant HSPB1 overexpression in neurons is sufficient to cause age-related motor neuronopathy in mice. Neurobiol Dis. 47 (2), 163-173 (2012).
- Arnold, W. D., et al. Electrophysiological Biomarkers in Spinal Muscular Atrophy: Preclinical Proof of Concept. Ann Clin Transl Neurol. 1 (1), 34-44 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados