Method Article
Medição de raízes adventícias e rizomas de Turfgrasses usando um sistema de análise de imagem Digital
Neste Artigo
Resumo
Um sistema de análise de imagem baseado em software fornece um método alternativo para estudar a morfologia das espécies rizomatosas e stoloniferous. Este protocolo permite a medição do comprimento e diâmetro de raízes adventícias e rizomas e pode ser aplicado para amostras com uma grande quantidade de biomassa e uma grande variedade de espécies.
Resumo
Comprimento e diâmetro de raízes adventícias ou rizomas são geralmente mensurados usando pinças e réguas simples. Este procedimento é lento e trabalhoso, então muitas vezes é usado em um número limitado de raízes adventícias ou rizomas. Por esta razão, estes traços são limitados na sua utilização para caracterização morfológica das plantas. O uso da tecnologia de software de análise de imagem digital pode superar os erros de medição devido a erros humanos, que tendem a aumentar à medida que o número e o tamanho das amostras também aumentam. O protocolo pode ser usado para qualquer tipo de cultura, mas é particularmente apropriado para forragem ou gramíneas, onde as plantas são pequenas e numerosas. Amostras de relva consistem de biomassa acima do solo e uma camada superior do solo até a profundidade de desenvolvimento máximo rizoma, dependendo da espécie de interesse. Em estudos, amostras são lavadas do solo e raízes adventícias/rizomas são limpos manualmente antes da análise pelo software de análise de imagem digital. As amostras são mais secas em um laboratório de aquecimento do forno para medir peso seco; Portanto, para cada amostra, os dados resultantes são comprimento total, peso seco total e diâmetro médio. Imagens digitalizadas podem ser corrigidas antes da análise, excluindo partes estranhas visíveis, como restantes raízes ou folhas não removidas com o processo de limpeza. Com efeito, estes fragmentos têm normalmente diâmetros muito menores do que raízes adventícias ou rizomas, então eles podem ser facilmente excluídos análise fixando o diâmetro mínimo abaixo do qual os objetos não são considerados. Estolho ou rizoma densidade por unidade de área em seguida pode ser calculada com base no tamanho da amostra. A vantagem deste método é rápida e eficiente de medição do comprimento e diâmetro médio de amostra grande números de raízes adventícias ou rizomas.
Introdução
O estudo da morfologia vegetal destina-se, em grande parte, em todas as disciplinas da ciência de plantas incluindo ecologia, agronomia, biologia e fisiologia. O sistema de raiz da planta é amplamente estudado por sua importância na tolerância de estresse, estabilidade do solo, crescimento da planta e produtividade. Raízes adventícias e rizomas são também amplamente estudados por seu papel em estratégias de propagação da planta, capacidade de recuperação e armazenamento de carboidratos. Raízes adventícias e rizomas são caules modificados que crescem horizontalmente, ou acima do solo (raízes adventícias) ou abaixo do solo (rizomas). Raízes adventícias e rizomas também contêm regularmente espaçados nós e entrenós, bem como nós meristemáticas que são capazes de dar origem a novas raízes e brotos1. Tem havido um grande número de estudos sobre diferentes temas de investigação de raízes, raízes adventícias e rizomas de várias plantas2,3,4,5,6,7, 8. Sistemas de raiz, raízes adventícias e rizomas de turfgrasses são estudados por causa de sua importância no turf qualidade9, Primavera verde-up depois de dormência do inverno10e tolerância de desgaste e capacidade de recuperação11. Além disso, estes órgãos também são estudados em outras culturas, turfgrasses como arroz12, soja4e13de milho e pastagens onde hastes laterais desempenham um papel chave na de controle de erosão de solo5.
Densidade de comprimento de raiz (comprimento de raiz por volume de solo) e o diâmetro médio são comumente medidos através de digitalização software3,4,5,9,14,15, 16,17,18. Inversamente, o comprimento e o diâmetro das raízes adventícias ou rizomas são geralmente mensurados com uma régua e pinça apoio de19,3,20 e exigem um tempo significativo e trabalham21,22 , 23 , 24. assim, eles muitas vezes são medidos em um número restrito de raízes adventícias ou rizomas11,20,25 e muitas vezes são limitados para a caracterização morfológica de plantas espaçadas apenas. O estudo dos traços de estolhos e rizoma em um dossel maduro envolve uma grande quantidade de biomassa de amostragem para que normalmente só Estolho e rizoma peso seco densidade (peso seco por unidade de superfície) são determinados7,11, 26 , 27. massa seca Estolho, na verdade, pode ser medida mais facilmente do que o diâmetro e comprimento de estolhos por amostras em um forno de secagem. No entanto, estolhos comprimento é uma espécie importante e caráter varietal que não é bem relacionado com a massa seca. Um estudo recente sobre rastejando Azevém perene (Lolium perenne) demonstrou que amostras com densidade de comprimento Estolho alta não têm necessariamente de densidade alta Estolho peso6.
Sistemas de análise de imagem fazem a análise de raízes mais rápido28,29, mais precisos e menos propenso a erro humano30,21 do que métodos tradicionais, manual31,32, 33. Além disso, esses sistemas oferecem alta flexibilidade e fácil de usar ferramentas, incluindo a luz, configuração óptica e resolução, que muitas vezes são calibrados para cada digitalizados imagem34. Pornaro et al 24 demonstrou que o sistema de WinRHIZO, um sistema de análise de imagem projetado especificamente para a medição das raízes lavadas, pode fornecer um método alternativo para analisar traços Estolho e rizoma mais completamente do que os atuais métodos de superação erros de medição causados por erros humanos. Para uma descrição morfológica e informações quantitativas sobre o crescimento de estolhos e rizoma, sistemas de análise de imagem podem ser usados para analisar um grande número de amostras rapidamente, mesmo com uma grande quantidade de biomassa, permitindo uma maior precisão estatística. Portanto, pacotes de software de análise de raiz fornecem um método confiável e rápido de alternativa, para estudar o crescimento e a morfologia das raízes adventícias e rizomas de plantas diferentes espécies24.
Apresentamos um experimento realizado no nordeste da Itália para estudar o desenvolvimento Estolho e rizoma de quatro cultivares de bermudagrass (Cynodon spp.). O estudo teve como objetivo aumentar o conhecimento sobre o desenvolvimento de raízes adventícias e rizomas em semeado ("LaPaloma" e "Yukon") e vegetativa ("Patriota" e "Tifway") cultivares de bermudagrass. O experimento foi criado em maio de 2013, e turf amostras foram coletadas em três datas de amostragem por ano, de outono de 2013 para o verão de 2015 [março (antes de acabar o verde), julho (estação de crescimento completo) e outubro (antes da letargia do inverno)]. Para a descrição e explicação deste método, utilizado amostras coletadas no verão da segunda estação de crescimento (julho de 2014), como a grande biomassa das amostras neste momento justifica-se a necessidade de uma análise rápida. O WinRHIZO, uma ferramenta de software de análise de imagem digital projetada especificamente para medições de raiz lavada, foi usada para determinar a densidade de estolhos comprimento e diâmetro médio.
Protocolo
1. coleta de amostras de biomassa
- Coletar amostras, incluindo a biomassa acima do solo e uma camada de solo com uma profundidade apropriada, dependendo da espécie (para espécies de relva, uma profundidade de 15 cm é geralmente suficiente) para garantir a coleta de raízes adventícias e rizomas.
Nota: Total das parcelas devem ser consideradas antes de iniciar o estudo, desde que destrutivo amostras serão tomadas. Em geral, quanto mais tempo o experimento é realizado, quanto maior o tamanho da parcela necessária. - Verifique as condições do solo antes da coleta da amostra: se o solo está seco demais, especialmente em solos pesados, pode ser difícil coletar amostras. Neste caso, irriga as parcelas antes da coleta para suavizar as camadas da amostra.
- Coletar amostras usando um amostrador de núcleo de solo (≥ 8 cm de diâmetro) ou definir a área de superfície para coletar com um frame (≥ 10 x 10 cm) e coletar as amostras com uma pá. Etiquete cada amostra com fita de laboratório.
- Colete várias amostras aleatórias, por parcela, então eles são representativos da população de plantas.
- Usar o mesmo sistema de punção para todo o experimento e gravar a área que cada amostra representa para calcular a densidade de estolhos e rizoma.
Nota: O protocolo pode ser pausado aqui, e as amostras podem ser armazenadas em sacos plásticos e conservadas a uma temperatura inferior a-18 ° C.
2. limpeza da biomassa amostras
- Colocar a amostra em uma peneira grande com 0.5-1.5 aberturas mm dependendo do tamanho do Estolho ou rizoma. As aberturas devem ser pequenas o suficiente para reter todas as raízes adventícias e rizomas, mas grande o suficiente para permitir que as partículas de solo a ser removido. Para solos arenosos, duas peneiras com aberturas diferentes, colocadas um sobre o outro, podem permitir que para melhor precisão e eficiência.
- Limpe as amostras com um fluxo de água com energia suficiente para remover as partículas de solo sem danificar as plantas.
- Recuperar as amostras limpadas e coloque-os em uma bandeja com toalhas de papel, tendo o cuidado de rotular as bandejas apropriadamente.
Nota: O protocolo pode ser pausado aqui, e as amostras podem ser armazenadas em sacos plásticos e conservadas a uma temperatura inferior a-18 ° C. - Ainda mais, limpe as amostras através da remoção de raízes e folhas com tesoura. Durante esse processo, separar raízes adventícias e rizomas, se necessário e registrar informações adicionais tais como os números de plantas, perfilhos e raízes adventícias por planta.
Nota: Remoção de todo tecido de raiz e folha de raízes adventícias e rizomas irá melhorar a precisão. Raizes finas são difíceis de remover; no entanto, através da análise de imagem digital, é possível omiti-los a partir da análise usando um aplicativo de software que exclui órgãos com um diâmetro inferior a um valor escolhido (consulte a etapa 5.1), que é definido com bastante precisão com base em observações de imagens reproduzido na tela. - Raízes adventícias lugar e rizomas em papel rotulado sacos.
Nota: O protocolo pode ser pausado aqui, e as amostras podem ser armazenadas em sacos plásticos e conservadas a uma temperatura inferior a-18 ° C.
3. verificação e análise de amostras de imagem
- Coloca a amostra em uma bandeja de plástico transparente da norma WinRHIZO, equipamento de digitalização. Coloque manualmente o raízes adventícias e rizomas usando fórceps de laboratório para minimizar a sobreposição. Grandes amostras podem precisar de ser dividido em subamostras.
- Não adicione água para a bandeja (como recomendado para raízes), porque raízes adventícias e rizomas têm rigidez suficiente para evitar a excessiva proximidade dos órgãos que podem causar erros de leitura, que geralmente acontece com raizes finas.
- Coloque a bandeja sobre a superfície do scanner.
- Ligue o scanner e começa a correr o programa.
- Verifique o dpi da imagem no menu imagem , comando parâmetro de aquisição de imagem, para um possível controle adicional na imagem salva.
- Verifica o limiar em análise, comando Root & distinção de fundo, para a boa classificação de pixel pertencentes aos órgãos digitalizados.
- Verifique que a superfície da bandeja inteira será verificada no menu imagem , comando parâmetro de aquisição de imagem.
- Verifique a classe de diâmetro exibido para distribuição de órgãos por diâmetro, na área de gráfico acima a imagem digitalizada. Selecione 20 classes de igual largura, com intervalos de 0,1 mm, clicando-se no eixo horizontal do gráfico. Esta função permite a exclusão de dados pertencentes às raízes ou pequenos órgãos, quando raízes adventícias ou rizomas não perfeitamente limpas. A literatura relata que a maioria das raízes das espécies de relva têm diâmetros inferiores a 0,2 mm.
Nota: A largura e número de classes podem ser modificados tendo em conta o diâmetro médio de raízes adventícias e rizomas de amostras analisadas e variabilidade em torno a dizer. Um controle deve ser realizado em algumas amostras para determinar o diâmetro mínimo a ser excluído. - Executar a primeira amostra de digitalização e verificar que o editar permite uma boa análise.
- Siga as instruções do software para salvar a imagem e processados análise. Rotule a imagem e a análise com o rótulo da amostra.
- Prosseguir com a varredura de todas as amostras.
Nota: O protocolo pode ser pausado aqui, e as amostras podem ser armazenadas em sacos plásticos e conservadas a uma temperatura inferior a-18 ° C.
4. medição de peso seco
- Usando um contrapeso eletrônico preciso, coloca as amostras digitalizadas em uma bandeja de alumínio tarada.
- Repita a etapa 4.1 para todas as amostras digitalizadas.
- Colocar todas as amostras dentro de um forno conjunto para 105 ° C e secá-los durante 24 h.
- Remover as amostras e esperar até que o peso do tecido se estabilizou.
- Pese todas as amostras com sua Tara.
- Subtraia a Tara do peso gravada para obter o peso líquido de cada amostra.
5. correção de dados e cálculo do comprimento e densidade de peso
- Correção de comprimento e diâmetro em média
- Converta o arquivo. txt, resultante da análise com WinRHIZO para um arquivo. csv.
- Use os resultados agrupados por classes de diâmetro para excluir dados de órgãos inferiores a 0,2 mm (raízes, parte das folhas, ou arranhões na bandeja).
- Para cada WinRHIZO soma (linhas do arquivo. txt) a ler todos os comprimentos gravou para as classes de diâmetro superiores a 0,2 mm. O comprimento calculado com esta correção é o comprimento efectivo deve ser usado para processamento de dados ainda mais.
- Para cada leitura WinRHIZO, soma as áreas de projeção gravadas para diâmetro classes mais de 0,2 mm. A proporção entre a área de projeção e comprimento dá o diâmetro médio corrigido para exclusão dos órgãos com diâmetros inferiores a 0,2 mm.
- Se a amostra foi dividida em subamostras, calcule o comprimento final como a soma de todos os comprimentos de subamostra e calcular o diâmetro médio final como a proporção entre a soma de todos os comprimentos de subamostra e a soma de todas as áreas de projeção subamostra.
- Quando necessário, calcule a densidade de comprimento e peso por unidade de área superficial com base no tamanho da amostra.
- Use os dados obtidos para análise estatística.
Resultados
Um experimento de campo foi criado no Outono de 2013 para comparar o desenvolvimento Estolho e rizoma de quatro cultivares de bermudagrass, incluindo dois tipos semeados ("LaPaloma" e "Yukon") e dois híbridos vegetativos estéril ("Patriota" e "Tifway"). O delineamento experimental foi um bloco completo ao acaso com três repetições, para um total de 12 parcelas (2 x 2 m).
Raízes catorze adventícias e quatorze rizomas de cada cultivar turf-tipo e os selvagens bermudagrass foram coletados aleatoriamente nas tramas, bem como de plantas selvagens bermudagrass cresce perto as parcelas, para um total de 70 raízes adventícias e 70 rizomas. Todas as raízes adventícias e rizomas foram limpos conforme descrito no protocolo (etapa 2) antes da medição ainda mais. Comprimento e diâmetro de entrenó foram medidos com uma pinça e governante, respectivamente, e o número de nós foi contado para cada Estolho ou rizoma. Os tempos necessários para limpar e medir amostras Estolho e rizoma com régua e compasso de calibre também foram registrados. Diâmetros de estolhos e rizoma foram calculados como o meio de todos os diâmetros de entrenó medidos. Estolho total e total rizoma comprimentos foram calculados como a soma de todos os comprimentos de entrenó. Além disso, total verificados comprimentos e diâmetros digitalizados de cada Estolho e rizoma foram medidos utilizando um sistema de análise de imagem digital, conforme descrito nas etapas 3 e 5. As vezes necessárias medir traços Estolho e rizoma pelo sistema digital de análise foram gravadas. Cada Estolho e rizoma foram, em seguida, corte com tesoura para separar entrenós de nós, e os entrenós foram utilizados para estimar o diâmetro internode digitalizados conforme descrito nas etapas 3 e 5. Coeficientes de correlação de Pearson foram calculados para raízes adventícias e rizomas (n = 70 raízes adventícias, n = 70 rizomas) entre medidos e verificados comprimentos, medidos e digitalizados diâmetros, número de nós e o valor absoluto da diferença entre a medida e diâmetros digitalizados e diâmetros medidos e diâmetros de entrenó digitalizados. Os comprimentos medidos com régua foram usados para calibrar o comprimento estimado através do sistema de análise de imagem digital.
A análise de regressão indicou uma alta correlação entre comprimento Estolho digitalizado e comprimento medido (Figura 1a), com uma inclinação de 1,03 e de-4.22, bem como entre o comprimento de rizoma digitalizado e comprimento medido (Figura 1b), com um inclinação de 1,03 e interceptação de 4.22. Limpeza à mão, 14 raízes adventícias e 14 rizomas levaram um tempo médio de 21 min e 24 s e 11 min e 12 s, respectivamente. O tempo médio de medida de comprimento e diâmetro com uma régua e um compasso de calibre foi 14 min e 6 s de raízes adventícias e 13 min e 35 s de rizomas. A digitalização e software de análise de amostras usando WinRHIZO levou uma média de 11 min para raízes adventícias e 12 min e 4 s de rizomas.
Medido e diâmetros digitalizados foram também significativamente correlacionados em raízes adventícias e rizomas. As relações entre diâmetro medido e digitalizado eram perto de 1:1, indicando um bom ajuste dos dados (Figura 2a e 2b). No entanto, a interceptação indicou que o sistema de análise de imagem digital sobrestimada diâmetro medido, especialmente para valores mais baixos, e que valores mais altos de diâmetro de rizoma foram subestimados. Esta superestimação pode ser devido a nós de estolhos que são verificadas pelo software, afetando a superfície de projeção total que é usada para calcular o diâmetro (relação entre a superfície de projeção total e total comprimento) e em vez disso, são excluídas quando as medições são feitos com a pinça. A correlação entre o número de nós e a diferença entre os valores de diâmetro obtidos pelos dois métodos (medido e digitalizados) foi significativa apenas em raízes adventícias (Figura 3a); Além disso, variações no número de nós explicaram apenas uma pequena parte da variação dessa diferença (R2 = 14%). A correlação significativa entre digitalizados diâmetro internode e medido o diâmetro (pistas de 1,01 e 0,98 para raízes adventícias e rizomas, respectivamente; intercepta de quase zero) (figura 4a e 4b) demonstra esse diâmetro internode pode ser estimado com precisão através do sistema de análise de imagem digital, enquanto nós são removidos. Portanto, diâmetro de comprimento e média de Estolho total das amostras compostas por numerosas raízes adventícias ou rizomas pode ser facilmente e com precisão quantificado usando o sistema de análise de imagem digital.
Como parte de uma experiência em curso, uma amostra de relva (20 x 20 x 15 cm de profundidade) foi coletada em cada parcela sazonalmente de outono de 2013 para 2015 de verão e foi tratada como descrito no protocolo. O Estolho e rizoma comprimento por unidade de área de superfície (densidade de comprimento) e o peso por unidade de área superficial (densidade de peso) de amostras coletadas em julho de 2014 são apresentados na Figura 5. Diferenças na densidade de comprimento Estolho foram observadas entre as cultivares propagadas vegetativamente ("Patriota" e "Tifway") e sem sementes ("La Paloma" e "Yukon"). "Patriota" exibido a maior densidade de comprimento rizoma, seguida por "Tifway" e as cultivares semeadas. A densidade de peso Estolho foi diferente para todas as cultivares, com "Patriota", mostrando o valor mais alto, seguido por "Tifway", "La Paloma" e "Yukon". As cultivares propagadas vegetativamente também exibido densidades de peso rizoma maiores do que as cultivares semeadas. O desenvolvimento de estolhos e rizoma comprimento por unidade de área de superfície (densidade de comprimento) e o peso por unidade de área superficial (densidade de peso) de cultivar patriota durante todo o período de estudo são relatados na Figura 6. Densidade de comprimento Estolho exibido um aumento de março de 2014 para julho de 2014, e não variou de julho de 2014 para julho de 2015. Apenas alguns rizomas foram encontrados em amostras recolhidas em outubro de 2013 e de março de 2014. Densidade de comprimento rizoma aumentou em julho de 2104, atingindo seus valores mais altos, mas diminuiu novamente em outubro de 2014. Densidade de peso Estolho aumentada ligeiramente de março a julho de 2014; no entanto, um aumento mais rápido foi observado de julho para outubro de 2014, com uma diminuição posterior em março de 2015. Densidade de peso rizoma tinha uma tendência semelhante à densidade de comprimento do rizoma, com seu valor mais alto em julho de 2014.
O software inclui na análise todos os objetos na imagem digitalizada. Um exemplo de um layout de análise de imagem digital da WinRHIZO software é apresentado (Figura 7), onde as linhas de cor diferente sobreposição de objetos (raízes adventícias), de diâmetro variável para calcular o comprimento total por classe de diâmetro. Podemos observar que a análise leva em fragmentos de conta das raízes ou folhas. Conforme descrito na etapa 3.9, é possível restringir a largura e o número de classes de diâmetro que são analisados. O histograma mostra a distribuição de comprimentos em classes selecionadas de diâmetro (Figura 7). Este histograma pode ser usada para avaliar as classes de diâmetro mínimo a ser excluído. Uma observação visual deste gráfico na parte superior da tela imagem destaques que o comprimento tem uma distribuição normal em torno de uma média quer dizer classe de diâmetro, com exceção as duas primeiras classes que mostram valores mais altos do que aqueles montagem normal distribuição. Mesmo que as amostras foram cuidadosamente limpos, incluindo essas classes menores, análise de dados pode afetar os resultados, superestimando a densidade de comprimento e diâmetro médio a subestimar. Nossos resultados mostram que o comprimento das classes menores (diâmetro < 0.2 mm) representaram 13-32% dos valores de comprimento de rizoma total resultante da análise de software (tabela 1). Além disso, o diâmetro médio foi subestimado de 2-17% (tabela 1).
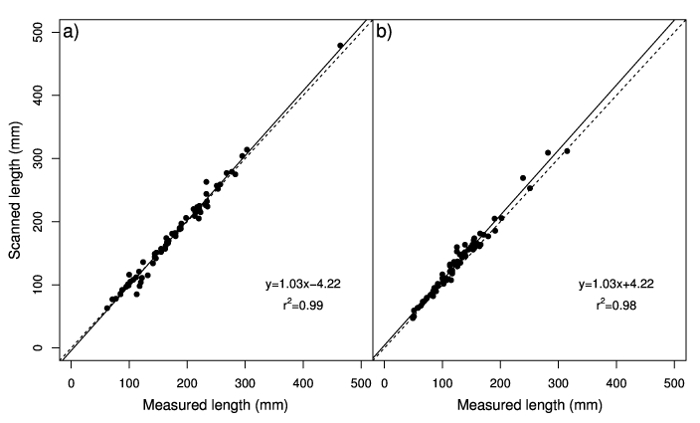
Figura 1: Análise de regressão dos valores de comprimento medido com a régua contra valores estimados com o sistema de análise de imagem digital de bermudagrass raízes adventícias24 (a) e) rizomas b. A linha tracejada representa uma proporção de 1:1. Painel A foi modificado de Pornaro et al 24. clique aqui para ver uma versão maior desta figura.
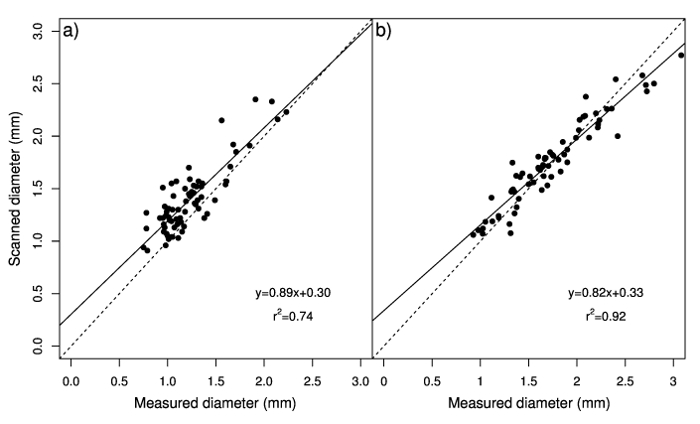
Figura 2: Análise de regressão dos valores de diâmetro medido com a pinça contra valores estimados com o sistema de análise de imagem digital de bermudagrass raízes adventícias24 (a) e rizomas (b). A linha tracejada representa uma proporção de 1:1. Painel A foi modificado de Pornaro et al 24. clique aqui para ver uma versão maior desta figura.
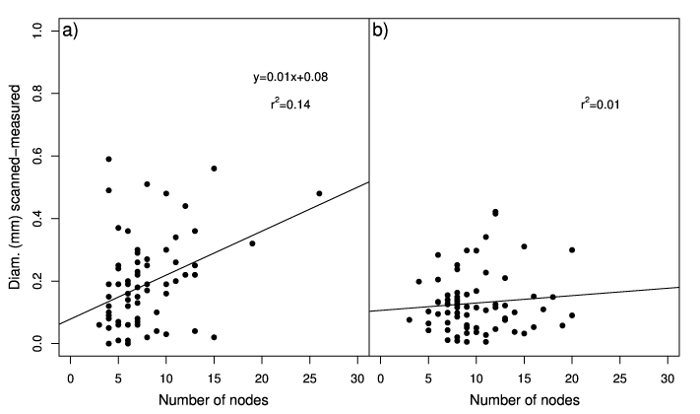
Figura 3: Análise de regressão do número de nós de bermudagrass raízes adventícias24 (a) e rizomas (b) contra valores absolutos da diferença entre o diâmetro estimado com o sistema de análise de imagem digital e medido com o compasso de calibre. A linha tracejada representa uma proporção de 1:1. Painel A foi modificado de Pornaro et al 24. clique aqui para ver uma versão maior desta figura.
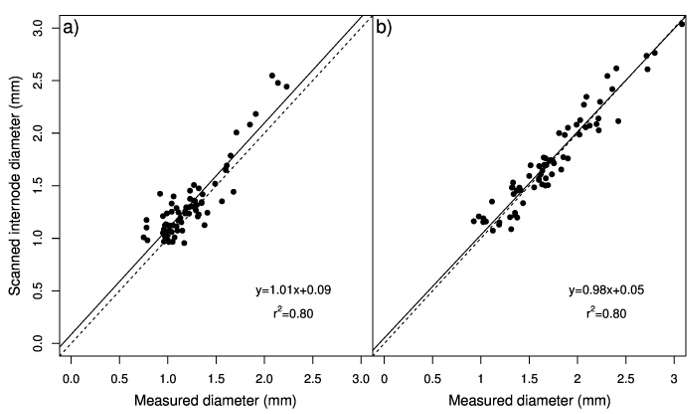
Figura 4: Análise de regressão dos valores de diâmetro medido com a pinça contra valores estimados com o sistema de análise de imagem digital de bermudagrass raízes adventícias24 (a) e rizomas (b) para entrenós só. A linha tracejada representa uma proporção de 1:1. Painel A foi modificado de Pornaro et al 24. clique aqui para ver uma versão maior desta figura.

Figura 5: resultados do exemplo da densidade de comprimento e peso de raízes adventícias e rizomas de um ensaio de campo, comparando quatro cultivares de bermudagrass turfgrass (patriota, Tifway, La Paloma, Yukon). Estolhos comprimento densidade (a), rizoma densidade comprimento (b), Estolho densidade peso (c) e rizoma peso densidade (d). Barras verticais representam erros-padrão de seis repetições. Clique aqui para ver uma versão maior desta figura.
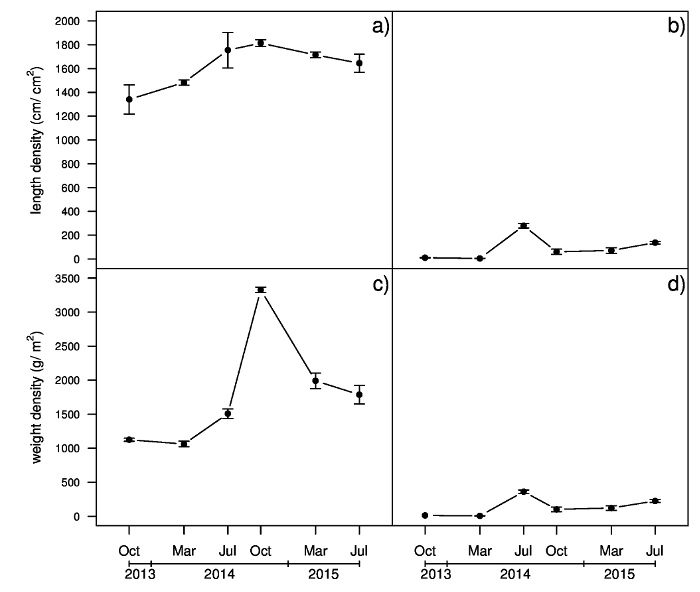
Figura 6: resultados do exemplo da densidade de comprimento e peso de raízes adventícias e rizomas de um ensaio de campo mostrando Estolho e rizoma desenvolvimento de cultivar de bermudagrass patriota. Estolhos comprimento densidade (a), rizoma densidade comprimento (b), Estolho densidade peso (c) e rizoma peso densidade (d). Barras verticais representam erros-padrão de seis repetições. Clique aqui para ver uma versão maior desta figura.
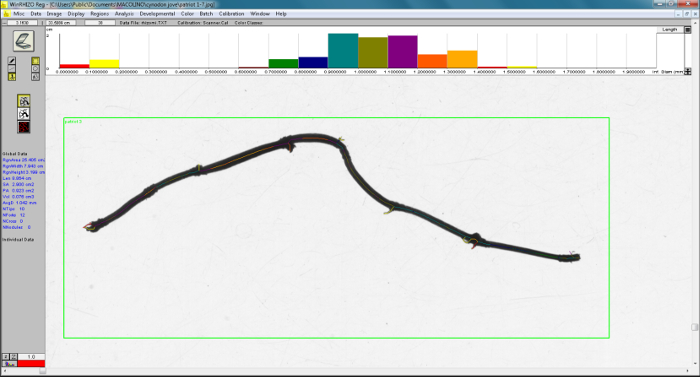
Figura 7: layout de exemplo de análise de imagem digital de software WinRHIZO. A imagem digitalizada em primeiro plano e os gráficos de barras na parte superior da imagem na tela mostram a distribuição de comprimento em classes de diâmetro selecionados. As linhas coloridas indicam a análise de imagem, e cada cor corresponde às cores das classes de diâmetro, relatadas nos gráficos de barras. Clique aqui para ver uma versão maior desta figura.
| Cultivar | Bloco | Comprimento de rizoma (cm/dm2) | Diâmetro médio (mm) | ||||
| < 0.2 mm | total | relaçãoum | < 0.2 mm | total | relaçãob | ||
| Patriota | 1 | 231 | 278 | 16,9 | 1.637846 | 1.5994 | 97,7 |
| Patriota | 2 | 304 | 349 | 12,8 | 1.620667 | 1.588371 | 98,0 |
| Patriota | 3 | 304 | 366 | 16,8 | 1.649918 | 1.621367 | 98,3 |
| Tifway | 1 | 184 | 231 | 20,6 | 2.149745 | 1.9951 | 92,8 |
| Tifway | 2 | 155 | 193 | 19,9 | 1.866253 | 1.76605 | 94,6 |
| Tifway | 3 | 119 | 150 | 20,9 | 1.877386 | 1.75865 | 93,7 |
| La Paloma | 1 | 17 | 23 | 24,4 | 2.139019 | 1.8904 | 88,4 |
| La Paloma | 2 | 26 | 38 | 31,6 | 2.101385 | 1.7455 | 83,1 |
| La Paloma | 3 | 34 | 47 | 27.5 | 2.033729 | 1.7354 | 85,3 |
| Yukon | 1 | 32 | 44 | 28.0 | 1.700155 | 1.4945 | 87,9 |
| Yukon | 2 | 17 | 25 | 33,2 | 1.68339 | 1.4284 | 84,9 |
| Yukon | 3 | 67 | 87 | 23,6 | 1.844721 | 1.6774 | 90,9 |
| um comprimento de classes ≤ 0.2 mm/total length | |||||||
| b diâmetro Total/diâmetro de classes ≤ 0.2 mm | |||||||
Tabela 1: densidade de rizoma comprimento e o diâmetro médio do rizoma com e sem classes de diâmetro menores. Densidade de comprimento, com e sem incluir classes de diâmetro menores do que 0,2 mm e seus rácios (comprimento de classes ≤ 0,2 mm/total de comprimento); e diâmetro médio com e sem incluir classes de diâmetro menores do que 0,2 mm e seus rácios (incluindo classes de diâmetro < 0.2/diâmetro sem incluir diâmetro classes < 0,2 mm).
Discussão
O protocolo descrito aqui foi desenvolvido e avaliado para o estudo de turfgrasses. No entanto, ele pode ser usado sobre uma gama de espécies stoloniferous ou rizomatosas, com os ajustes necessários de acordo com suas características morfológicas, condições ambientais e amostra limpeza de precisão.
O diâmetro médio estimado por meio do presente protocolo não pode ser comparado ao diâmetro do entrenó, medido com um paquímetro. A análise de imagem digital inclui nós e entrenós no cálculo do diâmetro médio, essa é a proporção entre a superfície de projeção total e total comprimento. Como discutido por Pornaro et al 24, diâmetro médio obtido para a bermuda raízes adventícias com WinRHIZO sistema superestimado diâmetro médio valores medidos com o compasso de calibre no entrenó. Diâmetro de Estolho é normalmente usado para descrever o diâmetro dos entrenós Estolho e é um parâmetro comum usado para descrição botânica18,25. Por esta razão, Pornaro et al 24 salientou que o diâmetro médio estimado através do sistema de WinRHIZO e o diâmetro medido manualmente entrenó descrever dois aspectos de morfologia diferente.
O tempo necessário para realizar este protocolo continua a ser um fator limitante para análise de rotina. A fase mais demorada é a limpeza das amostras (passo 2.4). Baseado em nossa experiência, a limpeza de uma amostra de relvado, com uma grande quantidade de biomassa (ou seja, 20 x 20 cm) requer aproximadamente três pessoas que trabalham para 2 a 4 horas. Conforme descrito no protocolo, o processo de limpeza é necessário, para tanto o sistema de análise digital e quando usando o compasso e régua. Quando amostras consistem em um número limitado de raízes adventícias/rizomas, o tempo necessário para coletar dados com os dois métodos é semelhante. No entanto, como o tamanho da amostra é aumentado, o método baseado em software não tem um tempo posterior aumentar, como o único fator limitante é a área da superfície do scanner. Pelo contrário, o tempo necessário para medir os órgãos com régua e compasso de calibre aumenta com o número de raízes adventícias ou rizomas, compondo a amostra.
O estudo dos traços de estolhos e rizoma em turfgrasses maduro tem sempre baseado na medição do comprimento do entrenó e diâmetro e massa seca peso7,11,26,27. Devido ao grande tempo necessário para processar as amostras e a diminuição da precisão com o aumento do tamanho da amostra, medição manual deve ser limitada a um pequeno número de raízes adventícias ou rizomas11,20,25. Como tal, eles apenas podem ser adequados para experimentos de single-planta. A vantagem de um sistema de análise de imagem sobre os métodos tradicionais é que que pode medir o comprimento da grande Estolho ou rizoma amostras e calcular a densidade de comprimento e peso específico (relação peso-comprimento).
Este protocolo permite a medição do comprimento de estolhos e rizoma e cálculo das densidades de comprimento em amostras com grande biomassa (para o qual Estolho ou rizoma peso atualmente é o único parâmetro usado para descrição de morfologia). Comprimento de Estolho ou rizoma pode ser um parâmetro importante em muitos estudos que não pode ser estimado com as técnicas atuais. Estudos recentes sobre a relva diferentes espécies6 demonstraram que densidades de peso e comprimento de estolhos não são sempre correlacionadas, indicando que pode ser desejável para medir vários parâmetros para avaliar adequadamente o sistema Estolho e rizoma. Este método deve ser particularmente apropriado para cultivar ou cultural comparação de práticas de gestão.
Diversas etapas dentro do protocolo são críticas para uma estimativa bem sucedida de comprimento e diâmetro médio de raízes adventícias e rizomas. Devido à alta variabilidade da morfologia vegetal sob condições de ambiente diferentes, o número de amostras (tamanho da amostra) e área de terreno dimensões que devem ser amostragem (dimensão da amostra) deve ser cuidadosamente avaliada e ser tão representativa quanto possível da a população a fim de reduzir a variabilidade de dados. Além disso, limpeza raízes e folhas das raízes adventícias antes de análise é um trabalho meticuloso que requerem atenção especial para evitar overestimations. Por último, antes de processamento de imagens, é recomendável selecionar cuidadosamente a largura do diâmetro classes e mínimo diâmetro usando opções de software para excluir tudo o que não é um Estolho ou rizoma da análise. Cada experimento requer a seleção de um diâmetro mínimo, conforme o diâmetro varia com a espécie e condições ambientais, incluindo as práticas culturais.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Nenhum.
Materiais
| Name | Company | Catalog Number | Comments |
| laboratory tape | Any | NA | Tags may be used to label samples |
| plastic bags | Any | NA | Any plastic bag can be used to keep samples until they have been cleened |
| paper bags | Any | NA | Any paper bag can be used to keep cleaned samples to avoid mold formation |
| paper towels | Any | NA | After samples have been washed with water and before to clean them with scissors it is helpful to put them on a paper towel to absorb water |
| scissor | Any | NA | Any scissor with fine tips |
| aluminium box | Any | NA | Any aluminium box large enough to contain the sample |
| trays | Any | NA | It is helpful to use plastic tray to hold samples during the cleaning process |
| sieve with 0.5-1.5 mm openings | Any | NA | Any sieve |
| soil core sampler | Any | NA | We use core sampler for soil collection with diameter of at least 8 cm |
| squared frame | Any | NA | To collect large samples we use squared frame (10 x 10 cm, or 15 x 15 cm, or 20 x 20 cm) |
| spade | Any | NA | We use spade to pull out samples delimited with squared frame |
| precision electronic balance | Any | NA | Any precision electronic balance |
| laboratory oven | Any | NA | Any laboratory oven |
| freezer | Any | NA | Any freezer |
| WinRHIZO software | Regent Instruments Inc., Quebec | NA | Excluded the "basic" version |
| WinRHIZO scanner | Regent Instruments Inc., Quebec | NA | WinRHIZO system includes a scanner calibrated for the software |
| WinRHIZO scanner accessories | Regent Instruments Inc., Quebec | NA | WinRHIZO system includes accessories, as plastic tray and positioner, to be used with the scanner |
Referências
- Beard, J. B. Beard's turfgrass encyclopedia for golf courses, grounds, lawns, sports fields. , Michigan State University Press. (2004).
- Anderson, J. A., Taliaferro, C. M., Wu, Y. Q. Freeze tolerance of seed- and vegetatively propagated bermudagrasses compared with standard cultivars. Applied Turfgrass Science. , (2007).
- Gennaro, P., Piazzi, L. The indirect role of nutrients in enhancing the invasion of Caulerpa racemosa var cylindracea. Biological Invasions. 16 (8), 1709-1717 (2014).
- Ortiz-Ribbing, L. M., Eastburn, D. M. Evaluation of digital image acquisition methods for determining soybean root characteristics. Crop Management. , (2003).
- Pornaro, C., Schneider, M. K., Leinauer, B., Macolino, S. Above-and belowground patterns in a subalpine grassland-shrub mosaic. Plant Biosystems. 151 (3), 493-503 (2017).
- Pornaro, C., Menegon, A., Macolino, S. Stolon development in four turf-type perennial ryegrass cultivars. Agronomy Journal. , In press (2018).
- Rimi, F., Macolino, S., Richardson, M. D., Karcher, D. E., Leinauer, B. Influence of three nitrogen fertilization schedules on bermudagrass and seashore paspalum: II. Carbohydrates and crude protein in stolons. Crop Science. 53, 1168-1178 (2013).
- Schiavon, M., Macolino, S., Leinauer, B., Ziliotto, U. Seasonal changes in carbohydrate and protein content of seeded bermudagrasses and their effect on spring green-up. Journal of Agronomy and Crop Science. 202 (2), 151-160 (2016).
- Macolino, S., Ziliotto, U. Comparison of Turf Performance and Root Systems of Bermudagrass Cultivars and Companion Zoysiagrass. Acta Horticulturae. 938, 185-190 (2012).
- Giolo, M., Macolino, S., Barolo, E., Rimi, F. Stolons reserves and spring green-up of seeded bermudagrass cultivars in a transition zone environment. HortScience. 48 (6), 780-784 (2013).
- Lulli, F., et al. Physiological and morphological factors influencing wear resistance and recovery in C3 and C4 turfgrass species. Functional Plant Biology. 39, 214-221 (2012).
- Ramalingam, P., Kamoshita, A., Deshmukh, V., Yaginuma, S., Uga, Y. Association between root growth angle and root length density of a near-isogenic line of IR64 rice with DEEPER ROOTING 1 under different levels of soil compaction. Plant Production Science. 20 (2), 162-175 (2017).
- Qin, R., Noulas, C., Herrera, J. M. Morphology and Distribution of Wheat and Maize Roots as Affected by Tillage Systems and Soil Physical Parameters in Temperate Climates: An Overview. Archives of Agronomy and Soil Science. , 1-16 (2017).
- Barnes, B. D., Kopecký, D., Lukaszewski, A. J., Baird, J. H. Evaluation of turf-type interspecific hybrids of meadow fescue with perennial ryegrass for improved stress tolerance. Crop Science. 54, 355-365 (2014).
- Biernacki, M., Bruton, B. D. Quantitative response of Cucumis melo inoculated with root rot pathogens. Plant Disease. 85, 65-70 (2001).
- Bouma, T. J., Nielsen, K. L., Koutstaal, B. Sample preparation and scanning protocol for computersied analysis of root length and diameter. Plant and Soil. 218, 185-196 (2001).
- Kraft, J. M., Boge, W. Root characteristics of pea in relation to compaction and Fusarium root rot. Plant Disease. 85, 936-940 (2000).
- Rimi, F. Performance of warm season turfgrasses as affected by various management practices in a transition zone environment. , University of Padova. Italy. Doctorate thesis (2012).
- Burgess, P., Huang, B. Growth and physiological responses of creeping bentgrass (Agrostis stolonifera) to elevated carbon dioxide concentrations. Horticulture Research. 1, 14021(2014).
- Volterrani, M., et al. The Effect of Increasing Application Rates of Nine Plant Growth Regulators on the Turf and Stolon Characteristics of Pot-grown 'Patriot' Hybrid Bermudagrass. HortTechnology. 25 (3), 397-404 (2015).
- Böhm, W. Methods of studying root systems. Ecological studies: Analysis and synthesis. , Springer-Verlag. New York. 64-71 (1979).
- Box, J. E. Modern methods for root investigations. Plant Roots: The Hidden Half. , Marcel Dekker. New York. 193-237 (1996).
- Dowdy, R. H., Nater, E. A., Dolan, M. S. Quantification of the length and diameter of root segments with public domain software. Communications in Soil Science and Plant Analysis. 26, 459-468 (1995).
- Pornaro, C., Macolino, S., Menegon, A., Richardson, M. WinRHIZO Technology for Measuring Morphological Traits of Bermudagrass Stolons. Agronomy Journal. 109 (6), 3007-3010 (2017).
- Patriot turf bermudagrass. United States Plant Patent. , US PP16,801 P2 (2006).
- Munshaw, G. C., Williams, D. W., Cornelius, P. L. Management strategies during the establishment year enhance production and fitness of seeded bermudagrass stolons. Crop Science. 41, 1558-1564 (2001).
- Rimi, F., Macolino, S., Richardson, M. D., Karcher, D. E., Leinauer, B. Influence of three nitrogen fertilization schedules on bermudagrass and seashore paspalum: I. Spring green-up and fall color retention. Crop Science. 53, 1161-1167 (2013).
- Murphy, S. L., Smucker, A. J. M. Evaluation of video image analysis and line-intercept methods for measuring root systems of alfalfa and ryegrass. Agronomy Journal. 87, 865-868 (1995).
- Wright, S. R., Jennette, M. W., Coble, H. D., Rufty, T. W. Root morphology of young Glycine max, Senna obtusifolia, and Amaranthus palmeri. Weed Science. 47, 706-711 (1999).
- Nilsson, H. E. Remote sensing and image analysis in plant pathology. Annual Review of Phytopathology. 15, 489-527 (1995).
- Ottman, M. J., Timm, H. Measurement of viable plant roots with the image analyzing computer. Agronomy Journal. 76, 1018-1020 (1984).
- Newman, E. I. A method of estimating the total length of roots in a sample. Journal of Applied Ecology. 3, 139-145 (1966).
- Tennant, D. A test of a modified line intersect method of estimating root length. Journal of Ecology. 63, 995-1001 (1975).
- Arsenault, J. L., Pouleur, S., Messier, C., Guay, R. WinRHIZO™, a root-measuring system with a unique overlap correction method. HortScience. 30, 906(1995).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados