É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Escolha e bioensaios não-escolha para estudar a preferência de pupa e sucesso de surgimento de Ectropis grisescens
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para investigar a preferência de pupa de larvas maduras de Ectropis grisescens em resposta a fatores de solo (por exemplo, conteúdo de tipo e umidade do substrato) utilizando bioensaios de escolha. Apresentamos também um protocolo de não-escolha de bioensaios para determinar os fatores que afetam os comportamentos de pupa e sobrevivência de E. grisescens.
Resumo
Muitos insetos vivem acima do solo, como larvas e adultos e como pupate abaixo do solo. Em comparação com as fases acima do solo dos respectivos ciclos de vida, menos atenção no efeito de fatores ambientais como estes insetos quando eles pupate dentro do solo. O looper chá, Warren Ectropis grisescens (Lepidoptera: Geometridae), é uma praga severa de plantas de chá e causou enormes prejuízos econômicos no sul da China. Os protocolos descritos aqui visam investigar, através de bioensaios de múltipla escolha, se amadurecer último ínstar E. grisescens larvas podem discriminar variáveis de solo, tais como o conteúdo de tipo e umidade do substrato e determinar, através da não-escolha bioensaios, o impacto do substrato tipo e umidade conteúdo comportamentos de pupa e o sucesso de surgimento de E. grisescens. Os resultados aumentaria a compreensão da ecologia de E. grisescens pupa e podem trazer insights sobre táticas de gestão dos solos para suprimir as populações de E. grisescens . Além disso, estes bioensaios podem ser modificados para estudar as influências de vários fatores sobre os comportamentos de pupa e sobrevivência de pragas de solo-pupating.
Introdução
Em comparação com as fases de larvas e adultas de insetos, a fase de pupa é altamente vulnerável, devido à limitada capacidade móvel de pupas, que não pode escapar rapidamente de situações perigosas. Pupating abaixo do solo é uma estratégia comum usada por diversos grupos de insetos (por exemplo, nas ordens Diptera1,2,3,4, Coleoptera5, Hymenoptera6, Thysanoptera7e Lepidoptera8,9,10,11,12) para protegê-los de predadores acima do solo e riscos ambientais. Muitos deles são graves agrícola e florestal pragas1,2,3,4,5,6,7,8 ,9,10,11,12. As larvas maduras desses insetos do solo-pupating geralmente deixar seus hospedeiros, cair no chão, vagueiam para encontrar um local adequado, escavam o solo e construir uma câmara pupal por pupating8,10.
O looper chá, Warren Ectropis grisescens (Lepidoptera: Geometridae), é uma das mais importantes pragas desfoliante do chá da planta Camellia sinensis L.13. Embora esta espécie foi descrita pela primeira vez em 1894, ele foi identificado por engano como Prout Ectropis obliqua (Lepidoptera: Geometridae) no passado décadas14,15. As diferenças na morfologia, biologia e distribuição geográfica entre as duas espécies de irmãos têm sido descritas em alguns recentes estudos14,15,16. Por exemplo, Zhang et al . 15 relatou que E. oblíquo ocorreu principalmente nas fronteiras de três províncias (Anhui, Jiangsu e Zhejiang) da China, enquanto que E. grisescens tem uma distribuição geográfica muito maior em comparação com oblíquo E.. Portanto, as perdas econômicas causadas por E. grisescens em grande parte são negligenciadas, e o conhecimento desta praga precisa ser amplamente revisto e renovado16,17,18,19 . Nossos estudos anteriores mostraram que E. grisescens preferem empupar no solo, mas também pode empupar quando o solo não está disponível (condições não-pupa-substrato)11,12.
Este artigo fornece um procedimento passo a passo para (1) determinar a preferência de pupa de E. grisescens em resposta a fatores como o tipo de substrato e umidade de conteúdo por meio de bioensaios de múltipla escolha e (2) determinar o impacto dos fatores abióticos sobre os comportamentos de pupa e sucesso de surgimento de E. grisescens por meio de bioensaios não-escolha. Todos estes bioensaios são conduzidos sob condições de laboratório bem controlados. Além disso, estes bioensaios são adaptados para avaliar a influência de outros fatores sobre os comportamentos de pupa e sobrevivência de diversos insetos de solo-pupating.
Protocolo
1. umidade-escolha bioensaios para determinar a preferência de pupa de E. grisescens
-
Obtenção de larvas de último ínstar maduras de E. grisescens
- Corte brotos frescos (30-40 cm de comprimento) de plantas de chá (Camellia sinensis L.). Inserir a 25-30 tiros num triangular de 250 mL. Encha o frasco com água da torneira. Colocar balões de 3-4 (com brotos de chá) em uma bacia plástica (lado superior: 51 cm de diâmetro; lado inferior: 40 cm de diâmetro; altura: 16 cm).
- Libere as larvas de 1.000-2.000 (segundo ao quinto ínstar) da colônia de E. grisescens laboratório sobre as folhas de chá brotos em cada bacia. Manter estas larvas em condições controladas de laboratório [um fotoperíodo de 14 h de luz seguido por 10 h de escuro (14:10 L:D), 24-28 ° C e umidade relativa de 60-90% (RH)]. Transferi com cuidado as larvas para folhas frescas à mão d cada 1-2. Cada dia remova fezes e detritos do fundo das bacias.
- Selecione as larvas de último ínstar maduras que cair das folhas de chá brotos e maravilhar-se ativamente na parte inferior da bacia. Obter pelo menos 240 larvas maduras para garantir que suficiente larvas estão disponíveis para os bioensaios.
Nota: Apenas selecione ativamente errantes larvas para os experimentos. Não selecione larvas que ficam nas folhas, porque estas não estão prontas para empupar. Além disso, não selecione pré-pupa com actividades limitadas móveis porque eles não ativamente procurará as condições apropriadas depois de ser libertado em arenas de bioensaio.
-
Preparo do substrato
- Coletar e identificar os 4 tipos de substrato (por exemplo, areia, arenoso 1, areia loam 2 e silte argila) usando o método de hidrômetro20. Esterilizar o solo e a areia em um forno de 80 ° C secador para > 3 d e em seguida seque completamente o solo e a areia a 50 ° C durante várias semanas até que o peso seco das amostras de substrato não muda mais ao longo do tempo.
- Solo o solo seco com macacos de madeira e morteiros. Peneire a areia e o solo aterrado através de uma peneira de 3 mm e armazená-los em sacos de plástico seláveis.
- Calcular o conteúdo de umidade diferentes de cada substrato (areia, areia barro 1, areia loam 2 ou silte argila) como segue2:
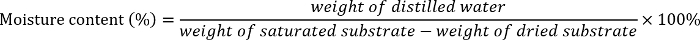
- Adicione a quantidade necessária de água destilada para os sacos de plástico seláveis contendo o solo seco ou areia para preparar 5%-20%-35%-, 50%, 65% e 80%-umidade substrato. Misture bem a água destilada e o solo ou areia.
-
Preparação de bioensaio arena
- Divida igualmente os contentores de polipropileno (lado superior: 20,0 cm de comprimento x 13,5 cm de largura, lado inferior: 17,0 cm de comprimento x 10,0 cm de largura, altura: 6,5 cm) em 6 câmaras com folhas impermeável cloreto de polivinila (PVC) (altura: 3,5 cm). Fixe as folhas de PVC e selar as rachaduras usando cola quente.
Nota: Sele completamente toda a rachadura para impedir a penetração de água. - Para cada teste, encha as 6 câmaras usando o mesmo tipo de substrato com conteúdo de umidade diferentes (5%-20%-35%-, 50%, 65% e 80%-umidade) (Figura 1a).
Nota: Utilize apenas 1 tipo de substrato de conteúdo de umidade diferentes em cada ensaio. Atribua aleatoriamente a ordem das câmaras que contêm o substrato com as 6 humidades. - Cole 4-6 pedaços de folhas de chá fresco usando pequenos pedaços de fita para cobrir a superfície interna das tampas dos recipientes de polipropileno (Figura 1b).
- Divida igualmente os contentores de polipropileno (lado superior: 20,0 cm de comprimento x 13,5 cm de largura, lado inferior: 17,0 cm de comprimento x 10,0 cm de largura, altura: 6,5 cm) em 6 câmaras com folhas impermeável cloreto de polivinila (PVC) (altura: 3,5 cm). Fixe as folhas de PVC e selar as rachaduras usando cola quente.

Figura 1: exemplos de arenas de bioensaio para os testes de escolha. (um) à prova d'água folhas de cloreto de polivinila (PVC) são usadas para dividir igualmente os contentores de polipropileno em 6 câmaras. Folhas de PVC são fixadas com cola quente, e todas as rachaduras são cuidadosamente seladas. Neste exemplo, arenoso 2 com conteúdo de umidade diferentes (5%, 20%, 35%, 50%, 65% e 80% de umidade) são usados para preencher as câmaras nas ordens de aleatoriamente atribuídas. (b) chá fresco folhas são coladas no lado interno das tampas onde o maduro Ectropis grisescens larvas serão lançadas. (c), PVC folhas são utilizadas para dividir igualmente os contentores de polipropileno em 4 câmaras, que são preenchidas com 4 tipos de substratos (areia, areia barro 1, areia loam 2 e sedimentos de barro) com 50% de humidade. Esta figura foi modificada de Wang et al . 11. clique aqui para ver uma versão maior desta figura.
-
Configuração de bioensaio e gravação de dados
- Versão 30 maduras último ínstar larvas (obtidas na etapa 1.1.3) para as folhas de chá fresco coladas na tampa do recipiente de polipropileno. Vire cuidadosamente a tampa e cubra firmemente o recipiente de polipropileno.
- Repita cada teste x 8. Manter as arenas de bioensaio em um cenário de câmara ambiental em um fotoperíodo de 14:10 (L:D) e 26 ° C.
- No dia 5, conte o número de pupas na superfície do solo em cada câmara. Também, desmontar os bioensaios e contar o número de pupas dentro do substrato.
Nota: Apenas conte as pupas ao vivo ou dentro do substrato. Verificar a viabilidade de pupas, observando movimentos abdominais depois de tocar as pupas usando fórceps.
-
Análises de dados
- Para cada ensaio, calcule a porcentagem de pupas encontradas em cada câmara de cada replicar. Transferi os dados de porcentagem para o log de-proporção usando o método fornecido pelo Kucera e Martins Rodrigues21.
- Compare a porcentagem de pupas (dados transformados) em cada câmara usando um unidirecional análise de variância (ANOVA). Definir os níveis de significância de α = 0,05 para cada teste.
2. substrato-escolha bioensaios para determinar a preferência de pupa de E. grisescens
- Repita a etapa 1.1 para obter larvas de último ínstar maduras, e passo 1.2 para preparar o substrato com conteúdo de umidade diferentes. Desta vez, apenas 20%, 50% e 80%-umidade substrato são necessários.
-
Preparação das arenas de bioensaio
- Semelhante ao passo 1.3.1, dividir igualmente os contentores de polipropileno em 4 câmaras, usando folhas de PVC. Fixe as folhas de PVC e selar as rachaduras usando cola quente.
- Para cada teste, encha as câmaras com os 4 tipos de substratos (areia, areia barro 1, areia loam 2 e sedimentos de barro) que possuem o mesmo teor de umidade (20%, 50% ou 80% de umidade) com aleatoriamente atribuído ordens (Figura 1C). Repita a etapa 1.3.3 para preparar as tampas.
- Repita a etapa 1.4 conjunto bioensaios e gravar os dados e passo 1.5 para analisar os dados.
3. não-escolha de bioensaios para determinar o comportamento de solo-construção de galerias e sucesso de surgimento de E. grisescens
- Repita a etapa 1.1 para obter a larva de último ínstar madura, e passo 1.2 para preparar os 4 substratos (areia, areia barro 1, areia loam 2 e sedimentos de barro) 3 conteúdo de umidade (20%, 50% e 80% de umidade).
-
Configuração de bioensaio
- Adicione o substrato em um recipiente plástico (lado superior: 11,5 cm de diâmetro; lado inferior: 8,5 cm de diâmetro; altura: 6,5 cm) a uma profundidade de 3 cm. No total, certifique-se de que haverá 12 tratamentos (as combinações de 4 tipos de substrato e 3 conteúdo de umidade). Repita cada tratamento 7 x.
- Versão 15 larvas de último ínstar maduras sobre o substrato de cada arena de bioensaio. Sele os recipientes firmemente cobrindo as tampas. Manter os bioensaios em um cenário de câmara ambiental em um fotoperíodo de 14:10 (L:D) e 26 ° C.
Nota: Não haverá nenhuma necessidade para colar folhas de chá fresco nas tampas como mencionado nos bioensaios escolha.
-
Gravação de dados e análises
- No dia 3, conte o número de pupas e qualquer larva morta na superfície do substrato de cada replicar. Calcule a percentagem de indivíduos E. grisescens que entocada no substrato da seguinte forma:
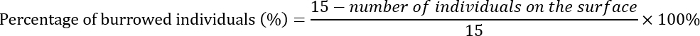
- Registrar o número de adultos emergentes cada dia até que não mais adultos surgiram para 15 m. calcular o sucesso do surgimento da seguinte forma:
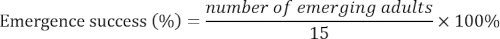
- Compare o percentual de indivíduos entocados e o sucesso de emergência entre os tratamentos utilizando ANOVA One-Way. Definir os níveis de significância de α = 0,05.
- No dia 3, conte o número de pupas e qualquer larva morta na superfície do substrato de cada replicar. Calcule a percentagem de indivíduos E. grisescens que entocada no substrato da seguinte forma:
Resultados
Bioensaios umidade-escolha mostraram que significativamente mais indivíduos E. grisescens puparam sobre ou dentro de 5% e 35%-umidade areia em comparação com a areia de 80%-umidade (Figura 2a). No entanto, significativamente mais indivíduos preferiram pupate ou dentro do solo (arenoso, 1 e 2 e silte-argila) que tinha um teor de umidade intermediária (figuras 2b - 2d).
Discussão
Preferências de pupa, respondendo às variáveis de solo diferentes têm sido estudadas em algumas pragas6,9,22,23. Por exemplo, para estudar a preferência de larvas maduras de Bactrocera tryoni (Froggatt) (Diptera: Tephritidae) entre as condições de umidade do solo diferentes, Hulthen e Clarke22 cenografia um 3x3 latino-Praça contendo 9 recipientes cheios ...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos Yuzhen Wen, Shiping Liang, Shengzhe Jian e Li Yanjun (Faculdade de silvicultura e paisagismo, South China Agricultural University) por sua ajuda na criação de insetos e montagem experimental. Este trabalho foi financiado pela Fundação Nacional de ciências naturais da China (Grant no. 31600516), a Fundação de ciência Natural de Guangdong (Grant No. 2016A030310445) e a ciência e a tecnologia planejamento projeto da província de Guangdong (Grant No. 2015A020208010) .
Materiais
| Name | Company | Catalog Number | Comments |
| Triangular flask | Bomex Chemical (Shanghai) Co., LTD | 99 | 250 mL |
| Plastic basin | Chahua, Fuzhou, China | 100 | upper side: 51 cm in diameter; bottom side: 40 cm in diameter; height: 16 cm |
| Zip lock bags | Glad, Guangzhou, China | 126/133 | |
| Polypropylene containers | Youyou Plastic Factory, Taian, China | 139/155/160/161/190 | upper side: 20.0 cm [L] × 13.5 cm [W], bottom side: 17.0 cm [L] × 10.0 cm [W], height: 6.5 cm |
| Waterproof polyviny chloride sheet | Yidimei, Shanghai, China | 141 | |
| Tape | V-tech, Guangzhou, China | VT-710 | |
| Oven drier | Kexi, Shanghai, China | KXH-202-3A | |
| Environmental chamber | Life Apparatus, Ningbo, China | PSX-280H |
Referências
- Dimou, I., Koutsikopoulos, C., Economopoulos, A. P., Lykakis, J. Depth of pupation of the wild olive fruit fly, Bactrocera (Dacus) oleae (Gmel.) (Dipt., Tephritidae), as affected by soil abiotic factors. Journal of Applied Entomology. 127 (1), 12-17 (2003).
- Chen, M., Shelton, A. M. Impact of soil type, moisture, and depth on swede midge (Diptera: Cecidomyiidae) pupation and emergence. Environmental Entomology. 36 (6), 1349-1355 (2007).
- Holmes, L. A., Vanlaerhoven, S. L., Tomberlin, J. K. Substrate effects on pupation and adult emergence of Hermetia illucens (Diptera: Stratiomyidae). Environmental Entomology. 42 (2), 370-374 (2013).
- Renkema, J. M., Cutler, G. C., Lynch, D. H., MacKenzie, K., Walde, S. J. Mulch type and moisture level affect pupation depth of Rhagoletis mendax Curran (Diptera: Tephritidae) in the laboratory. Journal of Pest Science. 84 (3), 281 (2011).
- Ellis, J. D., Hepburn, R., Luckman, B., Elzen, P. J. Effects of soil type, moisture, and density on pupation success of Aethina tumida (Coleoptera: Nitidulidae). Environmental Entomology. 33 (4), 794-798 (2004).
- Pietrantuono, A. L., Enriquez, A. S., Fernández-Arhex, V., Bruzzone, O. A. Substrates preference for pupation on sawfly Notofenusa surosa (Hymenoptera: Tenthredinidae). Journal of Insect Behavior. 28 (3), 257-267 (2015).
- Buitenhuis, R., Shipp, J. L. Influence of plant species and plant growth stage on Frankliniella occidentalis pupation behaviour in greenhouse ornamentals. Journal of Applied Entomology. 132 (1), 86-88 (2008).
- Zheng, X. L., Cong, X. P., Wang, X. P., Lei, C. L. Pupation behaviour, depth, and site of Spodoptera exigua. Bulletin of Insectology. 64 (2), 209-214 (2011).
- Wen, Y., et al. Effect of substrate type and moisture on pupation and emergence of Heortia vitessoides (Lepidoptera: Crambidae): choice and no-choice studies. Journal of Insect Behavior. 29 (4), 473-489 (2016).
- Wen, Y., et al. Soil moisture effects on pupation behavior, physiology, and morphology of Heortia vitessoides (Lepidoptera: Crambidae). Journal of Entomological Science. 52 (3), 229-238 (2017).
- Wang, H., et al. Pupation behaviors and emergence successes of Ectropis grisescens (Lepidoptera: Geometridae) in response to different substrate types and moisture contents. Environmental Entomology. 46 (6), 1365-1373 (2017).
- Wang, H., et al. No-substrate and low-moisture conditions during pupating adversely affect Ectropis grisescens (Lepidoptera: Geometridae) adults. Journal of Asia-Pacific Entomology. 21 (2), 657-662 (2018).
- Ge, C. M., Yin, K. S., Tang, M. J., Xiao, Q. Biological characteristics of Ectropis grisescens Warren. Acta Agriculturae Zhejiangensis. 28 (3), 464-468 (2016).
- Xi, Y., Yin, K. S., Tang, M. J., Xiao, Q. Geographic populations of the tea geometrid, Ectropis obliqua (Lepidoptera: Geometridae) in Zhejiang, eastern China have differentiated into different species. Acta Entomologica Sinica. 57, 1117-1122 (2014).
- Zhang, G. H., et al. Detecting deep divergence in seventeen populations of tea geometrid (Ectropis obliqua Prout) in China by COI mtDNA and cross-breeding. PloS One. 9 (6), e99373 (2014).
- Ma, T., et al. Analysis of tea geometrid (Ectropis grisescens) pheromone gland extracts using GC-EAD and GC× GC/TOFMS. Journal of Agricultural and Food Chemistry. 64 (16), 3161-3166 (2016).
- Zhang, G. H., et al. Asymmetrical reproductive interference between two sibling species of tea looper: Ectropis grisescens and Ectropis obliqua. Bulletin of Entomological Research. , (2016).
- Luo, Z. X., Li, Z. Q., Cai, X. M., Bian, L., Chen, Z. M. Evidence of premating isolation between two sibling moths: Ectropis grisescens and Ectropis obliqua (Lepidoptera: Geometridae). Journal of Economic Entomology. 110 (6), 2364-2370 (2017).
- Li, Z. Q., et al. Chemosensory gene families in Ectropis grisescens and candidates for detection of Type-II sex pheromones. Frontiers in Physiology. 8, (2017).
- Chen, L. Q. Research on structure of soil particle by hydrometer method. Environmental Science Survey. 29 (4), 97-99 (2010).
- Kucera, M., Malmgren, B. A. Logratio transformation of compositional data: a resolution of the constant sum constraint. Marine Micropaleontology. 34 (1-2), 117-120 (1998).
- Hulthen, A. D., Clarke, A. R. The influence of soil type and moisture on pupal survival of Bactrocera tryoni (Froggatt) (Diptera: Tephritidae). Australian Journal of Entomology. 45 (1), 16-19 (2006).
- Alyokhin, A. V., Mille, C., Messing, R. H., Duan, J. J. Selection of pupation habitats by oriental fruit fly larvae in the laboratory. Journal of Insect Behavior. 14 (1), 57-67 (2001).
- Torres-Muros, L., Hódar, J. A., Zamora, R. Effect of habitat type and soil moisture on pupal stage of a Mediterranean forest pest (Thaumetopoea pityocampa). Agricultural and Forest Entomology. 19 (2), 130-138 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados