Method Article
Um eletrodo de Micro-agar sal ponte para analisar a taxa de rotatividade de próton de proteínas recombinantes de membrana
Neste Artigo
Resumo
Nas medidas eletrofisiológicas, a presença de uma potencial de difusão perturba a medição precisa do potencial reverso, alterando o potencial de eletrodo. Usando uma ponte de sal de micro-agar, o impacto de difusão potencial é minimizado, que permite uma medição mais precisa dos números de volume de negócios de substrato de proteínas de membrana recombinante reconstituído.
Resumo
Até à data, mais de 50% de todas as drogas farmacológicas alvo a cinética de transporte de proteínas de membrana. A caracterização eletrofisiológica das proteínas de membrana transportadora reconstituído em membranas de bicamada lipídica é um método poderoso mas delicado para a avaliação das suas propriedades físico-químicas e farmacológicas. O número do volume de negócios de substrato é um parâmetro único que permite a comparação da atividade de proteínas de membrana diferentes. Um electrogenic dos transportes, o gradiente do substrato translocado cria um potencial de membrana que directamente se correlaciona com a taxa de rotatividade do substrato da proteína. Por meio de eletrodos de cloreto de prata, um potencial de difusão, também chamado junção líquida potencial, é induzido, que altera o potencial de eletrodo e perturba significativamente medições de potencial de membrana precisos. Potencial de difusão pode ser minimizado por uma ponte de sal, que equilibra o potencial de eletrodo. Neste artigo, uma ponte de sal de micro-agar é projetada para melhorar a afinação eletrofisiológica, que utiliza micropipetas para a formação de membrana. A solução salina é preenchida em uma ponta da pipeta conta, estabilizada pela adição de agarose e pode facilmente ser montada em um padrão de eletrodo. O potencial de elétrodo de um eletrodo de ponte de microsal é mais estável em comparação com um padrão de eletrodo. A implementação deste sistema estabiliza o potencial de eletrodo e permite medições mais precisas do potencial de membrana gerados por um gradiente de pH. Usando este sistema, as taxas de rotatividade de prótons das transportadoras mitocondriais UCP1 e UCP3 são revogadas e em comparação com medições anteriores.
Introdução
Proteínas da membrana são alvo de até 60% de todas as drogas farmacêuticas conhecido1. Medidas eletrofisiológicas das proteínas de membrana são uma ferramenta poderosa, mas delicada para analisar o transporte electrogenic de substratos mediada por proteínas de membrana transportadora. A modulação da corrente do transmembrane pela aplicação de tensões constantes ou rampas de tensão permite avaliar as propriedades farmacológicas e físicas das transportadoras, por exemplo, a ativação e inibição de substratos ou os transportes cinética. De especial interesse é o número de volume de negócios de substrato, que exibe a quantidade de substrato que é translocada por uma proteína de membrana por unidade de tempo. É um parâmetro importante quando se compara a cinética de várias proteínas de membrana. Estabelecimento de um gradiente de concentração do substrato carregado através da membrana gera uma força eletromotriz, da qual é deduzido o número de volume de negócios do substrato.
Usando um eletrodo de AgCl, a presença de um buffer de cloreto livre cria um potencial de difusão que altera o potencial de eletrodo e leva a uma mudança nas medições de corrente-tensão2. Embora sempre presente, é insignificante para condutância padrão e medidas de capacidade desde que esses parâmetros são também dependente na encosta da gravação de corrente-tensão (condutância) ou são a diferença de uma única gravação (capacidade), que Cancela o potencial. No entanto, a gravação do potencial reverso, que é criado pelo transporte do substrato, pode significativamente ser perturbada pelo potencial de difusão. Assim, para medidas exatas do potencial reverso, os potenciais de eletrodo tem que ser mantido constante.
O potencial de difusão pode ser minimizada por dois métodos: (i) na presença de uma membrana de BICAMADA, uma concentração de substrato tem que ser aumentada em um lado da membrana3,4, ou (ii) uma ponte de sal equilibra o potencial de eletrodo 5. o primeiro método é altamente dependente da estabilidade das medições. A membrana tem de sobreviver durante vários minutos, a partir da adição de substrato sob agitação até que o substrato é quase igualmente distribuído na solução. Se a membrana rompe no meio, o gradiente de substrato é alterado pelo livre intercâmbio de moléculas carregadas e medições virar imprecisas. O último método equilibra a potencial de difusão, mas é limitado pelo tamanho da afinação. Implementar um pequeno mas funcionamento ponte de sal em uma escala micro para um set-up eletrofisiológico está desafiando6. Para o último método, a solução salina é preenchida em uma dica de conta e estabilizada pela adição de agarose para impedir a difusão da solução de sal para a solução-tampão.
Neste protocolo, uma simples produção de um micro-agar sal ponte e implementação em um set-up eletrofisiológico baseada a pipeta de set-up7 é descrita. Uma dica de conta é ajustada para conter uma solução de KCl 3M com agarose a 1 mol % (p/v) e a ponte de uma solução de eletrodo e buffer de AgCl. A vantagem da ponte de microsal é exibida por vez gravações da mudança de potencial do eletrodo e as medidas mais precisas da membrana potencial em diferentes gradientes de pH. No sistema modelo de proteínas recombinantes, reconstituído em lipossomas, as taxas de rotatividade das transportadoras mitocondriais UCP1 e UCP3 produzidos sob condições similares são revogadas e comparadas ao anterior resultados3,8.
Protocolo
1. produção de proteínas recombinantes de desacoplamento (UCPs) e a formação de membranas de BICAMADA Planar
- Produzir UCP1 recombinante e UCP3, conforme descrito por Rupprecht et al 9 e Hilse et al 10
- Formar as membranas de BICAMADA planar sobre as pontas de pipetas de plástico descartáveis convencionais como descrito por Beck et al 7
2. preparação do eléctrodo Micro-agar sal ponte
- Ajustar uma pipeta conta ponta (ver Tabela de materiais) para o comprimento adequado.
- Marca a posição em uma ponta vazia no qual a ponta contendo tampão será anexado ao e usar uma pinça deslizante para medir o comprimento do eletrodo micro-agar sal ponte.
Cuidado: A ponta de conta deve ser suficientemente compridas introduzir a solução-tampão para as medições. - Corte a ponta do conta com uma faca afiada ou uma lâmina e limpe a superfície de corte com água e etanol.
- Marca a posição em uma ponta vazia no qual a ponta contendo tampão será anexado ao e usar uma pinça deslizante para medir o comprimento do eletrodo micro-agar sal ponte.
- Prepare o eletrodo revestido de AgCl.
- Cortar um fio de Ag de aproximadamente 8 cm de comprimento e limpe-o com água e etanol.
- Pegue um pedaço de lixa e suavizar a superfície de 1 cm de comprimento na extremidade do fio, que deve estar em contacto com a solução de sal.
- Mergulhe a extremidade suavizada em uma solução de KCl 3M e bata-eletroquimicamente com cloreto de usando uma fonte DC em 1.5 V para 10 s.
- Limpe o eletrodo com água, seque-o e ajuste o comprimento do eletrodo do lado sem revestimento AgCl para que penetra a mais profundamente possível de ponta de conta.
Nota: O protocolo pode ser pausado aqui.
- Prepare uma solução de sal de KCl 3M com agarose a 1% (v/v).
- Pesar 4,47 g de KCl e dissolvê-lo em 20 mL de água, agitando-lo num balão.
- Retire o agitador, pesar 0,2 g de agarose e adicioná-lo para o balão.
- Aquece a solução a 100 ° C para derreter o agarose e impedir a coagulação.
Cuidado: O frasco estará muito quente. Não tocá-lo com as próprias mãos. Use luvas para a manipulação.
- Encha a ponta de conta com a solução de sal de agarose.
Atenção: A solução está quente. Protege as mãos e o trabalho cuidadosamente para evitar salpicos.- Se a agarose começa a coagulação, aquece a solução de um sal totalmente derreter o agarose novamente.
- Mergulhe a ponta conta 10 µ l da solução de sal de ágar. Mergulhe-o lentamente e com cuidado evitar ar bolhas na ponta.
- Retire a ponta da pipeta e empurre o eletrodo de AgCl do lado mais amplo da ponta. Certifique-se de que o eléctrodo penetra a solução salina.
- Arrefecer o eletrodo à temperatura e ligá-lo dentro do amplificador.
- Prepare o buffer para as medições.
- Pesar 0,710 g de Na2SO4, 0,195 g do MES, 0,121 g de TRIS, 0,023 g de EGTA, adicionar 100 mL de água destilada para um béquer e agitar a solução.
- Verifique o valor de pH da reserva por meio de um eletrodo de pH e ajustar o valor de pH de 7,32.
- Verifique se o eletrodo de referência e o eletrodo de sal ponte de ágar estão em contato elétrico.
- Adicione 1 mL de tampão de um recipiente de plástico.
- Mergulhe no eléctrodo de referência e o eletrodo de sal ponte de ágar e procure uma resposta de sinal. Se a resposta de sinal está correta, vá para a etapa 2.7.
- Se houver uma resposta de sinal falso ou sem contato elétrico, execute a seguinte resolução de problemas.
- Verifique se o eletrodo estiver em contacto com a solução de sal e empurre o eletrodo na solução.
Nota: Se a solução estiver muito pegajosa, remover a ponte de micro-agar sal e preparar uma nova conta de ponta. - Verifique se existem bolhas de ar dentro da solução de sal. Se sim, prepare uma nova conta de ponta.
- Verifique se a solução de sal está em contato com a solução-tampão. Se não, então cortar outro 1 mm da extremidade da ponta de tubo.
Atenção: Certifique-se de que a ponta é ainda tempo suficiente para penetrar a ponta contendo tampão. Se não há ainda nenhum contato, prepare uma nova conta de ponta. - Se nenhuma dessas etapas ajudar, prepare uma nova conta de ponta.
- Verifique se o eletrodo estiver em contacto com a solução de sal e empurre o eletrodo na solução.
- Para armazenamento, mergulhe o eletrodo de sal ponte de ágar em uma solução de KCl 3M.
Nota: O protocolo pode ser parado aqui. Para uma pausa durante a noite, guarde o eletrodo na solução de sal de KCl 3 M a 4 ° C. - Prepare a ponta de plástico contendo tampão.
Nota: Se o eletrodo foi armazenado durante a noite, tirá-lo e deixá-lo calor até a temperatura ambiente por 30 min.- Pegue uma ponta de conta e dobrar o tubo, 2 cm da borda da parte estreita, cerca de 90 graus, usando um fio de aquecimento.
- Use uma faca bem afiada ou uma lâmina e cortar o tubo em torno de 5 mm da curva.
- Limpe a superfície no final com água e etanol e medir o diâmetro do furo da ponta. A partir disso, calcule a área da superfície.
- Revesti a superfície da ponta com hexano: hexadecano de 85:15 (v: v).
- Pipete 3 µ l de solvente e removê-lo da ponta.
- Espera 1 min para que todos o solvente residual na ponta tenha evaporado.
- Encher a ponta de medição com 3 µ l de tampão e ligá-lo para o eletrodo de ponte de sal.
Observação: Verifique novamente se o eléctrodo de ponte de sal e o eletrodo de referência estão em contato elétrico realizando passo 2.5.3. - Se não há nenhum contato elétrico, verifique o seguinte:
- Verificar se o eletrodo de ponte de sal é em contacto com a solução-tampão. Se não, então ou aumentar o volume da reserva na ponta ou preparar uma dica conta mais.
- Se há uma bolha de ar, retire a ponta do eletrodo a ponte de microsal, volte a encher o buffer na ponta e ligá-lo ao eléctrodo de novo.
3. medição dos parâmetros elétricos da membrana reconstituído com proteína recombinante
- Aplicar um sinal de tensão alternada triangular com máxima Voltagem Umáx = 50 mV e ΔTrampa = 50 ms, que cria uma resposta retangular de corrente alternada. Dos valores médios das correntes positivas e negativas (+ e eu–), calcule a capacidade da membrana de acordo com a seguinte fórmula:
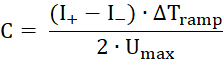
- Aplicar uma rampa de tensão variando de -50 mV para + 50 mV e registro atual. Caber uma função linear para os dados - o declive é a condutância - e calcular o ponto de intersecção do eixo x do ajuste.
- A solução na ponta plástica de descarga e preencher um novo com um buffer contendo uma concentração de substrato aumentada.
- Se nenhuma membrana é formada dentro os primeiros 20-30 s, o volume de descarga e recarregá-lo. Isto garante que o gradiente de concentração através da membrana não altera significativamente durante a formação da membrana.
- Após a formação de uma membrana, execute os passos 3.1 e 3.2 novamente para verificar a formação adequada da membrana e para obter o ponto de intersecção do eixo x.
4. cálculo da taxa de rotatividade do substrato
Nota: Ver trabalhos anteriores para detalhes3,7.
- Estimar a quantidade de proteína na membrana da massa molecular de lipídios e proteínas (Mlipídico e aproteínaM), a área da membrana e do grupo de cabeça um lipido (umamembrana e umlipido) e a proporção em massa da proteína por lipídios (r).
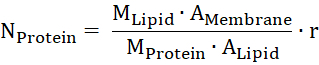
- Calcule o potencial para o substrato transportado de Nernst. R é a constante dos gases, T a temperatura, z a carga do substrato transportado, F o Faraday constante e c1 e c2 as concentrações do substrato de ambos os lados da membrana.
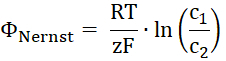
- Desde as gravações de corrente-tensão, apanhe o inverso potencial calculado com a diferença de pontos de interseção do eixo x da linear se encaixa na presença e na ausência do gradiente substrato.
- Calcule a proporção de condutância de substrato, Gsubstrato, para a condutância total da membrana, Gtotal, pelo quociente do potencial reverso para o potencial de Nernst11.
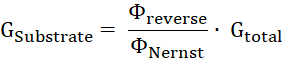
- Calcular o volume de negócios de substrato número ΔNsubstrato por hora unidade ΔT da condutância de substrato (Gsubstrato), a tensão aplicada U e a carga de a z: substrato
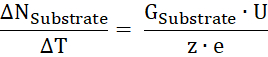
- Partir da relação de substrato transportado por hora para o número de proteínas, calcule o volume de negócios taxa κ.
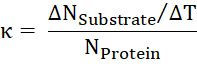
Resultados
Para verificar a minimização de potenciais a difusão, a estabilidade das medições da corrente-tensão de uma membrana intacta foi medida. Na Figura 2,gravações de representante-corrente tensão são retratadas na presença (pontos brancos) e na ausência (pontos pretos) de um gradiente de pH. De acordo com a equação de Nernst, o gradiente de pH induz uma mudança na voltagem. Desde o ponto de interseção do eixo x de um ajuste linear para os dados, é calculado o potencial de mudança. A fim de testar os dois eléctrodos, a mudança no ponto de intersecção do eixo x foi analisada para um padrão AgCl (Figura 2B; pontos brancos) e uma ponte de sal de microágar (Figura 2B; pontos pretos). Uma rampa de tensão foi gravada dez vezes seguidas, e a mudança média no eixo x é representada contra o tempo. Considerando que o eléctrodo de sal ponte agar tinha um deslocamento máximo de menos de 5 mV mesmo após 300 segundos de medição, o padrão de eletrodo variou de 30 mV no comportamento imprevisível e aleatório,.
Em seguida, os dois eléctrodos foram testados em gradientes de pH diferentes(Figura 3). Para o padrão de eletrodo, foi gerado um gradiente de pH de 0.35 e 1.0 (pontos brancos); para o eletrodo de sal ponte de ágar, gradientes de pH de 0.35, 0,7 e 1,0 (pontos negros). A mudança em potencial foi analisada em três medições independentes. Em contraste com um gradiente de 0.35, onde o deslocamento medido apenas varia ligeiramente, a mudança de tensão altera significativamente com o gradiente de pH de 1.0 na ausência da ponte microágar de sal. De um ajuste linear para os dados, a inclinação da função é de 26,4 ± 2,3 mV/ΔpH para o padrão de eletrodo e 50.1 ± 4,6 mV/ΔpH para o elétrodo de micro-agar sal ponte. De acordo com a equação de Nernst, a mudança de potencial calculada é 60.7 mV/ΔpH em T = 32 ° C.
Usando a ponte de sal micro-agar, o número do volume de negócios de próton, κ, mitocondrial UCP1 e UCP3 foi medido e em comparação com medições anteriores (Figura 3B). Semelhante à Figura 3A, ΔpH = 1.0 foi gerado e o potencial reverso foi medido. A quantidade de proteína na membrana foi estimada de acordo com a fórmula fornecida na seção 4 do protocolo, com uma proteína, a proporção de lipídios de 4 µ g / (mg de lipídios), uma massa molecular de 33.000 e 750 de proteínas e lipídios, uma área de superfície de membrana de 3,53 x 10 -4 cm2e uma área por lipídios de 7,8 x 10-15 cm2. O obtidos κwas 5,56 ± 0,38 s-1 e 4,10 ± 0,71 s-1 para UCP1 e UCP3, respectivamente (Figura 3B).
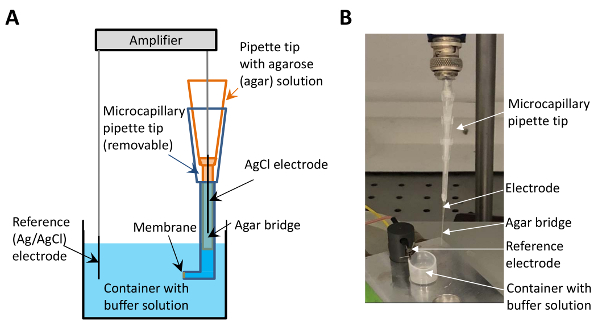
Figura 1 : A afinação eletrofisiológica com a ponte de micro-agar sal. (A), este painel mostra um esboço de afinação. A ponta de conta contendo a solução de sal de ágar (retratada em laranja) é colocada entre o eléctrodo (preto) e a ponta de tampão-contendo (azul). A membrana é formada na superfície no final da ponta do tampão-contendo (indicada pela seta). (B), este painel mostra uma imagem de afinação eletrofisiológica com a implementação da ponte microágar de sal. As setas apontam para o eletrodo, a ponte de sal de micro-agar, o eletrodo de referência e o recipiente com a solução-tampão. Clique aqui para ver uma versão maior desta figura.
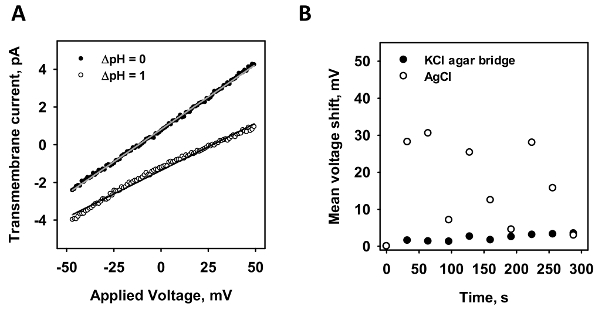
Figura 2 : A comparação de uma ponte de sal de micro-agar e um padrão de eletrodo AgCl. (A), este painel mostra uma representante atual tensão medida na presença (cinzas pontos) e na ausência (pontos brancos) de um gradiente de pH de 1. As linhas representam um ajuste linear para os dados, do qual condutância e o eixo x são obtidos valores de interseção. A mudança de voltagem é avaliada pela diferença dos valores de interseção de ambas as gravações. (B), este painel mostra o deslocamento da membrana potencial de um eletrodo padrão de AgCl (pontos brancos) para um eletrodo de micro-agar sal ponte (pontos pretos) no tempo. Medições de corrente-tensão dez foram gravadas em uma linha e a mudança de média tensão por difusão potencial é plotada contra o tempo. Em todos os experimentos, a membrana foi feita de 45:45:10 mol % DOPC:DOPE:CL reconstituído com ácido araquidônico 15 mol % na concentração de 1,5 mg/mL. O buffer contido 50mm Na2SO4, MES de 10 mM, 10 mM TRIS e 0,6 mM EGTA a pH = 7,34 e T = 32 ° C. Clique aqui para ver uma versão maior desta figura.
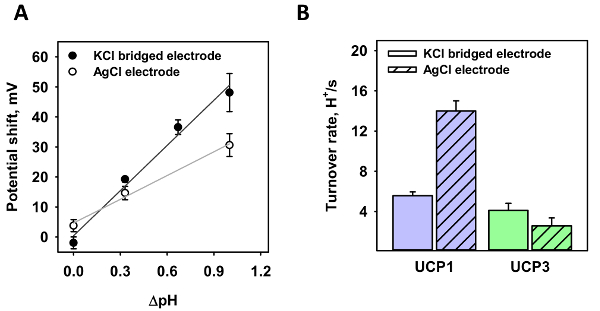
Figura 3 : Número de volume de negócios de próton de UCP1 e UCP3 calculado a partir do potencial reverso na presença de um gradiente de pH. (A), este painel mostra a mudança no potencial de membrana contendo UCP1 de vários gradientes de pH de um padrão AgCl (pontos brancos) e um eletrodo de micro-agar sal ponte (pontos negros). As linhas representam um ajuste linear para os dados. (B), este painel mostra o número do volume de negócios de próton de UCP1 (primeiro conjunto de dados) e UCP3 (segundo conjunto de dados) como calculado partir da razão de mudança de tensão para o potencial de Nernst, de acordo com as fórmulas na secção 4 do protocolo. A primeira barra de cada conjunto representa taxas de rotatividade, medidas com a ponte de sal de microágar. A segunda barra de cada conjunto de dados representa medições anteriores, utilizando um eléctrodo padrão de AgCl. Valores para UCP1 e UCP3 foram tirados de Urbankovaet al . 3 e Macher et al 8. em todas as medições, tornou-se a membrana de 45:45:10 mol % DOPC:DOPE:CL reconstituído com 15 mol % AA e UCP1/UCP3. A concentração de lipídios e proteínas foi 1,5 mg/mL e 4 µ g/mg de lipídios, respectivamente. O buffer contido 50mm Na2SO4, MES de 10 mM, 10 mM TRIS e 0,6 mM EGTA a pH = 7,34 e T = 32 ° C. O pH do buffer para as medições de gradientes foi aumentado para 7,66, 8,00 ou 8.33 adicionando TRIS e foi alterado em pipeta contendo solução. Os valores são o média ± desvio-padrão das três medições independentes. Clique aqui para ver uma versão maior desta figura.
Discussão
A implementação da micro-agar sal ponte com o eletrodo minimiza sua difusão potencial e permite medições mais precisas do potencial de membrana gerados por um gradiente de pH. Na presença de vários gradientes de pH transmembrana, o potencial de mudança de ambos os eletrodos era aceitável no ΔpH = 0.35 quando comparando com o valor teórico do equilíbrio Nernst potencial (ΦNernst = 23,8 mV para ΔpH = 0,4). No entanto, mais gradientes de pH fisiológico, como para a instância em mitocôndrias entre a matriz e o espaço intermembranar, o eletrodo padrão de AgCl falhou medir precisamente a mudança potencial no ΔpH = 1(Figura 3). O eletrodo em ponte com micro-agar sal entregues os valores que foram muito mais comparáveis com a teoria.
Potencial de difusão também pode ocorrer no eletrodo de referência AgCl se a solução-tampão é alterada durante o experimento. Solução tampão de cloreto livre foi usada nas experiências desde que proteínas de desacoplamento foram sugeridas para o transporte de íons cloreto, e o pH foi ajustado usando Tris ou MES. O potencial de eletrodo, na ausência de uma considerável concentração de cloreto, depende principalmente de impurezas de cloreto na solução tampão. Sua composição é inalterada durante os experimentos, simplesmente resultará em um potencial de deslocamento constante. No entanto, para a medição de uma absoluta diferença de potencial entre os dois eletrodos, um sistema de sal-ponte de ágar simples (Ag/AgCl 3 M KCl) pode também ser utilizado para o eletrodo de referência.
Uma ponte de micro-agar sal equilibra a potencial de difusão por um equilíbrio de potencial do eletrodo. A fim de estabilizar a solução salina, agarose a 1% (p/v) foi adicionado para evitar que a mistura da solução de sal com a solução-tampão. Os íons de sal K+ e Cl– tem mobilidades semelhantes em líquido e equilibrar o potencial de eletrodo. Para instalar corretamente a ponte de sal, a solução de ágar de sal tem de ser suficientemente aquecido para encher a ponta de conta sem quaisquer bolhas de ar e para cobrir o eletrodo de AgCl. Antes de nova utilização, contato elétrico entre o eletrodo de ponte de sal e o eletrodo de referência tem que ser verificado. Dependendo da hora em que a ponte de sal é usada, a solução de sal tem de ser suficientemente gelificada para evitar qualquer mistura da solução de sal com o buffer. Isto é especialmente crítico se K+ ou Cl– transportadores são investigados. A ponte de sal foi usada para um tempo muito curto e a eluição de agarose é insignificante neste intervalo de tempo. Uma maior concentração de agarose de até 5%, ou de ágar-ágar (3% - 5%), permite usar a ponte de sal por um longo período de tempo6,12.
Este método permite determinar a cinética de transporte de um transportador de membrana (i) com taxas de baixo volume de negócios e (ii) de mitochondrial proteínas da membrana interna, que dificilmente pode ser investigado em padrão remendo braçadeira set-ups13. Sua precisão é principalmente dependente da medição potencial reversa, que precisão é diminuída em uma condutância da membrana total baixa e pequenos gradientes de concentração que induzem uma membrana potencial abaixo do ruído de gravação.
Usando esta instalação, foram medidos os índices de volume de negócios de UCP1 e UCP3 produzidos nas mesmas condições. Devido o gradiente de pH mais elevado, as taxas obtidas parecem ser mais precisos e imperturbável por artefatos resultantes a partir da mudança de potencial do eletrodo menor. Ele pode ser usado para mais analisar e comparar os transportadores de membrana mitocondrial produzidos em condições similares.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi financiado pelo fundo de pesquisa austríaco (P31559-B20 para E.E.P.). Os autores Sarah Bardakji agradecer a excelente assistência técnica na produção e reconstituição de mouse UCP1 e UCP3 em proteoliposomes.
Materiais
| Name | Company | Catalog Number | Comments |
| Microloader tips | Eppendorf | 5242956.003 | Microcapillary pipette tip |
| Ethanol 99% | AustrAlco Österr. Agrar-Alkohol Handelsges.m.b.H | AAAH-5020-07025-230317 | |
| Kaliumchlorid | Carl Roth GmbH + Co. Kg | 6781.3 | |
| DC supply | Voltcraft | V10/CPG 1940 -01 | |
| Agarose Standard | Carl Roth GmbH + Co. Kg | 3810.2 | |
| Patch Clamp Amplifier | Heka | ||
| Sample tube | Carl Roth GmbH + Co. Kg | 5863.1 | |
| Na2SO4 | Carl Roth GmbH + Co. Kg | 8560.3 | |
| MES | Carl Roth GmbH + Co. Kg | 4256.2 | |
| TRIS | Carl Roth GmbH + Co. Kg | AE15.2 | |
| EGTA | Carl Roth GmbH + Co. Kg | 3054.1 | |
| Hexane | Sigma-Aldrich | 296090-100ML | |
| Hexadecane | Sigma-Aldrich | 296317-100ML | |
| Heating wire | Voltcraft | USPS-2250 |
Referências
- Terstappen, G. C., Reggiani, A. In silico research in drug discovery. Trends in Pharmacological Sciences. 22 (1), 23-26 (2001).
- Raynauld, J. P., Laviolette, J. R. The silver-silver chloride electrode: A possible generator of offset voltages and currents. Journal of Neuroscience Methods. 19 (3), 249-255 (1987).
- Urbankova, E., Voltchenko, A., Pohl, P., Jezek, P., Pohl, E. E. Transport kinetics of uncoupling proteins. Analysis of UCP1 reconstituted in planar lipid bilayers. Journal of Biological Chemistry. 278 (35), 32497-32500 (2003).
- Beck, V., et al. Polyunsaturated fatty acids activate human uncoupling proteins 1 and 2 in planar lipid bilayers. The FASEB Journal. 21 (4), 1137-1144 (2007).
- Shao, X. M., Feldman, J. L. Micro-agar salt bridge in patch-clamp electrode holder stabilizes electrode potentials. Journal of Neuroscience Methods. 159 (1), 108-115 (2007).
- Kleene, S. J. A simple intrapipette salt bridge. Journal of Neuroscience Methods. 46 (1), 11-16 (1993).
- Beck, V., et al. A new automated technique for the reconstitution of hydrophobic proteins into planar bilayer membranes. Studies of human recombinant uncoupling protein 1. Biochimica et Biophysica Acta-Bioenergetics. 1757 (5-6), 474-479 (2006).
- Macher, G., et al. Inhibition of mitochondrial UCP1 and UCP3 by purine nucleotides and phosphate. Biochimica et Biophysica Acta. 1860 (3), 664-672 (2018).
- Rupprecht, A., et al. Role of the transmembrane potential in the membrane proton leak. Biophysical Journal. 98 (8), 1503-1511 (2010).
- Hilse, K. E., et al. The expression of UCP3 directly correlates to UCP1 abundance in brown adipose tissue. Biochimica et Biophysica Acta. 1857 (1), 72-78 (2016).
- Fuks, B., Homble, F. Permeability and electrical properties of planar lipid membranes from thylakoid lipids. Biophysical Journal. 66 (5), 1404-1414 (1994).
- Barry, P. H., Lewis, T. M., Moorhouse, A. J. An optimised 3 M KCl salt-bridge technique used to measure and validate theoretical liquid junction potential values in patch-clamping and electrophysiology. European Biophysics Journal. 42 (8), 631-646 (2013).
- Huang, D., Li, J. The feasibility and limitation of patch-clamp recordings from neonatal rat cardiac ventricular slices. In Vitro Cellular & Developmental Biology. 47 (4), 269-272 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados