Method Article
Um método automatizado para realizar o ensaio de micronúcleos in vitro usando citometria de fluxo de imagem multiespectral
Neste Artigo
Resumo
O ensaio de micronúcleos in vitro é um método bem estabelecido para avaliar a genotoxicidade e a citotoxicidade, mas marcar o ensaio utilizando a microscopia manual é trabalhoso e sofre de subjetividade e variabilidade interscorer. Este papel descreve o protocolo desenvolvido para executar uma versão inteiramente automatizada do ensaio usando a citometria do fluxo da imagem latente Multispectral.
Resumo
O ensaio de micronúcleos in vitro (MN) é frequentemente utilizado para avaliar a citotoxicidade e genotoxicidade, mas a Pontuação do ensaio através da microscopia manual é trabalhosa e introduz incerteza nos resultados devido à variabilidade entre os marcadores. Para remediar isto, a microscopia automatizada da corrediça-exploração assim como métodos convencionais da citometria do fluxo foi introduzida em uma tentativa de remover o viés do artilheiro e de melhorar a taxa de transferência. No entanto, esses métodos têm suas próprias limitações inerentes, como incapacidade de visualizar o citoplasma da célula e a falta de verificação de MN Visual ou armazenamento de dados de imagem com citometria de fluxo. A citometria de fluxo de imagem multiespectral (MIFC) tem o potencial de superar essas limitações. O MIFC combina as imagens fluorescentes de alta resolução da microscopia com a robustez estatística e a velocidade da citometria de fluxo convencional. Além disso, todas as imagens coletadas podem ser armazenadas em arquivos de dose específica. Este artigo descreve o protocolo desenvolvido para realizar uma versão totalmente automatizada do ensaio MN no MIFC. As pilhas TK6 humanas do lymphoblastoid foram ampliadas usando uma solução hipotônica (75 milímetros KCl), fixadas com o formalina de 4% e o índice nuclear foi manchado com Hoechst 33342. Todas as amostras foram executadas em suspensão no MIFC, permitindo a aquisição de imagens de alta resolução de todos os principais eventos necessários para o ensaio (por exemplo, células binucleadas com e sem MN, bem como células mononucleadas e polinucleadas). As imagens foram automaticamente identificadas, categorizadas e enumeradas no software de análise de dados MIFC, permitindo a pontuação automatizada de citotoxicidade e genotoxicidade. Os resultados demonstram que o uso do MIFC para realizar o ensaio in vitro MN permite um aumento estatisticamente significativo da frequência de MN a ser detectado em vários níveis de citotoxicidade quando comparado aos controles de solvente após a exposição de células TK6 a Mitomicina C e colchicina, e que não há aumentos significativos na frequência de MN são observados após a exposição ao manitol.
Introdução
O ensaio de micronúcleos in vitro (MN) é um teste comumente usado para avaliar a citotoxicidade e genotoxicidade como uma ferramenta de triagem em vários campos de estudo, como desenvolvimento químico e farmacêutico, bem como biomonitorização humana entre indivíduos expostos a vários fatores ambientais, ocupacionais e de estilo de vida1,2,3. MN consistem em fragmentos cromossômicos ou cromossomas inteiros gerados durante a divisão celular que não são incorporados em um dos dois núcleos principais da filha. Depois do telophase, este material cromossomático dá forma em um corpo individual, arredondado dentro do citoplasma que é separado de um dos núcleos principais2. Portanto, MN são representativos de dano de DNA e têm sido usados por muitos anos como um EndPoint no teste de genotoxicidade4. O método mais adequado para medir MN é o teste de micronúcleos do citocinese-bloco (CBMN). Usando o ensaio de cbmn, a freqüência de Mn em pilhas binucleados (BNCS) pode ser pontuada incorporando cytochalasin b (CYT-b) na amostra. CYT-B permite divisão nuclear, mas impede a divisão celular e, portanto, restringe a pontuação de MN para BNCs que dividiram apenas uma vez5.
Protocolos que utilizam microscopia e citometria de fluxo foram desenvolvidos e validados e são rotineiramente utilizados para realizar o ensaio in vitro Mn6,7,8,9,10, 11,12,13,14. Microscopia beneficia de ser capaz de confirmar visualmente que MN são legítimos, mas é demorado e propenso a variabilidade entre os marcadores15. Para abordar isso, métodos de microscopia automatizada foram desenvolvidos para digitalizar slides e capturar imagens de núcleos e Mn16,17,18,19, mas o citoplasma não pode ser visualizado, tornando-se difícil determinar se um MN está realmente associado a uma célula específica. Além disso, estes métodos têm dificuldades em identificar células polinucleadas (poli) (incluindo células tri e quadranucleadas) que são necessárias para o cálculo da citotoxicidade ao usar CYT-B9. Métodos de citometria de fluxo desenvolvidos para realizar o ensaio MN empregam fluorescência, bem como intensidades de dispersão para a frente e para o lado para identificar populações de ambos os núcleos e Mn que foram liberados da célula após a Lise20,21 ,22. Isso permite que os dados sejam adquiridos de várias mil células em poucos minutos e permite a análise automatizada23; no entanto, a incapacidade de visualizar as células torna impossível confirmar que os eventos marcados são genuínos. Além disso, a lise da membrana celular inibe o uso de CYT-B, bem como a criação de uma suspensão que contenha outros detritos, como agregados cromossômicos ou corpos apoptóticos, e não há como diferenciá-los do MN24.
À luz destas limitações, a citometria do fluxo de imagem latente de Multispectral (MIFC) é um sistema ideal para executar o ensaio do MN desde que combina o imaginário fluorescente de alta resolução da microscopia com a robustez e a velocidade estatísticas da citometria de fluxo convencional. No MIFC, todas as células são introduzidas em um sistema de fluidics e, em seguida, são concentradas hidrodinamicamente no centro de uma cubeta de célula de fluxo. Iluminação ortogonal de todas as células é realizada através do uso de um brightfield (BF) diodo emissor de luz (LED), um laser de dispersão lateral e (pelo menos) um laser fluorescente. Os fótons fluorescentes são capturados por uma das três (20x, 40x ou 60x) lentes objetivas de alta abertura numérica e, em seguida, passam por um elemento de decomposição espectral. Os fótons são então focados em uma câmera de dispositivo acoplado a carga (CCD) para obter imagens de alta resolução de todas as células que passam pela célula de fluxo. Para evitar borrar ou Streaking, o CCD opera-se no modo da integração do atraso de tempo (TDI) que controla objetos transferindo o índice do pixel da fileira para enfileirá-lo abaixo do CCD na sincronia com a velocidade da pilha no fluxo. Informações de pixel, em seguida, são coletadas da última linha de pixels. A imagem latente de TDI combinada com a decomposição espectral permite que até 12 imagens (2 BF, 10 fluorescentes) sejam capturadas simultaneamente de todas as pilhas que passam através da pilha de fluxo. Todas as imagens capturadas são armazenadas em arquivos de dados específicos da amostra, permitindo que a análise seja realizada a qualquer momento usando o software de análise de dados MIFC. Finalmente, os arquivos de dados mantêm o vínculo entre imagens celulares e pontos em todas as parcelas bivariadas. Isso significa que qualquer ponto em um gráfico bivariado tradicional pode ser realçado e seu BF correspondente e imagens fluorescentes serão exibidas25.
Recentemente, os métodos mifc-baseados foram desenvolvidos para executar o ensaio do MN para a biodosimetria da radiação da triagem26,27,28,29,30,31 e genética Toxicologia32,33 testes. Este trabalho demonstrou que imagens celulares de núcleos principais, MN e o citoplasma podem ser imaged com maior throughput do que outros métodos26. Todos os tipos de células necessários para análise, incluindo células MONO, BNCs (com e sem MN) e células POLY, podem ser identificados automaticamente no software de análise de dados MIFC, e a implementação dos critérios de Pontuação desenvolvidos por Fenech et al. é realizada através de o uso de vários algoritmos matemáticos6,34. Os resultados da biodosimetria mostraram que as curvas de calibração da resposta da dose foram semelhantes em magnitude àquelas obtidas de outros métodos automatizados na literatura quando quantificando a taxa de MN por BNC29. Adicionalmente, o trabalho recente em toxicologia demonstrou que imagens de células MONO, BNCs (com e sem MN) e células POLY podem ser automaticamente capturadas, identificadas, classificadas e enumeradas usando MIFC. O protocolo e a análise dos dados permitiram o cálculo da citotoxicidade e do genotoxicidade após ter exposto TK6 pilhas a diversos clastogens e aneugens32.
O protocolo apresentado neste trabalho descreve um método para realizar o ensaio in vitro MN utilizando MIFC. A técnica de processamento de amostra usada neste trabalho requer menos de 2 h para processar uma única amostra e é relativamente fácil de executar em comparação com outros métodos. A análise de dados no software de análise MIFC é complicada, mas a criação do modelo de análise pode ser realizada em poucas horas seguindo as etapas descritas neste documento. Além disso, uma vez que o modelo foi criado, ele pode ser aplicado automaticamente a todos os dados recolhidos sem qualquer trabalho adicional. O protocolo descreve todas as etapas necessárias para expor células TK6 a clastogénios e aneugens, descreve como cultura, processo e mancha as células, e demonstra como adquirir imagens de alta resolução usando MIFC. Além disso, este artigo ilustra as práticas recomendadas atuais para analisar dados no software MIFC para identificar e marcar automaticamente células MONO, BNCs e células POLY para fins de cálculo de citotoxicidade e genotoxicidade.
Protocolo
1. preparação de meio de cultura e cultivo de células TK6
Nota: alguns produtos químicos utilizados neste protocolo são tóxicos. Inalar, engolir ou entrar em contato com a pele com Cytochalasin B pode ser fatal. Use equipamento de proteção individual apropriado, incluindo um revestimento de laboratório e dois pares de luvas de nitrilo. Lave as mãos cuidadosamente após o manuseamento. Formalina/formaldeído é tóxico se inalado ou engolido; é irritante para os olhos, sistema respiratório e pele; e pode provocar sensibilização por inalação ou contacto com a pele. Há um risco de sérios danos aos olhos. É um potencial carcinógeno.
- Prepare 565 mL de meio de cultura 1x RPMI. Adicionar 5 ml de MEM não essenciais aminoácidos (100x), 5 mL de piruvato de sódio (100 mM), 5 mL de penicilina-estreptomicina-glutamina (100x), e 50 mL de soro fetal bovino (FBS) para um frasco de 500 mL de 1x RPMI 1640 médio. Prepare o meio em um gabinete de biossegurança e armazene a 2-8 ° c. Aqueça o meio a 37 ° c antes de adicioná-lo às células TK6 (ver tabela de materiais).
- Descongelar 1 mL de células TK6 (armazenadas a-80 ° c em DMSO) em 10 mL de meio. Centrifugue as células a 200 x g durante 8 min e aspire o sobrenadante. Transfira as células para 50 mL de mídia e incubar a 37 ° c, 5% CO2. O tempo de duplicação das células TK6 varia de ~ 12-18 h e algumas (3 ou 4) passagens serão necessárias para que as células alcancem a sua taxa de proliferação máxima (ver tabela de materiais).
- Cultura 100 mL de células a uma concentração de ~ 7-8 x 105 células/ml.
2. preparação de clastogénios e/ou aneugens e Citocalasin B
- Prepare as concentrações apropriadas de ações de clastogénios e aneugens desejados. Por exemplo, para mitomycin C, dissolva uma garrafa completa de 2 mg em 10 mL de água estéril para atingir uma concentração de estoque final de 200 μg/mL. A mitomicina C pode ser armazenada a 4 ° c durante três meses (ver tabela de materiais).
- No dia do experimento, prepare diluições dos produtos químicos desejados que sejam 10 vezes ou 100 vezes superiores às concentrações de exposição desejadas se diluir em água estéril ou DMSO, respectivamente.
- Para mitomycin C, prepare diluições de 3 mL em água estéril de 0,5, 1,0, 2,0, 3,0, 4,0 e 5,0 μg/mL. Para colchicina, prepare diluições de 3 mL em água estéril de 0, 5, 0,1, 0,2, 0,3, 0,4 e 0,5 μg/mL. Finalmente, para manitol, prepare diluições de 3 mL em água estéril de 5, 10, 20, 30, 40 e 50 mg/mL.
- Prepare uma concentração de 200 μg/mL de Citocalasin B dissolvendo um frasco de 5 mg em 25 mL de DMSO. Cytochalasin B pode ser armazenado em-20 ° c por diversos meses.
3. exposição de células a clastogénios e/ou aneugens
- Adicionar 1 mL de produto químico pretendido (por exemplo, mitomicina C) a 9 mL de células a ~ 7-8x105 células/ml num frasco de T25. Para as amostras de controle, adicione 1 mL de água estéril. Coloc os frascos em um ° c 37, incubadora de 5% CO2 para 3 h.
Nota: se os produtos químicos forem diluídos no DMSO, adicione apenas 100 μL do produto químico a cada frasco e adicione 100 μL de DMSO aos controlos. Cada frasco deve conter 9,900 mL de células. - Após 3 h, retire as garrafas da incubadora e transfira as células para tubos de polipropileno de 15 mL. Centrifugue a 200 x g durante 8 min, Aspire o sobrenadante e transfira as células para novas garrafas T25 contendo um total de 10 ml de meio de cultura fresca. Adicionar 150 μL da concentração de ações (200 μg/mL) de Cytochalasin B a cada frasco para atingir uma concentração final de 3 μg/mL.
- Retorne os frascos ao ° c 37, incubadora de 5% CO2 para um tempo da recuperação igual a 1.5-2.0 vezes de duplicação, como recomendado pelas directrizes OECD9. Para as células TK6 utilizadas neste trabalho, o tempo de recuperação foi de 24 h.
Nota: o tempo de duplicação das células TK6 utilizadas aqui foi de 15 h e foi utilizado um tempo de recuperação de 24 h (1,6 vezes por duplicação). Os tempos de recuperação inferiores a 1,5 vezes de duplicação reduzirão a proliferação em amostras expostas a doses mais elevadas que afetam o número de BNCs. Inversamente, os tempos de recuperação de mais de 2,0 produzirão um número desproporcional de células polinucleadas em amostras de controle, cálculos da citotoxicidade do inclinação.
4. preparação de buffers para fixação e rotulagem de conteúdo de DNA (vide tabela de materiais)
- Prepare 75 mM de cloreto de potássio (KCl) adicionando 2,79 g a 500 mL de água ultrapura. Mexa a solução por 5 min usando um agitador magnético e filtro estéril através de um filtro de 200 μm. A solução KCl de 75 mM pode ser armazenada a 4 ° c durante vários meses.
- Prepare uma quantidade suficiente de formalina de 4% para o experimento, antecipando que um total de 2,1 mL deve ser adicionado a cada amostra. Por exemplo, para preparar 10 mL de formalina a 4%, adicione 4 mL de estoque de formalina a 10% a 6 mL de solução salina tamponada com tampão fosfato de 1x Dulbecco sem CA2 + ou mg2 + (PBS). Este formalina de 4% pode ser armazenado na temperatura ambiente por diversas semanas.
- Prepare 510 mL de tampão de lavagem (2% FBS em 1X PBS) adicionando 10 mL de FBS a um frasco de 500 mL de 1X PBS.
- Prepare 10 mL de uma concentração de 100 μg/mL de Hoechst 33342 adicionando 100 μL da concentração de estoque (1 mg/mL) a 9.900 μL de 1X PBS. A solução Hoechst 33342 pode ser armazenada a 4 ° c durante vários meses.
5. processamento da amostra: inchaço hipotônica, fixação, contagem de células e rotulagem de conteúdo de DNA
- No final do período de recuperação, retire todas as garrafas da incubadora e transfira todas as amostras para tubos de polipropileno de 15 mL. Centrifugue todas as amostras a 200 x g durante 8 min.
- Aspirar o sobrenadante, suspender as células e adicionar 5 mL de 75 mM KCl. Misture suavemente por inversão três vezes e incubar a 4 ° c durante 7 min.
- Adicionar 2 mL de formalina a 4% a cada amostra, misturar suavemente por inversão três vezes e incubar a 4 ° c durante 10 min. Esta etapa actua como uma "fixação macia".
- Centrifugue todas as amostras a 200 x g durante 8 min. aspirar o sobrenadante e ressuscitem em 100 μl de formalina a 4% durante 20 min. Esta etapa actua como uma "fixação dura".
- Adicionar 5 mL de tampão de lavagem e centrifugar a 200 x g durante 8 min. aspirar o sobrenadante e ressuscito em 100 μl de tampão de lavagem.
- Transfira todas as amostras para tubos de microcentrífuga de 1,5 mL.
- Realize uma contagem de células em cada amostra para determinar o número de células por amostra. As amostras serão altamente concentradas para uma diluição de 1:100 em 1X PBS (10 μL de amostra em 990 μL de PBS) provavelmente será necessária para obter uma contagem exata.
Nota: neste ponto é melhor executar contagens de células usando um Hemocytometer. Adicionando KCl dá o citoplasma uma aparência translúcida, tornando-se difícil para contadores de células automatizadas para reconhecê-los. Também, os contadores automatizados têm a dificuldade que Marc pilhas células devido a seu tamanho. - Se não estiver executando as amostras no MIFC imediatamente, elas podem ser armazenadas a 4 ° c por vários dias. Quando estiver pronto para executar amostras, adicione 5 μL de 100 μg/mL por 1x106 células/ml a cada amostra. Adicionar também 10 μL de 500 μg/mL de RNase por 100 μL de amostra para uma concentração final de 50 μg/mL. Incubar as amostras a 37 ° c, 5% CO2 por 30 min.
- Micro-centrífuga todas as amostras em 200 x g por 8 min e usar uma pipeta para remover o sobrenadante deixando ~ 30 μl. Use uma pipeta para Ressuspender todas as amostras antes de correr no MIFC garantindo que não haja bolhas no tubo. Não vórtice.
6. Iniciando e calibrando o MIFC
- Assegure-se de que a bainha, o reagente de calibração do sistema, o debubbler, os recipientes de limpeza e esterilizador estão cheios e o depósito de resíduos está vazio. Ligue o sistema e clique duas vezes no ícone do software MIFC. Clique no botão inicializar e certifique-se de que a caixa de seleção iniciar todas as calibrações e testes esteja marcada. Isso irá liberar o sistema, a bainha de carga e reagentes de calibração do sistema, e calibrar o sistema (ver tabela de materiais).
7. executando amostras no MIFC
Nota: esta secção assume a utilização de uma câmara 2 MIFC. Se estiver usando um 1 câmera MIFC, por favor consulte suplemento 1-protocolo completo, seção 7 para a criação de parcelas durante a aquisição
- Inicie o software de aquisição de dados MIFC (consulte a tabela de materiais). A Figura 1 mostra as configurações do instrumento. Ligue o laser de 405 nm e defina a potência do laser para 10 mW (a). Desative todos os outros lasers (incluindo SSC) e defina o BF para os canais 1 e 9 (B). Confirme se o controle deslizante de ampliação está definido como 60x (C), o modo de alta sensibilidade está selecionado (D) e que somente os canais 1, 7 e 9 estão sendo exibidos na Galeria de imagens.
- Clique no ícone scatterplot . Selecione toda a população e selecione a área M01 no eixo X e na relação de aspecto M01 no eixo Y. Clique no ícone de região quadrada e desenhe uma região ao redor das células individuais. Nomeie essa região células únicas. Clique com o botão direito do mouse no gráfico e selecione regiões. Realce a região de células única e altere as coordenadas x para 100 e 900 e altere as coordenadas y para 0,75 e 1 (Figura 1I).
- Clique no ícone scatterplot . Selecione células individuais como a população pai, selecione gradiente RMS M01 no eixo X e gradiente RMS M07 no eixo Y. Clique no ícone de região quadrada e desenhe uma região em torno da maioria das células. Nomeie esta região células focalizadas. Clique com o botão direito do mouse no gráfico e selecione regiões. Realce a região de células focalizadas e altere as coordenadas x para 55 e 75 e altere as coordenadas y para 9,5 e 20 (Figura 1J).
- Clique no ícone do histograma . Selecione a população de células focalizadas e selecione intensidade M07 como o recurso. Clique no ícone de região linear e desenhe uma região em todo o pico principal no histograma. Nomeie esta região DNA-positivo. Clique com o botão direito do mouse no gráfico e selecione regiões. Realce a região DNA-positiva e mude as coordenadas para 2 x 105 e 2 x 106. O intervalo pode ter que ser ajustado dependendo do pico de intensidade no histograma (Figura 1K).
- Defina os parâmetros de aquisição (Figura 1E). Especifique o nome do arquivo e a pasta de destino, altere o número de eventos para 20.000 e selecione a população DNA positivo .
- Clique em carregar (Figura 1F) e coloque o exemplo de controle no mifc. Clique no botão adquirir para coletar os dados (Figura 1G). Depois que a aquisição for concluída, clique no botão Return para retornar a amostra (Figura 1H). Retire o tubo de amostra do instrumento. Repita esse processo para todas as amostras restantes no experimento.
8. abrindo um arquivo de dados no IDEAS
- Inicie o pacote de software de análise MIFC (consulte a tabela de materiais). Clique em iniciar análise para iniciar o Assistente de arquivo aberto. Selecione um arquivo de dados navegando até o arquivo de imagem RAW desejado (. Rif). Clique no botão abrir e clique em Avançar.
- Uma vez que este é um ensaio de cor única, a compensação não é necessária, então clique em Avançar para ignorar a etapa de compensação. Neste estágio não há nenhum modelo de análise para aplicar, então clique em Avançar novamente. Se o modelo de análise tiver sido descarregado do material complementar, selecione-o agora. Estes modelos só funcionam com uma câmera 2 MIFC com BF definido para os canais 1 e 9 e imagens nucleares no canal 7 durante a aquisição.
- Por padrão, os nomes de arquivo. CIF e. DAF são gerados automaticamente para corresponder ao. Rif. Não é recomendável alterar os nomes do. CIF e. DAF. Clique em Avançar. Defina as propriedades de exibição da imagem selecionando 01 e 07. Clique em Avançar. Não há nenhum assistente para este aplicativo, então clique em Finish. É muito importante salvar o arquivo de análise de dados (. DAF) e o modelo de análise (. AST) muitas vezes durante as seções 9 – 14 para evitar a perda de progresso.
9. criando máscaras e recursos para identificar BNCs
- Clique no ícone de Propriedades da Galeria de imagens (ícone azul/branco). Na guia Propriedades de exibição , clique em definir intervalo para dados de pixel e altere a cor para amarelo. Clique em OK. Imagens Hoechst agora são mais fáceis de ver contra o fundo preto.
- Crie o gráfico de células não-apoptóticas.
- Clique na guia análise e, em seguida, clique em máscaras. Clique em novo em seguida, clique em função. Em função escolha limiar, em máscara escolha M07 e defina a percentagem de intensidade para 50. Clique em OK e OK novamente. Clique em fechar.
- Clique no separador análise , clique em funcionalidadese, em seguida, clique em novo. Para o tipo de recurso selecionar área. Para máscara , selecione o limiar (M07, Ch07, 50). Clique em definir nome predefinido e clique em OK. Clique em fechar para começar a calcular os valores do recurso.
- Clique no ícone do gráfico de pontos . Selecione a população de todos . Para o recurso de eixo X escolha o recurso Contrast_M01_Ch01 e para o recurso de eixo Y , escolha Area_Threshold (M07, Ch07, 50). Clique em OK.
- Clique no botão região quadrada e desenhe uma região em torno da maioria das células. Chame esta região não-apoptótica. Clique com o botão direito do mouse no gráfico e clique em regiões. Realce a região não-apoptótica . Defina as coordenadas x como 0 e 15 e defina as coordenadas y para 50 e 300. Clique em fechar.
- Crie a máscara de BNC (etapas 9.3.1-9.3.5) para identificar as pilhas que contêm somente dois núcleos.
- Procure um BNC na Galeria de imagens e clique nele. Isto é para visualizar a criação da máscara no canal Hoechst.
- Clique na guia análise e, em seguida, clique em máscaras. Clique em novo em seguida, clique em função. Em função escolha Levelset, em máscara escolha M07, selecione o botão de opção máscara de nível médio e defina a escala de detalhe de contorno para 3, 0. Clique em OK e OK novamente.
- Clique em novo em seguida, clique em função. Em função, escolha dilatee, em máscara , escolha Levelset (M07, Ch07, Middle, 3). Defina a imagem para exibir para Ch07e defina o número de pixels para 2. Clique em OK e OK novamente.
- Clique em novo em seguida, clique em função. a função escolha a bacia hidrográfica, e a máscara escolha o dilate (Levelset (M07, Ch07, meio, 3) 2). Defina a imagem para exibir para Ch07e defina a espessura da linha como 1. Clique em OK e OK novamente.
- Clique em novo em seguida, clique em função. a função escolha a escala, a máscara escolhe a bacia hidrográfica (dilate (Levelset (M07, Ch07, meio, 3) 2)). Defina a imagem para exibir para Ch07. Defina os valores de área mínima e máxima para 115 e 5000, respectivamente. Defina os valores de taxa de proporção mínima e máxima para 0,4 e 1, respectivamente. Clique em OK. No campo nome , altere o texto para ler BNC e clique em OK.
- Crie os recursos e Plotagens para obter a população final de BNC
- Spot Count característica BNC: clique na guia análise , em seguida, recursos, em seguida, novo. Para o tipo de recurso selecione contagem pontual. Para Mask, selecione a máscara BNC final criada em 9.3.5. Ajuste o Connectedness a quatro e mude o nome para manchar a contagem BNC. Clique em OK e feche para calcular os valores do recurso.
- Histograma BNC de contagem pontual. Clique no ícone do histograma . Selecione não-apoptótico como a população pai. Para a característica do eixo X escolha a característica da contagem Spot BNC . Clique em OK. Clique no ícone região linear. Desenhe uma região na posição 2. Chame esta região 2n.
Nota: consulte a seção 9 no suplemento 1-protocolo completo para criar as máscaras restantes, recursos e Plotagens para identificar a população final BNC
10. criando máscaras e características para identificar MN dentro da população BNC
- Crie a máscara MN. Procure um BNC que contenha um MN na Galeria de imagens e clique nele. Isto é para visualizar a criação da máscara MN no canal Hoechst. Clique na guia análise e, em seguida, clique em máscaras.
- Criar máscara de identificação de spot 1:
- Clique em novo em seguida, clique em função. a função escolha o ponto e assegure-se de que o botão de rádio brilhante esteja selecionado. a máscara escolha M07, ajuste o ponto à relação do fundo da pilha a 2, 0. Defina o raio mínimo para 2 e o raio máximo para 6. Clique em OK e OK novamente.
- Clique em novo em seguida, clique em função. a função escolha o intervalo, e a máscara escolha o Levelset (M07, Ch07, meio, 3). Defina a imagem para exibir para Ch07. Defina a área mínima e máxima para 80 e 5000, respectivamente. Defina a taxa de proporção mínima e máxima como 0 e 1, respectivamente. Clique em OK e OK novamente.
- Clique em novo em seguida, clique em função. a função escolha o dilate, a máscara escolhe a escala (Levelset (M07, Ch07, meio, 3), 80-5000, 0-1). Defina a imagem para exibir para Ch07. Defina o número de pixels para 2. Clique em OK e OK novamente.
- Clique em novo. Clique duas vezes na máscara Spot (M07, Ch07, Bright, 2, 6, 2) para adicioná-la à definição da máscara. Clique no operador and e, em seguida, o operador not . Clique duas vezes o dilate (Range (LevelSet (M07, Ch07, médio, 3), 80-5000, 0-1), 2) Mask para adicioná-lo à definição de máscara. Clique em OK.
- Clique em novo, em seguida, função. a função escolha o intervalo e a máscara escolha a máscara criada em 10.1.1.4:
- Selecione Spot (M07, Ch07, Bright, 2, 6, 2) e não dilate (intervalo (Levelset (M07, Ch07, Middle, 3), 80-5000, 0-1), 2).
- Defina a imagem para exibir para Ch07. Defina a área mínima e máxima para 10 e 80, respectivamente. Defina a taxa de proporção mínima e máxima para 0,4 e 1, respectivamente. Clique em OK e OK novamente. A máscara de identificação do ponto 1 está completa.
Nota: consulte a seção 10 no suplemento 1-protocolo completo para criar as máscaras, recursos e Plotagens para identificar a população final MN
- Criar máscara de identificação de spot 1:
11. Crie máscaras, características e parcelas para identificar as populações Mononucleated e Polynucleated
- Crie a máscara POLY. Clique em análise, em seguida, máscaras, em seguida, nova função. a função escolha a escala, a máscara escolha a bacia hidrográfica (dilate (Levelset (M07, Ch07, médio, 3), 2)). Defina a imagem para exibir para Ch07. Defina os valores de área mínima e máxima para 135 e 5000, respectivamente. Defina os valores de taxa de proporção mínima e máxima para 0,4 e 1, respectivamente. Clique em OK. No campo nome , altere o texto para ler poli , em seguida, clique em OK , em seguida, fechar. A máscara da pilha de Polynucleated é completa.
- Crie as máscaras de componente poli.
- Máscara componente poli 1: clique na guia análise , em seguida, máscaras, em seguida, novo, em seguida, função. Em função selecionar componentee em máscara , selecione a máscara de poli . Para a áreade seleção de recurso de classificação , e para classificar ordem clique no botão de opção descendente . Defina Rank como 1. Clique em OK e OK novamente.
- Máscaras de componentes poli 2, 3 e 4: Repita todas as etapas em 11.2.1, exceto definir a classificação para 2, 3 e 4 para criar as máscaras de componente individuais.
- Contagem do ponto usando a máscara poli.
- Clique na guia análise , em seguida, recursos, em seguida, novo. Em tipo de feição, selecione contagem pontual. Para a máscara escolha a máscara poli e ajuste o Connectedness em 4. Clique em definir nome padrão e clique em OK , em seguida, Fechar para calcular os valores de recurso.
- Clique no ícone histograma. Selecione a população não-apoptótica . Para o recurso de eixo X , escolha o recurso Spot Count_POLY_4 .
- Região de contagem de pontos MONO. Clique no ícone região linear. Desenhe uma região na posição 1 no histograma criado em 11.3.2. Chame esta região 1N.
- Região de contagem de pontos TRI. Clique no ícone região linear. Desenhe uma região na posição 3 no histograma criado em 11.3.2. Chame esta região 3N.
- Região de contagem de pontos QUAD MONO. Clique no ícone região linear. Desenhe uma região através do compartimento 4 no histograma criado em 11.3.2. Chame esta região 4n.
- Identifique a população MONO.
- Crie o recurso de taxa de proporção MONO. Clique na guia análise , em seguida, recursos, em seguida, novo. Em tipo de recurso, selecione o recurso de taxa de proporção e em máscara selecionar componente (1, área, poli, descendente). Clique em definir nome predefinido e, em seguida, clique em OK.
- Crie o recurso de circularidade MONO. Com a janela do Gerenciador de recursos ainda aberta, clique em novo. Em tipo de recurso, selecione o recurso circularidade e em máscara selecionar componente (1, área, poli, descendente). Clique em definir nome padrão e clique em OK e clique em Fechar para calcular os valores do recurso.
- Para o gráfico de pontos de células MONO circulares, clique no ícone gráfico de pontos . Selecione 1N como a população principal. Para a característica do eixo X escolha Circularity_Component (1, área, poli, descendente) e para a característica do eixo de Y escolha o aspecto Ratio_Component (1, área, poli, descendente). Clique em OK. Clique no botão região quadrada e desenhe uma região ao redor da população de células para a parte superior direita da plotagem. Nomeie essa região como Circular_1N. Clique com o botão direito do mouse no gráfico e clique em regiões. Realce a região Circular_1N . Altere as coordenadas X para 20 e 55 e altere as coordenadas Y para 0,85 e 1,0. Clique em fechar.
- Crie o recurso área poli/Area_M07. Clique na guia análise , em seguida, recursos, em seguida, novo. Em tipo de recurso, selecione o recurso de área e em máscara selecione componente (1, área, poli, decrescente). Clique em definir nome predefinido e, em seguida, clique em OK.
- Com a janela do Gerenciador de recursos ainda aberta, clique em novo em seguida, em tipo de recurso clique no botão de opção combinado . Na lista de recursos, realce o Area_Component (1, área, Poly, decrescente) e clique na seta para baixo para adicioná-lo à definição de recurso. Clique no símbolo de divisão (/). Selecione o recurso Area_M07 e clique na seta para baixo para adicioná-lo à definição de recurso. Clique em definir nome predefinido e clique em OK. Clique em fechar para começar a calcular os valores do recurso.
- Para o gráfico de pontos de população MONO final, clique no ícone de plotagem de ponto . Selecione Circular_1N como a população pai. Para o recurso eixo X escolha aspecto Ratio_M07 e para o recurso eixo Y escolha Area_Component (1, área, poli, descendente)/Area_M07. Clique em OK. Clique no botão região quadrada e desenhe uma região em torno da maioria das células. Nomeie esta região Mononucleada. Clique com o botão direito do mouse no gráfico e clique em regiões. Realce a região Mononucleada . Altere as coordenadas X para 0,85 e 1,0 e altere as coordenadas Y para 0,55 e 1,0. Clique em fechar.
Nota: consulte a seção 11 no suplemento 1-protocolo completo para criar as máscaras, características e parcelas para identificar as populações finais trinucleadas e polinucleadas.
12. Crie uma vista personalizada para examinar as máscaras BNC e MN
- Clique no botão Propriedades da Galeria de imagens e clique na guia Exibir . Clique na guia Composites e clique em novo. Em nome tipo Ch01/Ch07. Clique em Adicionar imagem. Em imagem , escolha Ch01 e defina a porcentagem para 100. Clique em Adicionar imagem novamente, em imagem , escolha Ch07 e defina a porcentagem para 100.
- Clique em novo e em nome tipo BNC e máscaras MN
- Clique em adicionar coluna. Em tipo de imagem escolha Ch01 e máscara escolha nenhum
- Clique em adicionar coluna. Em tipo de imagem escolha Ch07 e máscara escolha nenhum
- Clique em adicionar coluna. o tipo da imagem escolha Ch07 e a máscara escolha BNC
- Clique em adicionar coluna. o tipo da imagem escolha Ch07 e a máscara escolha a máscara do MN
- Clique em adicionar coluna. Em tipo de imagem , clique no botão de opção composto . A imagem composta de Ch01/Ch07 deve ser adicionada automaticamente à vista. Clique em OK para fechar a janela de propriedades da Galeria de imagens.
13. Crie uma vista personalizada para examinar a máscara POLY
- Refira a seção 13 no suplemento 1-protocolo cheio para criar uma vista feita encomenda para examinar a máscara poli
14. criar uma tabela de estatísticas para enumerar os principais eventos
- Clique na guia relatórios e clique em definir relatório de estatísticas. Na nova janela, clique em Adicionar colunas.
- Adicione a estatística de contagem de BNC. Em estatísticas selecione contagem e, em população selecionada , escolha a população BNCS . Clique em adicionar estatísticas para adicionar a estatística à lista.
- Repita a etapa 14,2 para criar colunas separadas para as populações MN BNCs, mono, Tri e Poly . Clique em fechar e clique em OK.
- O modelo de análise de dados está completo (Figura 2). Salve o modelo (arquivo, salvar como modelo). A lista completa da máscara pode ser encontrada na lista da máscara do suplemento 2.
15. arquivos de experimento de processo em lote usando o modelo de análise de dados
- No menu ferramentas , clique em arquivos de dados em lote e clique em Adicionar lote na nova janela.
- Na nova janela, clique em Adicionar arquivos para selecionar os arquivos de experimento (. Rif) para adicionar ao lote. Na opção selecionar um modelo ou arquivo de análise de dados (. AST,. DAF) , clique no ícone de pasta aberta para procurar e abrir o modelo de análise de dados (arquivo. AST) que foi salvo na etapa 14,4.
- Clique no botão Visualizar relatório de estatísticas para visualizar a tabela de estatísticas. Nenhum valor será exibido aqui, pois eles ainda não foram calculados. No entanto, esta etapa serve como uma verificação para garantir que o modelo de análise adequado foi selecionado antes de executar o lote.
- Clique em OK para fechar a janela atual. Em seguida, clique em Enviar lotes para iniciar o processamento em lote de todos os arquivos.
- Quando o processamento em lote for concluído, um arquivo. txt estará disponível na pasta que contém todos os arquivos. Rif. Use estas estatísticas para calcular a genotoxicidade e a citotoxicidade.
16. cálculo dos parâmetros de genotoxicidade e citotoxicidade
- Cálculo da genotoxicidade: para calcular a genotoxicidade, use a tabela de estatísticas criada em 15,5. Divida o número de células na população de MN BNCs pelo número de células na população BNCs, em seguida, multiplicar por 100:
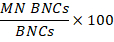
- Calculando a citotoxicidade: Determine o número total de células POLY somando o número de células TRI e QUAD.
- Calcule o índice de proliferação do Citokinesis-Block (CBPI) usando o número de pilhas no MONO, no BNCs e no POLY como segue:
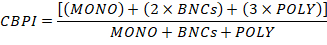
- Por fim, calcule a citotoxicidade de cada cultura usando os valores de CBPI das culturas de controle (C) e da cultura quimicamente exposta (T) da seguinte forma:
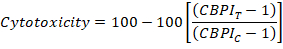
- Calcule o índice de proliferação do Citokinesis-Block (CBPI) usando o número de pilhas no MONO, no BNCs e no POLY como segue:
Resultados
O método de análise delineado neste trabalho permite a identificação automática e a Pontuação dos BNCs, com e sem MN, para o cálculo da genotoxicidade. Além disso, as células MONO e POLY também são automaticamente identificadas e pontuadas para calcular a citotoxicidade. Os critérios de Pontuação publicados6,34 que devem ser respeitados ao marcar esses eventos são implementados no software de análise de dados mifc. Os resultados aqui apresentados indicam que aumentos estatisticamente significantes da frequência de MN com aumento da citotoxicidade podem ser detectados após a exposição de células linfoblastóides TK6 humanas a substâncias químicas induzidas por MN bem conhecidas (mitomycin C e Colchicina). Resultados semelhantes para produtos químicos adicionais testados foram demonstrados em uma publicação separada32. Além disso, os resultados do uso de manitol mostram que os produtos químicos induzidos não-MN também podem ser corretamente identificados usando o método MIFC descrito aqui. Os parâmetros descritos no protocolo para criar todas as máscaras, recursos e limites de região provavelmente terão que ser ajustados se tipos de células diferentes (por exemplo, células de hamster chinês) são usados para executar o ensaio.
A Figura 3 mostra quatro painéis selecionados para identificar BNCS (Figura 3a-3D). Aqui é mostrado um histograma que possibilita a seleção de células com dois núcleos (Figura 3a) e parcelas bivariadas que possibilitam a seleção de BNCS com circularidade semelhante (Figura 3B), áreas e intensidades semelhantes (Figura 3C ) e BNCS que possuem núcleos bem separados, não sobrepostos (Figura 3D) de acordo com a pontuação seguintes6,34. Figura 3 E mostra as imagens BF e Hoechst, bem como as máscaras BNC e MN, indicando que os BNCS com MN único ou Múltiplo podem ser identificados e enumerados. Isto permite que a genotoxicidade seja calculada determinando a taxa de BNCs micronucleados na população final de BNC. A Figura 4 mostra a aplicação do recurso contagem pontual usando a máscara Poly para identificar células mono, tri e quad. O número de células TRI e QUAD pode então ser resumido para obter o número final de células POLY (tabela 1). Isso permite que a citotoxicidade seja calculada usando a fórmula mostrada no protocolo. Portanto, cada ponto de dose no experimento pode ser avaliado por parâmetros de genotoxicidade e citotoxicidade.
A Figura 5 mostra os valores de genotoxicidade e citotoxicidade para o aneugénio colchicina, o clastogênio mitomycin C e para um controle negativo, manitol. Para Colchicina (Figura 5a) as doses de 0, 2 a 0, 5 μg/ml produziram aumentos estatisticamente SIGNIFICANTES na frequência de MN, variando de 1,28% a 2,44%, respectivamente, sobre o controle do solvente (tabela 1). No caso de mitomycin C (Figura 5B), as duas doses superiores de 0,4 e 0,5 μg/ml produziram frequências MN estatisticamente significativas quando comparadas com os controlos dos solventes. Estas frequências de MN foram de 0,93% a 0,4 μg/mL e 1, 2% a 0,5 μg/mL (tabela 2). Finalmente, para manitol (Figura 5C), nenhuma dose testada induziu uma citotoxicidade acima de 30%, nem produziu aumentos significativos na frequência de MN quando comparados aos controles solventes, como esperado (tabela 3).
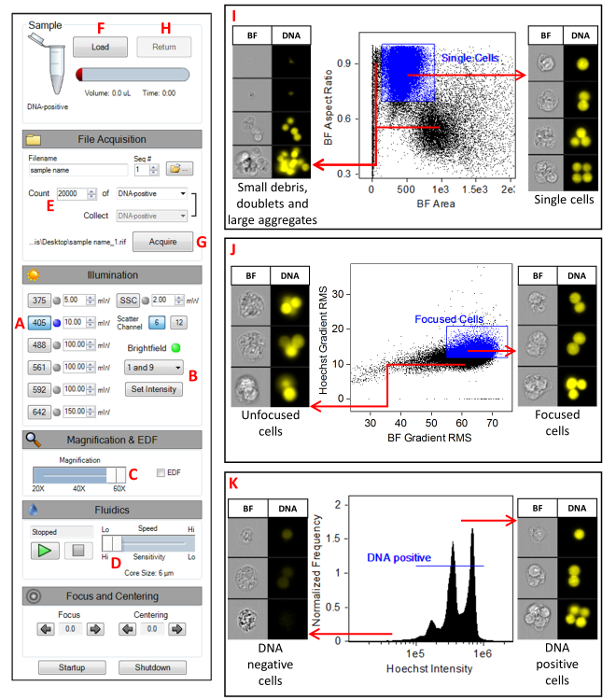
Figura 1 : Definições do instrumento Mifc. Uma captura de tela das configurações do MIFC, conforme descrito na seção etapa 7 do protocolo. (A) definir a potência do laser de 405 nm para 10 MW. (B) definir os canais BF 1 e 9. (C) selecionando a lente objetiva de ampliação 60x. (D) selecionando a velocidade de fluxo mais lenta que gera imagens com a resolução mais alta. (E) especificando o número de eventos a serem recolhidos para 20.000. (F) clicando no botão Load para iniciar o processo de carregamento de amostra. (G) clicando no botão adquirir para começar a adquirir imagens. (H) clicando no botão Return para retornar qualquer amostra não utilizada. (I) gráfico de dispersão da relação de aspecto BF versus área de BF para a seleção de células individuais. (J) gráfico de dispersão de Hoechst gradiente RMS versus BF Gradient RMS para a seleção de células focalizadas. (K) histograma da intensidade de Hoechst para a seleção de células positivas de DNA. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2 : Software de análise de estratégia de gating. Uma captura de tela da estratégia de gating descrita na seção 9 do protocolo. As regiões são mostradas em ordem sequencial para a identificação de células binucleadas (caixa vermelha), micronúcleos (caixa amarela) e células mono e polinucleadas (caixa azul). Por favor clique aqui para ver uma versão maior desta figura.
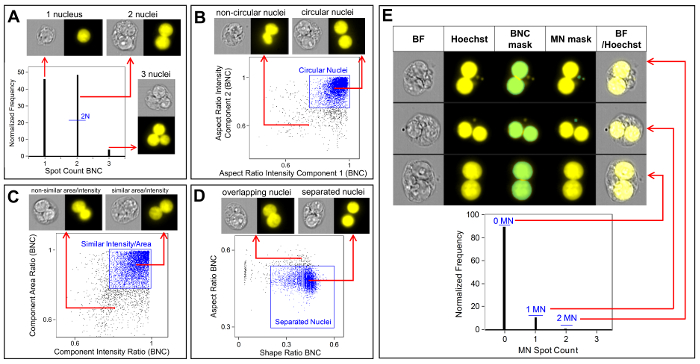
Figura 3 : Identificação e pontuação de BNCs com e sem MN. (A) seleção de células com dois núcleos distintos. (B) identificação de células binucleadas (BNCS) que possuem dois núcleos altamente circulares através da utilização do recurso intensidade da relação de aspecto. (C) seleção de BNCS que possuem núcleos com áreas e intensidades semelhantes. Isto é conseguido calculando a relação da área de ambos os núcleos e a relação da relação de aspecto de ambos os núcleos. (D) uso das características da relação da forma e da relação de aspecto para identificar BNCS que têm dois núcleos bem separados. (E) o recurso de contagem pontual usando a máscara de micronúcleos (MN) demonstrando que os BNCS com MN único ou Múltiplo podem ser identificados e enumerados. Por favor clique aqui para ver uma versão maior desta figura.
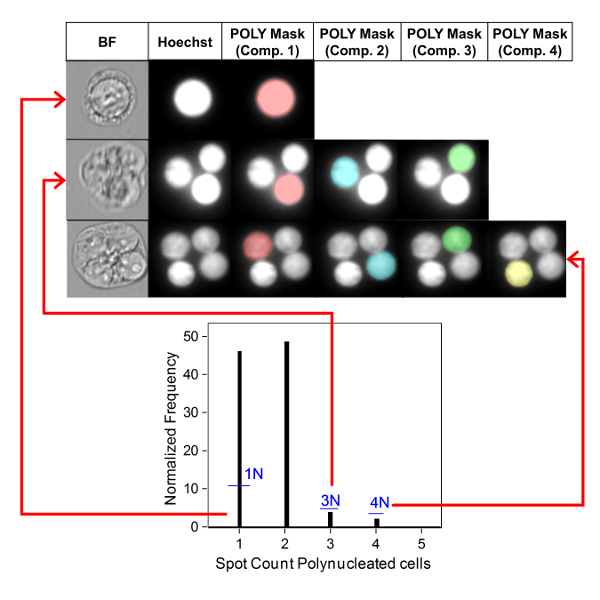
Figura 4 : Identificação e pontuação de células mono e Poly. Uso do recurso de contagem de pontos para identificar e enumerar células mono, tri e quadranucleadas. A máscara componente 1 permite a identificação de células mononucleadas (imagem superior). As máscaras de componentes 1 a 3 permitem a identificação de células trinucleadas (imagem média). As máscaras de componentes 1 a 4 permitem a identificação de células quadranucleadas (imagem inferior). Este valor foi modificado de Rodrigues 201832. Por favor clique aqui para ver uma versão maior desta figura.

Figura 5 : Quantificação da citotoxicidade. A citotoxicidade quantificada utilizando o índice de proliferação de blocos de citocinese (círculos pretos) e genotoxicidade quantificada utilizando a percentagem de MN (barras claras) após uma exposição de 3 h e 24 h de recuperação para (a) colchicina, (B) mitomicina C e ( C) manitol. Aumentos estatisticamente significantes da freqüência de MN em relação aos controles são indicados por estrelas (teste qui-quadrado; *p < 0, 5, * *p < 0, 1, * * *p < 0, 1). Todas as quantidades são a média de duas repetições em cada ponto de dose. Este valor foi modificado de Rodrigues 201832. Por favor clique aqui para ver uma versão maior desta figura.
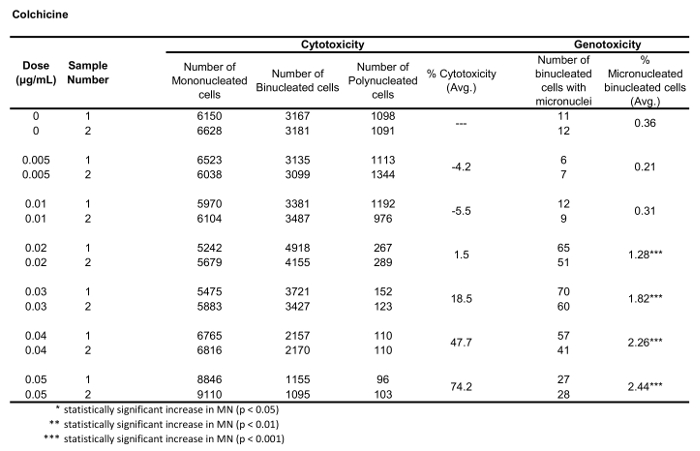
Tabela 1: Os parâmetros necessários para calcular a citotoxicidade (o número de células mono, bi e polinucleadas) e genotoxicidade (o número e a percentagem de células binucleadas micronucleadas) para Colchicina. Todas as quantidades calculadas são a média de duas repetições em cada ponto de dose.
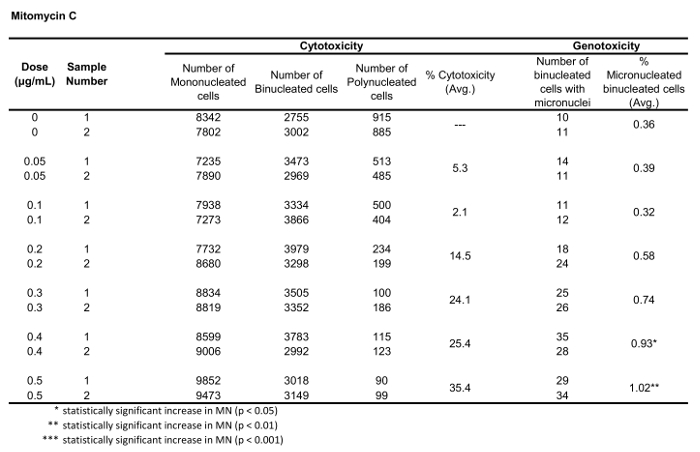
Tabela 2: T osparâmetros necessários para calcular a citotoxicidade (o número de células mono, bi e polinucleadas) e genotoxicidade (o número e a percentagem de células binucleadas micronucleadas) para mitomicina C. Todas as quantidades calculadas são a média de duas repetições em cada ponto de dose.
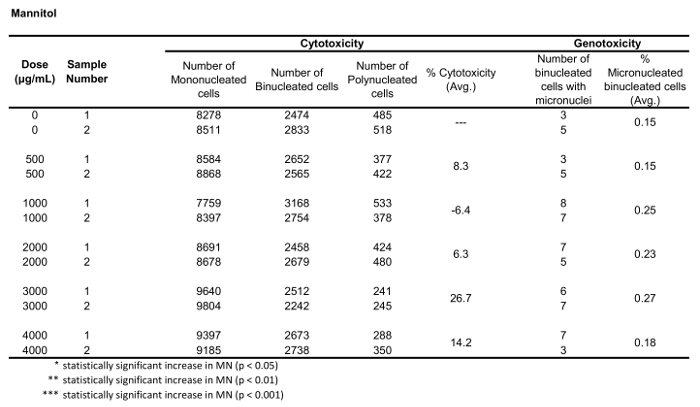
Tabela 3: Os parâmetros necessários para calcular a citotoxicidade (o número de células mono, bi e polinucleadas) e genotoxicidade (o número e a percentagem de células binucleadas micronucleadas) para o manitol. Todas as quantidades calculadas são a média de duas repetições em cada ponto de dose.
Suplemento 1: protocolo completo. Por favor, clique aqui para baixar este arquivo.
Suplemento 2: lista de máscaras. Por favor, clique aqui para baixar este arquivo.
Discussão
Em uma publicação recente, Verma et al. ressaltou a importância de desenvolver um sistema que combine a vantagem de alta produtividade da citometria de fluxo com os benefícios de armazenamento de dados e imagens da análise de imagem35. O ensaio MIFC in vitro de MN descrito neste artigo satisfaz esta citação e tem o potencial de superar muitos dos desafios acima mencionados nos métodos de microscopia e citometria de fluxo. O protocolo descrito aqui demonstra que a citotoxicidade e a genotoxicidade podem ser avaliadas usando MIFC. A preparação da amostra, a coloração celular e a coleta de dados são simples, mas há algumas etapas críticas no protocolo que deve ser sempre implementado. A adição de cloreto de potássio (KCl) às células é fundamental para inchar as células, gerando separação entre os núcleos principais. Isso garante que o algoritmo de mascaramento pode identificar todos os núcleos individuais em BNCs e células POLY (células POLY) que é necessário para sua enumeração. Adicionalmente, KCL fornece a separação entre núcleos e MN, que é essencial para o mascaramento exato do MN e a quantitation. Além disso, o uso do formalin que segue a adição de KCl impede que as pilhas lising durante a centrifugação. A adição de Cytochalasin B causa TK6 células que sofreram mais de uma divisão nuclear para ser bastante grande. Em conseqüência, o citoplasma torna-se frágil e pode lyse se a centrifugação é executada imediatamente depois da adição de KCl. Além disso, é muito importante introduzir Hoechst à amostra de acordo com o número de pilhas na amostra e não de acordo com uma concentração final. Por exemplo, uma concentração final de 10 μg/mL de Hoechst irá manchar uniformemente uma amostra de 1 x 106 células, mas pode não manchar adequadamente uma amostra contendo 5 x 106 células e pode resultar em muitas células com núcleos mal manchados, tornando a análise difícil. Também é importante notar que Hoechst pode ser substituído por outro corante de DNA, como DAPI se o MIFC está equipado com o laser de excitação 405 nm ou DRAQ5 se o MIFC está equipado com o 488 nm e/ou laser de excitação 642nm (s). Se modificando a mancha nuclear, é crítico para titular a mancha a fim encontrar a concentração apropriada para a potência exigida/desejada do laser.
Ao coletar dados no MIFC, é importante determinar os limites de região ideais para os recursos do gradiente RMS. Os limites apresentados neste protocolo podem requerer ajuste devido a algumas pequenas variações entre os instrumentos do MIFC. A aplicação deste recurso durante a coleta de dados é essencial para garantir que as imagens altamente focalizadas sejam capturadas. Se os arquivos de dados contiverem muitas imagens borradas ou não focalizadas, é provável que os algoritmos de mascaramento no software de análise destacem incorretamente os artefatos de coloração nas áreas turva, levando a um grande número de artefatos falsos positivos sendo marcados como MN. Embora as técnicas de processamento de imagens descritas aqui possam ser difíceis, uma vez que um modelo de análise foi desenvolvido no software MIFC, o processamento em lote permite que os arquivos de dados sejam analisados automaticamente, eliminando a intervenção do usuário e, portanto, o artilheiro Viés. Além disso, se uma linha de célula diferente de TK6 células são usadas para executar o ensaio, será necessário modificar as máscaras e limites de região como as propriedades morfológicas (por exemplo, tamanho) das células serão diferentes das células TK6.
Os resultados apresentados aqui (Figura 5) mostram aumentos estatisticamente significantes na indução de MN ao expor células TK6 a várias doses de mitomicina C e Colchicina. Aumentos estatisticamente significativos na frequência de MN quando comparados aos controles de solvente foram observados para várias doses em ambos os produtos químicos. Além disso, nenhuma dose de manitol induziu uma citotoxicidade acima de 30%, nem um aumento estatisticamente significativo na frequência de MN quando comparado aos controles solventes, como esperado. O protocolo descrito neste artigo usando MIFC para executar o ensaio in vitro do MN dá resultados esperados dos produtos químicos positivos e negativos do controle. É muito importante realizar uma série de experimentos usando ambos os controles de solventes e químicos de controle negativo para desenvolver valores basais tanto da freqüência de MN, bem como o índice de proliferação de blocos de citocinese (CBPI). Para genotoxicidade, aumentos estatisticamente significativos na frequência de MN são determinados através da comparação com as frequências de MN de base que devem ser bem conhecidas para o tipo de célula que está sendo usado. Além disso, todos os cálculos de citotoxicidade baseiam-se no CBPI das amostras de controle e, portanto, as taxas de base das células MONO, BNCs e POLY devem ser bem quantificadas nos controles.
Várias limitações e vantagens do uso do mifc no contexto do ensaio MN foram descritas no trabalho anterior29,32. As principais limitações referem-se a frequências de MN mais baixas quando comparadas à microscopia, o que provavelmente resulta tanto da falta de flexibilidade na implementação dos critérios de pontuação no software de análise quanto da profundidade de campo limitada do MIFC. Máscaras bem contornadas podem ser criadas para identificar com precisão os núcleos principais, mas MN que estão tocando (ou muito perto) os núcleos principais podem ser capturados dentro da máscara BNC. Adicionalmente, MN muito pequeno que pode ser bastante facilmente pontuado usando microscopia são, provavelmente, incorretamente perdidas quando usando MIFC devido o limite inferior no parâmetro de área da máscara MN para evitar a pontuação de pequenos artefatos. Além das dificuldades presentes na análise de dados baseada em imagem, devido ao seu design, o MIFC Obtém imagens de projeção bidimensional de objetos celulares tridimensionais. Isso provavelmente faz com que alguns MN a ser capturado em uma profundidade diferente de foco que os dois MN principal, tornando-os parecem muito Dim e un-scorable usando mascaramento. Além disso, uma pequena fração de MN poderia residir atrás de um dos dois núcleos principais, tornando-os impossíveis de Visualizar e pontuar. Portanto, considerando essas dificuldades, deve-se ter cautela ao interpretar aumentos significativos na frequência de MN em doses baixas.
Apesar dessas deficiências, o método MIFC descrito aqui oferece várias vantagens em relação a outras técnicas. Fenech et al. critérios e diretrizes propostos que devem ser considerados no desenvolvimento de sistemas automatizados e metodologias para ensaios de MN36. Estes incluem, mas não estão limitados a, visualização direta dos principais núcleos e citoplasma, determinação da frequência de MN de várias doses do produto químico ou agente a ser testado e a capacidade de quantificar morfologia e determinar a posição de todos os núcleos e MN para garantir que eles estão dentro do citoplasma. Este artigo mostra que o método MIFC desenvolvido para realizar o ensaio in vitro de MN satisfaz (ou possui o potencial para satisfazer) esses critérios. Especificamente, imagens dos núcleos e MN podem ser capturadas pelos lasers fluorescentes, enquanto as imagens citoplasmáticas podem ser obtidas usando o LED BF. Imagens de células com morfologia nuclear normal podem ser diferenciadas automaticamente daquelas células com morfologia irregular usando uma combinação de máscaras e características avançadas. Os resultados apresentados para colchicina e mitomicina C (Figura 5) mostram que tanto a genotoxicidade como a citotoxicidade podem ser avaliadas em várias doses quando comparadas com os controles solventes e que as frequências de MN estatisticamente significantes são observadas quando Esperado. Além disso, a diretriz de teste 487 da OCDE recomenda marcar 2.000 BNCs por concentração de teste para avaliar a presença de MN para determinar a genotoxicidade junto com pelo menos 500 células por concentração de teste para determinar a citotoxicidade9; Isto pode tomar sobre 1 h usando a microscopia manual. O protocolo e os resultados deste trabalho mostram que uma média de cerca de 6.000 BNCs, 16.000 células MONO e 800 células POLY foram capturadas e pontuadas por concentração de teste em cerca de 20 min. A rápida taxa de aquisição de dados e o elevado número de células candidatas pontuadas em tão pouco tempo destacam outra vantagem importante de empregar o MIFC para realizar o ensaio in vitro MN.
Embora os resultados apresentados neste artigo sejam encorajadores, eles são representativos de um método de prova de conceito precoce. Este trabalho deve ser acompanhado por uma investigação mais aprofundada de um conjunto químico maior e mais diversificado que abrange múltiplas classes e mecanismos de genotoxicidade e citotoxicidade, como os sugeridos por Kirkland et al.37 a realização desses estudos são demorado e trabalhoso, e se enquadram fora do escopo deste artigo no entanto, esses estudos de maior escala fornecerão informações valiosas sobre a capacidade do método de identificar de forma confiável agentes fracamente genotóxicos. A metodologia aqui apresentada ainda não foi miniaturizada para um formato de micropoços, o que permitiria uma triagem mais rápida e eficiente em uma faixa de dose maior. Como tal, em sua forma atual, o ensaio de MN in vitro baseado em MIFC aqui apresentado pode ser mais adequado para estudos de acompanhamento intensivos em trabalho ou pesquisa em boas práticas laboratoriais. No entanto, o método continuará a ser otimizado e validado, e possui o potencial de permitir maior flexibilidade na detecção de eventos químicos específicos relacionados à morfologia, como a exposição ao aneugênio que aumenta a proporção de células com núcleos não circulares que ainda são pontuáveis38. Finalmente, o método mifc apresenta uma oportunidade para introduzir biomarcadores adicionais no ensaio MN (por exemplo, coloração cinetócoro) para fornecer uma visão mais abrangente do mecanismo de indução de MN.
Divulgações
O autor é empregado pela Luminex Corporation, o fabricante do citometro de fluxo de imagem multiespectral ImageStream que foi utilizado neste trabalho.
Agradecimentos
O autor agradece a Christine Probst (Luminex Corporation) por seus esforços no desenvolvimento de formas anteriores do modelo de análise de dados, bem como a Dr. Haley Pugsley (Luminex Corporation) e o Dr. Phil Morrissey (Luminex Corporation) para revisar e editar o Manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 15 mL centrifuge tube | Falcon | 352096 | |
| Cleanser - Coulter Clenz | Beckman Coulter | 8546931 | Fill container with 200 mL of Cleanser. https://www.beckmancoulter.com/wsrportal/page/itemDetails?itemNumber=8546931#2/10//0/25/1/0/asc/2/8546931///0/1//0/ |
| Colchicine | MilliporeSigma | 64-86-8 | |
| Corning bottle-top vacuum filter | MilliporeSigma | CLS430769 | 0.22 um filter, 500 mL bottle |
| Cytochalasin B | MilliporeSigma | 14930-96-2 | 5 mg bottle |
| Debubbler - 70% Isopropanol | EMD Millipore | 1.3704 | Fill container with 200 mL of Debubbler. http://www.emdmillipore.com/US/en/product/2-Propanol-70%25-%28V%2FV%29-0.1-%C2%B5m-filtred,MDA_CHEM-137040?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Dimethyl Sulfoxide (DMSO) | MilliporeSigma | 67-68-5 | |
| Dulbecco's Phosphate Buffered Saline 1X | EMD Millipore | BSS-1006-B | PBS Ca++MG++ Free |
| Fetal Bovine Serum | HyClone | SH30071.03 | |
| Formaldehyde, 10%, methanol free, Ultra Pure | Polysciences, Inc. | 04018 | This is what is used for the 4% and 1% Formalin. CAUTION: Formalin/Formaldehyde toxic by inhalation and if swallowed. Irritating to the eyes, respiratory systems and skin. May cause sensitization by inhalation or skin contact. Risk of serious damage to eyes. Potential cancer hazard. http://www.polysciences.com/default/catalog-products/life-sciences/histology-microscopy/fixatives/formaldehydes/formaldehyde-10-methanol-free-pure/ |
| Hoechst 33342 | Thermo Fisher | H3570 | 10 mg/mL solution |
| Mannitol | MilliporeSigma | 69-65-8 | |
| MEM Non-Essential Amino Acids 100X | HyClone | SH30238.01 | |
| MIFC - ImageStreamX Mark II | EMD Millipore | 100220 | A 2 camera ImageStreamX Mark II eqiped with the 405nm, 488nm, and 642nm lasers was used. http://www.emdmillipore.com/US/en/life-science-research/cell-analysis/amnis-imaging-flow-cytometers/imagestreamx-Mark-ii-imaging-flow-cytometer/VaSb.qB.QokAAAFLzRop.zHe,nav?cid=BI-XX-BDS-P-GOOG-FLOW-B325-0006 |
| MIFC analysis software - IDEAS | EMD Millipore | 100220 | The companion software to the MIFC (ImageStreamX MKII) |
| MIFC software - INSPIRE | EMD Millipore | 100220 | This is the software that runs the MIFC (ImageStreamX MKII) |
| Mitomycin C | MilliporeSigma | 50-07-7 | |
| NEAA Mixture 100X | Lonza BioWhittaker | 13-114E | |
| Penicllin/Streptomycin/Glutamine solution 100X | Gibco | 15070063 | |
| Potassium Chloride (KCl) | MilliporeSigma | P9541 | |
| Rinse - Ultrapure water or deionized water | NA | NA | You can use any ultrapure water or deionized water. Fill container with 900 mL of Rinse. |
| RNase | MilliporeSigma | 9001-99-4 | |
| RPMI-1640 Medium 1X | HyClone | SH30027.01 | |
| Sheath - PBS | EMD Millipore | BSS-1006-B | This is the same as Dulbecco's Phosphate Buffered Saline 1X Ca++MG++ free. Fill container with 900mL of Sheath. |
| Sterile water | HyClone | SH30529.01 | |
| Sterilizer - 0.4-0.7% Hypochlorite | VWR | JT9416-1 | This is assentually 10% Clorox bleach that can be made by deluting Clorox bleach with water. Fill container with 200 mL of Sterilzer. |
| System Calibration Reagent - SpeedBead | EMD Millipore | 400041 | Each tube holds ~10 mL. https://www.emdmillipore.com/US/en/life-science-research/cell-analysis/amnis-imaging-flow-cytometers/support-training/XDqb.qB.wQMAAAFLBDUp.zHu,nav |
| T25 flask | Falcon | 353109 | |
| T75 flask | Falcon | 353136 | |
| TK6 cells | MilliporeSigma | 95111735 |
Referências
- Bonassi, S., et al. An increased micronucleus frequency in peripheral blood lymphocytes predicts the risk of cancer in humans. Carcinogenesis. 28 (3), 625-631 (2007).
- Fenech, M. The in vitro micronucleus technique. Mutation Research - Fundamental and Molecular Mechanisms of Mutagenesis. 455 (1-2), 81-95 (2000).
- Fenech, M. The Lymphocyte Cytokinesis-Block Micronucleus Cytome Assay and its Application in Radiation Biodosimetry. Health Physics. 98 (2), 234-243 (2010).
- Hintzsche, H., et al. Fate of micronuclei and micronucleated cells. Mutation Research - Reviews in Mutation Research. 771, 85-98 (2017).
- Fenech, M. The advantages and disadvantages of the cytokinesis-block micronucleus method. Mutation Research. 392 (1-2), 11-18 (1997).
- Fenech, M. Cytokinesis-block micronucleus cytome assay. Nature Protocols. 2 (5), 1084-1104 (2007).
- Fenech, M., Holland, N., Chang, W. P., Zeiger, E., Bonassi, S. The HUman MicroNucleus Project - An international collaborative study on the use of the micronucleus technique for measuring DNA damage in humans. Mutation Research - Fundamental and Molecular Mechanisms of Mutagenesis. 428 (1-2), 271-283 (1999).
- Kirsch-Volders, M., et al. Report from the in vitro micronucleus assay working group. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 540 (2), 153-163 (2003).
- OECD Library. Test No. 487: In vitro Mammalian Cell Micronucleus Test. OECD Guidelines for the Testing of Chemicals, Section 4. , (2016).
- Aardema, M. J., et al. SFTG international collaborative study on in vitro micronucleus test. III. Using CHO cells. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 607 (1), 61-87 (2006).
- Clare, M. G., et al. SFTG international collaborative study on in vitro micronucleus test. II. Using human lymphocytes. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 607 (1), 37-60 (2006).
- Lorge, E., et al. SFTG international collaborative study on in vitro micronucleus test. I. General conditions and overall conclusions of the study. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 607 (1), 13-36 (2006).
- Oliver, J., et al. SFTG international collaborative study on in vitro micronucleus test. V. Using L5178Y cells. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 607 (1), 125-152 (2006).
- Wakata, A., et al. SFTG international collaborative study on in vitro micronucleus test. IV. Using CHL cells. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 607 (1), 88-124 (2006).
- Fenech, M., et al. Intra- and inter-laboratory variation in the scoring of micronuclei and nucleoplasmic bridges in binucleated human lymphocytes: Results of an international slide-scoring exercise by the HUMN project. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 534 (1-2), 45-64 (2003).
- Decordier, I., et al. Automated image analysis of cytokinesis-blocked micronuclei: an adapted protocol and a validated scoring procedure for biomonitoring. Mutagenesis. 24 (1), 85-93 (2009).
- Decordier, I., et al. Automated image analysis of micronuclei by IMSTAR for biomonitoring. Mutagenesis. 26 (1), 163-168 (2011).
- Schunck, C., Johannes, T., Varga, D., Lorch, T., Plesch, A. New developments in automated cytogenetic imaging: unattended scoring of dicentric chromosomes, micronuclei, single cell gel electrophoresis, and fluorescence signals. Cytogenetic and Genome Research. 104 (1-4), 383-389 (2004).
- Rossnerova, A., Spatova, M., Schunck, C., Sram, R. J. Automated scoring of lymphocyte micronuclei by the MetaSystems Metafer image cytometry system and its application in studies of human mutagen sensitivity and biodosimetry of genotoxin exposure. Mutagenesis. 26 (1), 169-175 (2011).
- Nüsse, M., Marx, K. Flow cytometric analysis of micronuclei in cell cultures and human lymphocytes: Advantages and disadvantages. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 392 (1-2), 109-115 (1997).
- Avlasevich, S. L., Bryce, S. M., Cairns, S. E., Dertinger, S. D. In vitro micronucleus scoring by flow cytometry: Differential staining of micronuclei versus apoptotic and necrotic chromatin enhances assay reliability. Environmental and Molecular Mutagenesis. 47 (1), 56-66 (2006).
- Bryce, S. M., Bemis, J. C., Avlasevich, S. L., Dertinger, S. D. In vitro micronucleus assay scored by flow cytometry provides a comprehensive evaluation of cytogenetic damage and cytotoxicity. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 630 (1-2), 78-91 (2007).
- Bryce, S. M., et al. Flow cytometric 96-well microplate-based in vitro micronucleus assay with human TK6 cells: Protocol optimization and transferability assessment. Environmental and Molecular Mutagenesis. 54 (3), 180-194 (2013).
- Fenech, M. Commentary on the SFTG international collaborative study on the in vitro micronucleus test: to Cyt-B or not to Cyt-B. Mutation Research. 607 (1), 9-12 (2006).
- Basiji, D. A. Methods in Molecular Biology. 1389, 13-21 (2016).
- Rodrigues, M. A., Beaton-Green, L. A., Kutzner, B. C., Wilkins, R. C. Automated analysis of the cytokinesis-block micronucleus assay for radiation biodosimetry using imaging flow cytometry. Radiation and Environmental Biophysics. 53 (2), 273-282 (2014).
- Rodrigues, M. A., Beaton-Green, L. A., Kutzner, B. C., Wilkins, R. C. Multi-parameter dose estimations in radiation biodosimetry using the automated cytokinesis-block micronucleus assay with imaging flow cytometry. Cytometry Part A. 85 (10), 883-893 (2014).
- Rodrigues, M. A., Beaton-Green, L. A., Wilkins, R. C. Validation of the cytokinesis-block micronucleus assay using imaging flow cytometry for high throughput radiation biodosimetry. Health Physics. 110 (1), 29-36 (2016).
- Rodrigues, M. A., Probst, C. E., Beaton-Green, L. A., Wilkins, R. C. Optimized automated data analysis for the cytokinesis-block micronucleus assay using imaging flow cytometry for high throughput radiation biodosimetry. Cytometry Part A. 89 (7), 653-662 (2016).
- Rodrigues, M. A., Probst, C. E., Beaton-Green, L. A., Wilkins, R. C. The effect of an optimized imaging flow cytometry analysis template on sample throughput in the reduced culture cytokinesis-block micronucleus assay. Radiation Protection Dosimetry. 172 (1-3), 223-229 (2016).
- Wang, Q., et al. Automated Triage Radiation Biodosimetry: Integrating Imaging Flow Cytometry with High-Throughput Robotics to Perform the Cytokinesis-Block Micronucleus Assay. Radiation Research. 191 (4), 342-351 (2019).
- Rodrigues, M. A. Automation Of The In vitro Micronucleus Assay Using The ImageStream® Imaging Flow Cytometer. Cytometry Part A. 93, 706-726 (2018).
- Rodrigues, M. A., Beaton-Green, L. A., Wilkins, R. C., Fenech, M. F. The potential for complete automated scoring of the cytokinesis block micronucleus cytome assay using imaging flow cytometry. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 836, 53-64 (2018).
- Fenech, M., et al. HUMN project: Detailed description of the scoring criteria for the cytokinesis-block micronucleus assay using isolated human lymphocyte cultures. Mutation Research - Genetic Toxicology and Environmental Mutagenesis. 534 (1-2), 65-75 (2003).
- Verma, J. R., et al. Evaluation of the automated MicroFlow® and Metafer™ platforms for high-throughput micronucleus scoring and dose response analysis in human lymphoblastoid TK6 cells. Archives of Toxicology. 91 (7), 2689-2698 (2017).
- Fenech, M., et al. HUMN project initiative and review of validation, quality control and prospects for further development of automated micronucleus assays using image cytometry systems. International Journal of Hygiene and Environmental Health. 216 (5), 541-552 (2013).
- Kirkland, D., et al. Updated recommended lists of genotoxic and non-genotoxic chemicals for assessment of the performance of new or improved genotoxicity tests. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 795, 7-30 (2016).
- Verma, J. R., et al. Investigating FlowSight® imaging flow cytometry as a platform to assess chemically induced micronuclei using human lymphoblastoid cells in vitro. Mutagenesis. 33 (4), 283-289 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados