Method Article
Uso da imagem latente de ressonância magnética e dados da biópsia para guiar procedimentos da amostragem para o cancro da próstata Biobanking
Neste Artigo
Resumo
Este método envolve a utilização de dados diagnósticos clínicos para pacientes do cancro da próstata a fim guiar procedimentos da amostragem, quando o tecido para que segue o Prostatectomy radical. Isso supera as questões com métodos publicados anteriormente em torno da eficiência e disponibilidade de tecido fresco para uma ampla gama de aplicações a jusante.
Resumo
Métodos prévios para o tecido de próstata para, seguindo prostatectomia radical, geralmente envolveram amostragem aleatória. A fim de aumentar a eficiência, e permitir uma maior gama de aplicações a jusante, um método mais direcionado de amostragem de tecido prostático foi desenvolvido. Aqui nós usamos a imagem latente de ressonância magnética (MRI) e os dados da biópsia para alvejar áreas específicas do órgão para a amostragem. O método envolve o uso de um dispositivo de fatiamento da próstata previamente publicado que remova uma fatia transversal de 5 milímetros de uma região predeterminada da próstata, seguida pela remoção de biópsias do perfurador de 6 milímetros das áreas predeterminadas desta fatia. Essas amostras podem ser armazenadas congeladas ou fixas para fins de para, ou usadas imediatamente com 70% de confiança do conteúdo tumoral, em comparação com 10% de confiança na abordagem de amostragem aleatória. Isto permite o uso de todas as técnicas downstream padrão tais como a genômica, o proteômica ou o trabalho histológico, mas igualmente o trabalho que exige o tecido fresco tal como a imagem latente viva do tecido ou a cultura ex vivo.
Introdução
O acesso ao tecido do cancro da próstata humano da alta qualidade é uma exigência chave para conduzir a pesquisa eficaz no campo. Há um número de métodos existentes para a amostra de tecido prostático após prostatectomia radical para pesquisa. Tipicamente, estes envolvem o uso de biópsias de punção para tirar amostras aleatórias de uma fatia fresca, congelada ou fixa de tecido prostático, e confirmando retrospectivamente se o tumor está ou não presente em cada amostra por hematoxilina & eosina (H & E), conforme avaliado por um uropatologista1,2,3,4,5. Uma revisão recente compilou uma visão geral desses métodos existentes6. Estes métodos são úteis para determinadas aplicações a jusante, onde o tecido pode ser armazenado e avaliado para o índice do tumor em uma data mais atrasada, tal como análises genomic da grande escala como o consórcio internacional do genoma do cancro (ICGC) e o Atlas do genoma do cancro (TCGA) 4,7. Entretanto, estes métodos podiam ser melhorados em cima se nós fôssemos usar a imagem latente de ressonância magnética (MRI) e/ou dados da biópsia para alvejar áreas específicas da próstata para a amostragem. Isso melhoraria a metodologia de duas maneiras; em primeiro lugar, reduzindo o número de amostras de tecido coletadas, aumentando a eficiência e reduzindo a pressão sobre os departamentos de patologia e o custo do armazenamento, e em segundo lugar, permitindo que o tecido fresco seja usado imediatamente sem a necessidade de confirmação imediata de conteúdo tumoral, para novas tecnologias de ponta a jusante, como imagens de tecidos vivos, geração organóide ou cultura ex vivo. Esta necessidade da pesquisa conduziu ao desenvolvimento do método dos povos (amostras da próstata paciente para a pesquisa), e os resultados dos primeiros 84 casos biobanked usando povos foram publicados recentemente8. Uma variação desse método também foi publicada com um aparelho de corte impresso tridimensional (3D) e um molde específico para o paciente, a fim de facilitar a RM ex vivo no tecido pré e pós-fixação9,10.
Protocolo
O protocolo adere às diretrizes locais e é aprovado pelo Comitê de ética em pesquisa da UCL/UCLC Biobank (referência 15/YH/0311).
Nota: Como este método envolve a amostragem do tecido humano, todos os procedimentos locais em relação à ética e consentimento devem ser observados antes do início do protocolo. Os casos prostatectomia radicais podem ser incluídos se os dados de MRI e de biópsia estiverem disponíveis antes da cirurgia, com diâmetro do tumor ≥ 5 milímetros. os casos devem ser excluídos se a lesão do índice não é bem definida, isto é, somente as mudanças difusas são visíveis por MRI.
1. próstata cortando o aparelho
- Compre o aparelho de corte da próstata (tabela de materiais). Como alternativa, imprima uma alça de lâmina usando uma impressora 3D como anteriormente publicada10.
Nota: O dispositivo e as lâminas descartáveis usados aqui foram comprados o acordo de transferência material do Instituto da pesquisa do cancer, Londres, Reino Unido.
2. segmentação por tumor
- Examine as notas clínicas para identificar a lesão do índice como indicado pela biópsia diagnóstica, por exemplo, posterior esquerdo.
- Reveja imagens de MRI para medir a posição do tumor acima.
- Encontre a sequência em que o tumor é mais visível no plano axial, por exemplo, ponderado em T2.
- Percorra imagens axiais para encontrar a imagem onde o tumor é maior e imprima a imagem para referência.
- Na imagem coronal correspondente, medir a distância da base da próstata para a posição axial selecionada, e o comprimento total da próstata do ápice para a base (mm), e imprimir para referência.
3. coleção de Ppróstata
- Verifique as notas do paciente para garantir o consentimento informado adequado foi obtido para este procedimento e quaisquer aplicações de investigação a jusante.
- Após a prostatectomia radical, colete a próstata em um pote seco. Assegure-se de que nenhum formalina ou outro fixador estêve adicionado à próstata.
- Transfira para um local estéril adequado para amostragem, por exemplo, uma capa de fluxo laminar em um laboratório de patologia.
- Proceder à amostragem o mais rapidamente possível se o tecido fresco é necessário.
Nota: Para determinadas aplicações (por exemplo, a avaliação do ADN que não deve degradar tão rapidamente quanto o RNA), pode ser apropriado refrigerar o espécime e tomar amostras no dia seguinte.
4. preparação do espécime
- Prepare a capa do fluxo laminar e o instrumento de fatiamento da próstata de acordo com procedimentos locais da descontaminação, usando a técnica estéril. Aqui, pulverize 70% de etanol e limpe em todas as superfícies. Use agulhas e bipels estéreis de uso único. Use lâminas de fatiador até três vezes; Lave depois de cada uso em água quente e sabão, em seguida, spray e limpe com 70% etanol.
- Pesar a próstata (g) usando uma escala padrão.
- Tinta da próstata. Pinte o lado esquerdo com tinta azul e o lado direito com tinta preta. Cubra a cápsula completa e as vesículas seminais com tinta para denotar posteriormente as margens cirúrgicas.
Nota: Os procedimentos de tinta podem variar localmente e podem ser modificados de acordo.
5. corte da próstata
- Montar o aparelho de fatiamento inserindo as paredes perpendicularmente na base do suporte (Figura 1a).
- Coloc a próstata de modo que a base e o vértice estejam enfrentando paredes opostas, com o lado do posterior para baixo e anterior acima. Coloc os pinos do ouro em torno da próstata. Empurre a próstata para dentro um pouco se necessário para obter um ajuste confortável, que irá apoiar a próstata durante o corte.
- Meça o comprimento da próstata da base ao vértice, usando uma régua, e compare com o comprimento da próstata como medido por MRI. Se a próstata encolhido, aplique uma correção ad hoc à distância esperada da base à fatia transversal do alvo. Por exemplo, se o comprimento total da próstata na imagem de ressonância magnética for de 50 mm, mas quando medido com uma régua neste ponto tem encolhido para 45 mm, reduza a posição de fatiamento antecipada em 10%.
- Medir a partir da base para a fatia transversal desejada. Escolha o pino que fica mais próximo a esta medida para cortar ao redor.
- Vestindo luvas Chainmail para evitar ferimentos, segure o dispositivo de corte (Figura 1B), coloque as lâminas de cada lado do pino identificado e use o espaçador para manter as lâminas de 5 mm de distância. Tome a fatia lentamente e firmemente movendo as lâminas para baixo, para a frente e para trás com cursos longos (Figura 1C). Assegure-se de que uma fatia completa tenha sido separada antes de desmontar o aparelho.
- Retire as paredes e os pinos e cuidadosamente retire a fatia para uma folha estéril de placa de cortiça usando luvas.
6. amostragem do tecido
- Inspecione visualmente a fatia transversal e compare com a imagem axial de MRI. Em alguns casos, a área do tumor pode parecer mais pálida do que o tecido circundante.
- Palpate a fatia transversal delicadamente. Em alguns casos, o tumor pode se sentir mais firme do que o tecido circundante.
- Usando a imagem axial de ressonância magnética como guia, selecione uma ou mais áreas para amostragem.
-
Tome os socos da biópsia da área desejada do tecido.
- Usando um perfurador de 6 milímetros, empurre para baixo na área desejada do tecido.
- Torça o perfurador do tecido no ponto e para baixo de encontro à cortiça para assegurar a separação cheia e para usar um bisturi afiado para separar se necessário.
- Retire o perfurador e coloque em tubos/moldes, conforme necessário, ejectando usando o êmbolo.
- Repita para mais tumor e amostras benignas como exigido, com os socos estéreis separados da biópsia. Tinta os buracos onde os socos foram tomados em vermelho.
- Anote a posição de cada perfurador junto com o peso da próstata e todas as observações na cor/firmeza do tecido.
7. submissão da próstata para diagnósticos locais
- Fixe a próstata à cortiça com agulhas estéreis do único-uso antes da fixação a fim impedir o encolhimento e o entortamento do tecido, que poderiam alterar a aparência das margens cirúrgicas.
- Depois de fixar a cortiça, submeter a próstata para o departamento de histopatologia para diagnósticos clínicos padrão.
8. descontaminação de aparelhos
- Descarte todos os equipamentos descartáveis em fluxos de resíduos biomédicos e/ou recipientes de Sharps como designados localmente.
- Descontaminar a capota e o aparelho de corte de próstata de acordo com as avaliações de risco locais apropriadas ao tecido humano (por exemplo, pulverizando com 70% EtOH e limpando).
Resultados
O tecido de próstata fresco amostrado usando o método PEOPLE pode ser usado para uma variedade de técnicas downstream, incluindo sequenciamento genômico e cultura ex vivo. Os primeiros 59 casos amostrados usando esse método foram publicados anteriormente em comparação com uma versão anterior do método, juntamente com dados iniciais de downstream8. O tempo do primeiro fatiar a próstata para congelar/fixar as biópsias do perfurador aqui era aproximadamente 1 minuto, que foi mantido a um mínimo para evitar a degradação do RNA. O tempo da remoção da próstata ao fatiamento da próstata deve igualmente ser mantido a um mínimo, embora aqui este fêz exame de aproximadamente 20 minutos devido a nossos laboratórios do Theatre e da patologia que estão em posições diferentes.
Dependendo da aplicação a jusante, tipicamente pelo menos duas amostras são tomadas: uma de uma área do tecido do tumor antecipado e uma de uma área do tecido benigno antecipado. A medida chave do sucesso para o método de amostragem próprio é avaliar o índice do tumor em uma amostra dada.
Para a entrada no projeto dos genomas 100.000, uma seção manchada do tecido de H & e deve ser avaliada por um uropathologist, e a amostra deve conter pelo menos 40% de pilhas do tumor. Amostras que contenham menos de 40% de tumor ainda podem ser incluídas no projeto se forem macrodissecadas com sucesso. Dos primeiros 92 casos amostrados dessa forma, 64% continham pelo menos 40% de tumor e foram submetidos ao projeto genomes 100.000 sem macrodissecção. O DNA foi extraído e foi de rendimento e qualidade suficientes em todos os casos (tabela 1). Um subconjunto inicial de 59 dessas amostras foi publicado anteriormente em comparação com um método anterior8.
Para a cultura ex vivo, o tumor combinado e o tecido benigno devem ser de qualidade suficiente para resistir à cultura 72 h sem degradação significativa. As amostras múltiplas do tecido de um total de três pacientes foram cultivadas com sucesso8.
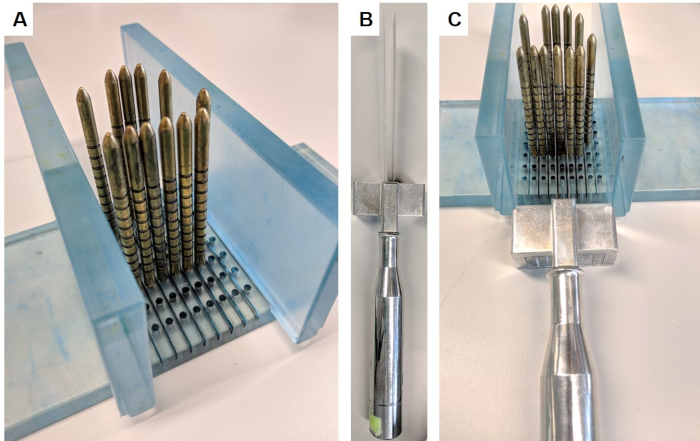
Figura 1: aparelho de fatiamento da próstata. Este aparelho foi obtido acordo de transferência de material do Instituto de pesquisa do câncer. (A) asparedes são inseridas perpendiculares à base, e os pinos dourados são inseridos na base que circunda a próstata (próstata não retratada). (B) as lâminas paralelas substituíveis são inseridas no punho da lâmina. (C) as lâminas passam entre os pinos de ouro, a fim de cortar uma seção de 5 mm da próstata. Por favor clique aqui para ver uma versão maior desta figura.
| n (%) | |
| Hit (> 40% tumor) | 59 (64%) |
| Acerto parcial (5-30% tumor) | 6 (7%) |
| Senhorita (0% tumor) | 27 (29%) |
| Total | 92 (100%) |
Tabela 1: taxa de acerto tumoral. A taxa de batida do tumor foi determinada por um patologista do consultante que especializa-se no cancro de próstata, seguindo a revisão do tecido manchado de H & E. O índice da pilha do tumor de > 40% foi determinado para ser apropriado para a inclusão no projeto de 100.000 genomes, como por directrizes de Genomics Inglaterra.
Discussão
As etapas críticas dentro deste protocolo incluem a identificação da região do tumor para a amostragem, a medida da próstata, e a amostragem do tecido. Em primeiro lugar, a medição da RM para identificar a área correta da amostragem é fundamental. Demonstramos este método no vídeo que o acompanha; no entanto, também recomendamos a confirmação de medições com um radiologista em primeira instância. As notas clínicas desobstruídas que apontam o investigador para a área das imagens de MRI que contêm a lesão do índice são ideais. Em segundo lugar, a medida da próstata deve ser realizada com cuidado, assegurando-se de que a régua esteja prendida em um ângulo para medir o comprimento cheio da base ao vértice, paralelo ao anterior da próstata. Em terceiro lugar, as áreas do tumor devem ser confirmadas antes da amostragem inspecionando visualmente a fatia do tecido com relação à imagem original de MRI, palpando o tecido (em alguns casos a área do tumor pode sentir mais densa), e avaliando visualmente a cor do tecido (em alguns casos o tumor parecerá mais pálido do que o tecido benigno circunvizinho).
Este protocolo foi realizado na íntegra na UCL/UCLH por pesquisadores não-clínicos de pós-doutorado, um colega de patologia, consultores de patologia e técnicos de pesquisa. Em nossa experiência todos os passos do protocolo pode ser aprendido em menos de dez casos, independentemente do fundo técnico. No entanto, recomendamos a formação de um radiologista sobre a medição da RM e treinamento de um patologista em relação ao fatiamento em primeira instância. O protocolo pode ser modificado usando uma alça de corte impressa em 3D, conforme publicado anteriormente10.
As limitações potenciais da técnica incluem o risco de impedir no diagnóstico. Fatiar a próstata é um passo chave, que poderia impedir a classificação ou taxas de margem positiva se feito incorretamente. Há dois problemas potenciais aqui. Primeiramente, se toda a lesão do índice for removida e usada para a experimentação fresca do tecido imediatamente, o diagnóstico clínico rotineiro não será realizado para esta lesão e o paciente pode ser diagnosticado mal como tendo um cancro mais baixo da classe. Para evitar isso, o pesquisador deve discutir o plano amostral com o patologista consultor que revisará rotineiramente o caso, antes da amostragem, e concordará com o número e localização das amostras a serem tomadas. Os tumores pequenos podem ser excluídos localmente por esta razão. Em segundo lugar, se a cápsula prostática não é fixada corretamente para a placa de cortiça antes da fixação, isso poderia permitir que o tecido interno a protuberância para fora durante a fixação, alterando as margens cirúrgicas. Isto poderia conduzir a uma margem falsa positiva, onde o tumor restante pareça residir na cápsula puramente devido ao entortamento do tecido.
O significado desta técnica com respeito aos métodos existentes encontra-se principalmente com a segmentação do tumor. Uma série de métodos para amostragem de espécimes de prostatectomia radical foi publicada até à data; no entanto, todos estes dependem de uma abordagem de amostragem totalmente ou parcialmente aleatório1,2,3,4,5,6,7. O uso de biópsia e, em particular, dados de RM aqui melhorou a eficiência, permitindo uma amostragem reduzida com maior confiança na obtenção do tecido tumoral8.
Futuras aplicações deste método permitem a adoção de uma gama mais ampla de técnicas a jusante do que com métodos de amostragem anteriores. Por exemplo, a disponibilidade do tecido fresco que tem uma probabilidade elevada de ser tumor significa que umas técnicas frescas mais caras e/ou labor-intensive do tecido podem ser utilizadas, porque muitas amostras não são exigidas para assegurar a presença de tumor. Isso pode incluir e não está limitado a, cultura ex vivo, ex vivo MRI, imagens avançadas e transcriptomics.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores desejam reconhecer o câncer de próstata do Reino Unido para financiar SH o câncer de próstata Reino Unido centro de excelência e viagem prêmio Fellowship (TLD-PF16-004) e HP inovar (PG14-018-TR2). Este trabalho foi apoiado por pesquisadores do Instituto Nacional de pesquisa em saúde University College London Hospitals centro de pesquisa biomédica.
Materiais
| Name | Company | Catalog Number | Comments |
| 6 mm biopsy punch | Fisher Scientific | 13404607 | Disposable biopsy punches for removing 6 mm tissue samples |
| Black Ink | Leica Biosystems | 3801753 | Tissue marking & margin dye |
| Blue Ink | Leica Biosystems | 3801751 | Tissue marking & margin dye |
| Chainmail hand glove | Arco | 1456803 | Chainmail gloves to protect hand during slicing |
| Cork board | Fisher Scientific | 12396447 | Cork board for pinning prostate to following sampling procedure |
| Needles | SLS (Scientific Laboratory supplies) | SYR6112 | Sterile needles to use to pin tissue to cork board following sampling |
| Prostate slicing aparatus | Insitute of Cancer Research, London | NA - must be obtained under MTA | A kit containing the slicer handle, blades, spacer, base, walls and pins |
Referências
- Sooriakumaran, P., Henderson, A., Denham, P., Langley, S. E. A novel method of obtaining prostate tissue for gene expression profiling. International Journal of Surgical Pathology. 17 (3), 238-243 (2009).
- Jhavar, S. G., et al. Processing of radical prostatectomy specimens for correlation of data from histopathological, molecular biological, and radiological studies: a new whole organ technique. Journal of Clinical Pathology. 58 (5), 504-508 (2005).
- Wheeler, T. M., Lebovitz, R. M. Fresh tissue harvest for research from prostatectomy specimens. The Prostate. 25 (5), 274-279 (1994).
- Esgueva, R., et al. Next-generation prostate cancer biobanking: toward a processing protocol amenable for the International Cancer Genome Consortium. Diagnostic Molecular Pathology. 21 (2), 61-68 (2012).
- Dev, H., et al. Biobanking after robotic-assisted radical prostatectomy: a quality assessment of providing prostate tissue for RNA studies. Journal of Translational Medicine. 9, 121(2011).
- Tolkach, Y., et al. Blind Biobanking of the Prostatectomy Specimen: Critical Evaluation of the Existing Techniques and Development of the New 4-Level Tissue Extraction Model With High Sampling Efficacy. The Prostate. 77 (4), 396-405 (2017).
- Warren, A. Y., et al. Method for sampling tissue for research which preserves pathological data in radical prostatectomy. The Prostate. 73 (2), 194-202 (2013).
- Heavey, S., et al. PatiEnt prOstate samPLes for rEsearch, a tissue collection pathway utilizing magnetic resonance imaging data to target tumor and benign tissue in fresh radical prostatectomy specimens. The Prostate. 79 (7), 768-777 (2019).
- Bailey, C., et al. VERDICT MRI validation in fresh and fixed prostate specimens using patient-specific moulds for histological and MR alignment. NMR in Biomedicine. 32 (5), 4073(2019).
- Bourne, R. M., et al. Apparatus for Histological Validation of In Vivo and Ex Vivo Magnetic Resonance Imaging of the Human Prostate. Frontiers in Oncology. 7, 47(2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados