Method Article
Isolamento e Cultura de Adipócitos Maduros Humanos Usando culturas agregadas de adipócitomaduros de membrana (MAAC)
Neste Artigo
Resumo
A cultura agregada madura de membrana (MAAC) é um novo método para cultivar adipócitos humanos maduros. Aqui detalhamos como isolar adipócitos do adipose humano e como configurar o MAAC.
Resumo
A disregulação do tecido adiposo branco (WAT) desempenha um papel central no desenvolvimento da resistência à insulina e diabetes tipo 2 (T2D). Para desenvolver novos tratamentos para T2D, são necessários modelos de adipocito in vitro mais fisiologicamente relevantes. Este estudo descreve uma nova técnica para isolar e cultivar adipócitos humanos maduros. Este método é intitulado MAAC (cultura adipocito madura de membrana), e comparado a outros modelos in vitro adipocitos, o MAAC possui uma assinatura genética adipogênica que é a mais próxima de adipócitos maduros recém-isolados. Usando MAAC, os adipócitos podem ser cultivados a partir de pacientes magros e obesos, diferentes depósitos adiposos, co-cultivados com diferentes tipos de células e, principalmente, podem ser mantidos na cultura por 2 semanas. Experimentos funcionais também podem ser realizados no MAAC, incluindo captação de glicose, lipogênese e lipolisse. Além disso, o MAAC responde robustamente ao agonismo farmacológico diversificado e pode ser usado para estudar alterações de adipocito eadipocito, incluindo a transdiferenciação de adipocitos brancos em células de gordura marrom.
Introdução
O aumento mundial das comorbidades relacionadas à obesidade e à obesidade requer o desenvolvimento de novas terapêuticas. O tecido adiposo branco (WAT) é um importante regulador do metabolismo do corpo inteiro, homeostase energética, e é um player central no desenvolvimento da resistência à insulina e diabetes tipo 2 (T2D)1,2. Durante o consumo crônico de calorias em excesso, os adipócitos aumentam para lidar com o excedente de energia. No entanto, a capacidade de armazenamento lipídico adipocito pode ser excedida, resultando em uma elevação dos níveis circulantes de ácidos graxos e aumento do armazenamento em tecidos periféricos não adippose e levando à lipotoxicidade3,4.
A falta de modelos in vitro adipocitos com alta relevância translacional é um desafio fundamental no desenvolvimento de novos tratamentos para obesidade e T2D. O modelo exvivo explant, onde pequenos pedaços de tecido adipo são cultivados, está associado a alterações rápidas na expressão genética adipogênica impulsionada pela hipóxia e inflamação5,6. Culturas de teto (CCs) onde os adipócitos maduros flutuam e aderem ao topo dos frascos cheios de mídia, rapidamente desdiferenciam-se em células semelhantes a fibroblastos sem lipídio7,8,9,10. O modelo mais usado são adipócitos diferenciados in vitro de precursores comprometidos. As células diferenciadas são, no entanto, morfologicamente distintas dos adipócitos maduros in vivo, uma vez que são muito menores em tamanho e carecem de gotícula lipídica não ilócula. Outras limitações com este modelo incluem a necessidade não fisiológica de um coquetel químico para conduzir a diferenciação, bem como a variabilidade na eficiência da diferenciação que pode ser afetada por uma série de fatores11,12,13,14.
Desenvolvemos recentemente a cultura adipocito madura de membrana (MAAC), um método para a cultura de longo prazo de adipócitos maduros recém-isolados, onde os adipócitos são cultivados membranas permeáveis10. A análise imparcial dos dados de sequenciamento de RNA mostrou que em relação às explantas de tecido adipposados e adipócitos in vitro diferenciados, o MAAC é mais semelhante aos adipócitos recém-isolados. O MAAC pode ser usado para cultivar adipócitos maduros isolados tanto de tecido adipano subcutâneo quanto visceral, bem como adipócitos de indivíduos obesos e magros. Essa metodologia permite o estudo de alterações adipocitos adipocitos adipocitos de longo prazo e facilita a co-cultura de adipócitos com outros tipos de células. Aqui fornecemos um protocolo detalhado para o isolamento de adipócitos maduros do tecido adippose humano e como configurar o sistema MAAC.
Protocolo
Amostras anônimas de tecido adiposo foram coletadas da região abdominal de pacientes do sexo feminino submetidos a cirurgia eletiva no Hospital Universitário Sahlgrenska, em Gotemburgo, Suécia. Todos os sujeitos do estudo receberam informações escritas e orais antes de dar em contato por escrito para o uso do tecido. Os estudos foram aprovados pelo Conselho Regional de Revisão Ética em Gotemburgo, Suécia.
NOTA: Uma visão geral do método é fornecida na Figura 1.
1. Preparação de Buffers, Mídia de Cultura Tecidual e Placas de Cultura
- Prepare um estoque de 5x Krebbs Ringer (KR) dissolvendo 35,1 g de NaCl, 1,75 g de KCl, 0,82 g de KH2PO4, e 1,48 g de MgSO4·7H2O em 900 mL de água. Adicione 1,84 g de CaCl2·2H2O e ajuste o volume para 1 L adicionando água. Filtro estéril através de um filtro de 0,22 μm e armazenar a 4 °C.
- A partir do estoque 5x KR, prepare 1 L de tampão contendo 1x KR, 25 mM HEPES, 2 mM glicose e 2% de albumina de soro bovino (BSA) (referido a seguir como tampão de lavagem). Ajuste o pH para 7,4.
- Prepare 500 mL de tampão colagenase contendo 1x HBSS + CaCl2 + MgCl2, 2% BSA e 450 mL de água (referido a seguir como tampão de digestão).
NOTA: A colagenase não deve ser adicionada ao tampão de digestão até que o tecido adiposo tenha sido pesado na etapa 2.2. - Ajuste o pH do Médio 199 para 7,4.
- Filtro estéril tanto tampões quanto médio 199 através de um frasco de filtro de 0,22 μm e quente a 37 °C.
NOTA: Para economizar tempo, a mídia de cultura tecidual pode ser preparada e adicionada às placas antes de processar o tecido adiposo. Para um formato de placa de 24 poços (Figura 1A),use 0,5-1 mL/well da mistura de nutrientes de Águia modificada de Dulbecco F12 (DMEM/F12), 10% de soro bovino fetal (FBS), 1% de penicilina-estreptomicina (penn/estreptococo) e 20 nM de insulina. Pequenas moléculas e outros agentes farmacológicos estáveis também podem ser adicionados neste momento à mídia no layout desejado. Coloque as placas em uma incubadora de cultura tecidual (37 °C, 5% CO2).
2. Dissecção de Tecido Adipose Subcutâneo Humano
NOTA: Trabalhe dentro de um gabinete de segurança biológica e utilize técnica estéril durante todo o processo de isolamento, bem como uso exclusivo de equipamentos autocelavados e estéreis.
- Coloque o tecido adiposo humano em uma placa de petri de 15 cm e adicione um pequeno volume de 199 médios para mantê-lo hidratado durante a dissecação.
- Trabalhando com pedaços de adipose aproximadamente do tamanho de uma bola de golfe, segure grandes vasos fibrosos com pinças e solte suavemente os adiócitos raspando o adipose com a parte de trás de tesouras fechadas. Descarte os grandes pedaços de tecido fibroso. Pesar a gordura aparada.
3. Tratamento colagenase
- Adicione colagenase ao tampão de digestão (ver passo 1.3) em uma concentração de 1 mg/mL. Filtrar estéril a solução usando um filtro estéril de 0,22 μm.
NOTA: Recomenda-se três mL de tampão de digestão por grama de gordura (ou seja, para 100 g de gordura, prepare 300 mL de tampão de digestão com 300 mg de colagenase tipo 2).
ATENÇÃO: A colagenase tipo 2 é perigosa para os olhos, pele e pode causar irritação respiratória. Use luvas, proteção ocular e trabalhe em um capô ventilado ao manusear a colagenase. - Mova aproximadamente 10 g de tecido adiposo para uma placa de petri de 15 cm e pique a gordura cuidadosamente usando um par de tesouras curvas até que se torne uma mistura homogênea lisa e não haja grandes pedaços de adipose à esquerda. Repita o processo até que toda a gordura tenha sido processada.
NOTA: Cada rodada deve levar aproximadamente 2 min e as peças de adipose devem ser pequenas o suficiente para que possam ser pipetadas usando uma ponta de pipette de furo largo. Este passo é crucial para produzir adipócitos de alta qualidade. Se as peças forem muito grandes, os tempos de digestão terão que ser estendidos, comprometendo a viabilização celular. - Transfira a gordura picada em tubos cônicos de 50 mL usando uma colher. Adicione 10 mL de tecido picado e 30 mL de tampão de digestão a cada tubo. Reduza para volumes apropriados se houver menos de 10 mL de gordura picada disponível.
- Digerir o tecido a 37 °C em uma incubadora de tremor com agitação constante a 150 rpm por 30-45 min. Após 30 min, verifique o processo a cada 5 min para evitar a digestão excessiva.
NOTA: A digestão é completa quando a solução de adipose é homogênea sem peças grandes e tem uma cor damasco.
4. Filtragem da Suspensão celular e purificação dos Adipócitos Maduros
- Coloque um funil em cima de um frasco estéril de 1 L e coloque um filtro de malha estéril de 250 μm dentro do funil. Despeje a solução de gordura digerida no filtro para remover o tecido não digerido.
- Quando toda a suspensão de adipocito passar pelo filtro, aperte suavemente o filtro de malha para aumentar o rendimento dos adipócitos. Despeje aproximadamente 50-100 mL de tampão de lavagem no filtro para enxágüá-lo e espremer o filtro novamente.
- Despeje a suspensão de adipocito isolado do frasco em um funil de separação e adicione tampão de lavagem até que o funil esteja quase completamente preenchido. Inverta suavemente o funil algumas vezes para misturar a suspensão de adipocito com o tampão.
- Deixe a suspensão ficar de 2 a 3 min até que haja uma separação distinta de 2 camadas (Figura 1B), com uma camada amarela superior contendo os adipócitos maduros e lipídio livre e uma camada inferior contendo o tampão e a fração vascular de estroma adipposa (SVF).
- Abra o bocal no funil de separação e elute lentamente a solução inferior em um frasco estéril (as células do SVF podem ser pelotas e coletadas após centrífuga separação a 200 x g por 7 min). Mantenha a camada superior com os adipócitos maduros no funil de separação.
- Repita o processo de lavagem nas etapas 4.3-4,5 três vezes para lavar completamente os adipócitos maduros e remover toda a colagenase.
5. Embalagem dos Adipócitos Maduros
- Abra o bico e colete a suspensão purificada de adipócito maduro em tubos cônicos de 50 mL.
- Embale levemente os adipócitos maduros girando os tubos a 50 x g por 3 min.
- Use uma agulha de 18 G e uma seringa para remover o buffer restante abaixo da suspensão do adipocito.
- Remova a camada lipídica livre (óleo da pequena porção de adipócitos que quebrou durante o procedimento de isolamento) flutuando em cima dos adipócitos maduros usando uma pipeta.
NOTA: Para reduzir o risco de que os adipócitos esgotem as membranas na etapa 6.5, é importante que a camada lipídica e todo o tampão de lavagem tenham sido removidos quando os adipócitos maduros forem semeados em membranas. Por essa razão, recolhem os adipócitos em 3 tubos. As amostras coletadas por último terão o lipídio mais de transporte e, portanto, serão da menor qualidade. No entanto, com tubos cuidadosos, essas amostras podem ser usadas.
6. Sementes de Adipócitos Maduros
- Abra a embalagem contendo as pastilhas de membrana permeável(Tabela de Materiais)e tire o componente da membrana. Vire-o de cabeça para baixo e coloque em uma superfície estéril para que as membranas encabeçam o teto.
- Pipette 30 μL de adipócitos maduros embalados em cada uma das membranas (Figura 1C). Evite tocar na membrana com a ponta. Use dicas de pipette de furo largo para semear as células, ou use tesouras para cortar um pequeno pedaço de uma ponta de pipeta para torná-lo mais amplo.
- Inverta suavemente os tubos de 50 mL com adipócitos embalados várias vezes durante todo o processo de semeagem para garantir uma distribuição uniforme de adipócitos com diferentes tamanhos.
- Leve as placas multiwell preparadas contendo a mídia da incubadora para o armário de biossegurança e remova as tampas. Pegue as membranas semeadas com adipócitos e agarre-a do fundo para que possa ser invertida na etapa 6.5.
- Em um movimento suave inverta as membranas com os adipócitos em cima para que os adipócitos semeados estejam agora voltados para baixo(Figura 1D). Abaixe a placa com adipócitos nos poços que contêm mídia(Figura 1E).
- Coloque a tampa na placa e transfira cuidadosamente a placa para uma incubadora de cultura tecidual. Evite o movimento rápido da placa, uma vez que os adipócitos podem facilmente ser desalojados inicialmente.
NOTA: Leva alguns dias para as células aderirem mais firmemente à membrana.
7. Manutenção de Adipócitos e Colheita para Análise
- Mude a mídia pelo menos a cada 7 dias. Remova e adicione a mídia através do orifício de recorte em cada inserção de membrana. Para remover a mídia, use uma seringa e uma agulha, uma varinha aspiradora ou uma pipeta com uma ponta p200. Para adicionar mídia, use uma pipeta e lentamente pipeta nova mídia nos poços ao longo da parede para evitar perturbar os adipócitos.
NOTA: Os adipócitos foram cultivados por 2 semanas com uma mudança de mídia após 7 dias. No entanto, diferentes origens adiposas e questões experimentais podem se beneficiar do aumento das mudanças na mídia. - Para colher RNA, remova a mídia conforme descrito na etapa 7.1 e adicione 500 μL de tampão de lise(Tabela de Materiais)diretamente nos poços para lyse as células. Para corrigir as células para imagem, adicione formaldeído diretamente ao poço com uma concentração final de 1%.
NOTA: As células podem então ser armazenadas a 4 °C.
Resultados
Adipócitos maduros cultivados como MAAC preservam sua função, fenótipo, e podem ser usados para estudar respostas adipócitos a vários tratamentos farmacológicos. Após 1 semana de cultura MAAC isolado do tecido adiposo subcutâneo manter a característica gotícula lipídica não ilocular encontrada apenas em adipócitos maduros(Figura 2A). O MAAC foi cultivado por 1 semana enquanto tratado com os agonistas pparγ rosiglitazone (Rosi) e pioglitazone (Pio), ou o receptor glicocorticoide (GR) agonista agonista (Dex) para determinar se diferentes agonistas de hormônionuclear (NHR) dirigem mudanças previstas nos genes alvo a jusante no MAAC. Rosi e Pio aumentaram a expressão dos genes responsivos PPARγ FABP4 e LPL em 4 e 2-3 vezes, respectivamente, enquanto a dexametasona não teve efeito (Figura 2B). Da mesma forma, a dexametasona impulsionou robustamente a expressão genética dos genes alvo GR APOD e FKBP5 em 13 e 55 vezes, respectivamente, enquanto os agonistas PPARγ não tiveram efeitos significativos. Já demonstramos anteriormente que adipócitos brancos maduros humanos recém-isolados podem se transdiferenciar em um fenótipo marrom no MAAC quando tratados com Rosi10. Um tratamento de 7 dias com Rosi ou Pio robustamente induziu a expressão genética do gene específico de gordura marrom UCP1 por 44-65 dobra, bem como aumentou a expressão do marcador de gordura marrom PDK4 12-18 dobra(Figura 2C).
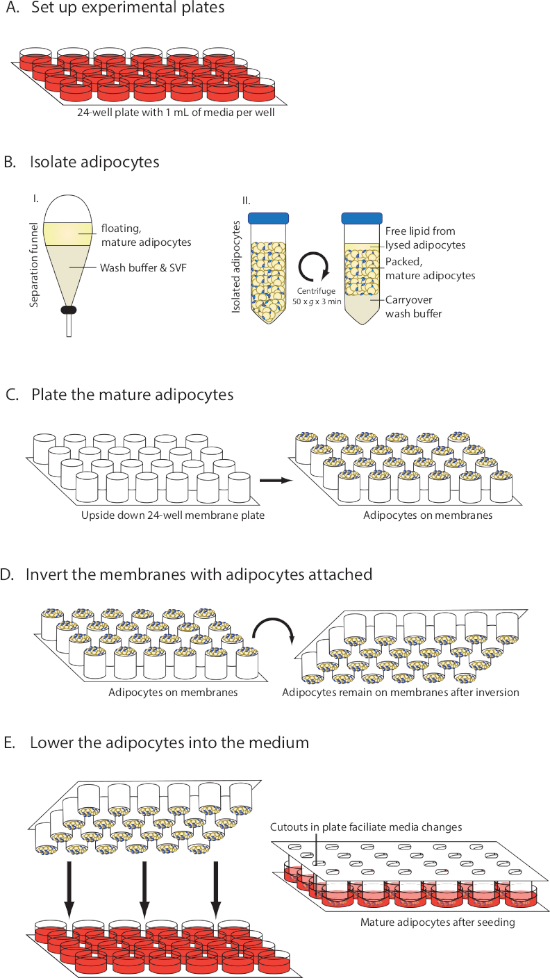
Figura 1: Diagrama visual da configuração MAAC. (A)Preparação do meio. (B)Isolamento e embalagem de adipócitos maduros. (C)Adipócitos maduros em membranas. (D) Invertendo membranas enquanto mantém os adipócitos ligados. (E)Baixar as membranas para o meio e alterar o meio. Este número foi modificado de Harms et al.10. Clique aqui para ver uma versão maior deste valor.
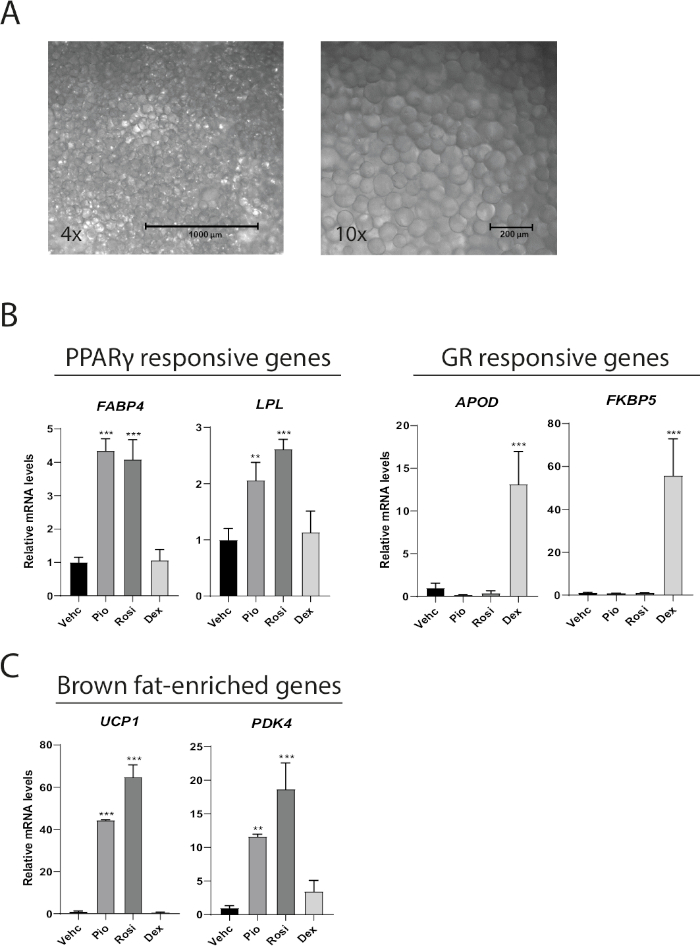
Figura 2: MAAC mantém aparência não ocular durante uma semana e responde ao agonismo farmacológico diverso. (A)Representante 4x e 10x imagens de campo brilhante do MAAC após uma semana de cultura. Adipocitos que têm um diâmetro médio de 100 μm com grandes gotículas lipídicas não ilculares são facilmente perceptíveis. (B) níveis de mRNA de genes alvo PPARγ e receptor glucocorticoide (GR) têm genes-alvo no MAAC após 7 dias de tratamento com veículo (Vehc), rosiglitazone (Rosi), pioglitazone (Pio) ou dex.a. Rosi, Pio e Dex foram utilizados em uma concentração final de 10 μM.(C) níveis de mRNA de genes enriquecidos com gordura marrom no MAAC após 7 dias de tratamento com veículo (Vehc), rosiglitazone (Rosi), pioglitazone (Pio) ou dex. Rosi, Pio e Dex foram todos usados em uma concentração final de 10 μM. Para todos os dados de expressão genética, a proteína de ligação TATA (TBP) foi usada como um controle de normalização interna. As estatísticas foram calculadas usando ANOVA unidirecional com o teste de comparações múltiplas de Tukey. (média ± SD, n = 3, *p < 0,05; **p < 0,01; ***p < 0,001). Clique aqui para ver uma versão maior deste valor.
Discussão
A cultura adipocito madura da membrana (MAAC) é um novo método para a cultura de longo prazo de adipócitos maduros recém-isolados. Na criação do MAAC, existem alguns passos críticos no protocolo que impactam muito o rendimento, a qualidade e a viabilidade dos adipócitos maduros. Muito esforço deve ser colocado para picar a gordura na etapa 3.2, uma vez que esta etapa influencia diretamente na quantidade de tempo que os adipócitos são expostos à colagenase. Se os pedaços de adipose forem muito grandes, o tempo de digestão terá que ser estendido, o que impacta negativamente a viabilidade das células. Por outro lado, se o tecido for processado muito bem com uma tesoura, a viabilidade também pode ser impactada. Para uma cultura bem sucedida de adipócitos maduros como MAAC, deve-se dar atenção especial aos seguintes passos: para a semeação bem sucedida dos adipócitos nas membranas, é crucial que o protetor de labuta lipídico livre e de transporte seja removido dos adipócitos maduros nos passos 5.3 e 5.4. O lipídio ou tampão de lavagem restante reduzirá a tensão superficial dos adipócitos e aumentará o risco de adipócitos pingando as membranas quando são virados. Quando os adiócitos são semeados e na mídia, as células permanecem em contato com a membrana principalmente através da flutuação, assim, recomenda-se uma técnica lenta e suave ao mudar a mídia para não perder células. Remova a mídia da parte inferior dos poços, conforme descrito na etapa 7.1 e adicione mídia, canalizando lentamente os meios de comunicação pelas laterais das paredes. Por fim, uma sugestão de economia de tempo é preparar as placas com mídia e tratamentos antes do processo de isolamento adipócito. Particularmente para projetos experimentais complexos, a pré-preparação das placas pode economizar muito tempo e garante que os adiócitos sejam colocados na mídia com seus tratamentos assim que estiverem isolados.
Um benefício do uso do MAAC em comparação com os preadipócitos diferenciados é que a mídia MAAC usada é muito simples e não requer um coquetel hormonal não fisiológico. Aqui temos maac cultivado em mídia rica em glicose (DMEM/F12), 10% FBS, 1% penn/estrep, e 20 nM insulina. É importante ressaltar que a insulina é absolutamente necessária para a indução impulsionada pela rosiglitazone/pioglitazone do UCP110. A insulina, no entanto, não é necessária para manter o fenótipo adipogênico das células. Assim, dependendo da questão experimental, a insulina pode ser incluída ou omitida.
O procedimento detalhado acima foi otimizado para o isolamento e cultura dos adipócitos humanos. No entanto, o rato, e possivelmente os adipócitos de outros organismos, também podem ser cultivados como MAAC. Se os adipócitos do camundongo devem ser cultivados como MAAC, há considerações adicionais e precauções que devem ser mantidas em mente. Descobrimos que adipócitos maduros de camundongos são muito mais frágeis do que os humanos. Como resultado, o tempo de digestão deve ser reduzido para um mínimo absoluto para aumentar a viabilidade celular. Também descobrimos que os adipócitos de camundongos jovens (8 semanas de idade e mais jovens) forneceram os resultados mais robustos e reprodutíveis. Por fim, o mouse MAAC pode ser cultivado por até uma semana, no entanto, dado que seu fenótipo adipogênico parece menos estável do que os humanos (que podem ser cultivados ao longo de pelo menos duas semanas) recomendamos o rato de culturing MAAC pelo tempo mínimo necessário para abordar questões experimentais.
Uma vez que o modelo MAAC é baseado no uso de membranas permeáveis, uma vantagem dessa técnica é a possibilidade de co-culturing os adipócitos maduros com outros tipos de células. Já demonstramos anteriormente a capacidade de adipócitos maduros e macrófagos para falar cruzado através do uso do MAAC10. Isso abre oportunidades para explorar ainda mais a ligação entre obesidade, resistência à insulina e respostas imunes15,16,17. Experimentos futuros poderiam incorporar outros tipos de células, como hepatocitos, preadipócitos, células endoteliais ou células pancreáticas para aumentar ainda mais a complexidade e a relevância translacional do modelo MAAC e investigar crosstalk entre vários tipos de células.
Embora o MAAC tenha se mostrado superior na manutenção da funcionalidade e identidade dos adipócitos em relação a outros modelos in vitro adipócitos, ele também tem limitações que precisam ser consideradas. Em comparação com o uso de adiócitos diferenciados das células precursoras, o MAAC é um modelo mais trabalhoso e demorado. Placas com membranas também são mais caras em comparação com placas regulares de cultura celular. É importante ressaltar que os adipócitos maduros precisam ser recém-isolados a cada vez após a semeação e não podem ser expandidos ou congelados em estoques como células precursoras. Assim, isso requer ter acesso a amostras frescas de tecido adiposo branco, mas também adiciona um nível de complexidade decorrente de variações de doadores a doadores.
Aqui apresentamos um protocolo detalhado para isolar adipócitos maduros humanos e configurar o MAAC. Demonstramos que os adipocitos cultivados como MAAC permanecem viáveis ao longo de duas semanas, sua assinatura genética adipogênica é preservada, e eles respondem ao agonismo farmacológico diverso. O uso do MAAC permite o estudo de adipócitos betweeen e outros tipos de células, e a avaliação de mudanças pénotipicas de longo prazo de adipócitos maduros em resposta a diferentes estímulos.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos a Xiao-Rong Peng e Stefan Hallen por fornecerrecursos e otimizar o isolamento adipócito, Martin Uhrbom por assistência técnica, e Daniel Olausson e Malin Lönn por coordenar e fornecer o adipose humano.
Materiais
| Name | Company | Catalog Number | Comments |
| Autoclaved scissors | |||
| Autoclaved spoons | |||
| Autoclaved tweezers | |||
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A6003 | |
| Buffer RLT | QIAGEN | 79216 | Lysis buffer |
| CaCl2*2H2O | Sigma-Aldrich | C7902 | |
| Conical tubes, 50 mL | |||
| D-(+)-Glucose | Sigma-Aldrich | G7528 | |
| DMEM/F-12 | Gibco | 31331-028 | |
| Fetal bovine serum (FBS) | Gibco | 10270-106 | |
| Filter flask 0.2 µm pore size, 75 mm | Thermo Scientific | 156-4020 | 500 mL |
| Filter flask 0.2 µm pore size, 75 mm | Thermo Scientific | 158-0020 | 1000 mL |
| HBSS+CaCl2+MgCl2 | Gibco | 14065-49 | |
| HEPES buffer solution (1M) | Gibco | 15630-056 | |
| High-Capacity cDNA Reverse Transcription kit | Applied Biosystems | 4368814 | |
| Insulin (Actrapid Penfill) | Novo Nordisk A/S | ||
| KCl | Merck | 104936 | |
| KH2PO4 | Merck | 104873 | |
| Medium 199 | Gibco | 10012-011 | |
| Mesh filter (250 µM) | Sintab AB | 6111-025043 | |
| MgSO4*7H2O | Sigma-Aldrich | M1880 | |
| NaCl | Sigma-Aldrich | S7653 | |
| Needles, 18 G, 1.20 mm x 40 mm | Sterican | 613-2948 | |
| Pencillin-Streptomycin (Penn/Strep) | Gibco | 15140 | |
| Petri dishes, 150 mm x 21 mm | Thermo Scientific | 168381 | |
| Power SYBR Green PCR master mix | Applied Biosystems | 4367659 | |
| Quantstudio 7 Flex Real-Time PCR machine | Applied Biosystems | ||
| RNeasy Mini kits | QIAGEN | 74106 | |
| Separation funnel | VWR | 527-0008 | For large scale preparation |
| Separation funnel | VWR | 527-0005 | For small scale preparation |
| Shaking incubator (37 °C) | |||
| Syringes, 5 mL | Omnifix | 612-2892 | 100 st |
| Tissue culture incubator (37 °C, 5% CO2) | |||
| Transwells, 24-well (6.5 mm) | Costar | 3397 | Permeable membrane inserts |
| TRIzol reagent | Invitrogen | 10296010 | Lysis buffer |
| Type 2 Collagenase | Worthington | LS004177 |
Referências
- Guilherme, A., Virbasius, J. V., Puri, V., Czech, M. P. Adipocyte dysfunctions linking obesity to insulin resistance and type 2 diabetes. Nature Reviews Molecular Cell Biology. 9 (5), 367-377 (2008).
- Rosen, E. D., Spiegelman, B. M. What we talk about when we talk about fat. Cell. 156 (1-2), 20-44 (2014).
- Lotta, L. A., et al. Integrative genomic analysis implicates limited peripheral adipose storage capacity in the pathogenesis of human insulin resistance. Nature Genetics. 49 (1), 17-26 (2017).
- Gustafson, B., Hedjazifar, S., Gogg, S., Hammarstedt, A., Smith, U. Insulin resistance and impaired adipogenesis. Trends in Endocrinology and Metabolism. 26 (4), 193-200 (2015).
- Gesta, S., et al. Culture of human adipose tissue explants leads to profound alteration of adipocyte gene expression. Hormone and Metabolic Research. 35 (3), 158-163 (2003).
- Fain, J. N., Cheema, P., Madan, A. K., Tichansky, D. S. Dexamethasone and the inflammatory response in explants of human omental adipose tissue. Molecular and Cellular Endocrinology. 315 (1-2), 292-298 (2010).
- Lessard, J., et al. Characterization of dedifferentiating human mature adipocytes from the visceral and subcutaneous fat compartments: fibroblast-activation protein alpha and dipeptidyl peptidase 4 as major components of matrix remodeling. PLoS One. 10 (3), e0122065(2015).
- Asada, S., et al. Ceiling culture-derived proliferative adipocytes retain high adipogenic potential suitable for use as a vehicle for gene transduction therapy. American Journal of Physiology - Cell Physiology. 301 (1), C181-C185 (2011).
- Shen, J. F., Sugawara, A., Yamashita, J., Ogura, H., Sato, S. Dedifferentiated fat cells: an alternative source of adult multipotent cells from the adipose tissues. International Journal of Oral Science. 3 (3), 117-124 (2011).
- Harms, M. J., et al. Mature Human White Adipocytes Cultured under Membranes Maintain Identity, Function, and Can Transdifferentiate into Brown-like Adipocytes. Cell Reports. 27 (1), 213-225 (2019).
- Wang, Q. A., Scherer, P. E., Gupta, R. K. Improved methodologies for the study of adipose biology: insights gained and opportunities ahead. Journal of Lipid Research. 55 (4), 605-624 (2014).
- Gregoire, F. M., Smas, C. M., Sul, H. S. Understanding adipocyte differentiation. Physiological Reviews. 78 (3), 783-809 (1998).
- Ruiz-Ojeda, F. J., Ruperez, A. I., Gomez-Llorente, C., Gil, A., Aguilera, C. M. Cell Models and Their Application for Studying Adipogenic Differentiation in Relation to Obesity: A Review. International Journal of Molecular Sciences. 17 (7), 1040(2016).
- McBeath, R., Pirone, D. M., Nelson, C. M., Bhadriraju, K., Chen, C. S. Cell shape, cytoskeletal tension, and RhoA regulate stem cell lineage commitment. Developmental Cell. 6 (4), 483-495 (2004).
- Lackey, D. E., Olefsky, J. M. Regulation of metabolism by the innate immune system. Nature Reviews Endocrinology. 12 (1), 15-28 (2016).
- Saltiel, A. R., Olefsky, J. M. Inflammatory mechanisms linking obesity and metabolic disease. The Journal of clinical investigation. 127 (1), 1-4 (2017).
- Lee, Y. S., Wollam, J., Olefsky, J. M. An Integrated View of Immunometabolism. Cell. 172 (1-2), 22-40 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados