É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Ensaio repetível de escadaria para acessar o potencial allelopático de Arroz Weedy (Oryza sativa ssp.)
Neste Artigo
Resumo
A allelopathy mostrou-se promissora como uma estratégia útil de controle de ervas suplementais em sistemas de cultivo. Para determinar o potencial aelopático de um espécime de planta desejado, um método de triagem de escadas é fornecido.
Resumo
A concorrência de maconha contribui significativamente para gerar perdas nos sistemas de cultivo em todo o mundo. A evolução da resistência em muitas espécies de ervas daninhas a herbicidas continuamente aplicadas tem apresentado a necessidade de métodos adicionais de manejo. A alopatia é um processo fisiológico que algumas espécies de plantas possuem que proporcionam à planta uma vantagem sobre seus vizinhos. As variedades de culturas allelopáticas seriam equipadas com a capacidade de suprimir o crescimento dos concorrentes circundantes, reduzindo assim a perda potencial de rendimento devido à interferência de maconha. Este artigo foca na construção e operação de um ensaio de escada usado para a triagem do potencial aelopático de uma espécie doadora(Oryza sativa) contra uma espécie de semente receptora(Echinochloa crus-galli) em um ambiente de estufa. A estrutura descrita neste artigo serve como suporte para as amostras da planta e incorpora um sistema de rega cronometrado para o acúmulo e distribuição de aeloquímicos. Os allelochemicals produzidos pelas raízes da planta podem fluir para baixo através de uma série de quatro potes separadamente em um tanque de coleta e reciclados de volta para a planta superior através de bombas elétricas. Este método de triagem fornece uma avenida para os aeloquímicos da planta doador atingirem plantas receptoras sem qualquer concorrência de recursos, permitindo assim a medição quantitativa do potencial alopático da planta de doadores selecionada. O potencial alopático é mensurável através da redução de altura das plantas receptoras. Dados preliminares de triagem para a eficácia desse método demonstraram redução de altura nas espécies receptoras, barnyardgrass(E. crus-galli),e assim a presença de resíduos alopatopáticos da planta doadora, arroz de capina(Oryza sativa).
Introdução
A alopatia é um fenômeno natural e complexo que tem sido o foco de muitos cientistas vegetais nas últimas décadas. Os mecanismos relativos à alopatia para uso em culturas têm sido objeto de muita pesquisa desde a década de 1930, quando Molisch observou que uma planta tem um efeito direto ou indireto em uma planta vizinha através da produção e secreção de compostos químicos no ambiente1. A alopatia é a produção de metabólitos secundários que têm efeitos inibitórios sobre o crescimento e germinação de algumas espécies vegetais. Compostos químicos aopáticos liberados ajudam a fornecer às plantas doadoras uma vantagem competitiva adicionando fitotoxinas ao ambiente ao seu redor2. Muitos fatores contribuem para a atividade allelopática. É seletivo em sua eficácia e varia entre variedades, condições ambientais, estágio de crescimento, estresse, ambiente e disponibilidade de nutrientes3.
Nos últimos anos, a aelopatia tem sido destacada na pesquisa como um possível complemento à constante e crescente crise de controle de ervas ervas. Com a crescente população global, a demanda por alimentos e produção sustentável de alimentos e fibras aumentou4. O controle de weed é uma das maiores ameaças à produção enfrentada pelos agrônomos5,6. Os métodos tradicionais de controle de sementes de sementes se concentram em práticas mecânicas, químicas e culturais. O uso contínuo de herbicidas, embora eficaz, útil e eficiente, promoveu a evolução de populações resistentes de ervas daninhas a um ritmo alarmantemente rápido7. As práticas de engenharia genética e reprodução têm sido usadas efetivamente para dar às culturas vantagens competitivas sobre as maconhas, projetando-as para resistir a aplicações químicas que seus vizinhos não podem sobrevivera 7,8. Embora eficazes, essas tecnologias nem sempre são sustentáveis e às vezes representam preocupações de ultrapassação9. Práticas de gestão suplementar de ervas ervas devem ser introduzidas se o objetivo de aumentar a produção de alimentos for cumpridoem 10. A alopatia mostra excelente promessa como uma nova ferramenta de defesa para as culturas melhorarem sua qualidade e sobreviverem aos seus concorrentes1,7.
Os allelochemicals são frequentemente produtos secundários, e como sua produção é altamente influenciada por fatores ambientais, os compostos específicos associados à supressão vegetal podem ser difíceis de identificar3. Os fatores de produção incluem genética e a ação conjunta de metabólitos secundários que podem agir sinergicamente11,12. É desafiador separar a atividade aloopática da competição que naturalmente existe dentro das interações de colheita- weed, e devido a isso, quando a triagem para a alopatia deve haver um conjunto padrão de resultados que qualificam o ensaio como válido e repetitivo. Abaixo está um conjunto de critérios que qualifica os achados da alopatia, conforme descrito pelo Olofsdotter et al.12 1) Uma planta deve demonstrar supressão de outra planta em um padrão; 2) Os produtos químicos liberados no ambiente em quantidades bioativas devem ser produzidos pela planta doadora; 3) Os produtos químicos produzidos devem ser transportados para a planta receptora; 4) Algum mecanismo de captação deve estar presente na planta receptora; 6) O padrão de inibição observado não deve ter outra explicação exclusiva (por exemplo, concorrência por recursos)12.
Em um esforço para superar a barreira entre o desconhecimento dos mecanismos que apoiam a alopatia e o desenvolvimento de variedades, traços fenotipicos associados a variedades allelopáticas podem ser identificados e selecionados para mais pesquisas e usos. Algumas plantas conhecidas por terem qualidades allelopáticas são centeio, sorgo, arroz, girassol, colza e trigo13. Durante as primeiras observações da alopatia nas culturas, devido às distintas fronteiras do crescimento de maconha em experimentos de campo, foi proposto que os produtos químicos estavam envolvidos em vez de a concorrência por recursos14. No entanto, a maioria dos estudos foram experimentos de campo que impossibilitaram a eliminação da concorrência como fator14. Os esforços de eliminação da concorrência deram lugar a experimentos de laboratório e estufa em tentativas de provar e quantificar a atividade aloopática no arroz e em outras culturas. Métodos de campo e estufa para triagem de plantas para alopatia demonstram que tendências allelopáticas estão presentes em ambas as condições de crescimento11,15. Alguns críticos acreditam que as triagens laboratoriais só podem ter valor limitado devido à falta de condições naturais, o que pode afetar os resultados15.
O método proposto para triagem do potencial alopático nas plantas fornece recursos e espaço adequados e elimina a concorrência de recursos com o uso de uma estrutura de escada11,17. O método foi adaptado e modificado a partir de experimentos anteriores explorando aalopatia em grama e cevada17,18. Esses estudos descobriram que um sistema semelhante foi capaz de produzir resultados precisos sobre o potencial alopático de uma planta-alvo, removendo quaisquer dúvidas de que as observações poderiam ser atribuídas à concorrência natural. O método escada-passo cria um sistema circulatório onde uma solução de nutrientes de um reservatório pode pedalar através de cada planta até uma bandeja de incubação através de alguns passos. Uma bomba elétrica então recicla a solução junto com qualquer allelochemicals produzido18. Um método como este é eficiente tanto no tempo, no espaço quanto nos recursos. Também fornece condições de campo semelhantes para as plantas e elimina qualquer concorrência de recursos. Os métodos e ferramentas utilizados para a triagem são facilmente manipulados para se adequar às metas de estudo desejadas, condições e espécies específicas. O objetivo deste estudo é confirmar a aelopatia do arroz de erva-de-erva através de medidas de supressão de altura na grama do celeiro com o uso do método escada-passo.
Protocolo
1. Stand Construction
NOTA: As medidas para a madeira são listadas como espessura (cm) x largura (cm) x comprimento (m).
- Corte a madeira em tamanhos e quantidades apropriados da seguinte forma: cinco 10,16 cm x 5,08 cm x 0,91 m peças de madeira, três 10,16 cm x 5,08 cm x 0,76 m peças de madeira, três peças de madeira de 10,16 cm x 5,08 cm x 0,61 m, cinco 10,16 cm x 5,08 cm x 0,46 m peças de madeira , três peças de madeira de 10,16 cm x 5,08 cm x 0,3 m, e três peças de madeira de 10,16 cm x 5,08 cm x 0,15 m.
- Para o nível mais alto, fique uma placa de 2,44 m em duas peças de 0,91 m em cada extremidade na borda e fure dois parafusos verticalmente em cada uma das peças de 0,91. Dane-se mais 0,91 m peça a 1,22 m de cada extremidade para suporte, e coloque uma placa de 2,44 m na parte de trás das arquibancadas de 0,91 m e aparafusar no lugar para suporte.
NOTA: Os oito 3.175 cm x 15,24 cm x 2,44 m são mantidos como está e sem cortes para servir como bancada para cada nível de banco. - Repita o passo 1.2 para o próximo nível de banco com as peças de 0,76 m.
- Repita o passo 1.2 para o banco seguinte com as peças de 0,61 m até o sexto banco a 0,15 m.
NOTA: Não é necessário apoiar a diretoria de 2,44 m para os bancos 3-6. A arquibancada final tem seis bancos com três suportes verticais cada, um em cada extremidade e um no meio. - Bancos de linha em ordem de altura descendente com o lábio pendente voltado para o traseiro tocando o banco acima dele, permitindo uma lacuna entre os níveis.
- Forre uma placa de 0,91 cm em cada uma das bordas inferiores dos bancos ao longo do chão e dane os bancos no lugar.
- Dane-se uma placa de 0,46 m horizontalmente para apoio nos três bancos mais altos de cada lado da estrutura a 0,61 m do chão.
- Dane-se três chaves de canto nas pontas dianteiras e no centro do banco mais alto.
- Parafuso um 2,54 cm x 5,08 cm x 20,32 cm de madeira através da cinta 2,54 cm da base do banco.
NOTA: Faça um 0,91 m por 0,91 m por estrutura de 2,44 m. Consulte a Figura 1 para o produto base final. As dimensões estão sujeitas a alterações com as necessidades experimentais. A estrutura descrita foi projetada para caber potes de 15,24 cm. As alturas entre bancos foram projetadas para caber nos vasos e materiais vegetais usados neste experimento, a fim de manter um fluxo constante de allelochemicals e solução de um pote para outro pelos bancos pela gravidade.

Figura 1: Vista frontal do suporte de base de madeira. Uma base de madeira serve como suporte para as amostras da planta. Os materiais para o sistema devem ser montados e adicionados dependendo do número de amostras necessárias para o experimento. Neste estudo, dois estandes serviram como base para 31 amostras. Clique aqui para ver uma versão maior deste valor.
2. Montagem do sistema
- Retire a tampa de uma garrafa de refrigerante 1 L e pinte tinta spray com tinta preta.
NOTA: As garrafas de refrigerante servirão como um reservatório na parte superior do sistema para uma coluna. A tinta fornece um bloco para a luz, diminuindo ou prevenindo o crescimento das algas. - Na parte inferior de cada garrafa de refrigerante, faça um pequeno furo, apenas grande o suficiente para incorporar um diâmetro interno de 0,35 cm (ID), 0,64 cm de diâmetro externo (OD), tubo de PVC plástico de 5,08 cm de comprimento.
- Esfregue uma camada de selante à prova de silicone ao redor da borda do orifício após a inserção para evitar vazamentos. Deixe secar completamente.
- Repita os passos 2.2 e 2.3 em cada um dos pratos de plástico usados para segurar as panelas.
NOTA: Quatro pratos serão necessários para uma coluna. - Retire a tampa e pinte spray na parte externa dos recipientes de plástico 2,27 L com tinta preta. Estes botides servirão como tanques de coleta na base de cada coluna.
- Faça um pequeno buraco na parte superior do traseiro do botide.
NOTA: Os suprimentos listados nas etapas 2.1-2.6 fazem uma coluna. O número de colunas está sujeito ao número de amostras necessárias para o experimento desejado. Duas colunas são necessárias para uma amostra. Todas as dimensões estão sujeitas a alterações dependendo das necessidades experimentais. - Depois que os suprimentos forem preparados e secos, coloque a garrafa de refrigerante no banco mais alto para que o tubo de PVC esteja pendurado sobre a borda de frente para as escadas.
- Logo abaixo da garrafa de refrigerante no banco seguinte, coloque um prato de plástico com seu tubo pendurado sobre a borda do banco.
- Repita a etapa 2.8 para os próximos dois bancos.
- Coloque o botide no banco inferior com o buraco de frente para trás.
- Conecte o botide com o prato acima dele, amarrando o tubo do prato através do orifício na parte de trás do botide.
- Esfregue selante à prova d'água ao redor da borda do botijão onde o tubo passa para evitar vazamentos.
- Coloque uma bomba elétrica submersível de 21 W 1.000 L/hr dentro do botiveinferior.
- Conecte um tubo DE PVC De 1,07 m de comprimento, 1,27 cm, tubo DE PVC OD de 1,59 cm ao bocal da bomba elétrica.
- String o tubo através da distância entre os bancos e sobre a parte de trás da garrafa de refrigerante na parte superior do sistema.
- Conecte a bomba em um temporizador digital e ajuste a configuração do temporizador conforme necessário.
NOTA: O temporizador foi definido para correr por 1 min a cada 3 h durante todo o experimento. O tempo selecionado permitiu que a quantidade máxima de líquido no tanque de coleta fosse pedalada e permitida por aproximadamente 10 min de vazão cada vez que a bomba fosse ligada, evitando inundações e derramamentos.
3. Plantio
- Esterilizar todas as sementes de arroz necessárias enxaguando 70% de etanol para 30 s, absorvendo 5% de alvejante por 20 min, e enxaguando 6x com água destilada.
- Pregermine as sementes de arroz esterilizada em pratos petri forrados com papel filtro preenchido com 5 mL de água destilada em uma câmara de crescimento fixada a 25 °C.
- Depois que as sementes germinam, forre o fundo de cada panela com dois grandes filtros de café colocando-os dentro das panelas em sua forma natural de cupped.
- Encha cada pote até o topo do filtro (aproximadamente 75% da panela) com areia de quartzo autocelava, lavada e exibida especialmente classificada. Amortece a areia com água destilada derramando água sobre o topo da areia ou colocando panelas em bandejas de plantio preenchidas ligeiramente com água destilada para permitir que os vasos absorvam a água e permaneçam úmidos. Transplante seis mudas de plantas de doadores pré-germâm na areia, uniformemente espaçadas.
- Cubra as mudas com areia.
- Deixe as mudas se estabelecerem por 3 semanas.
NOTA: A areia seca muito rapidamente. Portanto, colocar panelas em bandejas é uma técnica eficiente de rega. Trocar água constantemente ajudará a prevenir o. - Pregerminar as mudas de planta receptora (E. crus-galli) em pratos petri 3 semanas após o plantio de plantas doadoras forrando o fundo do prato com papel filtro e junto com 5 mL de água destilada. Coloque os pratos em uma câmara de crescimento a 25 °C por 3 a 5 dias.
- Prepare os potes conforme descrito nas etapas 3.1-3.2.
- Após as mudas germinam, transplante três mudas nos vasos preparados e cubra com areia.
NOTA: O experimento começa um dia após o tratamento (DAT), ou no dia em que as mudas da planta receptora emergem e são transplantadas e colocadas no sistema.
4. Colocação de amostras
- Coloque quatro potes de uma adesão de plantas doadoras nos quatro pratos da coluna 1, um único pote por fileira. A Coluna 1 consiste apenas em plantas doadoras.
- Coloque dois potes da mesma adesão de plantas doadoras nos pratos da coluna 2 na primeira e terceira fila da coluna.
- Coloque dois potes de plantas receptoras nos pratos da coluna 2 na segunda e quarta fila da coluna.
- Para cada replicação, certifique-se de que apenas uma linha de plantas receptoras seja adicionada. Duas colunas, a primeira composta apenas por plantas doadoras e a segunda alternada de doadores e receptores, fazem um tratamento (Figura 2).
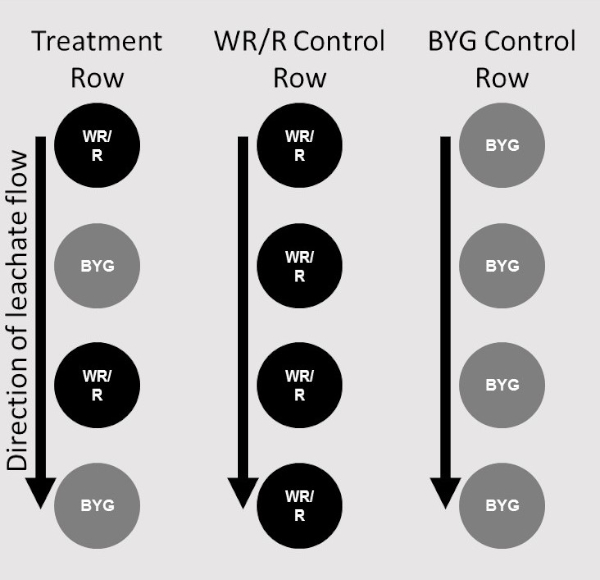
Figura 2: Mapa de colocação. Diagrama retratando colocações de plantas de doadores (WR/R) e receptores (BYG) em respectivas posições no sistema de etapas de escada. Duas colunas do sistema de escada com plantas no local compreendem um tratamento. Uma única coluna de plantas receptoras serviu como um controle para uma replicação (extrema direita), uma única coluna de plantas doadoras como controle para cada adesão (centro), e a coluna de tratamento consistia em plantas alternadas de doadores e receptores (extrema esquerda). Clique aqui para ver uma versão maior deste valor.
- Repita as etapas 4.1-4.4 para cada tratamento ou adesão à planta doadora (Figura 3).
NOTA: Cada replicação requer uma coluna de amostras de plantas receptoras para servir como um controle para uma replicação. Os tratamentos foram replicados 3x em um projeto de bloco completo randomizado.

Figura 3: Estrutura final de etapas de escada. O sistema de escada-passo montado com as plantas no lugar. O sistema continha quatro linhas de amostras de plantas e um tanque de coleta na parte inferior para a solução pedalar até a garrafa superior e para baixo pela gravidade através de cada panela respectiva. Clique aqui para ver uma versão maior deste valor.
5. Operação
- No DAT 1, encha o tanque de coleta na parte inferior de cada coluna com solução hoagland de meia-força17 em água destilada, aproximadamente 1.500 mL.
- Defina os cronéis para correr como desejado na configuração automática.
- Cubra os tanques de coleta com plástico preto para limitar a exposição e evaporação da luz.
- Encha os tanques a cada 2 dias com 500 mL da solução de Hoagland para manter o sistema fluindo constantemente.
- Mantenha as temperaturas do efeito estufa a 28 °C durante o dia e 24 °C à noite, respectivamente, com uma divisão de 16/8 h e umidade em 53%.
6. Coleta de Dados
- Meça e registre as alturas de cada planta no sistema de escada-passo no DAT 1 e uma vez por semana até o DAT 21 colocando uma régua na base de cada planta e observando o suporte de folhas mais alta.
- Meça e registre os níveis de clorofila de cada planta no DAT 7 e 14 usando o medidor de conteúdo da clorofila.
- No último dia do experimento (ou seja, DAT 21) rotular um saco de papel para cada pote.
- Corte amostras de plantas na base e coloque em sacos separados.
- Coloque todas as amostras em um secador de forno fixado a 60 °C por 48 h16.
- Remova amostras secas e conteúdos vazios individualmente em uma escala e grave o peso em gramas.
7. Análise de Dados
- Calcule o potencial allelopático das plantas doadoras com base na inibição percentual da planta receptora usando esta equação:
redução de altura (%) = [altura de controle (cm) – altura do tratado (cm)] × 100 - Calcule a redução de altura da planta do doador como verificação para qualquer efeito reverso que a planta receptora possa ter nas plantas-alvo.
- Analisar as adesões como efeito fixo enquanto replicações e corridas são os efeitos aleatórios18.
- Analise os dados usando um modelo linear geral com valores médios separados usando a diferença protegida de Fisher em ou abaixo de um nível de probabilidade de 0,05 em um software estatístico (por exemplo, JMP 14).
- Visualize a correlação entre as variáveis originais utilizando a análise dos componentes principais através do upload de dados.
- Selecione a guia Analisar na barra de ferramentas, selecione Ajuste Y por X. Em colunas, destaque a resposta (ou seja, redução de altura por cento) clique em Y, resposta para especificar o fator que está sendo observado para Y, (ou seja, redução de altura por cento). Para o fator X, aadesão hightlight e clique em X, fator,em seguida, selecione OK.
- Selecione a seta vermelha para baixo na barra De análise oneway, selecione Meios/ANOVA. Selecione novamente a seta para baixo na barra De análise oneway e destaque comparar significa, em seguida, selecionar cada par, T do aluno.
Resultados
Duas triagens preliminares utilizando este método foram realizadas em nove adesões de arroz de ervas (B2, S33, B83, S97, S94, B81, B8, B34, B14) e cinco linhas de arroz cultivadas (PI338046, Rex, Rondo, PI3127777, CL163). As adesões de arroz de weedy e as linhas de arroz foram selecionadas com base em seu desempenho em exibições aelopáticas anteriores conduzidas por Shrestha (2018)18. As sementes de arroz de maconha foram coletadas de todo o estado do Arkansas. As linhas de arroz selecionada...
Discussão
Explorar a alopatia pode potencialmente servir como um controle biológico para as massas que são difíceis de gerenciar1,7,13. A alelopatia tem mostrado grande potencial como possível solução para a crise da ervas no arroz e serve como alternativa ou suplemento a produtos químicos e práticas manuais de controle de ervas ervas amítadas5,13,
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
O financiamento para este projeto foi fornecido pelo Prêmio especial de Iniciativa de Pesquisa patrocinado pela Estação de Experimentos Agrícolas e Florestais do Mississipi e é baseado em trabalhos que são apoiados pelo Instituto Nacional de Alimentos e Agricultura, Departamento de Agricultura dos EUA Agricultura, Projeto Hatch aadesão número 230060.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.25 in by 6 in by 8 ft standard severe weather wood board | Lowe's, Mooresville, NC | 489248 | N/A |
| 2 in by 4 in by 8 ft white wood stud | Lowe's, Mooresville, NC | 6005 | Cut into appropriate sizes |
| 63 mm (2.5 in) corner braces | Lowe's, Mooresville, NC | 809449 | N/A |
| Asporto 16 oz Round Black Plastic To Go Box - with Clear Lid, Microwavable – 6.25 in by 6.25 in by 1.75 in - 100 count box | Restaurantware.com, Chicago, IL | RWP0191B | black |
| ATP vinyl-flex PVC food grade plastic tubing, clear, 0.125 in id by 0.25 in od, 100 ft | Amazon, Seattle WA | B00E6BCV0G | N/A |
| Ccm-300 chlorophyll content meter | Opti-Sciences, Inc. Hudson, NH | ccm/300 | N/A |
| Common 1 in by 2 in by 8 ft pine board | Lowe's, Mooresville, NC | 1408 | N/A |
| Contractors choice contractor 24-pack 42-gallon black outdoor plastic construction trash bag | Lowe's, Mooresville, NC | 224272 | Cut to cover collection tanks |
| EURO POTS | Greenhouse Megastore, Danville, IL | CN-EU | 15 cm short black 6 in diameter 4.25 in height 1.37 qt volume |
| Fisher brand petri dish with clear lid | Fisher Scientific, Waltham, MA | FB0857513 | N/A |
| Aexit Ac 220 V-240 V electrical equipment US plug 21 W 1,000 L/hr multipurpose submersible pump | Amazon, Seattle WA | B07MBMYQNT | Nozzle size should fit tubes and can be repaced |
| Woods 50015 WD outdoor 7 day heavy-duty digital outlet timer | Walmart, Bentonville, AR | 565179767 | 20 settings |
| GE silicone 2+ 10.1 oz almond silicone caulk | Lowe's, Mooresville, NC | 48394 | Sealant for edges of any attached tubing |
| Great Value Distilled Water | Walmart, Bentonville, AR | 565209428 | N/A |
| Great Value White Basket coffee filters 200 count | Walmart, Bentonville, AR | 562723371 | Size may vary |
| Grip-rite primgaurd plus #9-3 in pollimerdex screws | Lowe's, Mooresville, NC | 323974 | N/A |
| Hoagland’s No. 2 basal salt mixture | Caisson Laboratories, INC. Smithfield, UT | HOP01/50LT | ½ strength rate |
| JMP (14) | SAS Institute Inc. North Carolina State University, NC | N/A | |
| Project source flat black spray paint | Lowe's, Mooresville, NC | 282254 | N/A |
| Project source utility 1.88 in by 165 ft gray duct tape | Lowe's, Mooresville, NC | 488070 | N/A |
| Rubbermaid 2 qt square food storage canister clear | Walmart, Bentonville, AR | 555115144 | Collection tank discard lid |
| Sealproof unreinforced PVC clear vinyl tubing, food-grade .5 in id by .625 in od, 100 ft | Amazon, Seattle WA | B07D9CLGV3 | Connects to pump |
| Short Mountain Silica 50 lb Play sand | Lowe's, Mooresville, NC | 10392 | Sand should be purified |
| Steve Spangler's 1 L Soda Bottles - 6 Pack - For Science Experiment Use | Amazon, Seattle WA | UPC 192407667341 | Top step tank discard lid |
Referências
- Weston, L. A. History and Current Trends in the Use of Allelopathy for Weed Management. HortTechnology. 15 (3), 529-534 (2005).
- Pratley, J. E. Allelopathy in annual grasses. Plant Protection Quarterly. 11, 213-214 (1996).
- Bertin, C., Yang, X., Weston, L. A. The role of root exudates and allelochemicals in the rhizosphere. Plant and Soil. 256 (1), 67-83 (2003).
- Stevenson, G. R. Pesticide Use and World Food Production: Risks and Benefits. Environmental Fate and Effects of Pesticides. American Chemical Society. , 261-270 (2003).
- Chopra, N., Tewari, G., Tewari, L. M., Upreti, B., Pandey, N. Allelopathic Effect of Echinochloa colona L. and Cyperus iria L. Weed Extracts on the Seed Germination and Seedling Growth of Rice and Soybean. Advances in Agriculture. 2017, 1-5 (2017).
- Jabran, K., Mahajan, G., Sardana, V., Chauhan, B. S. Allelopathy for weed control in agricultural systems. Crop Protection. 72, 57-65 (2015).
- Worthington, M., Reberg-Horton, C. Breeding Cereal Crops for Enhanced Weed Suppression: Optimizing Allelopathy and Competitive Ability. Journal of Chemical Ecology. 39, 213-231 (2013).
- Sudianto, E., et al. Corrigendum to "Clearfield (R) rice: Its development, success, and key challenges on a global perspective.". Crop Protection. 55, 142-144 (2014).
- Gressel, J., Valverde, B. E. A strategy to provide long-term control of weedy rice while mitigating herbicide resistance transgene flow, and its potential use for other crops with related weeds. Pest Management Science. 65, 723-731 (2009).
- Muthayya, S., Sugimoto, J. D., Montgomery, S., Maberly, G. F. An overview of global rice production, supply, trade, and consumption. Annals of the New York Academy of Sciences. 1324, 7-14 (2014).
- Chung, I. M., Kim, K. H., Ahn, J. K., Lee, S. B., Kim, S. H. Allelopathy Comparison of Allelopathic Potential of Rice Leaves, Straw, and Hull Extracts on Barnyardgrass. Agronomy Journal. 95 (4), 1063-1070 (2003).
- Olofsdotter, M., Jensen, L. B., Courtois, B. Improving crop competitive ability using allelopathy Ð an example from rice. Journal of Plant Breeding. 121, 1-9 (2002).
- Olofsdotter, M., Navarez, D., Rebulanan, M., Streibig, J. C. Weed-suppressing rice cultivars-does allelopathy play a role. Weed Research. 39 (6), 441-454 (1999).
- Jensen, L. B., et al. Locating Genes Controlling Allelopathic Effects against Barnyardgrass in Upland Rice. Agronomy Journal. 93 (1), 21-26 (2001).
- Kuijken, R. C., Eeuwijk, F. A. V., Marcelis, L. F., Bouwmeester, H. J. Root phenotyping: from component trait in the lab to breeding. Journal of Experimental Botany. 66 (18), 5389 (2015).
- Lickfeldt, D. W., Voigt, T. B., Branham, B. E., Fermanian, T. W. Evaluation of allelopathy in cool season turfgrass species. International Turfgrass Society. 9, 1013-1018 (2001).
- Liu, D. L., Lovett, J. V. Biologically active secondary metabolites of barley: Developing techniques and assessing allelopathy in barley. Journal of Chemical Ecology. 19, 2217-2230 (1993).
- Shrestha, S. . Evaluation of Herbicide Tolerance and Interference Potential among Weedy rice germplasm. , (2018).
- Kim, K. U., Shin, D. H., Olofsdotter, Rice allelopathy research in Korea. Allelopathy in Rice. IRRI. , (1998).
- Quasem, J. R., Hill, T. A. On difficulties with allelopathy. Weed Research. 29, 345-347 (1989).
- Singh, S., et al. Evaluation of mulching, intercropping with Sesbania and herbicide use for weed management in dry-seeded rice (Oryza sativa L.). Crop Protection. 26, 518-524 (2007).
- Kong, C. H., Li, H. B., Hu, F., Xu, X. H., Wang, P. Allelochemicals released by rice roots and residues in soil. Plant and Soil. 288 (1-2), 47-56 (2006).
- Ervin, G. N., Wetzel, R. G. Allelochemical autotoxicity in the emergent wetland macrophyte Juncus effusus (Juncaceae). American Journal of Botany. 87 (6), 853-860 (2000).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados