É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Avaliação da oxidação celular usando uma proteína fluorescente verde específica do compartimento subcelular
Neste Artigo
Resumo
Este protocolo descreve a avaliação do status de redox específico do compartimento subcelular dentro da célula. Uma sonda fluorescente sensível ao redox permite uma análise racionmétrica conveniente em células intactas.
Resumo
A medição do equilíbrio de oxidação/redução intracelular fornece uma visão geral do estado fisiológico e/ou fisiofisiológico de um organismo. Os tiais são especialmente importantes para iluminar o status de redox das células através de suas relações reduzidas de dithiol e dissulfeto oxidado. Proteínas fluorescentes que contêm cisteína projetadas abrem uma nova era para biosensores sensíveis ao redox. Uma delas, a proteína fluorescente verde sensível ao redox (roGFP), pode ser facilmente introduzida em células com transdução adenoviral, permitindo que o status de redox dos compartimentos subcelulares seja avaliado sem interromper os processos celulares. Cisteínas reduzidas e cistinos oxidados de roGFP têm máxima de excitação em 488 nm e 405 nm, respectivamente, com emissão de 525 nm. Avaliar as proporções dessas formas reduzidas e oxidadas permite o cálculo conveniente do equilíbrio de redox dentro da célula. Neste artigo de método, foram utilizadas células cancerígenas de mama humanas triplas-negativas (MDA-MB-231) para avaliar o estado de redox dentro da célula viva. As etapas do protocolo incluem transdução de linha celular MDA-MB-231 com adenovírus para expressar roGFP citosomico, tratamento com H2O2, e avaliação da razão cisteína e cistina com citometria de fluxo e microscopia de fluorescência.
Introdução
O estresse oxidativo foi definido em 1985 por Helmut Sies como "uma perturbação no equilíbrio prooxidante-antioxidante em favor do primeiro"1, e uma infinidade de pesquisas foi conduzida para obter o estado de redox específico da doença, nutrição e envelhecimento dos organismos1,,2,,3. Desde então, a compreensão do estresse oxidativo tornou-se mais ampla. Testar as hipóteses do uso de antioxidantes contra doenças e/ou envelhecimento mostrou que o estresse oxidativo não só causa danos, mas também tem outros papéis nas células. Além disso, os cientistas mostraram que os radicais livres desempenham um papel importante para a transdução de sinais2. Todos esses estudos reforçam a importância de determinar as mudanças na razão de redução-oxidação (redox) das macromoléculas. A atividade enzimápica, antioxidantes e/ou oxidantes e produtos de oxidação podem ser avaliados com vários métodos. Entre estes, os métodos que determinam a oxidação do tiol são indiscutivelmente os mais utilizados porque relatam o equilíbrio entre antioxidantes e prooxidantes nas células, bem como organismos4. Especificamente, as relações entre glutationa (GSH)/glutatione dissulfeto (GSSG) e/ou cisteína (CyS)/cystine (CySS) são usadas como biomarcadores para monitorar o estado redox dos organismos2.
Os métodos utilizados para avaliar o equilíbrio entre prooxidantes e antioxidantes dependem principalmente dos níveis de proteínas reduzidas/oxidadas ou pequenas moléculas dentro das células. Manchas ocidentais e espectrometria de massa são usadas para avaliar amplamente as proporções de macromoléculas reduzidas/oxidadas (proteínas, lipídios etc.), e as razões GSH/GSSG podem ser avaliadas com espectrofotometria5. Uma característica comum desses métodos é a perturbação física do sistema por lise celular e/ou homogeneização tecidual. Essas análises também se tornam desafiadoras quando é necessário medir o estado de oxidação de diferentes compartimentos celulares. Todas essas perturbações causam artefatos no ambiente de ensaio.
Proteínas fluorescentes sensíveis ao redox abriram uma era vantajosa para avaliar o equilíbrio redox sem causar perturbação nas células6. Eles podem atingir diferentes compartimentos intracelulares, permitindo a quantificação de atividades específicas do compartimento (por exemplo, o que diz respeito ao estado redox das mitocôndrias e do citosol) para investigar o crosstalk entre organelas celulares. Proteína fluorescente amarela (YFP), proteína fluorescente verde (GFP) e proteínas HyPeR são revisadas por Meyer e colegas6. Entre essas proteínas, o GFP sensível ao redox (roGFP) é único devido a diferentes leituras fluorescentes de seus resíduos CyS (ex. 488 nm/em. 525 nm) e CySS (ex. 405 nm/525 nm), que permitem análise ratiométrica, ao contrário de outras proteínas sensíveis à redox, como YFP7,8. A saída racionada é valiosa porque contrabalança as diferenças entre os níveis de expressão, sensibilidades de detecção e fotobleaching8. Compartimentos subcelulares de células (citoso, mitocôndrias, núcleo) ou organismos diferentes (bactérias, bem como células mamíferas) podem ser alvo modificando roGFP7,,9,10.
Os ensaios roGFP são conduzidos utilizando técnicas de imagem fluorescente, especialmente para experimentos de visualização em tempo real. Análises citométricas de fluxo de roGFPs também são possíveis para experimentos com pontos de tempo predeterminados. O artigo atual descreve tanto o uso de microscopia fluorescente quanto a citometria de fluxo para realizar uma avaliação ratiométrica do estado de redox em células de mamíferos superexpressando roGFP (direcionado para citosol) via transdução adenoviral.
Access restricted. Please log in or start a trial to view this content.
Protocolo
NOTA: Este protocolo foi otimizado para células MDA-MB-231 confluentes de 70%-80%. Para outras linhas celulares, o número de células e a multiplicidade de infecção (MOI) devem ser reotimizados.
1. Preparação de células (dia 1)
- Mantenha a linha celular MDA-MB-231 em frascos de 75 cm2 com 10 mL do meio Eagle modificado (DMEM) modificado de Dulbecco suplementado com 10% de soro bovino fetal (FBS) a 37 °C em uma atmosfera umidificada de 5% CO2.
NOTA: DMEM suplementado com 10% de FBS, 37 °C e atmosfera umidificada de 5% de CO2 são utilizados para todas as incubações de apego e tratamento em todo o protocolo. - Prepare as células MDA-MB-231 para experimento.
- Aspire o meio dentro do frasco, desprende as células com solução de 0,25% trypsin-EDTA de 0,25% por 2 min, e inativa a atividade de trippsina com 6 mL de meio completo (DMEM com 10% de FBS). Centrifugar as células a 150 x g por 5 min. Aspire o supernasce e suspenda as células em 5 mL de meio completo.
- Misture uma suspensão celular de volume igual e 0,4% azul trypan. Pegue 10 μL desta mistura e conte as células com o contador automático de células.
NOTA: Um contador Coulter ou um hemócito também podem ser usados para contagem de células. - Semeou as células em uma placa de 6 poços para análises de citometria de fluxo e sementes de 150.000 células em 1 mL de médio por poço. Aguarde 16 h para fixação celular.
- Semear as células em um slide de câmara de 4 poços para imagens fluorescentes e sementes de 25.000 células em 0,5 mL de médio por poço. Aguarde 16 h para fixação celular.
NOTA: Poços de controle de sementes, além de poços de tratamento. Use um dos poços de controle para determinar o número da célula (opcional: se o período de fixação das células for menor do que o tempo de duplicação, o número da célula pode ser considerado o mesmo que a densidade de semeadura) e o outro para um controle não infectado (0 MOI).
2. Transdução roGFP adenoviral (dias 2 e 3)
ATENÇÃO: Os adenovírus podem causar doenças. Ao transdunar as células, use pontas filtradas e dicas descontaminadas, pipetas Pasteur e tubos de microcentrifus de microcentrifus com 10% de alvejante.
NOTA: Este protocolo foi demonstrado com roGFP específico para citosol, mas outros compartimentos celulares (por exemplo, mitocôndrias ou espaço intermembrano mitocondrial) podem ser direcionados com este mesmo protocolo.
- Gere uma curva de dose-resposta para o MOI obter a maior eficiência de transdução calculando o volume de adenovírus (mL) necessário para cada valor MOI para a linha celular MDA-MB-231(Tabela 1):
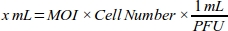
NOTA: O título funcional de cada lote de estoque adenoviral, expresso como unidade de formação de placas (PFU) por mL, é fornecido pela empresa. O MOI ideal para transdução difere entre os tipos de células. Para a maioria das células mamíferas, a faixa ideal de MOI é entre 10 e 300. De acordo com a resposta celular, os valores de MOI devem ser recalculados (por exemplo, a gama de MOI deve ser reduzida se as células tiverem resposta citotóxica, ou o alcance deve ser aumentado se as células tiverem baixa eficiência de transdução). - Faça 1:100 diluição de 6 x 1010 solução roGFP adenoviral PFU/mL com meio de cultura celular (DMEM com 10% FBS) para tubulação confiável.
- Pipeta e adicionar 0,0125 mL (12,5 μL), 0,025 mL (25 μL), 0,05 mL (50 μL) de diluição roGFP adenoviral em cada poço da placa de 6 poços, a fim de transduzir as 150.000 células com 50, 100, e 200 MOI, respectivamente, para análise de citometria de fluxo(Tabela 1).
- Pipeta e adicionar 0,0042 mL (4,2 μL) de diluição roGFP adenoviral nos poços de slides de 4 câmaras para transduzir 25.000 células com 100 MOI para imagem de fluorescência(Tabela 1).
NOTA: Uma quantidade mínima de meio deve ser usada nos poços para garantir a maior interação entre o construto roGFP adenoviral e as células. O teor de soro do meio de cultura pode precisar ser diminuído para diferentes linhas celulares, pois altos níveis de soro podem afetar negativamente a eficiência da transdução em alguns tipos de células. - Incubar células por 16-24 h sob as condições de manutenção celular. No dia seguinte (dia 3), altere o meio de cultura média para celular (DMEM com 10% de FBS) para permitir a recuperação celular por mais 24 h. Visualizar células sob um microscópio para avaliar sua morfologia; as células podem expressar roGFP mesmo que tenham alterações morfológicas.
NOTA: No dia 3, as células devem começar a expressar roGFP; portanto, a eficiência transdutor pode ser monitorada por meio de microscopia de fluorescência (filtros com ex. 488/em. 525). Para obter resultados consistentes de ensaios, esteja ciente e documente as alterações morfológicas sob o microscópio de contraste de fase e observe a morfologia enquanto avalia a eficiência da transdução. - Construa uma curva de resposta de dose utilizando as amostras de 50, 100 e 200 MOI preparadas na etapa 2.3 e seus resultados de eficiência de transdução obtidos a partir da análise da citometria de fluxo (etapas 3.1 e 4.1). Avalie a eficiência de transdução ideal com documentação de alterações morfológicas (etapa 2.5) e a curva dose-resposta do MOI.
NOTA: Embora mais de 98% da população celular em 100 MOI e 200 MOI express roGFP (ver resultados representativos), 200 grupos DE MOI apresentaram mudanças substanciais na morfologia celular das células MDA-MB-231. Consequentemente, o MOI mais eficaz para células MDA-MB-231 foi determinado como sendo 100 MOI. - Depois que o MOI ideal (aqui, 100 MOI) foi escolhido para a linha celular MDA-MB-231, realizar experimentos com materiais de teste (10 μM H2O2 e seu veículo 0,1% água deionizada).
- Preparem e semeiem as células de acordo com a seção 1. Utilizando o volume de transdução adenoviral para 100 MOI calculado na etapa 2.1, repita as etapas 2.2-2.4 para 100 transdução adenoviral moi das células. Em seguida, incubar a placa e os slides da câmara de acordo com a etapa 2.5.
3. Aquisição do saldo CyS/CySS
- Citometria de fluxo (dia 4)
- No dia 4, incubam células da etapa 2.7.1 com 10 μM H2O2 para 1 h.
NOTA: 10 μM H2O2 foi utilizado como substância de ensaio e 0,1% de água deionizada foi utilizada como tratamento veicular neste protocolo. Outros agentes oxidantes podem ser usados como controles positivos aqui. - Aspirar a mídia da placa de 6 poços, substituir por 750 μL de solução trypsin-EDTA de 0,25% e esperar por 2 minutos para as células se desprenderem. Inativar trippsina com 2 mL de meio completo (DMEM com 10% de FBS) e coletar o volume em tubos cônicos de 15 mL.
- Centrifugar os tubos a 150 x g por 5 min a 4ºC. Descarte o supernasciente e suspenda as células em 500 μL de soro fisiológico tamponado por fosfato (PBS).
- Repetir o passo 3.1.3
- Filtre as suspensões celulares em tubos compatíveis com citometria de fluxo usando malha de 40 μm. Mantenha os tubos no gelo e longe da luz e siga o passo 4.1 para análise de dados.
- No dia 4, incubam células da etapa 2.7.1 com 10 μM H2O2 para 1 h.
- Imagem microscópica (dia 4)
- No dia 4, trate as células com 10 μM H2O2,adquira imagens imediatamente (ponto de tempo 0) e 1h após o tratamento e siga a etapa 4.2 para análise de dados.
4. Análise de dados
- Quantificação da citometria de fluxo
- Definir o método de citometria de fluxo para 3 análises diferentes através de software de aquisição de amostras (ver Tabela de Materiais): dispersão para a frente (FCS) no eixo x e dispersão lateral (SSC) no eixo y para avaliar o tamanho e a complexidade das células (SSC pode ser usado para identificação aproximada de células mortas e vivas); ex. 488 nm/em. 525 nm (fluoresceína isothiocyanato [FITC]) filtro de bandpass no eixo x e SSC no eixo y para avaliar CyS-roGFP; ex. 405 nm/em. 525 nm (Brilhante Violet 510 [BV510]) filtro de bandpass no eixo x e SSC no eixo y para avaliar CySS-roGFP.
- Adquira 0 controle MOI e visualize células com software de aquisição de amostras. Repita esta etapa para amostras remanescentes (50, 100, 200 grupos DE MOI e posteriormente em 10 μM H2O2 células tratadas e células tratadas do veículo). Salve os arquivos para análise de dados.
- Abra o software de análise de dados (ver Tabela de Materiais) e abra 0 arquivo de amostra MOI. Avaliar população celular de interesse (Portão 1). Configure as seguintes gatings para minimizar a fluorescência de fundo para ex. 488 nm/em. 525 nm (Portão 2) e ex. 405 nm/em. Filtros de bandpass de 525 nm (Portão 3) com as células de controle não infectadas (0 MOI).
- Abra 50, 100 e 200 arquivos de amostras de MOI dentro do software de análise de dados para avaliar a curva dose-resposta. Analise as intensidades médias de fluorescência com os portões 2 e 3 para cada amostra. Repita esta etapa para amostras de teste (10 μM H2O2 células tratadas e células tratadas do veículo).
- Calcule a relação média de intensidade fluorescente entre formas oxidadas versus reduzidas de roGFP com a seguinte equação.

- Avaliação de imagem
- Use um microscópio que contenha filtros de fluorescência para filtros CyS-roGFP e CySS-roGFP (ex. 488 nm/em. 525 nm e ex. 405 nm/em. 525 nm filtros, respectivamente).
- Em cada poço do escorregador da câmara, escolha 4 áreas aleatórias para adquirir imagens, utilizando o objetivo 4x de visualizar áreas maiores.
NOTA: O objetivo de 20x também pode ser usado para exibições de imagens. - Abra a imagem com o software ImageJ11. Aplicar análise | Meça comandos para cada imagem e use a equação na etapa 4.1.5 para quantificar os dados.
NOTA: A quantificação das imagens é ratiométrica; portanto, o protocolo não inclui subtração de fundo. No entanto, para poder comparar imagens, brilho, contraste e saturação deve ser o mesmo para cada imagem. A significância estatística foi avaliada com análise unidirecional de variância (ANOVA) e teste pós-hoc de Tukey.
Access restricted. Please log in or start a trial to view this content.
Resultados
O estado redox de CyS/CySS é facilmente avaliado com roGFPs transduzidas. A sonda fluorescente quantifica a razão entre as formas reduzidas e oxidadas (comprimentos de onda de excitação 488 nm e 405 nm, respectivamente). Os dados de fluorescência podem ser obtidos tanto por citometria de fluxo quanto por microscopia.
Um grande número de células pode ser adquirida de forma consistente e conveniente usando citometria de fluxo. A análise consiste em 3 etapas principais: 1) selecionar a po...
Access restricted. Please log in or start a trial to view this content.
Discussão
O equilíbrio tiol/dissulfeto em um organismo reflete o estado redox das células. Organismos vivos têm glutationa, cisteína, tialis proteicos e tiols de baixo peso molecular, todos afetados pelo nível de oxidação e ecoam o estado redox das células4. RoGFPs projetados permitem a quantificação sem interrupções do equilíbrio thiol/dissulfeto através de seus resíduos CyS7. A propriedade racionmétrica do roGFP fornece medições de redox confiáveis para células ...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
O adenovírus construto e recombinante para a expressão de roGFP específico para citosol em células foram gerados no laboratório de Paul T. Schumacker, PhD, Freiberg School of Medicine, Northwestern University e ViraQuest Inc., respectivamente. Este estudo foi apoiado pelo Centro de Estudos de Resposta ao Câncer P20GM109005 através do INSTITUTO Nacional de Ciências Médicas Gerais do NIH Centros de Excelência em Pesquisa Biomédica (COBRE NIGMS), Instituto Nacional de Clínicas Médicas Gerais Programa de Pharnacologia e Treinamento toxicológico conceder T32 GM106999, UAMS Foundation/Medical Research Endowment Award AWD00053956, UAMS Year-End Chancellor's Awards AWD00053484. A instalação do núcleo de citometria de fluxo foi apoiada em parte pelo Centro de Patogênese Microbiana e Respostas Inflamatórias hospedeiras que concedem P20GM103625 através do COBRE NIGMS. O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente as opiniões oficiais do NIH. A ATA foi apoiada pela bolsa de estudos 2214-A do Conselho de Pesquisa Científica e Tecnológica da Turquia (TUBITAK).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco by Life Sciences | 25200-056 | Cell culture |
| 4-well chamber slide | Thermo Scientific | 154526 | Cell seeding material for fluorescent imaging |
| 5 ml tubes with cell strainer cap | Falcon | 352235 | Single cell suspension tube for flow cytometry analysis |
| 6-well plate | Corning | 353046 | Cell seeding material for flow cytometry analysis |
| 15 ml conical tubes | MidSci | C15B | Cell culture |
| 75 cm2 ventilated cap tissue culture flasks | Corning | 4306414 | Cell culture |
| Adenoviral cytosol specific roGFP | ViraQuest | VQAd roGFP | roGFP construct kindly provided by Dr. Schumaker |
| Class II, Type A2 Safety Hood Cabinet | Thermo Scientific | 1300 Series A2 | Cell culture |
| Countess automated cell counter | Invitrogen | C10227 | Cell counting |
| Countess cell counter chamber slides | Invitrogen | C10283 | Cell counting |
| DMEM | Gibco by Life Sciences | 11995-065 | Cell culture |
| FBS | Atlanta Biologicals | S11150 | Cell culture |
| Filtered pipette tips, sterile, 20 µl | Fisherbrand | 02-717-161 | Cell culture |
| Filtered pipette tips, sterile, 1000 µl | Fisherbrand | 02-717-166 | Cell culture |
| Flow Cytometer | BD Biosciences | LSRFortessa | Instrument equipped with FITC and BV510 bandpass filters for flow cytometry analyses |
| Fluorescent Microscope | Advanced Microscopy Group (AMG) | Evos FL | Fluorescent imaging |
| Hydrogen Peroxide 30% | Fisher Scientific | H325-100 | Positive control |
| Light Cube, Custom | Life Sciences | CUB0037 | Fluorescent imaging of roGFP expressing cells (ex 405 nm) |
| Light Cube, GFP | Thermo Scientific | AMEP4651 | Fluorescent imaging of roGFP expressing cells (ex 488 nm) |
| MDA-MB-231 | American Tissue Culture Collection | HTB-26 | Human epithelial breast cancer cell line |
| Microcentrifuge tubes, 2 ml | Grenier Bio-One | 623201 | Cell culture |
| PBS | Gibco by Life Sciences | 10010-023 | Cell culture |
| Pipet controller | Drummond | Hood Mate Model 360 | Cell culture |
| Serologycal pipet, 1 ml | Fisherbrand | 13-678-11B | Cell culture |
| Serologycal pipet, 5 ml | Fisherbrand | 13-678-11D | Cell culture |
| Serologycal pipet, 10 ml | Fisherbrand | 13-678-11E | Cell culture |
| Tissue Culture Incubator | Thermo Scientific | HERACell 150i | CO2 incubator for cell culture |
| Trypan blue stain 0.4% | Invitrogen | T10282 | Cell counting |
Referências
- Sies, H. Oxidative stress: A concept in redox biology and medicine. Redox Biology. 4, 180-183 (2015).
- Jones, D. P. Redefining Oxidative Stress. Antioxidants & Redox Signalling. 8 (9-10), (2006).
- Pizzino, G., et al. Oxidative Stress: Harms and Benefits for Human Health. Oxidative Medicine and Cellular Longevity. 20117, 8416763(2017).
- Go, Y. M., Jones, D. P. Thiol/disulfide redox states in signaling and sensing. Critical Reviews in Biochemistry and Molecular Biology. 48 (2), 173-191 (2013).
- Hansen, J. M., Go, Y., Jones, D. P. Nuclear and Mitochondrial Compartmentation of Oxidative Stress and Redox Signaling. Annual Review of Pharmacology and Toxicology. 46 (1), 215-234 (2006).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants and Redox Signaling. 13 (5), 621-650 (2010).
- Dooley, C. T., et al. Imaging dynamic redox changes in mammalian cells with green fluorescent protein indicators. Journal of Biological Chemistry. 279 (21), 22284-22293 (2004).
- Björnberg, O., Østergaard, H., Winther, J. R. Measuring intracellular redox conditions using GFP-based sensors. Antioxidants and Redox Signaling. 8 (3-4), 354-361 (2006).
- Bhaskar, A., et al. Reengineering Redox Sensitive GFP to Measure Mycothiol Redox Potential of Mycobacterium tuberculosis during Infection. PLoS Pathogens. 10 (1), 1003902(2014).
- Loor, G., et al. Mitochondrial oxidant stress triggers cell death in simulated ischemia-reperfusion. Biochimica et Biophysica Acta - Molecular Cell Research. 1813 (7), 1382-1394 (2011).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Loor, G., et al. Menadione triggers cell death through ROS-dependent mechanisms involving PARP activation without requiring apoptosis. Free Radical Biology and Medicine. 49 (12), 1925-1936 (2010).
- Esposito, S., et al. Redox-sensitive GFP to monitor oxidative stress in neurodegenerative diseases. Reviews in the Neurosciences. 28 (2), 133-144 (2017).
- Meyer, A. J., et al. Redox-sensitive GFP in Arabidopsis thaliana is a quantitative biosensor for the redox potential of the cellular glutathione redox buffer. Plant Journal. 52 (5), 973-986 (2007).
- Galvan, D. L., et al. Real-time in vivo mitochondrial redox assessment confirms enhanced mitochondrial reactive oxygen species in diabetic nephropathy. Kidney International. 92 (5), 1282-1287 (2017).
- Swain, L., Nanadikar, M. S., Borowik, S., Zieseniss, A., Katschinski, D. M. Transgenic organisms meet redox bioimaging: One step closer to physiology. Antioxidants and Redox Signaling. 29 (6), 603-612 (2018).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51 (11), 1943-1951 (2011).
- Dey, S., Sidor, A., O'Rourke, B. Compartment-specific control of reactive oxygen species scavenging by antioxidant pathway enzymes. Journal of Biological Chemistry. 291 (21), 11185-11197 (2016).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados