Method Article
Um Modelo de Epipetogênese em Culturas de Fatia Organotipica Do Cortex-Hipocampo Rhinal
Neste Artigo
Resumo
Aqui, descrevemos a preparação de fatias organotipicas do córtex-hipocampo rhinal. Sob uma privação gradual e controlada de soro, essas fatias retratam eventos epilépticos em evolução e podem ser consideradas um modelo ex vivo de episetogênese. Este sistema representa uma excelente ferramenta para monitorar a dinâmica da atividade espontânea, bem como para avaliar a progressão das características neuroinflamatórias ao longo do curso da epipesogênese.
Resumo
Culturas de fatias organotípicas têm sido amplamente utilizadas para modelar distúrbios cerebrais e são consideradas excelentes plataformas para avaliar o potencial neuroprotetor e terapêutico de uma droga. As fatias organotipadas são preparadas a partir de tecido explantado e representam um complexo ambiente ex vivo multicelular. Eles preservam a citoarquitetura tridimensional e o ambiente local das células cerebrais, mantêm a conectividade neuronal e a interação recíproca neurônio-glia. As fatias organotípicas hipocampal são consideradas adequadas para explorar os mecanismos básicos da episetogênese, mas pesquisas clínicas e modelos animais de epilepsia sugerem que o córtex rhinal, composto de cortices perirhinal e entorhinal, desempenham um papel relevante na geração de convulsões.
Aqui, descrevemos a preparação de fatias organotipicas do córtex-hipocampo rhinal. Registros de atividade espontânea da área ca3 sob perfusão com meio de crescimento completo, em temperatura fisiológica e na ausência de manipulações farmacológicas, mostraram que essas fatias retratam eventos epilépticos em evolução ao longo do tempo na cultura. O aumento da morte celular, através do ensaio de absorção de ióides propides, e gliose, avaliado com imunohistoquímica acoplada à fluorescência, também foram observados. A abordagem experimental apresentada destaca o valor das culturas de fatia organotipípicas do córtex rhinal como plataforma para estudar a dinâmica e progressão da epipesogênese e para testar potenciais alvos terapêuticos para essa patologia cerebral.
Introdução
A epilepsia, um dos distúrbios neurológicos mais prevalentes em todo o mundo, é caracterizada pela ocorrência periódica e imprevisível de atividade neuronal sincronizada e excessiva no cérebro. Apesar dos vários medicamentos antiepilépticos (AEDs) disponíveis, um terço dos pacientes com epilepsia são refratários à terapia1 e continuam a experimentar convulsões e declínio cognitivo. Além disso, os AEDs disponíveis dificultam a cognição devido às suas ações relativamente generalizadas sobre a atividade neuronal. A epieptogênese é difícil de estudar em humanos, devido às múltiplas e heterogêneas lesões epilégênicas, longos períodos latentes que duram meses a décadas, e os efeitos enganosos do tratamento anticonvulsivo após a primeira convulsão espontânea.
A identificação de potenciais agentes terapêuticos para o tratamento da epilepsia tornou-se possível devido a modelos animais de epilepsia: 1) modelos genéticos, que utilizam animais geneticamente predispostos nos quais as convulsões ocorrem espontaneamente ou em resposta a um estímulo sensorial; 2) modelos de convulsões induzidas por estimulação elétrica; e 3) modelos farmacológicos de indução convulsiva que utilizam pilocarpina (agonista receptor muscarinic), kainate (agonista receptor kainate) ou 4-aminopirridina (bloqueador de canal de potássio), entre outros. Esses modelos foram cruciais na compreensão das mudanças comportamentais, bem como mecanismos moleculares e celulares subjacentes à epilepsia, e levaram à descoberta de muitos AEDs2.
Os preparativos ex vivo também são uma ferramenta poderosa para explorar os mecanismos subjacentes à episetogênese e à ictogênese. As fatias hipocampais agudas, que permitem estudos eletrofisiológicos de células vivas durante um período de 6-12 h, e fatias hipocampais organotípicas que podem ser preservadas em uma incubadora durante um período de dias ou semanas têm sido amplamente utilizadas em estudos de atividade epidepiliforme3.
As fatias cerebrais organotípicas são preparadas a partir de tecido explantado e representam um modelo fisiológico tridimensional do cérebro. Essas fatias preservam a citoarquitetura da região de interesse e incluem todas as células cerebrais e sua comunicação intercelular4. A região mais utilizada para culturas organotípicas de longo prazo é o hipocampo, já que esta região é afetada pela perda neuronal em múltiplas condições neurodegenerativas. Eles têm sido amplamente utilizados para modelar distúrbios cerebrais e são considerados excelentes ferramentas para avaliar o potencial neuroprotetor e terapêutico de uma droga5,6. Modelos de epieptogênese, derrame e toxicidade induzida por Aβ foram descritos em fatias organotipicas hipocampal7,8,9,10. A doença de Parkinson foi explorada em mesenceciano ventral e estriatum, bem como córtex-corpus calosum-estriatum-substantia nigra, fatias organotipicas11. Culturas de fatias cerebelares organotípicas imitam muitos aspectos da mielinação de axônio e funções cerebelares e são um modelo generalizado para investigar novas estratégias terapêuticas na esclerose múltipla12.
No entanto, pesquisas clínicas e modelos animais de epilepsia sugerem que o córtex rhinal, composto por cortices perirhinal e entorhinal, desempenha um papel na geraçãoconvulsão 13. Assim, foi estabelecido um modelo de epipetogênese em fatias organotipicas do córtex-hipocampo rhinal14. Sob uma privação gradual e controlada de soro, as fatias organotipópicas do córtex-hipocampo rhinal retratam eventos epilépticos em evolução, ao contrário de fatias análogas sempre mantidas em um meio contendo soro.
Na epilepsia, como em muitas doenças agudas e crônicas do sistema nervoso central, a visão neurocêntrica não consegue elucidar os mecanismos subjacentes ao início e à progressão da doença. Evidências clínicas e experimentais apontam para a inflamação cerebral, na qual microglia e astrócitos desempenham um papel relevante, como um dos principais atores que contribuem para o processo epiléptico. Experimentos farmacológicos em modelos animais de epilepsia sugerem que efeitos antiepileptogênicos podem ser alcançados mirando vias pró-inflamatórias, e hoje em dia a neuroinflamação é considerada como uma nova opção para o desenvolvimento de abordagens terapêuticas para epilepsia15.
Aqui, descrevemos minuciosamente a preparação de culturas de fatia organotipípicas do córtex rhinal- hipocampo, bem como os detalhes para o registro de atividade epilepiforme espontânea a partir delas. Destaca-se que este sistema imita vários aspectos neuroinflamatórios da epilepsia, sendo assim adequado explorar o papel das células gliais e da neuroinflamação nesta patologia. Além disso, representa uma plataforma fácil de usar para a triagem de potenciais abordagens terapêuticas para epilepsia.
Protocolo
As diretrizes da legislação portuguesa e da União Europeia (2010/63/UE) foram respeitadas em todos os procedimentos relativos à proteção dos animais para fins científicos. Todos os métodos descritos aqui foram aprovados pelo Órgão Institucional de Bem-Estar Animal (ORBEA-iMM) do IMM e pela Autoridade Nacional competente (DGAV – Direção Geral de Alimentação e Veterinária).
1. Preparação de fatias de córtex-hipocampo rhinal
NOTA: A preparação de fatias de córtex-hipocampo rhinal usa ratos P6-7 Sprague-Dawley.
- Configuração cultural e preparação média
- Na véspera da cultura, prepare os meios de comunicação necessários e coloque-os a 4 °C.
- Prepare o meio de dissecção: 25 mM de glicose na Solução de Sal Balanceado da Gey (GBSS).
- Preparar meio de cultura: 50% Opti-MEM, 25% HBSS, 25% Soro de Cavalo (HS), 25 mM de glicose, 30 μg/mL Gentamicina.
- Preparar o meio de manutenção: Neurobasal-A (NBA), 2% B27, 1 mM L-glutamina, 30 μg/mL Gentamicina, HS (15%, 10%, 5% e 0%).
- Colheita cerebral
- Pouco antes de iniciar a cultura, adicione 1,1 mL de cultura média a cada poço da placa de 6 poços com uma pipeta P1000 e coloque-a a 37 °C.
- Coloque todos os equipamentos (microscópio de dissecção, helicóptero de tecido, lâmpada dissecando, ferramentas de dissecação, eletrodos, placas, inserções e papéis de filtro) dentro do armário de segurança biológica e esterilize sob luz UV por 15 minutos.
- Ajuste a espessura da fatia para 350 μm.
- Retire o GBSS da geladeira. Adicione 5 mL de GBSS a seis pratos de Petri. Serão exigidas seis pratos de Petri por animal.
- Eutanize o filhote de rato. Faça a decapitação usando uma tesoura afiada na base do tronco cerebral do animal.
- Lave a cabeça do animal três vezes em GBSS frio e leve-a para dentro do armário de segurança.
- Isolamento tecidual e preparação de fatias
- Insira firmemente fórceps afiados nas órbitas oculares para segurar a cabeça.
- Usando uma tesoura fina corte a pele/couro cabeludo ao longo da linha média começando do foien vertebral em direção aos lobos frontais e colocá-lo de lado.
- Corte da mesma forma o crânio e ao longo da fissura transversal cerebral (espaço entre cérebro e cerebelo). Com fórceps longos curvados, afaste-o.
- Descarte as lâmpadas olfativas com uma espátula. Remova o cérebro da cabeça e coloque-o em GBSS gelado com a superfície dorsal enfrentada(Figura 1A).
- Insira as fórceps finas no cerebelo e siga a linha média com a espátula abrindo cada hemisfério com muito cuidado(Figura 1B).
- Com fórceps curvas curtas, remova cuidadosamente o excesso de tecido que cobre o hipocampi, sem tocar na estrutura hipocampal. Em seguida, com uma espátula, corte abaixo de cada hipocampo (Figura 1C).
- Pegue um hemisfério e coloque-o, com hipocampo virado para cima, em um papel filtro. Repita o procedimento com o outro hemisfério e coloque-o paralelamente ao primeiro, no papel filtro. Coloque o papel filtro no helicóptero de tecido, com os hemisférios perpendiculares à lâmina, e corte os hemisférios em fatias de 350 μm(Figura 1D).
- Coloque o tecido fatiado em uma placa de Petri com GBSS frio(Figura 1E).
- Separe cuidadosamente as fatias usando os eletrodos de ponta redonda(Figura 1F). Mantenha apenas as fatias com um córtex rhinal estruturalmente intacto e hipocampo. As áreas de DG e CA devem ser perfeitamente definidas, assim como o córtex entorhinal e perirhinal(Figura 1G).
- Coloque cada fatia na pastilha(Figura 1H-I),com uma espátula e um eletrodo de ponta redonda. Remova o meio de dissecção em excesso em cada fatia com uma pipeta P20(Figura 1J). Quatro fatias de córtex-hipocampo rhinal podem ser cultivadas em uma única inserção(Figura 1K).
- Manutenção da cultura
- Mude o meio dia não.
- Aqueça o meio a 37 °C.
- Pegue as placas da incubadora. Pegue cada inserção segurando a borda plástica com fórceps(Figura 1L).
- Use uma mão livre para aspirar o meio do poço. Coloque a inserção de volta no poço e adicione 1 mL, com uma pipeta P1000, de meio fresco aquecido(Figura 1M). Repita para todas as pastilhas. Certifique-se de que nenhuma bolha de ar está presa entre a membrana e o meio.
NOTA: As fatias epilépticas sofrem uma privação gradual e controlada do soro no meio. A partir de 9 Dias In Vitro (DIV) em diante, as fatias são mantidas na NBA sem HS14.
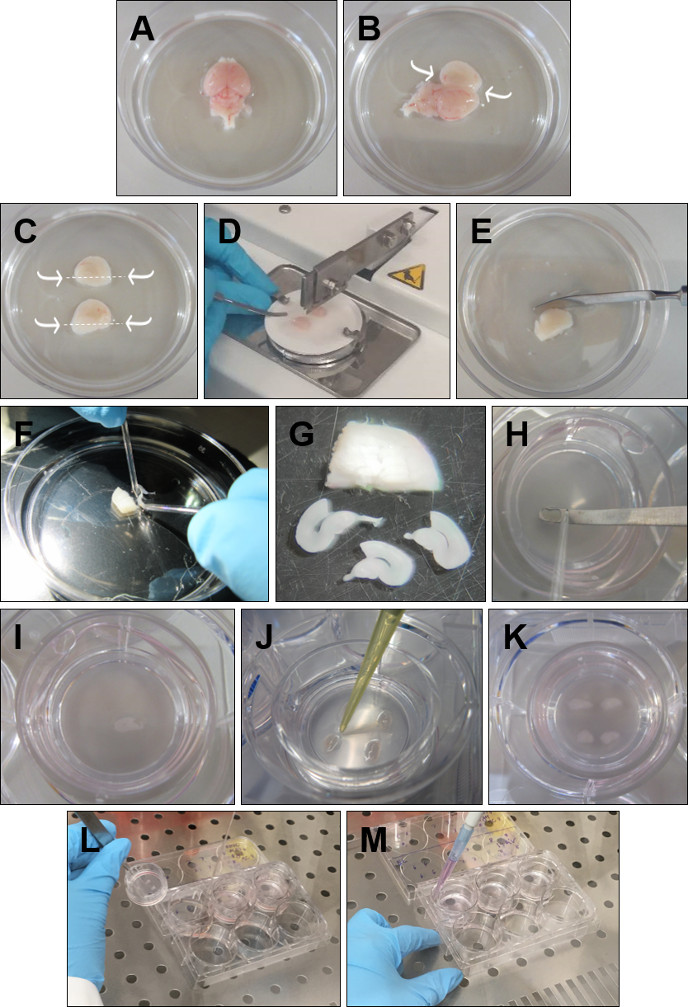
Figura 1: Procedimento detalhado para a preparação de fatias organotipópicas do córtex-hipocampo rhinal. (A) Remova o cérebro da cabeça e coloque-o em GBSS gelado com a superfície dorsal enfrentada. (B) Insira as fórceps no cerebelo. Abra o cérebro através da linha média e remova o excesso de tecido sobre o hipocampo. (C) Com uma espátula cortada abaixo do hipocampo, conforme indicado pelas setas. (D) Coloque os dois hipocampi voltados para cima e paralelos entre si no papel do filtro e corte fatias de 350 μm no helicóptero de tecido. (E) Coloque o hipocampo fatiado em GBSS gelado. (F) Separe as fatias com a ajuda de eletrodos de vidro com ponta redonda. (G) Escolha apenas as fatias que retratam um córtex rhinal intacto e hipocampo. (H, eu) Com a ajuda de um eletrodo de vidro redondo, empurre cada fatia para a espátula e coloque-a na pastilha. (J) Remova o GBSS ao redor da fatia. (K) Coloque quatro fatias por inserção. (L) Para trocar o meio, levante a pastilha e aspire o meio com uma pipeta de vidro. (M) Adicione o meio fresco colocando a pipeta entre a pastilha e as paredes da placa de 6 poços. Certifique-se de que não há bolhas de ar sob as fatias. Clique aqui para ver uma versão maior desta figura.
2. Gravações eletrofisiológicas
NOTA: As gravações eletrofisiológicas foram realizadas em fatias organotipópicas do córtex rhinal-hipocampo aos 7, 14 e 21 DIV em uma câmara tipo interface. As gravações foram obtidas com um amplificador, digitalizado e analisado com software. Todas as gravações foram filtradas por band-pass (filtro Bessel de oito polos a 60 Hz e filtro gaussiano a 600 Hz).
- Preparação de configuração
- Prepare 50 mL de média nba com 1 mL de B27 e 250 μL de L-Glutamina. Aqueça a 37 °C.
- Coloque a configuração de eletrofisiologia em circuito próximo. Verifique se a vazão é de 2 mL/min.
- Abra a caixa de carro (válvula de 5% DE CO2/95% O2) e verifique o nível de água no sistema.
- Coloque o papel do filtro na câmara de gravação da interface para drenar o excesso médio e o papel de limpeza da lente sob o quadro para fornecer meio à fatia.
- Ligue o controlador de temperatura, os amplificadores e o micromanipulador.
- Deixe a temperatura na câmara de interface estabilizar a 37 °C antes de iniciar as gravações.
- Prepare o fluido cerebrospinal artificial (aCSF: 124 mM NaCl, 3mM KCl, 1,2 mM NaH2PO4, 25 mM NaHCO3, 10 mM de glicose, 2 mM CaCl2, 1 mM MgSO4 com pH 7.4) e use-o para encher o eletrodo de vidro com um seringe. Coloque-o no eletrodo receptor.
- Gravações de atividade espontânea
- Uma vez que a temperatura esteja estável, retire a placa da incubadora e corte uma fatia da pastilha com uma lâmina altamente afiada. Coloque-o em uma placa de 60 mm com uma gota de meio. Leve-o para a câmara de gravação de interface.
- Coloque a fatia na câmara de interface com o hipocampo para a direita inferior. Coloque o eletrodo receptor na camada de célula piramimácida CA3.
- Prossiga para o protocolo de aquisição contínua e regisário por 30 min.
3. Ensaio de absorção de PI
NOTA: A morte celular foi avaliada pelo monitoramento da captação celular do iodeto de ílio de corante fluorescente (PI). Pi é um composto polar, que entra em células com membranas celulares danificadas e interage com o DNA emitindo fluorescência vermelha (absorvância de 493 nm, emissão de 630 nm). Como o PI não é permeante para células vivas, é usado para detectar células mortas em uma população.
- Incubação pi
- Prepare, em meio de cultura, uma diluição fresca de 1:10 do estoque de PI.
- Para o ensaio de absorção de PI, retire a placa da incubadora e levante cuidadosamente a pastilha. Adicione 13 μL de PI ao meio, com uma pipeta P20, obtendo uma concentração final de 2 μM. Agitar lentamente a placa antes de colocar a inserção de volta no lugar. Certifique-se de que não há bolhas sob as fatias.
- Coloque as fatias de volta na incubadora de 37 °C por 2h.
- Prossiga com o protocolo de imunohistoquímica, conforme descrito na próxima seção. Cubra as placas com alumínio, já que a PI é sensível à luz.
4. Imunohistoquímica
NOTA: Na imunohistoquímica um anticorpo específico do neurônio, bem como anticorpos capazes de discriminar fenótipos de repouso e reativas de microglia e astrócitos, foram utilizados para avaliar a extensão da morte neuronal e gliose em fatias organotipos epilépticos do córtex rhinal.
- Fixação tecidual
- Retire a placa da incubadora e aspire o meio. Fixar as fatias com 4% de paraformaldeído (PFA) por 1h no RT, adicionando 1 mL de PFA abaixo e acima das fatias, com uma pipeta P1000.
- Remova o PFA e adicione 1 mL de PBS. Adicione também PBS por baixo e acima das fatias.
- Mantenha as fatias a 4 °C, em PBS, até que use mais. Coloque sempre o parafilm ao redor das placas para evitar a secagem.
- Passos de imunossuar
- Lave duas vezes, 10 min cada vez, com 1 mL de PBS.
- Prepare a solução de permeabilização/bloqueio contendo 1% Triton-X100, 10% HS e 10% BSA na PBS. Prepare a solução BSA de 5%.
- Desenhe dois retângulos com a caneta hidrofóbica(Figura 2A). Corte as fatias da pastilha(Figura 2B)com uma lâmina altamente afiada. Coloque duas fatias por slide (Figura 2C) e adicione 140 μL de solução de permeabilização/bloqueio na parte superior de cada fatia, usando uma pipeta P200. Incubar por 3 h na RT.
- Diluir os anticorpos primários à diluição de trabalho em 5% de BSA na PBS. Incubar com os anticorpos primários durante a noite a 4 °C.
- Incubar com os anticorpos secundários por 4h na RT. A partir deste passo, proteja a placa da luz, uma vez que os fluoroforos estão sendo trabalhados.
- Coloque uma gota de 50 μL da solução Hoechst na parte superior de cada fatia e incubar por 20 minutos na RT.
- Lave entre incubações. Lave sempre três vezes, por 10 minutos cada vez, com PBS-T.
- Remova Hoechst e lave conforme recomendado.
- Adicione 50 μL de meio de montagem na parte superior de cada fatia. Cubra com uma tampa de vidro e rodee com esmalte(Figura 2D).
- Deixe secar na RT por 24 h.
- Visualize a imunostaining sob um microscópio confocal. Mantenha as fatias manchadas a -20 °C.

Figura 2: Procedimento específico para o ensaio imunohistoquímico. (A) Com a caneta hidrofóbica desenhe dois quadrados no escorregador. (B) Corte a peça de inserção que contém a fatia. (C) Coloque cada fatia nos quadrados desenhados com a caneta hidrofóbica e inicie a etapa de permeabilização/bloqueio. (D) Após concluir o protocolo, finalize montando as fatias em meio de montagem, cobrindo com um deslizamento de vidro e cercando-o com esmalte. Clique aqui para ver uma versão maior desta figura.
Resultados
Com base em descrições anteriores da análise de sinais epilépticos em fatias hipocampais organotipadas, as descargas epilépticas intericital são aqui definidas como descargas paroxísticas claramente distinguidas da atividade de fundo, com uma mudança abrupta na polaridade e ocorrendo em baixa frequência (<2 Hz). Descargas paroxísmicas com duração superior a 10 s e ocorrendo em maior frequência (≥2 Hz) são caracterizadas como atividade epiltotal ictal. Se um evento ictal ocorrer dentro de 10 s após o anterior, esses dois eventos são considerados como apenas um evento ictal.
As fatias organotípicas do córtex rhinal-hipocampo a 7 DIV(Figura 3A) retratam atividade interictal e ictal mista. Aos 14 DIV(Figura 3B),a atividade espontânea é caracterizada por descargas ictal, que evoluem para uma atividade ictal avassaladora em 21 DIV, com eventos ictal com duração de >1 min (Figura 3C).

Figura 3: Atividade epileptiforme espontânea de fatias organotipópicas do córtex-hipocampo rhinal. Eventos representativos de apreensão eletrográfica, registrados a partir da área ca3 em uma câmara tipo interface, após (A) 7 DIV, (B) 14 DIV e (C) 21 DIV. Detalhes da apreensão são mostrados em traços mais baixos. Clique aqui para ver uma versão maior desta figura.
Ensaio de absorção de PI seguido de imunohistoquímica contra o marcador neuronal NeuN visando identificar a morte neuronal. A absorção de PI por neurônios granulares e piramihários foi observada em 7 fatias de DIV (setas na Figura 4A), mas o número de neurônios PI+ aumentou em 14 DIV (setas na Figura 4B),corroborando um aumento da morte neuronal com progressão de epileptogênese.
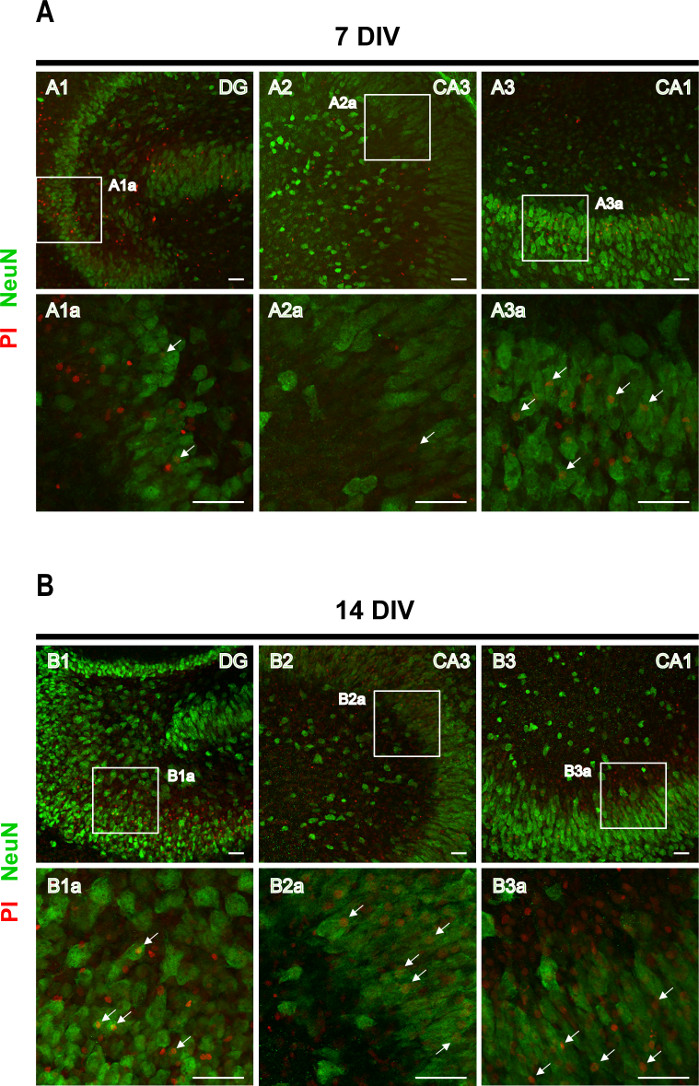
Figura 4: Imagens representativas de fatias organotipópicas do córtex-hipocampo rhinal manchadas de NeuN e PI. Imagens de NeuN manchadas de neurônios maduros e células PI-positivas foram adquiridas em (A) 7 DIV e (B) 14 DIV, em um microscópio a laser confocal com um objetivo de 20x. Imagens ampliadas das áreas tracejadas são mostradas. Flechas apontam para neurônios da morte (em laranja). Barra de escala, 50 μm. Clique aqui para ver uma versão maior desta figura.
Foi utilizada uma coloração dupla de Iba1, juntamente com CD68, para avaliação do fenótipo de microglia. Iba1 é um marcador de microglia/macrófagos, enquanto CD68 é uma proteína lisesômica expressa em altos níveis por microglia reativa e em baixos níveis por microglia de repouso. Em 7 fatias DIV, microglia ramificada com baixa expressão CD68 (setas na Figura 5A) são mais abundantes que Iba1+/CD68+ microglia reativa (pontas de flecha na Figura 5A),enquanto em 14 DIV, em todas as áreas do hipocampo, Iba1+/CD68+ microglia espessa/amoeboida M1 (pontas de flecha na Figura 5B) excedem a microglia com baixa expressão CD68 (setas na Figura 5B). A 14 DIV algumas células Iba1+/CD68+ com aparência de hiper-ramificação podem ser identificadas (pontas de flecha abertas na Figura 5B), o que pode sugerir a ocorrência do fenótipo anti-inflamatório M2 da microglia. No entanto, este assunto requer um estudo mais aprofundado.
Estudos recentes demonstraram que diferentes lesões de CNS podem provocar pelo menos dois tipos de astrócitos reativos, A1 e A2, sendo astrócitos A1 neurotóxicos16. O subtipo A1 de astrócitos é caracterizado por uma expressão aumentada do Complement C316,17,18. O ComplementO C3, que desempenha um papel central na ativação do sistema de complemento, gera C3b, que é ainda mais degradado para iC3b, C3dg e C3d19. Assim, foi utilizada uma coloração dupla de GFAP e C3d para avaliar a astrogliose. Em 7 DIV a expressão de C3d é mal detectável (Figura 6A), enquanto em 14 fatias DIV gfap hipertrófica+/C3d+ astrócitos podem ser observados (pontas de flecha na Figura 6B), sugerindo uma ativação progressiva de astrócitos A1.
Os resultados demonstram uma ativação progressiva de microglia e astrócitos ao longo do curso da episetogênese, imitando os eventos descritos em pacientes com epilepsia e em modelos animais dessa patologia.

Figura 5: Imagens representativas de fatias organotipicas do córtex-hipocampo manchado de Iba1 e CD68 manchadas. Imagens de Iba1 e CD68 minguantes manchadas, e núcleos manchados de Hoechst, foram adquiridas em (A) 7 DIV e (B) 14 DIV, em um microscópio laser confocal com um objetivo de 20x. Imagens ampliadas das áreas tracejadas são mostradas. Setas apontam para Iba1+/CD68- microglia de repouso, pontas de flecha indicam Iba1+/CD68+ microglia espessa/amoebóide e setas abertas revelam Iba1+/CD68+ microglia hiper-ramificada. Barra de escala, 50 μm. Clique aqui para ver uma versão maior desta figura.
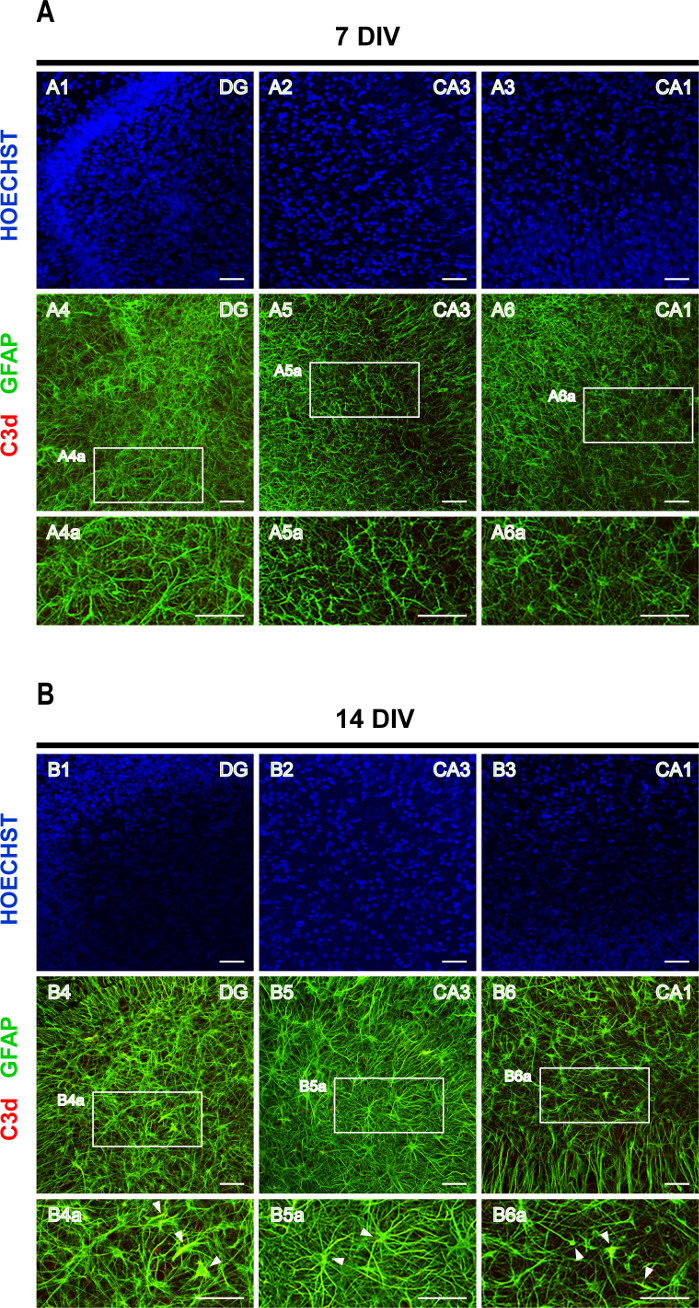
Figura 6: Imagens representativas de GFAP e C3d manchadas de corte córtex-hipocampo fatias organotipicas. Imagens de astrócitos manchados de GFAP e C3d, e núcleos manchados de Hoechst, foram adquiridas em (A) 7 DIV e (B) 14 DIV, em um microscópio laser confocal com um objetivo de 20x. Imagens ampliadas das áreas tracejadas são mostradas. Pontas de flecha apontam para GFAP+/C3d+ astrócitos A1 reativos (em amarelo). Barra de escala, 50 μm. Clique aqui para ver uma versão maior desta figura.
Discussão
Modelos animais de epilepsia têm sido cruciais para a descoberta de muitos AEDs, no entanto eles requerem muitos animais e a maioria deles são demorados devido ao período latente para o início da convulsão. A indução de baixo magnésio da atividade epilépti em fatias agudas hipocampais também foi completamente revisada na literatura3, mas as fatias agudas têm uma viabilidade de 6-12 h tornando impossível avaliar mudanças a longo prazo. As fatias organotípicas podem ser mantidas na cultura de dias a semanas, permitindo superar o curto tempo de viabilidade das fatias agudas, e foram propostos modelos de epipetogênese em fatias hipocampais organotípicas3,7,8.
Aqui descrevemos a preparação de fatias organotipas, compreendendo o córtex rinal e o hipocampo. Essas fatias levam de 15 a 20 minutos para preparar por animal, desde o sacrifício animal até a colocação de fatias nas pastilhas, e 6-8 fatias por hemisfério podem ser obtidas. Deve-se tomar cuidado extra ao abrir o hemisfério para expor o hipocampo e ao remover o tecido do papel filtro após o corte. O excesso de tecido acima do hipocampo também pode comprometer a integridade da fatia durante o corte.
As fatias organotípicas do córtex-hipocampo rhinal retratam uma atividade epiléptica em evolução semelhante à epilepsia in vivo. Depois de uma semana na cultura, a maioria das fatias retrata atividades intericital e ictal mistas, que progride para eventos apenas semelhantes a ictal com tempo na cultura. Até agora, registramos poucas descargas intericital em fatias com 2-3 semanas. Neste sistema, a atividade epiléptica parece desenvolver-se mais rápido do que em fatias hipocampais organotípicas. Isso pode ser atribuído à presença do córtex rinal, que preserva a maior parte da entrada funcional para o hipocampo. Para abordar totalmente essa questão, uma caracterização completa dos sinais epilépticos exibidos por essas fatias ao longo do tempo na cultura, como número e duração dos eventos ictal, juntamente com sua amplitude e frequência, está sendo realizada atualmente.
Esse sistema pode ser mantido na cultura por mais de três semanas, e imita muitas correlações moleculares da epilepsia, como morte neuronal, ativação de microglia e astrócitos e aumento da produção de citocinas pró-inflamatórias14,permitindo uma caracterização a longo prazo desses aspectos. Também representa uma plataforma de triagem fácil de usar, onde intervenções farmacológicas direcionadas a vias celulares específicas podem ser implementadas e potenciais alvos terapêuticos podem ser testados. Sem dúvida, o sistema aqui apresentado pode ajudar a iluminar ainda mais os mecanismos da epipetogênese.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores gostariam de reconhecer a Unidade de Bioimagem do Instituto de Medicina Molecular João Lobo Antunes, por todas as sugestões relativas à aquisição de imagens.
Este projeto recebeu financiamento do programa de pesquisa e inovação Horizon 2020 da União Europeia sob o acordo de subvenção Nº 952455, Fundação para a Ciênciae Tecnologia (FCT) por meio do Projeto PTDC/MEDFAR/30933/2017, e Faculdade de Medicina da Universidade de Lisboa.
Materiais
| Name | Company | Catalog Number | Comments |
| 50 mL Centrifuge Tube, Conical Bottom | Corning | 430829 | |
| 70% Ethanol | Manuel Vieira, Lda | UN1170 | |
| Amplifier | Axon Instruments | Axoclamp 900A | |
| Amplifier | Axon Instruments | Digidata 1440A | |
| Anti-C3d (goat) | R&D Systems | AF2655 | Dilute at a ratio 1:1000 |
| Anti-CD68 (mouse) | Abcam | ab31630-125ug | Dilute at a ratio 1:250 |
| Anti-GFAP (mouse) | Millipore SAS | MAB360 | Dilute at a ratio 1:500 |
| Anti-Iba1 (rabbit) | Abcam | ab108539 | Dilute at a ratio 1:600 |
| Anti-NeuN (rabbit) | Werfen | 16712943S | Dilute at a ratio 1:500 |
| Artificial cerebrospinal fluid (aCSF) | Homemade | ||
| B-27™ Supplement (50X), serum free | Thermo Fisher Scientific | 17504-044 | |
| Blades for scalpel handle | Fine Science Tools | 10011-00 | |
| Bovine Serum Albumin (BSA) | NZYTech | MB04602 | 5% BSA is used to dilute the primary antibodies. Add 0.5g BSA in 10 mL PBS. |
| Brain/Tissue Slice Chamber System | Warner Instruments | ||
| Calcium chloride dihydrate | Merck Millipore | 1.02382.0500 | |
| Cell culture inserts, 30 mm, hydrophilic PTFE | Millipore SAS | PICM03050 | |
| Cold light source | SCHOTT | KL 300 LED | |
| Confocal laser microscope | Zeiss | LSM 710 | |
| Conventional incubator | Thermo Scientific Heraeus | BB15, Function Line | Set to 37 °C and 5% CO2 |
| D(+)-Glucose monohydrate | Merck Millipore | 1.08342.1000 | |
| D-(+)-Glucose solution, 45% in water | Sigma | G8769 | |
| di-Sodium hydrogen phosphate dihydrate | Merck Milipore | 1.06580.1000 | |
| Dissecting microscope/magnifier | MEIJI TECHNO CO. LTD | 122285 | |
| Donkey anti-goat IgG (H+L) coupled to Alexa Fluor 568 | Invitrogen | A11057 | Dilute at a ratio 1:200 |
| Donkey anti-mouse IgG (H+L) coupled to Alexa Fluor 488 | Invitrogen | A21202 | Dilute at a ratio 1:200 |
| Donkey anti-mouse IgG (H+L) coupled to Alexa Fluor 568 | Invitrogen | A10037 | Dilute at a ratio 1:200 |
| Donkey anti-rabbit IgG (H+L) coupled to Alexa Fluor 488 | Invitrogen | A21206 | Dilute at a ratio 1:500 |
| Donkey anti-rabbit IgG (H+L) coupled to Alexa Fluor 568 | Invitrogen | A10042 | Dilute at a ratio 1:500 |
| Dumont #5 Fine Forceps Biologie Inox | Fine Science Tools | 11254-20 | |
| Dumont #5 Forceps Standard Inox | Fine Science Tools | 11251-20 | |
| Dumont #7 Forceps Standard Dumoxel | Fine Science Tools | 11271-30 | |
| Dumont Medical #7S Forceps Short Curve Inox | Fine Science Tools | 11273-22 | |
| Gentamycin stock solution, 50 mg/mL | Thermo Fisher Scientific | 15750-037 | |
| Gey’s Balanced Salt Solution (GBSS) | Biological Industries | 01-919-1A | |
| Glass Electrodes | Science Products | GB150F-10 | Round tips homemade |
| Glass Pasteur pipettes, 230 mm | VWR International | 612-1702 | |
| Hank’s Balanced Salt Solution (HBSS) | Thermo Fisher Scientific | 24020-091 | |
| Hoechst 33342 | Invitrogen | H1399 | Stock solution at 2 mg/mL in PBS |
| Horse Serum, Heat Inactivated (HS) | Thermo Fisher Scientific | 26050-088 | |
| Hydrochloric acid | Merck Milipore | 1.09057.1000 | |
| Hydrophobic Pen | Dako | S200230-2 | |
| INCU-Line IL10 | VWR | 390-0384 | |
| Interface chamber | Warner Instruments | BSC-HT Haas Top | |
| Iris Spatula Curved | Fine Science Tools | 10092-12 | |
| Labculture Class II Biological Safety Cabinet | HERASafe | HS 12 | |
| Lens Cleaning Paper | TIFFEN | ||
| L-Glutamine solution 200 mM (Q) | Thermo Fisher Scientific | 25030-024 | |
| Magnesium sulfate heptahydrate | Merck Millipore | 1.05886.0500 | |
| Micro tube 0.5 mL, PP | SARSTEDT | 72,699 | |
| Micro tube 1.5 mL, PP | SARSTEDT | 72.690.001 | |
| Micro tube 2.0 mL, PP | SARSTEDT | 72.691 | |
| Micromanipulators | Sutter Instrument | MP-285 | |
| Miroscope Cover Glasses, 24 mm x 60 mm | Marienfeld | 102242 | |
| Nail polish | Cliché | ||
| Neurobasal-A Medium (NBA) | Thermo Fisher Scientific | 10888-022 | |
| Opti-MEM® I Reduced-Serum Medium | Thermo Fisher Scientific | 31985-047 | |
| Paraformaldehyde, powder | VWR Chemicals | 2,87,94,295 | |
| Peristaltic pump | Gilson | M312 | |
| Phosphate saline buffer (PBS) | Homemade. PBS with 0.5% Tween-20 (PBS-T) is used to wash slices during the immunohistochemistry assay. | ||
| Phosphate standard solutions, PO43- in water | BDH ARISTAR | 452232C | |
| Pipette set | Gilson | P2, P10, P20, P100, P200, P1000 | |
| Platinum 5 blades | Gillette | ||
| Potassium chloride | Sigma-Aldrich | P5405-250g | |
| Propidium iodide (PI) | Sigma-Aldrich | P4170-25MG | Stock solution at 1 mg/mL in water. |
| Qualitative Filter Paper, Cellulose, Grade 1, 55 mm | Whatman | 1001-055 | Medium retention 11µm |
| Qualitative Filter Paper, Cellulose, Grade 1, 90 mm | Whatman | 1001-090 | Medium retention 11µm |
| Scalpel handle | Fine Science Tools | 91003-12 | |
| Slip Tip Insulin Syringe without Needle 1 mL | SOL-M | 161000 | |
| Sodium chloride | VWR Chemicals | 27800.360 | |
| Sodium dihydrogen phosphate monohydrate | Merck Millipore | 1.06346.1000 | |
| Sodium hydrogen carbonate | Merck Millipore | 1.06329.1000 | |
| Sodium Hydroxide | Merck Milipore | 535C549998 | |
| Stimulator | Astro Med Inc GRASS Product Group | S48 Stimulator | |
| Student Scissors Straight SharpSharp 12cm | Fine Science Tools | 91402-12 | |
| SuperFrost Plus™ Adhesion slides | Thermo Fisher Scientific | J1800AMNZ | |
| TC-Treated Sterile 60 x 15mm Tissue Culture Dish | Corning | CORN430166 | |
| TC-Treated Sterile 6-Wells Plates | Corning | CORN3516 | |
| Temperatue controller | MEDICAL SYSTEMS CORP. | TC-102 | |
| Tissue Chopper | The Mickle Laboratory Engineering CO. LTD. | MTC/2 | Set to 350 μm |
| Triton X-100 | BDH | 14630 | |
| Tween-20 | Sigma | P2287 |
Referências
- Fisher, R. S., et al. Electrical stimulation of the anterior nucleus of thalamus for treatment of refractory epilepsy. Epilepsia. 51, 899-908 (2010).
- Loscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20, 359-368 (2011).
- Heinemann, U., Kann, O., Schuma, S., Pitkänen, A., Schwartzkroin, P. A., Moshé, S. L. An overview of in vitro seizure models in acute and organotypic slices. Models of seizures and epilepsy. , 35-44 (2006).
- Sundstrom, L., Morrison, B., Bradley, M., Pringle, A. Organotypic cultures as tools for functional screening in the CNS. Drug Discovery Today: Targets. 10, 993-1000 (2005).
- Holopainen, I. E. Organotypic hippocampal slice cultures: a model system to study basic cellular and molecular mechanisms of neuronal cell death, neuroprotection, and synaptic plasticity. Neurochemical Research. 30, 1521-1528 (2005).
- Noraberg, J., et al. Organotypic hippocampal slice cultures for studies of brain damage, neuroprotection and neurorepair. CNS Neurological Disorders Drug Targets. 4, 435-452 (2005).
- Dyhrfjeld-Johnsen, J., Berdichevsky, Y., Swiercz, W., Sabolek, H., Staley, K. J. Interictal spikes precede ictal discharges in an organotypic hippocampal slice culture model of epileptogenesis. Journal of Clinical Neurophysiology. 27, 418-424 (2010).
- Chong, S. A., et al. Intrinsic Inflammation Is a Potential Anti-Epileptogenic Target in the Organotypic Hippocampal Slice Model. Neurotherapeutics. 15, 470-488 (2018).
- Li, Q., Han, X., Wang, J. Organotypic hippocampal slices as models for stroke and traumatic brain injury. Molecular Neurobiology. 53 (6), 4226-4237 (2016).
- Cho, S., Wood, A., Bowlby, M. R. Brain slices as models for neurodegenerative disease and screening platforms to identify novel therapeutics. Current Neuropharmacology. 5, 19-33 (2007).
- Humpel, C. Organotypic brain slice cultures: a review. Neuroscience. 305, 86-98 (2015).
- Doussau, F., Dupont, J. L., Neel, D., Schneider, A., Poulain, B., Bossu, J. L. Organotypic cultures of cerebellar slices as a model to investigate demyelinating disorders. Expert Opinion on Drug Discovery. 12 (10), 1011-1022 (2017).
- Vismer, M. S., Forcelli, P. A., Skopin, M. D., Gale, K., Koubeissi, M. Z. The piriform, perirhinal, and entorhinal cortex in seizure generation. Frontiers in Neural Circuits. 9, 27 (2015).
- Magalhães, D. M., Pereira, N., Rombo, D. M., Beltrão-Cavacas, C., Sebastião, A. M., Valente, C. A. Ex vivo model of epilepsy in organotypic slices - a new tool for drug screening. Journal of Neuroinflammation. 15, 203 (2018).
- Ravizza, T., Balosso, S., Vezzani, A. Inflammation and prevention of epileptogenesis. Neuroscience Letters. 497 (3), 223-230 (2011).
- Liddelow, S. A., et al. Neurotoxic reactive astrocytes are induced by activated microglia. Nature. 541, 481-487 (2017).
- Wu, T. Complement C3 is activated in human AD brain and is required for neurodegeneration in mouse models of amyloidosis and tauopathy. Cell Reports. 28 (8), 2111-2123 (2019).
- Hartmann, K., et al. Complement 3+-astrocytes are highly abundant in prion diseases, but their abolishment led to an accelerated disease course and early dysregulation of microglia. Acta Neuropathologica Communications. 7, 83 (2019).
- Nilsson, U. R., Funke, L., Nilsson, B., Ekdahl, K. N. Two conformational forms of target-bound iC3b that distinctively bind complement receptors 1 and 2 and two specific monoclonal antibodies. Upsala Journal of Medical Sciences. 116, 26-33 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados