É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Planarian Scrunching como uma leitura comportamental quantitativa para sensoriamento de estímulos nocivos
Neste Artigo
Resumo
Os planários de água doce exibem três marchas (deslizamento, peristalse e scrunching) que são distinguíveis pela análise comportamental quantitativa. Descrevemos um método para induzir o scrunching usando vários estímulos nocivos, quantificação e distinção da peristalse e deslizamento. Usando knockdown genético, demonstramos a especificidade do scrunching como uma leitura fenotípica quantitativa.
Resumo
Os planários de água doce normalmente deslizam suavemente através da propulsão ciliar em seu lado ventral. Certas condições ambientais, no entanto, podem induzir formas de locomoção orientadas pela musculatura: peristalse ou scrunching. Embora a peristalse resulte de um defeito ciliar, o scrunching é independente da função cílio e é uma resposta específica a certos estímulos, incluindo amputação, temperatura nociva, pH extremo e etanol. Assim, essas duas marchas orientadas por musculatura são mecanicamente distintas. No entanto, eles podem ser difíceis de distinguir qualitativamente. Aqui, fornecemos um protocolo para induzir o scrunching usando vários estímulos físicos e químicos. Detalhamos a caracterização quantitativa do scrunching, que pode ser usado para distingui-lo da peristalse e do deslizamento, utilizando software livremente disponível. Uma vez que o scrunching é uma marcha planária universal, embora com diferenças específicas características das espécies, este protocolo pode ser amplamente aplicado a todas as espécies de planários, ao usar considerações apropriadas. Para demonstrar isso, comparamos a resposta das duas espécies planárias mais populares utilizadas na pesquisa comportamental, Dugesia japonica e Schmidtea mediterrânea,com o mesmo conjunto de estímulos físicos e químicos. Além disso, a especificidade do scrunching permite que este protocolo seja usado em conjunto com a interferência do RNA e/ou exposição farmacológica para dissecar os alvos moleculares e circuitos neuronais envolvidos, potencialmente fornecendo uma visão mecanicista sobre aspectos importantes da nocicepção e da comunicação neuromuscular.
Introdução
Além de sua popularidade para a pesquisa de células-tronco e regeneração1,,2,3, os planários de água doce têm sido usados há muito tempo em estudos comportamentais4,,5, aproveitando seu tamanho comparativamente grande (alguns milímetros de comprimento), facilidade e baixo custo de manutenção laboratorial, e amplo espectro de comportamentos observáveis. A introdução da visão computacional e o rastreamento automatizado aos estudos de comportamento planário6,,7,,8,,9,,10,11 permitiram diferenciação quantitativa de fenótipos comportamentais. O comportamento animal é uma leitura direta da função neuronal. Como o sistema nervoso planário é de médio porte e complexidade, mas compartilha elementos-chave conservados com o cérebro vertebrado12,,13,14, estudar o comportamento planário pode fornecer insights sobre mecanismos conservados de ação neuronal que podem ser difíceis de sondar diretamente em organismos mais complexos. Assim, os planários são um modelo valioso para estudos comparativos de neurobiologia8,,12,15,16,17,18,19,20,21. Além disso, o ambiente aquático permite a exposição rápida e fácil a produtos químicos para estudar seu efeito na função cerebral na regeneração e planários adultos, tornando-os um sistema popular de neurotoxicologia22,,23,,24,,25,26.
Os planários possuem três marchas distintas, chamadas de deslizamento, peristalse e scrunching. Cada marcha é exibida em circunstâncias específicas: deslizar é a marcha padrão, a peristose ocorre quando a função ciliar é comprometida7,27, e scrunching é uma marcha de fuga – independente da função cílio – em resposta a certos estímulos nocivos7. Mostramos que o scrunching é uma resposta específica, provocada pela sensação de certos sinais químicos ou físicos, incluindo temperaturas extremas ou pH, lesões mecânicas ou indutores químicos específicos, e portanto não é uma resposta geral ao estresse7,,28,,29.
Devido à sua especificidade e parâmetros estereotipados, que podem ser facilmente quantificados usando este protocolo, o scrunching é um poderoso fenótipo comportamental que permite aos pesquisadores realizar estudos mecanicistas dissecando vias sensoriais e controle neuronal do comportamento25,,28. Além disso, o scrunching tem se mostrado um ponto final sensível para avaliar efeitos químicos adversos no desenvolvimento do sistema nervoso e função em estudos de neurotoxicologia22,,24,,25,,30. Como várias vias sensoriais diferentes parecem convergir para induzir o scrunching através de vários mecanismos28, o scrunching difere de outros comportamentos planários porque vários, mas específicos, estímulos podem ser usados para dissecar circuitos neuronais distintos e estudar como diferentes sinais são integrados para produzir o fenótipo de scrunching.
É importante ressaltar que existem diferenças de espécies, onde um produto químico pode provocar scrunching em uma espécie planária, mas uma resposta comportamental diferente em outra. Por exemplo, descobrimos que a anandamida induz o esmagamento na espécie planária Dugesia japonica, mas induz a peristalse na mediterranea Schmidtea28. Este exemplo destaca a importância de ser capaz de distinguir de forma confiável entre as diferentes marchas, pois são as manifestações fenotípicas de mecanismos moleculares distintos. No entanto, a distinção da peristose é difícil usando dados observacionais qualitativos, pois ambas as marchas são orientadas pela musculatura e compartilham semelhanças qualitativas7,,28. Assim, para distinguir as marchas é necessário realizar imagens de cílios ou um estudo comportamental quantitativo, que permita a distinção com base nos parâmetros característicos7,28. Como a imagem de cílios é experimentalmente desafiadora e requer equipamentos especializados, como um microscópio composto de alta ampliação e uma câmera de alta velocidade7,,28, não é tão amplamente acessível aos pesquisadores quanto a análise comportamental quantitativa.
Aqui, apresentamos um protocolo para (1) a indução de scrunching utilizando vários estímulos físicos (temperatura nociva, amputação, luz quase UV) e químicos (isothiocyanato aliado (AITC), cinnamaldeído) e (2) a análise quantitativa do comportamento planário utilizando software livremente disponível. Quantificando quatro parâmetros (frequência de oscilações do comprimento do corpo, velocidade relativa, amplitude máxima e assimetria do alongamento corporal e contração)7, o scrunching pode ser diferenciado de deslizamento, peristalse e outros estados comportamentais relatados na literatura, como locomoção semelhante a cobra15 ou epilepsias15. Além disso, enquanto o scrunching é conservado entre diferentes espécies planárias7, cada espécie tem sua própria frequência e velocidade características; portanto, uma vez que as velocidades de deslizamento e esmagamento de uma espécie foram determinadas, a velocidade por si só pode ser usada como um meio para distinguir o esmagamento do deslizamento e peristalse29. O protocolo não pressupõe treinamento prévio em análise de imagem computacional ou estudos comportamentais e, portanto, também pode ser aplicado para experimentos comportamentais planários em um contexto laboratorial de ensino no nível de graduação. Exemplos de dados para facilitar a adaptação do protocolo são fornecidos no Material Suplementar.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Ensaios quantitativos de comportamento planário
- Configuração experimental
- Coloque um painel LED escurecido sobre uma superfície plana. O painel LED serve a dois propósitos: (1) fornecer um fundo branco uniforme e (2) ser usado como fonte de luz ajustável para obter o contraste adequado. Coloque uma arena de placas de Petri de 100 mm sobre o painel LED.
NOTA: Para aumentar o throughput, uma placa multi-poço pode ser usada como arena23,24, mas arenas maiores facilitam a análise automatizada de imagens. - Monte uma câmera em um suporte de anel acima da arena (Figura 1A). Ajuste a posição da câmera, altura e foco conforme necessário para que toda a arena esteja centrada dentro do campo de visão e esteja em foco(Figura 1B).
NOTA: A resolução da câmera precisa ser alta o suficiente para distinguir claramente um planário do fundo homogêneo fornecido pelo painel LED. - Encha a arena com os meios de exposição apropriados (água planária ou solução química) ao volume meio máximo (isso será chamado de banho). Isso corresponde a aproximadamente 25 mL para uma placa de Petri de 100 mm. Ligue o painel LED e desligue quaisquer outras fontes de luz que possam afetar negativamente a qualidade da gravação (ou seja, fontes de luz próximas que produzem um brilho na arena).
ATENÇÃO: Gerencie soluções químicas perigosas adequadamente usando equipamentos de proteção individual completos (EPI) e movendo a configuração experimental para um capô de fumaça, se necessário. Siga as normas federais e estaduais sobre o descarte de resíduos. - Jogue um planário em direção ao centro da arena usando uma pipeta de transferência. Comece a gravar. Registo de dados como sequências de imagem em um formato fiji31 nativo (TIFF, GIF, JPEG, PNG, DICOM, BMP, PGM ou FITS; veja a seção de análise de imagem 1.2).
NOTA: Como os comportamentos e a sensibilidade aos estímulos externos variam entre os planários individuais, é importante coletar dados sobre um número suficientemente grande de réplicas biológicas, além de realizar réplicas técnicas. Trabalhamos com até 10 planários de tamanho médio (4-7 mm) em uma placa de Petri de 100 mm de uma só vez. Embora o tempo seja eficiente, vários planários na placa de Petri de uma só vez dificultam a análise de dados, uma vez que os planários podem cruzar caminhos.- Para experimentos de deslizamento, grave usando pelo menos 1 quadro por segundo (FPS). Para experimentos de scrunching/peristalsis, registo usando um FPS que é pelo menos o dobro da frequência de scrunching/peristalsis das espécies planárias. Se a espécie planária tiver uma frequência desconhecida de scrunching/peristalsis, use 10 FPS como ponto de partida e aumente/diminua conforme apropriado.
- Ao utilizar uma solução química, transfira o planário usando o menor número possível de gotas de água planária para que a concentração da solução química não seja significativamente alterada.
- Para experimentos de deslizamento, registo 1-2 minutos de comportamento deslizante. Para experimentos de scrunching/peristalsis, registo tempo suficiente para capturar pelo menos 3 oscilações consecutivas ocorrendo em linha reta. Assim que o experimento estiver concluído, termine a gravação.
NOTA: Para experimentos de scrunching/peristalse, se um planário não satisfaz o critério de rescisão dentro de um período de tempo fixo que precisa ser consistente entre as réplicas e é empiricamente determinado com base no estímulo, encerre a gravação e teste outro planário.- Se o planário chegar ao limite da arena sem satisfazer o critério de rescisão, pipeta o planário de volta ao centro da arena.
NOTA: Evite a pipetação repetida de um indivíduo para gravação, pois isso pode mudar seu comportamento.
- Se o planário chegar ao limite da arena sem satisfazer o critério de rescisão, pipeta o planário de volta ao centro da arena.
- Remova os planários da arena e descarte a solução planária de água ou química em recipientes de resíduos apropriados. Planários que estavam em água planária podem ser devolvidos ao seu recipiente.
NOTA: Evite a contaminação cruzada usando diferentes arenas para diferentes mídias (ou seja, deslizar em experimentos de água planariana não deve ser executado em uma arena anteriormente usada para experimentos de scrunching/peristalse com exposição química).- Enxágüe em série planários expostos a uma solução química em 3 pratos de Petri limpos de 100 mm preenchidos com 25 mL de água planariana para diluir completamente quaisquer produtos químicos. Se o esmagamento ou peristalse foi induzido, coloque esses planários em um recipiente separado. Os planários podem ser devolvidos ao seu contêiner depois de um mês, já que a maioria das células teria virado por esse tempo1.
NOTA: Se vários experimentos diferentes forem necessários para a mesma população de planários, por exemplo, para uma população rnai, permita que os planários se recuperem por 24 horas antes de executar o próximo experimento. Ordene os experimentos de tal forma que o experimento menos invasivo seja o primeiro e o experimento mais invasivo (por exemplo, amputação) seja executado por último. - Se executar vários experimentos na mesma arena, descarte corretamente a solução de banho e remova quaisquer trilhas de muco limpando a arena com uma toalha de papel entre as corridas.
NOTA: O protocolo pode ser pausado aqui.
- Enxágüe em série planários expostos a uma solução química em 3 pratos de Petri limpos de 100 mm preenchidos com 25 mL de água planariana para diluir completamente quaisquer produtos químicos. Se o esmagamento ou peristalse foi induzido, coloque esses planários em um recipiente separado. Os planários podem ser devolvidos ao seu contêiner depois de um mês, já que a maioria das células teria virado por esse tempo1.
- Coloque um painel LED escurecido sobre uma superfície plana. O painel LED serve a dois propósitos: (1) fornecer um fundo branco uniforme e (2) ser usado como fonte de luz ajustável para obter o contraste adequado. Coloque uma arena de placas de Petri de 100 mm sobre o painel LED.
- Análise quantitativa do comportamento planário
- Realize ensaios de comportamento planário descritos na Seção 1.1.
- Abra a sequência de imagem bruta para um experimento em Fiji (File > Import > Image Sequence) e selecione a primeira imagem na sequência de imagem. Na janela Opções de sequência, marque a caixa para "Classificar nomes numericamente" e clique em "OK". Uma vez que a sequência de imagem seja carregada, converta a sequência de imagem em 8 bits (Imagem > Tipo > 8 bits) e use a ferramenta de seta ou controle deslizante na parte inferior da pilha de imagens para assistir ou passar pela sequência de imagem.
NOTA: Para experimentos de deslizamento, todos os dados podem ser usados desde que o planário possa ser claramente visto durante toda a gravação. No entanto, geralmente é suficiente analisar o movimento livre no centro da arena, extraindo a parte relevante como descrito abaixo. - Para extrair um período de tempo e região de interesse, desenhe uma região de interesse que abrange todo o caminho de um planário utilizando a ferramenta retângulo(Figura 2A, 2B). Clique com o botão direito do mouse na pilha de imagens e selecione Duplicar..., marque a caixa para duplicata,digite o primeiro e o último quadros da sequência de interesse e clique em OK. Se vários planários foram imagens simultaneamente, repita essa etapa de seleção e duplicação da região para cada planário na arena para que haja tantas pilhas de imagens abertas quanto planários na arena. As etapas seguintes (Etapas 1.2.4-1.2.10) devem ser executadas em cada pilha de imagens, uma de cada vez.
- Para experimentos de deslizamento, extraia um período de deslizamento onde o planário se move pelo menos o dobro do seu comprimento corporal.
NOTA: Quanto mais dados de deslizamento extraídos por planário, mais confiáveis serão os dados. O planário não precisa estar se movendo em linha reta para a análise de deslizamento. - Para experimentos de scrunching/peristalsis, extrair uma instância em que o planário sofre um mínimo de três oscilações corporais consecutivas (idealmente mais) em linha reta, certificando-se de que cada oscilação é um ciclo completo de alongamento-contração, pois oscilações completas são necessárias para determinar com precisão a frequência.
NOTA: Quanto mais oscilações puderem ser extraídas, mais confiáveis serão os dados. Não use sequências onde o planário está girando, pois estas resultarão em medidas de comprimento imprecisas.
- Para experimentos de deslizamento, extraia um período de deslizamento onde o planário se move pelo menos o dobro do seu comprimento corporal.
- Aplique um limiar à pilha de imagens duplicada (Image > Adjust > Threshold) para binarizar a imagem e extrair o planário do plano de fundo. Ajuste as barras deslizantes conforme necessário, de modo que todo o planário seja destacado em vermelho. Os valores exatos dependem da qualidade da imagem. Deixe as caixas para fundo escuro, empilhe histogramae não reinicie o intervalo sem controle. Role a pilha de imagens para garantir um bom alcance de limiar (ou seja, o planário está bem separado do plano de fundo em toda a pilha) e, em seguida, clique em Aplicar.
- Na pilha converter para binária, defina o método como padrão e o fundo para a luz. Desmarque todas as caixas nesta janela e clique em OK. Uma imagem binarizada mostrando um planário preto em um fundo branco aparecerá(Figura 2C). Certifique-se de que todo o planário esteja visível em todos os quadros da sequência de imagem.
NOTA: Objetos indesejados na sequência de imagem binarizada menor ou maior que o planário podem ser filtrados na análise subsequente usando um filtro de tamanho(Figura 2Ciii). - Definir medições clicando em Analisar > Definir Medidas. Verifique as caixas para Área, Centro de massa, Posição de pilhae elipse fit e clique em OK.
NOTA: Esses parâmetros só precisam ser definidos uma vez por sessão Fiji. - Selecione a pilha de imagens abertas e selecione Analisar > Analisar partículas.
- Na janela Analisar partículas, selecione Mostrar > Máscaras para abrir uma nova pilha mostrando todos os objetos que foram detectados com os parâmetros escolhidos. Isso pode ser usado para verificar visualmente que apenas medidas do planário estão sendo tomadas. Um filtro de tamanho pode ser definido nesta etapa para remover ruídos indesejados entrando na área aproximada do planário (em unidades pixel2) no espaço fornecido. Verifique as caixas para obter resultados de exibição e limpar resultados e clique em OK.
NOTA: Na janela Resultados, se o índice (primeira coluna) não for igual ao número de fatia para todas as linhas, isso significa que muitos ou poucos objetos foram rastreados. Uma possibilidade para essa discrepância é a presença de outros objetos além do planário ou que o planário não tenha sido rastreado em quadros específicos. - Passe a pilha de imagens da máscara usando o controle deslizante na parte inferior do painel. Se houver algum ruído ou houver quadros que não tenham um planário, feche a janela Resultados e a pilha de imagens da máscara. Repita as etapas 1.2.7-1.2.8 ajustando o filtro de área para remover apenas objetos que não sejam o planário.
NOTA: Se faltar o planário do quadro na máscara, isso sugere que o limite inferior do filtro de área estava muito alto. - Na janela Resultados, salve os dados usando File>Save As. Adicione a extensão .csv ao nome do arquivo para salvar dados como valores separados por círias. Uma vez salvos dados da pilha de imagens, feche a respectiva pilha de imagens e as janelas Resultados e Máscaras.
- Importe dados e analise ainda mais usando qualquer software de planilha ou freeware. Para calcular a velocidade de deslizamento, consulte a seção 1.3. Para calcular o conjunto completo do parâmetro scrunching/peristalsis, consulte a seção 1.4.
NOTA: O protocolo pode ser pausado aqui. - Para determinar o pixel para conversão de comprimento real, abra uma imagem em Fiji com um comprimento de referência (por exemplo, o diâmetro da arena). Selecione a ferramenta de linha e desenhe uma linha sobre o comprimento conhecido.
- Converta unidades de pixels em uma unidade padrão de comprimento clicando em Analisar > Escala de conjunto. Digite o comprimento correspondente à linha desenhada na imagem na caixa de distância Conhecida e altere a unidade de comprimento do pixel para a unidade padrão de comprimento escolhida. O fator de conversão está escrito ao lado da Escala.
NOTA: Um valor de conversão de pixels não é necessário para análises de deslizamento ou scrunching/peristalse nas seções 1.3 e 1.4.
- Cálculo da velocidade de deslizamento
- Usando o arquivo de dados salvo na Seção 1.2, carregue as coordenadas do centro de massa (COM) x e y e os dados principais do eixo. Se os dados forem salvos como um arquivo de valores separados por ímpar, essas listas correspondem às colunas "XM", "YM" e "Major", respectivamente.
- Calcule o deslocamento (d) do centro planário de massa em pixels para cada quadro em relação ao próximo quadro usando as colunas de dados "XM" e "YM". O deslocamento (d) é dado por:
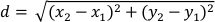
onde x1 e y1 referem-se às coordenadas COM (XM, YM) de um quadro e x2 ey 2 referem-se às coordenadas COM (XM, YM) do quadro subsequente. - Defina o comprimento do corpoth planário como o percentil 95 da coluna "Major". Uma vez que os planários apresentam um comportamento de preferência de parede32,isso garante que o comprimento do corpo planário calculado seja representativo de quando o planário é alongado24.
- Normalizar o deslocamento pelo comprimento do corpo planário dividindo os deslocamentos de pixels por quadro pelo comprimento do corpo planário (l). O deslocamento normalizado (dn) é dado por:
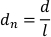
- Gerar uma lista de velocidades normalizadas dividindo os deslocamentos normalizados pelo tempo decorrido por quadro (inverso do FPS gravado). A velocidade de deslizamento normalizada (sn) é dada por:
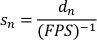
- Calcule a velocidade de deslizamento normalizada do planário tomando a média da lista de velocidades normalizada (sn). O desvio padrão pode ser usado como uma medida de incerteza para o planário.
- Repetir as etapas 1.3.1-1.3.6 para cada planário a ser analisado. Média e tomar o desvio padrão das velocidades de deslizamento para todos os planários para obter a velocidade de deslizamento e incerteza associada, respectivamente, para uma população planária.
- Distinção de marchas de scrunching e peristalsis usando o conjunto de parâmetros completos
- Carregue a lista de dados do eixo principal do arquivo de dados salvo da Seção 1.2. Se os dados forem salvos como um arquivo de valores separados por ímpar, isso corresponde à coluna Principal.
- Crie uma lista que números cada ponto de dados na coluna Principal, começando com 0. Converta esta lista em tempo decorrido por quadro dividindo-se pelo FPS gravado.
- Plote os dados da coluna Principal com relação ao tempo decorrido para gerar um gráfico de oscilação scrunching/peristálsis(Figura 3A). Utilizando o gráfico de oscilação, corte os dados para pelo menos três oscilações consecutivas em linha reta(Figura 3Bi). Corte os dados para iniciar e terminar em picos locais (alongamento máximo de oscilação) ou cochos (alongamento mínimo de oscilação).
NOTA: Se a extrema local não for aproximadamente igual (picos/calhas diferem dramaticamente em alturas), isso sugere que as oscilações não são linha reta(Figura 3Bii). Extrair outra sequência de pelo menos três oscilações consecutivas em linha reta. Consulte a Seção 1.2. - Confirme se a sequência de oscilação de juros foi extraída e aparada adequadamente, replantando os dados principais aparados em relação ao tempo. Use esta lista de dados aparada para todos os cálculos subsequentes.
- Para calcular a frequência de oscilação (νm),divida o número de oscilações (On) pelo número total de pontos de dados na lista de dados do eixo principal aparado (N). Multiplique FPS por este valor para obter frequência em oscilações por segundo.
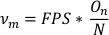
- Para calcular o alongamento máximo (|Δε| max), subtrair o comprimento mínimo absoluto do corpo (lmin) do comprimento máximo máximo do corpo (lmax). Normalize o comprimento do corpo alongado dividindo-se pelo comprimento máximo absoluto do corpo.
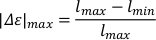
- Para calcular a velocidade por comprimento da carroceria(v*m),multiplique o alongamento máximo calculado pela frequência de oscilação.
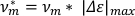
NOTA: A velocidade por si só pode ser usada para distinguir entre marchas de scrunching e peristalsis7. - Para calcular a fração do tempo gasto alongando (falongado), pegue a derivada da lista de dados do eixo principal aparada em relação ao tempo. Divida o número de pontos de dados positivos (ou seja, quando o derivado é >0 (np), pelo número total de pontos de dados na lista de dados do eixo principal(nt)."
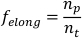
NOTA: Os planários de scrunching exibem uma fração assimétrica do tempo gasto alongando enquanto os planários que realizam a peristalse gastam quantidades iguais de tempo alongando e contraindo7. - Repetir as etapas 1.4.1-1.4.8 para cada planário a ser analisado. Calcule um parâmetro populacional planário definido tomando o desvio médio e padrão de cada parâmetro.
NOTA: O conjunto de parâmetros pode ser usado para determinar se o comportamento de oscilação está oscilando, peristalse ou alguma outra forma de locomoção com alterações periódicas da forma do corpo. Tanto o scrunching quanto a peristalse têm parâmetros fixos para uma determinada espécie7,com parâmetros de scrunching geralmente maiores do que os parâmetros de peristose7. Embora seja possível que um dos parâmetros possa estar fora da faixa específica da espécie, como observamos anteriormente com a indução química28,o comportamento observado deve concordar com pelo menos 3 dos 4 parâmetros publicados a serem categorizados como peristalse ou scrunching.
2. Indução de scrunching
- Estímulos físicos (temperatura nociva, luz UV, amputação)
- Para todos os experimentos de estímulo físico, consulte a Seção 1.1 para a configuração experimental.
NOTA: É melhor usar uma grande arena, como uma placa de Petri de 100 mm, para experimentos de estímulos físicos para permitir um espaço mais aberto para manobrar uma pipeta e/ou lâmina de barbear. - Para induzir o esmagamento através da temperatura nociva, aqueça a água planária em um copo de vidro (pelo menos 100 μL por planário a ser testado) a 65 °C em uma placa quente.
- Coloque um planário no centro da arena. Espere até que o planário se oriente ereto e comece a deslizar. Comece a gravar.
- Usando uma pipeta P-200, pipeta lentamente 100 μL da água planariana de 65 °C pós-faringeally na extremidade traseira do planário para induzir scrunching.
NOTA: Certifique-se de que a água planária aquecida permanece em 65°C. Se necessário, reaqueça a água para 65°C antes de iniciar outro experimento. Uma vez que a pressão também pode induzir o scrunching, a tubulação lenta é necessária. A tubulação da água da temperatura ambiente da mesma forma que no experimento pode servir como uma opção de controle e prática. - Pare a gravação assim que o scrunching cessar. Coloque o planário em um recipiente de recuperação e troque a mídia na placa de petri com água planária fresca e de temperatura ambiente se realizar mais experimentos.
- Para induzir o scrunching via amputação, transfira um planário para o centro da arena e espere até que o planário se oriente ereto e comece a deslizar. Comece a gravar.
- Ampute o planário usando uma lâmina de barbear limpa. Amputações podem ser feitas em qualquer lugar ao longo do planário, desde que o local do corte seja consistente entre experimentos.
NOTA: Os parâmetros de escrúpulos são extraídos da peça anterior. Assim, evite obstruir a visão da câmera desta parte do planário ao aplicar o corte se aproximando da extremidade posterior. Os deslizamentos de cobertura plástica também funcionam bem para o corte e são uma opção mais segura, especialmente em um ambiente de ensino. - Pare a gravação assim que a peça anterior parar de amassar. Retire ambas as peças, coloque-as em um recipiente separado e deixe-as se regenerar por 7 dias. Planários amputados podem ser reincorporados no recipiente doméstico uma vez regenerados.
- Ampute o planário usando uma lâmina de barbear limpa. Amputações podem ser feitas em qualquer lugar ao longo do planário, desde que o local do corte seja consistente entre experimentos.
- Para induzir o scrunching usando luz quase UV, conecte filtros apropriados (por exemplo, filtros Roscolux) à lente da câmera para reduzir a quantidade de luz quase UV refletida que é coletada pela câmera e pode interferir na imagem da resposta do planário. Em vez de usar o painel LED para iluminar a arena a partir de baixo, use iluminação vermelha ambiente para a qual os planários são insensíveis33.
- Encha uma arena de placas de Petri de 100 mm com água planária e coloque um único planário (5-9 mm) no centro da arena. Comece a gravar a 10 FPS.
- Segure um ponteiro laser UV classe II (405 ± 10 nm, potência de saída <5 mW) aproximadamente 30 cm da arena. Posicione o ponteiro laser em um ângulo de 45° do planário deslizante e, em seguida, brilhe o ponteiro laser por 5-10 segundos no meio do caminho entre a extremidade posterior da faringe e a ponta da cauda para induzir o scrunching.
NOTA: A potência do ponteiro laser pode ser medida usando um medidor de alimentação quase sensível a UV. - Aguarde que o planário comece a deslizar novamente antes de tentar mais duas estimulações no mesmo indivíduo para testar a reprodutibilidade da reação. Se o planário continuar mostrando o mesmo comportamento, pare de gravar e coloque o planário de volta em seu contêiner. Se o comportamento mudar entre estímulos, testes adicionais mostrarão qual resposta é a mais proeminente.
NOTA: Os planários podem ficar insensitados com luz quase UV e vão parar de reagir. Estimulações consecutivas requerem um período de descanso de 8-10 segundos.
- Para todos os experimentos de estímulo físico, consulte a Seção 1.1 para a configuração experimental.
- Estímulo químico (AITC)
- Para induzir o scrunching usando um produto químico, por exemplo, o Agonista TRPA1 AITC28,os planários são idealmente imersos em um banho do produto químico. Se necessário, a pipetação pode ser aplicada conforme descrito na seção 2.1.2.3.
ATENÇÃO: A AITC é inflamável, agudamente tóxica, pode causar irritação na pele e nos olhos, sensibilização respiratória e da pele, e é perigosa para a vida aquática. O óleo AITC deve ser manuseado em um capô de fumaça. Antes de fazer soluções de estoque da AITC, coloque epi apropriado (luvas de nitrito e um jaleco) e configure recipientes adequados de descarte de resíduos perigosos sólidos e líquidos. - Em um capô de fumaça, faça uma solução de estoque de 10 mM de AITC em água planariana em um tubo centrífuga de 50 mL. Esta solução de estoque é útil por até um mês quando armazenada a 4°C.
- A partir deste estoque, prepare uma solução de trabalho de 25 mL de 100 μM AITC em água planária em um tubo centrífuga de 50 mL. Esta solução AITC de 100 μM será usada para induzir scrunching em planários.
NOTA: 100 μM AITC induz scrunching consistente em D. japonica e S. mediterranea planarians28. Para outros planários aquáticos, 100 μM pode servir como uma concentração inicial e pode ser ajustado de acordo. - Configure a configuração experimental (consulte a Seção 1.1). Encha a arena com a solução de trabalho da AITC e coloque-a em um recipiente secundário. O recipiente secundário deve conter pelo menos o dobro do volume da arena.
NOTA: Experimentos podem ser realizados dentro de um capô de fumaça para maior segurança. - Transfira até 10 planários para o centro da arena e comece a gravar.
- Uma vez que os planários se tornam dessensibilizados e deixam de escrúpulos, pare de gravar. Remova os planários da solução AITC e enxágue (consulte a Seção 1.1). Descarte resíduos sólidos e líquidos da AITC em recipientes de resíduos apropriados.
- Verifique a especificidade da resposta à AITC usando RNAi para TRPA128 seguindo protocolos padrão.
- A partir deste estoque, prepare uma solução de trabalho de 25 mL de 100 μM AITC em água planária em um tubo centrífuga de 50 mL. Esta solução AITC de 100 μM será usada para induzir scrunching em planários.
- Para induzir o scrunching usando um produto químico, por exemplo, o Agonista TRPA1 AITC28,os planários são idealmente imersos em um banho do produto químico. Se necessário, a pipetação pode ser aplicada conforme descrito na seção 2.1.2.3.
Access restricted. Please log in or start a trial to view this content.
Resultados
A percepção extraocular quase-UV em S. mediterranea planarians é dependente de TRPA1 e foi proposta para ser ligada à versão H2O2 17. Como a exposição H2O2 induz o scrunching dependente de TRPA1 em S. mediterranea e D. japonica planarians28, as etapas da Seção 2.1.4 podem ser usadas para testar se a exposição à luz quase UV induz o esmagamento em ambas as espécies. Enquanto d. japonica
Access restricted. Please log in or start a trial to view this content.
Discussão
Utilizando este protocolo, pode-se estudar quantitativamente os efeitos dos estímulos físicos e químicos7,,28,29 ou manipulação genética (RNAi)28,29 sobre locomoção planária. Para maximizar a resolução espacial, é melhor mover a câmera o mais perto possível da arena, garantindo que toda a arena esteja no campo de visão. Para aumentar o rendimento, o compor...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores agradecem ao Sr. Tapan Goel pelos comentários sobre o manuscrito. Este trabalho foi financiado pela NSF CAREER Grant 1555109.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Allyl isothiocyanate, 95% (AITC) | Sigma-Aldrich | 377430-5G | CAUTION: Flammable and acutely toxic; handle in a fume hood with appropriate PPE. |
| Camera lens, 2/3 25mm F/1.4 | Tamron | 23FM25SP | |
| Cell culture plates, 6 well, tissue culture treated | Genesee Scientific | 25-105 | |
| Centrifuge tubes, 50 mL polypropylene, sterile | MedSupply Partners | 62-1019-2 | |
| Cinnamaldehyde, >95% | Sigma-Aldrich | W228613-100G-K | |
| Dimmable A4 LED Tracer Light Box | Amazon | B07HD631RP | |
| Flea3 USB3 camera | FLIR | FL3-U3-13E4M | |
| Heat resistant gloves | Fisher Scientific | 11-394-298 | |
| Hot plate | Fisher Scientific | HP88854200 | |
| Instant Ocean Sea Salt, prepared in deionized water | Instant Ocean | SS15-10 | Prepare in deionized water at 0.5 g/L. |
| Montjüic salts, prepared in Milli-Q water | Sigma-Aldrich | various | Prepare in milli-Q water at 1.6 mM NaCl, 1.0 mM CaCl2, 1.0 mM MgSO4, 0.1 mM MgCl2, 0.1 mM KCl, 1.2 mM NaHCO3; adjust pH to 7.0 with HCl. |
| Petri dishes, 100 mm x 20 mm, sterile polystyrene | Simport | D210-7 | |
| Pipette, 20-200 μL range | Rainin | 17008652 | |
| PYREX 150 mL beaker | Sigma-Aldrich | CLS1000150 | |
| Razor blade, 0.22 mm | VWR | 55411-050 | |
| Roscolux color filter: Golden Amber | Rosco | R21 | Alternatively purchase the Roscolux Designer Color Selector (Musson Theatrical product #SBLUX0306) which includes all 3 color filters together. |
| Roscolux color filter: Medium Red | Rosco | R27 | |
| Roscolux color filter: Storaro Red | Rosco | R2001 | |
| Samco transfer pipette, 62 µL large aperture | Thermo Fisher | 691TS | |
| Support stand | Fisher Scientific | 12-947-976 | |
| Thermometer | VWR | 89095-600 | |
| UV laser pointer | Amazon | B082DGS86R | This is a Class II laser (405nm ±10nm) with output power <5 mW. |
Referências
- Rink, J. C. Stem cell systems and regeneration in planaria. Development Genes and Evolution. 223, 67-84 (2013).
- Reddien, P. W., Alvarado, A. S. Fundamentals of Planarian Regeneration. Annual Review of Cell and Developmental Biology. 20, 725-757 (2004).
- Cebrià, F. Regenerating the central nervous system: how easy for planarians. Development Genes and Evolution. 217, 733-748 (2007).
- Pearl, R. Memoirs: The Movements and Reactions of Fresh-Water Planarians: A Study in Animal Behaviour. Journal of Cell Science. , 2-46 (1903).
- Mc Connell, J. A Manual of Psychological Experimentation on Planarians. , Planarian Press. (1967).
- Talbot, J., Schötz, E. M. Quantitative characterization of planarian wild-type behavior as a platform for screening locomotion phenotypes. Journal of Experimental Biology. 214, 1063-1067 (2011).
- Cochet-Escartin, O., Mickolajczk, K. J., Collins, E. M. S. Scrunching: a novel escape gait in planarians. Physical Biology. 12, 055001(2015).
- Inoue, T., et al. Planarian shows decision-making behavior in response to multiple stimuli by integrative brain function. Zoological Letters. 1, 1-15 (2015).
- Arenas, O. M., et al. Activation of planarian TRPA1 by reactive oxygen species reveals a conserved mechanism for animal nociception. Nature Neuroscience. 20, 1686-1693 (2017).
- Shomrat, T., Levin, M. An automated training paradigm reveals long-term memory in planarians and its persistence through head regeneration. Journal of Experimental Biology. 216, 3799-3810 (2013).
- Blackiston, D., Shomrat, T., Nicolas, C. L., Granata, C., Levin, M. A Second-Generation device for automated training and quantitative behavior analyses of Molecularly-Tractable model organisms. PLoS One. 5, 1-20 (2010).
- Ross, K. G., Currie, K. W., Pearson, B. J., Zayas, R. M. Nervous system development and regeneration in freshwater planarians. Wiley Interdisciplinary Reviews-Developmental Biology. 6, 266(2017).
- Cebrià, F., et al. The expression of neural-specific genes reveals the structural and molecular complexity of the planarian central nervous system. Mechanisms of Development. , 116-204 (2002).
- Mineta, K., et al. Origin and evolutionary process of the CNS elucidated by comparative genomics analysis of planarian ESTs. Proceedings of the National Academy of Sciences of the United States of America. 100, 7666-7671 (2003).
- Ross, K. G., et al. SoxB1 Activity Regulates Sensory Neuron Regeneration, Maintenance, and Function in Planarians. Developmental Cell. 47, 331-347 (2018).
- Nishimura, K., et al. Reconstruction of Dopaminergic Neural Network and Locomotion Function in Planarian Regenerates. Developmental Neurobiology. 67, 1059-1078 (2007).
- Birkholz, T. R., Beane, W. S. The planarian TRPA1 homolog mediates extraocular behavioral responses to near-ultraviolet light. Journal of Experimental Biology. 220, 2616-2625 (2017).
- Currie, K. W., Molinaro, A. M., Pearson, B. J. Neuronal sources of hedgehog modulate neurogenesis in the adult planarian brain. Elife. 5, (2016).
- Talbot, J. A., Currie, K. W., Pearson, B. J., Collins, E. M. S. Smed-dynA-1 is a planarian nervous system specific dynamin 1 homolog required for normal locomotion. Biology Open. , 1-8 (2014).
- Currie, K. W., Pearson, B. J. Transcription factors lhx1/5-1 and pitx are required for the maintenance and regeneration of serotonergic neurons in planarians. Development. 140, 3577-3588 (2013).
- Hagstrom, D., et al. Planarian cholinesterase: molecular and functional characterization of an evolutionarily ancient enzyme to study organophosphorus pesticide toxicity. Archives of Toxicology. 92, 1161-1176 (2018).
- Hagstrom, D., Cochet-Escartin, O., Collins, E. M. S. Planarian brain regeneration as a model system for developmental neurotoxicology. Regeneration. 3, 65-77 (2016).
- Hagstrom, D., Cochet-Escartin, O., Zhang, S., Khuu, C., Collins, E. M. S. Freshwater planarians as an alternative animal model for neurotoxicology. Toxicological Sciences. 147, 270-285 (2015).
- Zhang, S., Hagstrom, D., Hayes, P., Graham, A., Collins, E. M. S. Multi-behavioral endpoint testing of an 87-chemical compound library in freshwater planarians. Toxicological Sciences. , 26-44 (2019).
- Zhang, S., Hagstrom, D., Siper, N., Behl, M., Collins, E. M. S. Screening for neurotoxic potential of 15 flame retardants using freshwater planarians. Neurotoxicology and Teratology. 73, 54-66 (2019).
- Wu, J. P., Li, M. H. The use of freshwater planarians in environmental toxicology studies: Advantages and potential. Ecotoxicology and Environmental Safety. 161, 45-56 (2018).
- Rompolas, P., Azimzadeh, J., Marshall, W. F., King, S. M. Analysis of ciliary assembly and function in planaria. Methods in Enzymology. 525, 245-264 (2013).
- Sabry, Z., et al. Pharmacological or genetic targeting of Transient Receptor Potential (TRP) channels can disrupt the planarian escape response. PLoS One. , 753244(2019).
- Cochet-Escartin, O., Carter, J. A., Chakraverti-Wuerthwein, M., Sinha, J., Collins, E. M. S. Slo1 regulates ethanol-induced scrunching in freshwater planarians. Physical Biology. 13, 1-12 (2016).
- Hagstrom, D., Truong, L., Zhang, S., Tanguay, R. L., Collins, E. M. S., et al. Comparative analysis of zebrafish and planarian model systems for developmental neurotoxicity screens using an 87-compound library. Toxicological Sciences. , (2019).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Akiyama, Y., Agata, K., Inoue, T. Spontaneous Behaviors and Wall-Curvature Lead to Apparent Wall Preference in Planarian. PLoS One. 10, 0142214(2015).
- Paskin, T. R., Jellies, J., Bacher, J., Beane, W. S. Planarian Phototactic Assay Reveals Differential Behavioral Responses Based on Wavelength. PLoS One. 9, 114708(2014).
- Petrus, M., et al. A role of TRPA1 in mechanical hyperalgesia is revealed by pharmacological inhibition. Molecular Pain. 3, 40(2007).
- Takano, T., et al. Regeneration-dependent conditional gene knockdown (Readyknock) in planarian: Demonstration of requirement for Djsnap-25 expression in the brain for negative phototactic behavior. Development, Growth & Differentiation. 49, 383-394 (2007).
- Nishimura, K., et al. Identification of glutamic acid decarboxylase gene and distribution of GABAergic nervous system in the planarian Dugesia japonica. Neuroscience. 153, 1103-1114 (2008).
- Inoue, T., Yamashita, T., Agata, K. Thermosensory signaling by TRPM is processed by brain serotonergic neurons to produce planarian thermotaxis. Journal of Neuroscience. 34, 15701-15714 (2014).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados