É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolamento escalável e purificação de vesículas extracelulares de Escherichia coli e outras bactérias
Neste Artigo
Resumo
As bactérias secretam vesículas extracelulares (EVs) de tamanho nanométrico que transportam moléculas biológicas bioativas. A pesquisa EV se concentra na compreensão de sua biogênese, papel nas interações micróbio-micróbio e hospedeiro-micróbio e doença, bem como suas potenciais aplicações terapêuticas. Um fluxo de trabalho para isolamento escalável de EVs de várias bactérias é apresentado para facilitar a padronização da pesquisa de EV.
Resumo
Diversas espécies bacterianas secretam ~20-300 nm de vesículas extracelulares (EVs), compostas de lipídios, proteínas, ácidos nucleicos, glicanos e outras moléculas derivadas das células parentais. Os EVs funcionam como vetores de comunicação intra e interespécies, ao mesmo tempo em que contribuem para a interação entre bactérias e organismos hospedeiros no contexto de infecção e colonização. Dada a multiplicidade de funções atribuídas aos EVs na saúde e na doença, há um interesse crescente em isolar EVs para estudos in vitro e in vivo. Hipotetizou-se que a separação dos EVs com base em propriedades físicas, ou seja, tamanho, facilitaria o isolamento de vesículas de diversas culturas bacterianas.
O fluxo de trabalho de isolamento consiste em centrifugação, filtração, ultrafiltração e cromatografia de exclusão de tamanho (SEC) para o isolamento de EVs de culturas bacterianas. Uma etapa de filtragem de fluxo tangencial (TFF) acionada por bomba foi incorporada para melhorar a escalabilidade, permitindo o isolamento do material de litros de cultura de células iniciais. Escherichia coli foi utilizada como um sistema modelo que expressa nanoluciferase associada a EV e mCherry não associada a EV como proteínas repórteres. A nanoluciferase foi direcionada aos EVs pela fusão de seu N-terminal com a citolisina A. Frações de cromatografia inicial contendo EVs de 20-100 nm com citolisina A associada - nanoLuc foram distintas das frações posteriores contendo as proteínas livres. A presença de nanoluciferase associada à EV foi confirmada por marcação imunodourada e microscopia eletrônica de transmissão. Este fluxo de trabalho de isolamento EV é aplicável a outras espécies bacterianas gram-negativas e gram-positivas associadas ao intestino humano. Em conclusão, a combinação de centrifugação, filtração, ultrafiltração/TFF e SEC permite o isolamento escalável de EVs de diversas espécies bacterianas. Empregar um fluxo de trabalho de isolamento padronizado facilitará estudos comparativos de EVs microbianos entre espécies.
Introdução
As vesículas extracelulares (EVs) são estruturas do tamanho nanométrico, semelhantes a lipossomas, compostas por lipídios, proteínas, glicanos e ácidos nucleicos, secretadas por células procarióticas e eucarióticas1. Desde os primeiros estudos que visualizaram a liberação de EVs de bactérias gram-negativas2, o número de funções biológicas atribuídas a EVs bacterianas (20-300 nm de diâmetro) tem crescido constantemente nas últimas décadas. Suas funções incluem transferência de resistência a antibióticos3, formação de biofilme4, detecção de quórum5 e entrega de toxinas6. Há também um interesse crescente no uso de EVs bacterianos como terapêutica, especialmente em vacinologia7 e terapia do câncer8.
Apesar do crescente interesse na pesquisa de VE, ainda existem desafios técnicos em relação aos métodos de isolamento. Especificamente, há uma necessidade de métodos de isolamento que sejam reprodutíveis, escaláveis e compatíveis com diversos organismos produtores de EV. Para criar um conjunto unificado de princípios para o planejamento e relato de isolamento de EV e métodos de pesquisa, a Sociedade Internacional de Vesículas Extracelulares publica e atualiza o documento de posição MISEV9. Além disso, o consórcio EV-TRACK fornece uma plataforma aberta para relatar metodologias detalhadas para o isolamento de EV usadas em manuscritos publicados para aumentar a transparência10.
Neste protocolo, metodologias anteriores utilizadas para o isolamento de EVs da cultura de células de mamíferos foram adaptadas11,12 para permitir o isolamento de EVs da cultura de células bacterianas. Procuramos empregar métodos que permitam o isolamento de EV de uma variedade de micróbios, que podem ser escaláveis, e equilibrar a pureza e o rendimento do EV (conforme discutido no documentode posição MISEV 9). Após a remoção de células bacterianas e detritos por centrifugação e filtração, o meio de cultura é concentrado por ultrafiltração por dispositivo centrífugo (para um volume de até ~100 mL) ou TFF acionado por bomba (para volumes maiores). Os EVs são então isolados pela SEC usando colunas otimizadas para a purificação de pequenos EVs.
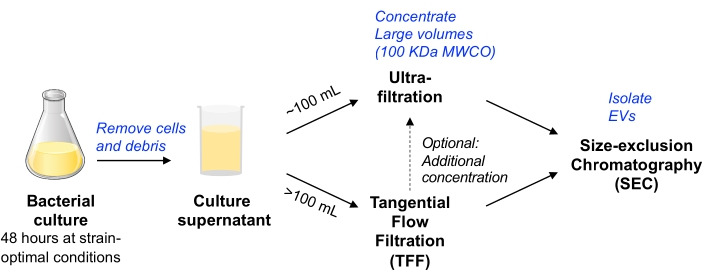
Figura 1: Visão geral esquemática do fluxo de trabalho de isolamento de EV bacteriano. Abreviaturas: EV = vesícula extracelular; TFF = filtração de fluxo tangencial; SEC = cromatografia de exclusão de tamanho; MWCO = ponto de corte do peso molecular. Por favor, clique aqui para ver uma versão maior desta figura.
Uma cepa comensal de camundongo de Escherichia coli (isto é, E. coli MP113) foi utilizada como organismo modelo e modificada para expressar nanoluciferase associada a EV por fusão com citolisina A, conforme relatado anteriormente14. Os métodos utilizados aqui podem processar pelo menos até vários litros de culturas bacterianas e efetivamente separar as proteínas associadas ao EV das proteínas não associadas ao EV. Finalmente, este método também pode ser usado para outras espécies bacterianas gram-positivas e gram-negativas. Todos os dados relevantes dos experimentos relatados foram submetidos à base de conhecimento EV-TRACK (EV-TRACK ID: EV210211)10.
Protocolo
NOTA: Garantir que todo o trabalho que envolva bactérias e ADN recombinante siga as melhores práticas de contenção de biossegurança adequadas ao nível de risco de biossegurança de cada estirpe. O trabalho deve ser feito de acordo com os regulamentos de biossegurança locais, nacionais e internacionais.
1. Estirpes bacterianas e condições de cultura
NOTA: As cepas bacterianas utilizadas neste estudo foram Escherichia coli MP113, Akkermansia mucinophila, Bacteroides thetaiotaomicron, Bifidobacterium breve e Bifidobacterium dentium.
- Para E. coli, usar uma alça estéril para inocular colônias individuais em 250 a 1.000 mL de caldo de Luria-Bertani (LB) e incubar aerobicamente em uma incubadora de agitação a 300 rpm e 37 °C por 48 h antes de processar a cultura. Para a cepa recombinante de E. coli MP1 que abriga p114-mCherry-Clyluc (Método Suplementar e Figura Suplementar S1), adicionar cloranfenicol ao ágar LB e caldo a uma concentração final de 17 μg/mL.
- Para A. mucinophila, B. thetaiotaomicron, B. breve e B. dentium, listrar em placas de ágar de infusão cardíaca cerebral (BHI) e incubar anaerobicamente dentro de uma câmara anaeróbia de vinil. Inocular colônias individuais em 100 mL de caldo de BHI pré-reduzido e incubar por 48 h anaerobicamente.
2. Isolamento do EV
- Meio de cultura bacteriana clarificante por centrifugação e filtração
- Transfira as culturas de células bacterianas inoculadas na etapa 1 para limpar frascos de centrífuga de polipropileno de 250 mL ou 500 mL derramando. Centrifugar as garrafas em um rotor de grande capacidade e ângulo fixo a 4 °C e 5.000 × g por 15 min. Transfira o sobrenadante para limpar frascos de centrífuga por meio de um derramamento cuidadoso e centrifugar novamente a 10.000 × g por 15 min.
NOTA: Reutilize os frascos após limpeza e descontaminação adequadas à biossegurança.- Se grandes pellets de células bacterianas estiverem presentes após a segunda centrifugação, repita a centrifugação em um frasco limpo para remover ainda mais as células.
- Transfira o sobrenadante para um dispositivo de filtro acionado a vácuo de polietersulfona de 0,22 μm de tamanho apropriado derramando. Filtre conectando o dispositivo de filtragem a uma fonte de parede de vácuo. Se a taxa de filtragem cair significativamente, basta mover qualquer material não filtrado para um novo dispositivo. Armazene o meio filtrado a 4 °C durante a noite e continue o protocolo no dia seguinte, se desejar.
NOTA: As centrifugações acima normalmente permitem o processamento de ~2x o volume indicado de cultura celular através de cada dispositivo. Por exemplo, um único dispositivo de filtro de 500 mL poderia filtrar ~1.000 mL de cultura pré-centrifugada. Esses dispositivos normalmente não são reutilizados. O uso de filtros de seringa nesta etapa não é recomendado sem otimização, pois perdas significativas foram observadas com os modelos testados. Este é um potencial ponto de parada. - Verificar a remoção completa das células viáveis neste ponto, espalhando uma alíquota do sobrenadante filtrado em placas de ágar adequadas e garantir a ausência de quaisquer colónias após a incubação em condições óptimas para a estirpe bacteriana. Se forem detectadas bactérias, otimize ainda mais o procedimento acima, realizando centrifugações e/ou filtrações adicionais.
- Transfira as culturas de células bacterianas inoculadas na etapa 1 para limpar frascos de centrífuga de polipropileno de 250 mL ou 500 mL derramando. Centrifugar as garrafas em um rotor de grande capacidade e ângulo fixo a 4 °C e 5.000 × g por 15 min. Transfira o sobrenadante para limpar frascos de centrífuga por meio de um derramamento cuidadoso e centrifugar novamente a 10.000 × g por 15 min.
- Concentração do meio filtrado
- Se trabalhar com volumes significativamente >100 ml, avance para o passo 2.2.2. Se trabalhar com volumes de ~100 mL, carregue 90 mL de meio de cultura filtrado no reservatório de um respectivo dispositivo de ultrafiltração centrífuga de corte de peso molecular (MWCO) de capacidade 100 kDa usando pipetas sorológicas. Sempre equilibre com um dispositivo de ultrafiltração correspondente e centrifugar no rotor da caçamba oscilante a 4 °C e 2.000 × g por intervalos de 15 a 30 minutos, até que o volume do meio no reservatório superior tenha sido concentrado em <0,5 mL.
- Encha o reservatório com qualquer meio de cultura filtrado restante. Se "recarregar", remova o fluxo na parte inferior do dispositivo e reequilibre todos os dispositivos.
NOTA: Observou-se que o volume máximo de meio de cultura filtrado que pode ser concentrado utilizando esses dispositivos é <2 vezes o volume recomendado. - Se a viscosidade do meio concentrado no reservatório estiver visivelmente aumentada (material escuro e viscoso), diluir com solução salina tamponada com fosfato (PBS) e reconcentrar por centrifugação para diluir quaisquer proteínas não-EV menores que o MWCO de 100 kDa.
Observação : este é um ponto de parada potencial. - Transfira o meio concentrado para um tubo de baixa ligação a proteínas, armazene a 4 °C durante a noite e continue o protocolo no dia seguinte, se desejar.
- Encha o reservatório com qualquer meio de cultura filtrado restante. Se "recarregar", remova o fluxo na parte inferior do dispositivo e reequilibre todos os dispositivos.
- Se estiver trabalhando com volumes significativamente >100 mL, selecione um dispositivo TFF de tamanho apropriado (100 kDa MWCO) para acomodar o volume a ser processado.
NOTA: Dispositivos de filtração para processamento de 100 mL a >1.000 mL estão disponíveis comercialmente. A disponibilidade, o custo e a compatibilidade locais com a bomba e a tubulação/conexões determinarão quais modelos específicos serão mais úteis. Até 2 L de meio de cultura foram processados com o dispositivo indicado na Tabela de Materiais antes de se precisar limpar o filtro (ver passo 2.3 abaixo para o protocolo de limpeza).- Monte um circuito de filtração com tubulação #16 de baixa ligação/baixa lixiviação, 1/8 de polegada de mangueira-barba para adaptadores Luer, o dispositivo TFF e uma bomba peristáltica, conforme indicado na Figura Suplementar S2.
NOTA: Realize TFF dentro de um gabinete de biossegurança para minimizar o risco de contaminação da preparação do EV com bactérias ambientais. - À temperatura ambiente, comece a circular o meio filtrado e condicionado a aproximadamente 200 mL/min (mínimo de 100 mL/min). Determinar o RPM apropriado correspondente à vazão desejada bombeando 200 mL de PBS para um recipiente graduado. Ao circular um meio filtrado e condicionado, recolher as moléculas <100 kDa que atravessam a membrana de ultrafiltração como resíduos num recipiente separado.
NOTA: O exemplo abaixo assumirá um volume inicial de 2 L de cultura. - Continue a circular o meio condicionado até que seu volume tenha sido reduzido para ~ 100-200 mL. Mude-se para embarcações menores, conforme necessário. Dilua 2 vezes com PBS e continue a circular com a bomba, concentrando-se até 75-100 mL. Diluir 2 vezes com PBS e continuar a circular até um volume final de 25 ml. Diluir 2 vezes com PBS e continuar a circular até <10 ml.
- Levante a tubulação de alimentação para fora do reservatório de amostra e continue a bombear para purgar o filtro e recuperar a quantidade máxima de amostra.
Observação : este é um ponto de parada potencial. - Transferir a amostra concentrada para um tubo cónico e conservar durante a noite a 4 °C, se assim o desejar. Como alternativa, continue com o protocolo.
- Mover a amostra concentrada para um dispositivo de ultrafiltração centrífuga MWCO de 15 mL com capacidade de 100 kDa. Centrífuga em um rotor de caçamba oscilante a 4 °C e 2.000 × g por intervalos de 15-30 min até que o volume do meio no reservatório superior tenha sido concentrado em <2 mL.
Observação : este é um ponto de parada potencial. - Transfira o meio concentrado para um tubo de baixa ligação a proteínas e armazene a 4 °C durante a noite, continuando o protocolo no dia seguinte, se desejado.
- Monte um circuito de filtração com tubulação #16 de baixa ligação/baixa lixiviação, 1/8 de polegada de mangueira-barba para adaptadores Luer, o dispositivo TFF e uma bomba peristáltica, conforme indicado na Figura Suplementar S2.
- Se trabalhar com volumes significativamente >100 ml, avance para o passo 2.2.2. Se trabalhar com volumes de ~100 mL, carregue 90 mL de meio de cultura filtrado no reservatório de um respectivo dispositivo de ultrafiltração centrífuga de corte de peso molecular (MWCO) de capacidade 100 kDa usando pipetas sorológicas. Sempre equilibre com um dispositivo de ultrafiltração correspondente e centrifugar no rotor da caçamba oscilante a 4 °C e 2.000 × g por intervalos de 15 a 30 minutos, até que o volume do meio no reservatório superior tenha sido concentrado em <0,5 mL.
- Limpeza do dispositivo TFF (opcional)
NOTA: A taxa de filtração diminui à medida que o dispositivo TFF começa a "entupir" durante o processo (incrustação). Se necessário, o dispositivo de filtro pode ser limpo para facilitar a filtração de amostras adicionais na mesma operação de purificação. Embora teoricamente possível, um filtro TFF limpo não foi usado para uma execução de purificação diferente para evitar a contaminação cruzada.- Para limpar, remova todos os tubos e tampas do dispositivo TFF e drene qualquer líquido residual.
- Use a bomba peristáltica e a tubulação para inundar os compartimentos interno e externo do dispositivo TFF (ou seja, através das portas paralelas e perpendiculares no modelo listado na Tabela de Materiais) com ~100 mL de água destilada. Remova todas as tubulações/tampas e drene o dispositivo TFF.
- Tampar as portas externas (perpendicular, filtrado) e circular 250 mL de etanol a 20% em água destilada a >200 mL/min por 10 min através do compartimento interno. Drene, inunde com água destilada e escorra novamente como acima.
- Circular 250 ml de solução fresca de NaOH 0,5 N durante 30 minutos através do compartimento interior e escorrar novamente.
- Reconecte todas as tubulações e tampas às portas de entrada, saída e filtrado, como na Figura Suplementar S2, e circule novamente a solução de NaOH 0,5 N até que um volume de NaOH > área de superfície do filtro de 1 mL/cm2 permeie através da membrana do filtro e seja coletado como filtrado/resíduo.
- Lave o dispositivo TFF com água destilada como acima. Use o dispositivo TFF imediatamente ou inunde o dispositivo com ~100 mL de etanol a 20% e armazene durante a noite a 4 °C.
NOTA: Se armazenado em etanol, certifique-se de drenar, enxaguar com água, drenar e circular 250 mL de PBS através do dispositivo até que um volume de >1 mL/cm2 de área de superfície do filtro permeie através da membrana do filtro e seja coletado como filtrado/resíduo para remover o etanol residual antes do processamento da amostra.
- Cromatografia de exclusão de tamanho (SEC)
NOTA: SEC é usado para aumentar a pureza dos EVs e remover proteínas não vesiculares.- Use uma pequena coluna SEC (volume de leito de 10 mL) para o isolamento de EVs de <100 mL de matéria-prima e uma coluna maior (volume de leito de 47 mL) para o isolamento de EVs de >100 mL de material de partida.
Observação : O exemplo abaixo listará volumes para a coluna maior, com volumes para a coluna menor entre parênteses. - Traga a coluna SEC e PBS à temperatura ambiente durante várias horas. Estabilize a coluna SEC em uma posição vertical usando um suporte e suporte de laboratório padrão. Alternativamente, use suportes de coluna de cromatografia comercial.
- Antes de se conectar à coluna SEC, hidrate o reservatório da amostra permitindo que 5 mL de PBS fluam através da frita e para um recipiente de resíduos. Desparafuse a tampa de entrada da coluna SEC, adicione 2 mL de PBS ao reservatório da amostra e conecte cuidadosamente o reservatório à coluna à medida que o PBS estiver escorrendo pela frita (não aplicável a pequenas colunas SEC).
NOTA: Esta etapa anterior evita que quaisquer bolhas de ar fiquem presas na parte superior da coluna SEC. Se o ar estiver preso, remova o reservatório, toque na coluna para retirar a bolha de ar e repita o procedimento de conexão. Para a coluna menor, basta destampar a parte superior da coluna SEC e anexar o funil de amostra. - Adicione 47 mL (10 mL) de PBS ao reservatório da amostra e destampe o fundo da coluna SEC. Permita que todo o buffer de amostra carregado flua através da coluna para equilíbrio. Descarte o fluxo.
- Carregue um máximo de 2 mL (0,5 mL) de amostra no reservatório da amostra, descarte o fluxo e permita que a amostra entre completamente na coluna.
- Adicionar imediatamente PBS ao reservatório ou funil da amostra a um volume de 14,25 ml menos o volume da amostra (3 ml menos o volume da amostra, para a coluna pequena). Deixe a solução fluir através da coluna e descarte essa quantidade igual ao volume vazio da coluna.
NOTA: Para uma amostra típica de 2 mL, a quantidade de PBS a ser adicionada ao reservatório ou funil da amostra será de 12,25 mL. - Posicione um microtubo de baixa ligação de 2 mL diretamente abaixo da coluna SEC. Adicione imediatamente 2 mL (0,5 mL) de PBS ao reservatório da amostra e deixe-o entrar na coluna. Rotule estes primeiros 2 mL (0,5 mL) de fluxo como Fração 1. Continue a adicionar 2 mL (0,5 mL) de cada vez ao reservatório da amostra para coletar cada fração subsequente.
NOTA: A maioria dos EVs bacterianos eluem nas primeiras 5 frações. Durante a otimização, as primeiras 12 frações foram coletadas. - Armazenar as fracções a 4 °C para armazenagem a curto prazo (dias) ou -80 °C para armazenagem a longo prazo.
- Limpeza e armazenamento das colunas SEC reutilizáveis
NOTA: As colunas SEC descritas neste protocolo podem ser reutilizadas até 5 vezes de acordo com o fabricante. Se a taxa de fluxo das colunas SEC diminuir após os usos de <5, o fabricante recomenda centrifugar as amostras concentradas a 10.000 x g por 10 minutos para limpar quaisquer agregados antes da SEC. Em seguida, carregue o sobrenadante dessa centrifugação na coluna SEC para isolamento de EV.- Para limpar e armazenar a coluna SEC após cada uso, adicione 2 mL (0,5 mL) de NaOH 0,5 M e deixe que ela entre completamente na coluna. Passe 100 mL (20 mL) de etanol a 20% pela coluna e armazene-o a 4 °C até o próximo uso. Antes do próximo uso, equilibre o etanol à temperatura ambiente como acima e troque-o pelo tampão PBS passando mais 150 mL (30 mL) de PBS através da coluna.
- Para limpar e reutilizar imediatamente a coluna SEC após cada uso, adicione 2 mL (0,5 mL) de NaOH 0,5 M e permita que ela entre completamente na coluna. Execute aproximadamente 150 mL (30 mL) de tampão PBS para lavar o NaOH. Quando o pH do eluato é igual ao PBS (~7), uma nova amostra pode ser carregada.
- Use uma pequena coluna SEC (volume de leito de 10 mL) para o isolamento de EVs de <100 mL de matéria-prima e uma coluna maior (volume de leito de 47 mL) para o isolamento de EVs de >100 mL de material de partida.
3. Controle de qualidade da preparação do EV
- Teste de esterilidade
NOTA: Como esses EVs vêm de culturas bacterianas, é fundamental garantir a esterilidade antes do uso a jusante.- Obter 100 μL (20 μL) das frações a serem utilizadas nos ensaios e inocular 3 mL do meio utilizado para o cultivo das bactérias de origem. Cultivar sob as respectivas condições ótimas por pelo menos 3 dias e observar a turbidez. Alternativamente, aplique as amostras de fração em placas de ágar contendo o meio usado para cultivar as bactérias produtoras e procure a formação de colônias.
NOTA: Se a contaminação bacteriana for detectada, não é recomendado o uso da preparação EV para experimentação. Em vez disso, repita o isolamento, tomando cuidado para minimizar o risco de contaminação bacteriana (a) realizando centrifugação/filtração suficiente do meio de cultura de células bacterianas condicionadas, (b) usando frascos limpos, tubos, filtros e colunas de cromatografia e (c) empregando técnicas assépticas apropriadas.
- Obter 100 μL (20 μL) das frações a serem utilizadas nos ensaios e inocular 3 mL do meio utilizado para o cultivo das bactérias de origem. Cultivar sob as respectivas condições ótimas por pelo menos 3 dias e observar a turbidez. Alternativamente, aplique as amostras de fração em placas de ágar contendo o meio usado para cultivar as bactérias produtoras e procure a formação de colônias.
- Quantificação de proteínas
NOTA: Foi utilizado um kit de quantificação de proteínas à base de fluorescência de alta sensibilidade (ver Tabela de Materiais). O kit funciona com um fluorímetro proprietário correspondente em comprimentos de onda de excitação/emissão de 485/590 nm.- Leve todos os reagentes, padrões e amostras à temperatura ambiente.
- Preparar uma mistura mestra de reagente proteico e tampão adicionando 1 μL do reagente a 199 μL de tampão para cada amostra e padrão a ser ensaiado. Usando tubos de PCR de 0,5 mL de paredes finas, adicione 10 μL padrão + 190 μL de mistura mestra a cada tubo padrão.
NOTA: Para estar dentro do intervalo do ensaio, a quantidade de cada fracção a adicionar a cada tubo de amostra depende do rendimento proteico esperado da purificação. Tipicamente, foram utilizados 5 μL de cada fração + 195 μL de master mix. O volume final de amostra + mistura principal deve ser de 200 μL. - Vórtice os tubos de ensaio e incube por pelo menos 15 minutos à temperatura ambiente no escuro.
- Meça os padrões no fluorímetro proprietário apropriado (consulte a Tabela de Materiais) selecionando a opção Ensaio de proteína usando os botões de seta e pressionando o botão GO para confirmar. Siga as instruções na tela, inserindo cada tubo padrão e pressionando GO.
- Inserir o tubo de amostra experimental; pressione GO para ler; e observe o resultado exibido, que é a concentração real de proteína na mistura tampão de ensaio/amostra. Para obter a concentração de proteína na amostra, use as teclas de seta para selecionar a opção Calcular concentração da amostra, pressione GO e use as teclas de seta para selecionar o volume da amostra adicionado ao buffer de ensaio para a amostra fornecida. Pressione GO e registre a concentração de proteína da amostra. Repita esta etapa para cada amostra a ser analisada.
- Contagem de partículas e distribuição de tamanho
NOTA: O sensor de pulso resistivo microfluídico (MRPS) foi utilizado para quantificar a concentração de EV e a distribuição de tamanho.- Diluir as amostras em PBS suplementado com Tween-20 a 1% que tenha sido filtrado através de um filtro de seringa de 0,02 μm até uma concentração de proteína de aproximadamente 0,1 μg/mL.
NOTA: O objetivo da diluição é atingir uma concentração de partículas esperada na faixa de 10a 10 partículas/mL em frações contendo EV. A diluição ideal pode precisar ser determinada empiricamente. Poucos EVs são esperados para frações posteriores (além da Fração 6). Assim, a concentração de partículas provavelmente será de <10a 10 partículas/mL, apesar de analisar em baixas diluições. - Carregue 3 μL de cada amostra no cartucho microfluídico descartável com uma micropipeta, insira o cartucho no instrumento MRPS e pressione o botão de metal com um aro azul iluminado.
- Clique em Go! no software de aquisição e aguarde que a amostra seja analisada pelo instrumento. Adquira de 1.000 a 10.000 eventos de partículas para minimizar o erro estatístico técnico de análise. Neste ponto, clique em Parar e Terminar Execução para concluir a aquisição de exemplo.
NOTA: Juntamente com os arquivos de dados brutos, o instrumento produz uma planilha de resumo listando a concentração de partículas na amostra. Correctar este valor de acordo com a diluição da amostra efectuada. - Usando software de análise, carregue os dados brutos e gere gráficos personalizados de distribuição de tamanho.
- Diluir as amostras em PBS suplementado com Tween-20 a 1% que tenha sido filtrado através de um filtro de seringa de 0,02 μm até uma concentração de proteína de aproximadamente 0,1 μg/mL.
4. Armazenamento EV
- Aliquotar fracções individuais ou agrupadas a 25-50% do tamanho da fracção individual (dependendo do tamanho da coluna utilizada) em tubos de baixa ligação às proteínas e conservar a -80 °C para evitar ciclos de congelamento-descongelamento.
NOTA: Aplicações diferentes podem exigir alíquotas menores ou maiores, dependendo da quantidade esperada utilizada em cada experimento. Isso precisará ser determinado empiricamente. As frações não contendo EV podem ser descartadas se não forem aplicáveis aos objetivos da pesquisa.
5. Microscopia eletrônica de transmissão
- Coloração negativa
- Adicionar 5 μL da amostra EV à grelha de malha de cobre revestida de carbono 400 e incubar à temperatura ambiente durante 10 minutos. Lavar o lado do provete com 5 gotas de tampão Tris de 5 mM (pH 7,1) e, em seguida, com 5 gotas de água destilada.
- Lado da mancha do espécime com 5 gotas de acetato de uranila a 2%. Limpe qualquer quantidade extra de mancha com papel de filtro e permita que a grade seque completamente por várias horas ou durante a noite. Visualize os espécimes com um microscópio eletrônico operado a 80 kV.
- Rotulagem Immunogold
- Aplicar 10 μL da suspensão EV numa grelha de malha formvar/carbono 400 e incubar à temperatura ambiente durante 1 h. Lave a grade em PBS três vezes e, em seguida, aplique 4% de paraformaldeído por 10 min para fixar a amostra. Lave as grades cinco vezes com PBS.
- Bloquear a grade com três lavagens de PBS contendo albumina sérica bovina (BSA) a 0,1%. Em seguida, aplique 10 μL de um anticorpo primário por 40 min à temperatura ambiente (aqui, 1 μg/mL de anticorpo nluc). Lave novamente três vezes com PBS contendo 0,1% de BSA.
- Adicione 10 μL de anticorpo secundário marcado com ouro à grelha e incube durante 40 minutos à temperatura ambiente. Lave as grades três vezes com PBS.
NOTA: Aqui, um anticorpo anti-rato de cabra conjugado com nanopartículas de ouro de 10 nm foi utilizado após diluição de 1:10 em tampão de bloqueio. Se a marcação de ouro obscurecer a visualização de EV, anticorpos secundários com nanopartículas de ouro menores (por exemplo, 5 nm) podem ser usados. - Pós-fixe a grade com 10 μL de glutaraldeído a 2,5% por 10 min à temperatura ambiente. Lave três vezes em PBS. Realizar coloração negativa com acetato de uranila a 2% (10 μL) por 15 min. Incorporar as amostras em 10 μL de acetato de uranilo a 0,5% e solução de metilcelulose a 0,13% por 10 min.
- Permita que as grades da amostra sequem durante a noite à temperatura ambiente antes da imagem no microscópio eletrônico.
- No software de aquisição do microscópio, determine a exposição empiricamente para obter a qualidade ideal da imagem (por exemplo, 0,80851 s nesta configuração específica) e ajuste-a digitando esse valor na caixa de opção de tempo de exposição . Selecione a opção de 80 kV e clique em Iniciar aquisição para capturar a imagem.
Resultados
Para avaliar quais frações de cromatografia SEC foram enriquecidas para EVs, a coluna SEC foi carregada com 2 mL de meio de cultura condicionado por E. coli MP1 que havia sido concentrado 1.000 vezes por TFF, e frações sequenciais foram coletadas. Utilizando MRPS, verificou-se que as frações 1-6 continham a maioria dos EVs (Figura 2A). As frações subsequentes continham muito poucos EVs, compreendendo em vez de proteínas livres de EV (Figura 2B)...
Discussão
No protocolo acima, é descrito um método que é escalável e isola de forma confiável os EVs de várias bactérias gram-negativas/positivas e aeróbicas/anaeróbias. Tem vários pontos de parada potenciais ao longo do procedimento, embora seja melhor evitar levar mais de 48 h para isolar os EVs dos meios de cultura bacteriana condicionados.
Primeiro, consiste em cultivar bactérias para gerar meio de cultura bacteriana condicionado. Verificou-se que aumentar o tempo de cultura para pelo men...
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
A pesquisa descrita acima foi apoiada pela bolsa de treinamento NIH TL1 TR002549-03. Agradecemos aos Drs. John C. Tilton e Zachary Troyer (Case Western Reserve University) por facilitarem o acesso ao instrumento analisador de tamanho de partícula; Lew Brown (Spectradyne) para assistência técnica com análise dos dados de distribuição de tamanho de partícula; Dr. David Putnam na Universidade de Cornell por fornecer plasmídeo pClyA-GFP14; e o Dr. Mark Goulian da Universidade da Pensilvânia por nos fornecer a E. coli MP113.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.5 mL flat cap, thin-walled PCR tubes | Thermo Scientific | 3430 | it is important to use thin-walled PCR tubes to obtain accurate readings with Qubit |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | Electron microscopy sciences | 15700 | |
| 250 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1495 | |
| 500 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1493 | |
| 65 mm Polypropylene Round-Bottom/Conical Bottle Adapter | Beckman Coulter | 392077 | Allows Vivacell to fit in rotor |
| Akkermansia mucinophila | ATCC | BAA-835 | |
| Amicon-15 (100 kDa MWCO) | MilliporeSigma | UFC910024 | |
| Avanti J-20 XPI centrifuge | Beckman Coulter | No longer sold by Beckman. Avanti J-26XP is closest contemporary model. | |
| Bacteroides thetaiotaomicron VPI 5482 | ATCC | 29148 | |
| Bifidobacterium breve | NCIMB | B8807 | |
| Bifidobacterium dentium | ATCC | 27678 | |
| Brain Heart infusion (BHI) broth | Himedia | M2101 | After autoclaving, Both BHI broth and agar were introduced into the anaerobic chamber, supplemented with Menadione (1 µg/L), hematin (1.2 µg/L), and L-Cysteine Hydrochloride (0.05%). They were then incubated for at least 24 h under anaerobic conditions before inoculation with the anaerobic bacterial strains. |
| C-300 microfluidics cartridge | Spectradyne | ||
| Chloramphenicol | MP Biomedicals | ICN19032105 | |
| Electron microscope | FEI company | Tecnai G2 SpiritBT | |
| Escherichia coli HST08 (Steller competent cells) | Takara | 636763 | |
| Escherichia coli MP1 | Dr. Mark Goulian (gift) | commensal bacteria derived from mouse gut | |
| Fiberlite 500 mL to 250 mL adapter | ThermoFisher | 010-0151-05 | used with Fiberlite rotor to enable 250 mL bottles to be used for smaller size of starting bacterial culture |
| Fiberlite fixed-angle centrifuge rotor | ThermoFisher | F12-6x500-LEX | fits 6 x 500 mL bottles |
| Formvar Carbon Film 400 Mesh, Copper | Electron microscopy sciences | FCF-400-CU | |
| Glutaraldehyde (EM-grade, 10% aqeous solution) | Electron microscopy sciences | 16100 | |
| Hematin | ChemCruz | 207729B | Stock solution was made in 0.2 M L-histidine solution as 1.2 mg/mL |
| Infinite M Nano+ Microplate reader | Tecan | This equibment was used to measure the mCherry fluorescence | |
| In-Fusion HD Cloning Plus | Takara | 638909 | For cloning of the PCR fragements into the PCR-lineraized vectors |
| JS-5.3 AllSpin Swinging-Bucket Rotor | Beckman Coulter | 368690 | |
| Lauria Bertani (LB) broth, Miller | Difco | 244620 | |
| L-Cysteine Hydrochloride | J.T. Baker | 2071-05 | It should be weighed and added directly to the autoclaved BHI media inside the anaerobic chamber |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer - special | HV-30800-08 | connection adapters for filtration tubing circuit |
| Masterflex Fitting, Polypropylene, Straight, Male Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer - special | HV-30800-24 | connection adapters for filtration tubing circuit |
| Masterflex L/S Analog Variable-Speed Console Drive, 20 to 600 rpm | Masterflex | HV-07555-00 | |
| Masterflex L/S Easy-Load Head for Precision Tubing, 4-Roller, PARA Housing, SS Rotor | Masterflex | EW-07514-10 | |
| Masterflex L/S Precision Pump Tubing, PharmaPure, L/S 16; 25 ft | Cole Palmer | EW-06435-16 | low-binding/low-leaching tubing |
| Menadione (Vitamin K3) | MP | 102259 | Stock solution was made in ethanol as 1 mg/mL |
| MIDIKROS 41.5CM 100K MPES 0.5MM FLL X FLL 1/PK | Repligen | D04-E100-05-N | TFF device we have used to filter up to 2 L of E. coli culture supernatant |
| Nano-Glo Luciferase Assay System | Promega | N1110 | This assay kit was used to measure the luminescence of the nluc reporter protein |
| NanoLuc (Nluc) Luciferase Antibody, clone 965808 | R&D Systems | MAB10026 | |
| nCS1 microfluidics resistive pulse sensing instrument | Spectradyne | ||
| nCS1 Viewer | Spectradyne | Analysis software for particle size distribution | |
| OneTaq 2x Master Mix with Standard Buffer | NEB | M0482 | DNA polymerase master mix used to perform the routine PCR reactions for colony checking |
| Protein LoBind, 2.0 mL, PCR clean tubes | Eppendorf | 30108450 | |
| Q5 High-Fidelity 2x Master Mix | NEB | M0492 | DNA polymerase master mix used to perform the PCR reactions needed for cloning |
| qEV original, 35 nm | Izon | maximal loading volume of 0.5 mL | |
| qEV rack | Izon | for use with the qEV-original SEC columns | |
| qEV-2, 35 nm | Izon | maximal loading volume of 2 mL | |
| Qubit fluorometer | ThermoFisher | Item no longer available. Closest available product is Qubit 4.0 Fluorometer (cat. No. Q33238) | |
| Qubit protein assay kit | ThermoFisher | Q33211 | Store kit at room temperature. Standards are stored at 4 °C. |
| Sorvall Lynx 4000 centrifuge | ThermoFisher | 75006580 | |
| SpectraMax i3x Microplate reader | Molecular Devices | This equipment was used to measure the nanoluciferase bioluminescence | |
| Stericup Quick-release-GP Sterile Vacuum Filtration system (150, 250, or 500 mL) | MilliporeSigma | S2GPU01RE S2GPU02RE S2GPU05RE | One or multiple filters can be used to accommodate working volumes. In our experience, you can filter twice the volume listed on the product size. |
| Uranyl acetate | Electron microscopy sciences | 22400 | |
| Vinyl anaerobic chamber | Coy Lab | ||
| Vivacell 100, 100,000 MWCO PES | Sartorius | VC1042 | |
| Whatman Anotop 10 Plus syringe filters (0.02 micron) | MilliporeSigma | WHA68093002 | to filter MRPS diluent |
Referências
- Yanez-Mo, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Chatterjee, S. N., Das, J. Electron microscopic observations on the excretion of cell-wall material by Vibrio cholerae. Journal of General Microbiology. 49 (1), 1-11 (1967).
- Ciofu, O., Beveridge, T. J., Kadurugamuwa, J., Walther-Rasmussen, J., Hoiby, N. Chromosomal beta-lactamase is packaged into membrane vesicles and secreted from Pseudomonas aeruginosa. Journal of Antimicrobial Chemotherapy. 45 (1), 9-13 (2000).
- Yonezawa, H., et al. Outer membrane vesicles of Helicobacter pylori TK1402 are involved in biofilm formation. BMC Microbiology. 9, 197 (2009).
- Mashburn, L. M., Whiteley, M. Membrane vesicles traffic signals and facilitate group activities in a prokaryote. Nature. 437 (7057), 422-425 (2005).
- Kato, S., Kowashi, Y., Demuth, D. R. Outer membrane-like vesicles secreted by Actinobacillus actinomycetemcomitans are enriched in leukotoxin. Microbial Pathogenesis. 32 (1), 1-13 (2002).
- Petousis-Harris, H., et al. Effectiveness of a group B outer membrane vesicle meningococcal vaccine against gonorrhoea in New Zealand: a retrospective case-control study. Lancet. 390 (10102), 1603-1610 (2017).
- Kim, O. Y., et al. Bacterial outer membrane vesicles suppress tumor by interferon-gamma-mediated antitumor response. Nature Communications. 8 (1), 626 (2017).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Consortium, E. -. T., et al. EV-TRACK: transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
- Watson, D. C., et al. Efficient production and enhanced tumor delivery of engineered extracellular vesicles. Biomaterials. 105, 195-205 (2016).
- Watson, D. C., et al. Scalable, cGMP-compatible purification of extracellular vesicles carrying bioactive human heterodimeric IL-15/lactadherin complexes. Journal of Extracellular Vesicles. 7 (1), 1442088 (2018).
- Lasaro, M., et al. Escherichia coli isolate for studying colonization of the mouse intestine and its application to two-component signaling knockouts. Journal of Bacteriology. 196 (9), 1723-1732 (2014).
- Kim, J. Y., et al. Engineered bacterial outer membrane vesicles with enhanced functionality. Journal of Molecular Biology. 380 (1), 51-66 (2008).
- Beveridge, T. J. Structures of gram-negative cell walls and their derived membrane vesicles. Journal of Bacteriology. 181 (16), 4725-4733 (1999).
- Reimer, S. L., et al. Comparative analysis of outer membrane vesicle isolation methods with an Escherichia coli tolA mutant reveals a hypervesiculating phenotype with outer-inner membrane vesicle content. Frontiers in Microbiology. 12, 628801 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados