É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um modelo de dano peritoneal induzido por gluconato de clorexidina em camundongos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O presente protocolo estabelece um modelo de diálise peritoneal (DP) em camundongos de fibrose peritoneal induzida por gluconato de clorexidina (GC). O modelo atual é simples e fácil de usar em comparação com outros modelos animais de DP.
Resumo
A fibrose peritoneal é uma importante complicação da diálise peritoneal (DP). Para investigar e resolver esse problema, um modelo animal apropriado de DP é necessário. O presente protocolo estabelece um modelo de fibrose peritoneal induzida por gluconato de clorexidina (GC) que mimetiza a condição de um paciente com DP. A fibrose peritoneal foi induzida pela injeção intraperitoneal de 0,1% de GC em etanol a 15% por 3 semanas (administrada em dias alternados), totalizando nove vezes em camundongos C57BL/6 machos. Os testes funcionais peritoneais foram então realizados no 22º dia. Após o sacrifício dos camundongos, o peritônio parietal da parede abdominal e o peritônio visceral do fígado foram retirados. Eles eram mais espessos e fibróticos quando analisados microscopicamente após a coloração tricrômico de Masson. A taxa de ultrafiltração diminuiu, e o transporte de massa de glicose indicou um aumento da permeabilidade peritoneal induzido por CG. O modelo de DP assim estabelecido pode ter aplicações no aprimoramento da tecnologia de DP, eficácia dialítica e prolongamento da sobrevida dos pacientes.
Introdução
A diálise peritoneal (DP) é um tipo de terapia renal substitutiva. No entanto, a DP tem problemas que não podem ser resolvidos. Por exemplo, o tratamento prolongado da DP pode causar dano peritoneal, eventualmente levando à falha da ultrafiltração e à suspensão do tratamento 1,2,3,4,5,6. A fibrose peritoneal é uma das complicações maisgraves7,8. A fibrose peritoneal é caracterizada pela deposição e acúmulo de matriz extracelular no interstício, neoangiogênese e vasculopatia do peritônio9,10.
As principais causas dessas alterações peritoneais são as peritonites recorrentes e a não biocompatibilidade do dialisato, que são hiperosmóticas, glicose elevada, pH baixo e acúmulo de produtos da degradação da glicose11,12. Portanto, modelos experimentais animais adequados podem ajudar os pesquisadores a estudar melhor as alterações fisiológicas e patológicas do peritônio durante a terapia da DP. Portanto, o estabelecimento de um modelo animal de DP é importante para melhorar a tecnologia de DP e a eficácia dialítica e prolongar a sobrevida dos pacientes. Este estudo teve como objetivo gerar um modelo de DP em camundongos por injeção intraperitoneal (i.p.) de gluconato de clorexidina (CG), conforme descrito anteriormente13,14. Este modelo de camundongo PD é simples, fácil de usar e viável em comparação com outros modelos animais PD.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos os experimentos com camundongos foram aprovados pelo Laboratory Animal Center do E-DA Hospital/ I-Shou University e manuseados de acordo com o "Guide for the Care and Use of Laboratory Animals" (NRC, EUA 2011). Camundongos C57BL/6 machos, com 7-8 semanas de idade, foram utilizados para o presente estudo.
1. Preparação química
- Preparar o irritante químico diluindo gluconato de clorexidina a 0,1% (CG, ver Tabela de Materiais) em etanol a 15%.
2. Tratamento dos animais
- Atribua três ratos como grupo de controle. Realizar injeção intraperitoneal (i.p.) de 1 mL/kg de solução fisiológica (SF) a 0,9% em dias alternados por 3 semanas, totalizando nove vezes.
- Atribua três camundongos ao grupo de fibrose peritoneal. Induzir fibrose peritoneal usando gluconato de clorexidina (GC) administrando injeções i.p. de 0,1% de GC em etanol a 15% (passo 1.1) na dose de 12,5 μL/g de peso corporal. Realize isso a cada dois dias por 3 semanas, por um total de nove vezes.
3. Testes de função peritoneal (teste de equilíbrio peritoneal modificado)
- Preparar uma solução de diálise contendo 4,25% de glicose. Extrair 0,5 ml de amostra de dialisato com uma seringa e, em seguida, verificar a concentração de glicose na amostra de dialisato.
NOTA: A concentração de glicose é determinada de acordo com o método hexoquinase/G6PD. As amostras de dialisato foram acessadas para o ensaio de Glu 2 do tipo L e investigadas com um analisador bioquímico (ver Tabela de Materiais). Esta é a concentração inicial de glicose do dialisato. - Anestesiar os ratinhos por injeção intramuscular de Zoletil e Xilazina (preparados numa proporção de 1:2 por volume, ver Tabela de Materiais) na dose de 20 μL/20 gw. Além disso, use pomada veterinária nos olhos para evitar o ressecamento sob anestesia.
- Realizar instilação i.p. da solução de diálise (2 mL/20 g de peso corporal).
- Após 30 min, avaliar e verificar a profundidade da anestesia com ausência do reflexo de pinça dos dedos. Em seguida, realizar uma incisão vertical na linha média do abdome (abaixo do processo xifoide), em seguida, abrir o abdome dos camundongos e coletar o líquido intraperitoneal com uma seringa (definido como "volume 1"). Em seguida, meça o peso de um algodão limpo e seco e coloque o algodão na cavidade abdominal dos camundongos para absorver o líquido intraperitoneal residual. Por fim, meça novamente o peso do algodão.
OBS: O ganho de peso do algodão é igual ao peso do líquido residual intraperitoneal. Em seguida, converta para o volume obtido (gravidade específica: 1 g/cm3; definido como "volume 2"). O volume final do dialisato é o volume 1 mais o volume 2. - Use 0,5 mL de amostra de dialisato (dialisato final) para medir a concentração de glicose. Esta é a concentração final de glicose do dialisato.
- Calcule a ultrafiltração líquida usando a fórmula15:
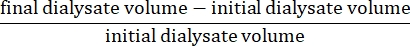
- Calcular a permeabilidade peritoneal utilizando a seguinte fórmula15:
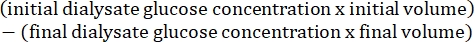
4. Preparo tecidual do músculo da parede abdominal e fígado e análise histológica
- Sacrificar os camundongos por punção cardíaca (flebotomia)3,16.
- Corte da parede abdominal (1 cm x 1 cm) e hepatectomia total. Fixe a parede abdominal e os tecidos hepáticos dos ratos durante a noite em formalina tamponada neutra a 10%.
- Preparar cortes de parafina de 3 μm de espessura do músculo da parede abdominal e do fígado e realizar análise histológica seguindo relato publicado anteriormente17.
- Avaliar o peritônio parietal da parede abdominal e o peritônio visceral das superfícies hepáticas dos camundongos utilizando morfometria18.
- Realizar análises estatísticas usando estatística e software gráfico (consulte Tabela de Materiais). Expresse todos os dados como média ± DP e analise a significância estatística usando um teste t19. Defina valores com P < 0,05 como resultados significativos.
Access restricted. Please log in or start a trial to view this content.
Resultados
Na Figura 1A,B, o peritônio parietal da parede abdominal era marcadamente mais espesso e fibrótico pela coloração tricrômico de Masson17, indicando que no grupo exposto ao GC a fibrose peritoneal é mais grave do que no grupo controle com solução salina (NS). Na Figura 2A,B, o peritônio visceral das superfícies hepáticas também era marcadamente mais espesso e fibrótico, comprovando que no grupo GC-exposto a fi...
Access restricted. Please log in or start a trial to view this content.
Discussão
Neste estudo, um modelo de DP em camundongos é apresentado por injeção i.p. de GC, e os resultados mostraram fibrose peritoneal e deterioração funcional neste modelo, o que mimetizou a condição do paciente em DP.
Há várias etapas críticas no protocolo. Primeiro, para a realização de uma injeção i.p. de GC ou NS, a pele da parede abdominal do camundongo deve ser captada com fórceps para evitar lesão intraperitoneal induzida por punção. Em segundo lugar, durante a coleta do per...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos sinceramente a Shin-Han Tseng pela discussão crítica e execução parcial do estudo. Este estudo foi apoiado por EDAHP110003 e NCKUEDA110002 da Fundação de Pesquisa do Hospital E-DA e da Universidade Nacional Cheng Kung, Taiwan.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.9% Normal Saline | Y F CHEMICAL CORP., New Taipei City, Taiwan | - | |
| 10% neutral buffered formalin | Taiwan Burnett International Co., Ltd., Taipei City, Taiwan | 00002A | |
| Automatic biochemical analyzer | Hitachi Ltd., Tokyo, Japan | Labospect Series 008 | for determining glucose concentration |
| Chlorhexidine digluconate solution, 20% in H2O | Sigma-Aldrich, MO, USA | C9394 | diluted to 0.1% with 15% ethanol for injection |
| Ethanol | Avantor Performance Materials, LLC, PA, USA | BAKR8006-05 | diluted to 15% with normal saline for working concentration |
| Glucose (Dianeal) | Baxter International, Inc., IL, USA | FNB9896 | Commercial dialysis solution (4.25%) |
| GraphPad Prism 8.0 | GraphPad Software, Inc., CA, US | ||
| L-type Glu 2 assay | FUJIFILM Wako, Japan | 461-32403 | |
| Xylazine 20 | Juily Pharmaceutical Co., Ltd., New Taipei City, Taiwan | - | |
| Zoletil 50 | Virbac Laboratories, Carros, France | - |
Referências
- Han, S. H., et al. Improving outcome of CAPD: twenty-five years' experience in a single Korean center. Peritoneal Dialysis International. 27 (4), 432-440 (2007).
- Kawaguchi, Y., Hasegawa, T., Nakayama, M., Kubo, H., Shigematu, T. Issues affecting the longevity of the continuous peritoneal dialysis therapy. Kidney International Supplements. 62, 105-107 (1997).
- Lee, Y. C., et al. Vitamin D can ameliorate chlorhexidine gluconate-induced peritoneal fibrosis and functional deterioration through the inhibition of epithelial-to-mesenchymal transition of mesothelial cells. BioMed Research International. 2015, 595030(2015).
- Nakamoto, H., Kawaguchi, Y., Suzuki, H. Is technique survival on peritoneal dialysis better in Japan. Peritoneal Dialysis International. 26 (2), 136-143 (2006).
- Schaefer, F., Klaus, G., Muller-Wiefel, D. E., Mehls, O. Current practice of peritoneal dialysis in children: results of a longitudinal survey. Mid European Pediatric Peritoneal Dialysis Study Group (MEPPS). Peritoneal Dialysis International. 19, Suppl 2 445-449 (1999).
- Woodrow, G., Turney, J. H., Brownjohn, A. M. Technique failure in peritoneal dialysis and its impact on patient survival. Peritoneal Dialysis International. 17 (4), 360-364 (1997).
- Schmidt, D. W., Flessner, M. F. Pathogenesis and treatment of encapsulating peritoneal sclerosis: basic and translational research. Peritoneal Dialysis International. 28, Suppl 5 10-15 (2008).
- Augustine, T., Brown, P. W., Davies, S. D., Summers, A. M., Wilkie, M. E. Encapsulating peritoneal sclerosis: clinical significance and implications. Nephron Clinical Practice. 111 (2), 149-154 (2009).
- Di Paolo, N., Nicolai, G. A., Garosi, G. The peritoneum: from histological studies to mesothelial transplant through animal experimentation. Peritoneal Dialysis International. 28, Suppl 5 5-9 (2008).
- Fusshoeller, A. Histomorphological and functional changes of the peritoneal membrane during long-term peritoneal dialysis. Pediatric Nephrology. 23 (1), 19-25 (2008).
- Goffin, E. Peritoneal membrane structural and functional changes during peritoneal dialysis. Seminars in Dialysis. 21 (3), 258-265 (2008).
- Ito, T., Yorioka, N. Peritoneal damage by peritoneal dialysis solutions. Clinical and Experimental Nephrology. 12 (4), 243-249 (2008).
- Io, K., et al. SAHA suppresses peritoneal fibrosis in mice. Peritoneal Dialysis International. 35 (3), 246-258 (2015).
- Yoh, K., Ojima, M., Takahashi, S. Th2-biased GATA-3 transgenic mice developed severe experimental peritoneal fibrosis compared with Th1-biased T-bet and Th17-biased RORgammat transgenic mice. Experimental Animals. 64 (4), 353-362 (2015).
- Karl, Z. J. T., et al. Peritoneal Equilibration Test. Peritoneal Dialysis International. 7 (3), 138-148 (1987).
- Lee, Y. C., et al. The clinical implication of vitamin D nanomedicine for peritoneal dialysis-related peritoneal damage. International Journal of Nanomedicine. 14, 9665-9675 (2019).
- Goldner, J. A. Modification of the masson trichrome technique for routine laboratory purposes. The American Journal of Pathology. 14 (2), 237-243 (1938).
- Cheng, F. Y., et al. Novel application of magnetite nanoparticle-mediated vitamin D3 delivery for peritoneal dialysis-related peritoneal damage. International Journal of Nanomedicine. 16, 2137-2146 (2021).
- Ross, A., Willson, V. L. Basic and Advanced Statistical Tests: Writing Results Sections and Creating Tables and Figures. , SensePublishers. 13-16 (2017).
- Suga, H., et al. Preventive effect of pirfenidone against experimental sclerosing peritonitis in rats. Experimental and Toxicologic Pathology. 47 (4), 287-291 (1995).
- Ishii, Y., et al. An experimental sclerosing encapsulating peritonitis model in mice. Nephrology Dialysis Transplantation. 16 (6), 1262-1266 (2001).
- Nishino, T., et al. Antisense oligonucleotides against collagen-binding stress protein HSP47 suppress peritoneal fibrosis in rats. Kidney International. 64 (3), 887-896 (2003).
- Mishima, Y., et al. Enhanced expression of heat shock protein 47 in rat model of peritoneal fibrosis. Peritoneal Dialysis International. 23 (1), 14-22 (2003).
- Kushiyama, T., et al. Effects of liposome-encapsulated clodronate on chlorhexidine gluconate-induced peritoneal fibrosis in rats. Nephrology Dialysis Transplantation. 26 (10), 3143-3154 (2011).
- Nishino, T., et al. Involvement of lymphocyte infiltration in the progression of mouse peritoneal fibrosis model. Renal Failure. 34 (6), 760-766 (2012).
- Lua, I., Li, Y., Pappoe, L. S., Asahina, K. Myofibroblastic conversion and regeneration of mesothelial cells in peritoneal and liver fibrosis. The American Journal of Pathology. 185 (12), 3258-3273 (2015).
- Kitamura, M., et al. Epigallocatechin gallate suppresses peritoneal fibrosis in mice. Chemico-Biological Interactions. 195 (1), 95-104 (2012).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados