Method Article
Usando reagentes de referência para confirmar a robustez dos ensaios de liberação de citocinas para a previsão da segurança do anticorpo monoclonal
Neste Artigo
Resumo
O uso de reagentes de referência para ensaio de liberação de citocinas permite perfis de segurança in vitro mais reprodutíveis e padronizados de anticorpos monoclonais imunoterapêuticos. Aqui, descrevemos como os ensaios de liberação de citocinas podem ser usados juntamente com um painel de reagentes de referência para prever a segurança de alguns anticorpos monoclonais terapêuticos.
Resumo
Novos medicamentos de anticorpos imunoestimulantes projetados para estimular diretamente células imunes específicas ou aumentar indiretamente a resposta imune, bloqueando ou ativando um regulador endógeno do sistema imunológico, têm o potencial de causar eventos adversos graves relacionados ao sistema imunológico, como a síndrome de liberação de citocinas (SRC). É, portanto, crucial avaliar o perfil de segurança de tais medicamentos com uma combinação de experimentos in vivo e in vitro antes da administração da primeira dose em humanos. Os ensaios de liberação de citocinas (CRAs), em que a terapia de anticorpos proposta é co-cultivada com células imunes humanas (como células mononucleares do sangue periférico (PBMCs), sangue total ou outras) e a quantidade de citocina inflamatória produzida é medida, são críticos para a identificação de perigos. No entanto, diferentes laboratórios usando diferentes anticorpos de controle podem ameaçar a harmonização de CRAs, e controles clinicamente relevantes (como TGN1412) podem ser difíceis de obter, o que pode levar a resultados ou dados menos precisos ou confiáveis que são difíceis de comparar entre laboratórios. A inclusão de controles positivos e negativos em uma CRA pode garantir a precisão e confiabilidade dos resultados. O Instituto Nacional de Padrões e Controle Biológico (NIBSC) produziu um painel de controles de anticorpos liofilizados destinados ao uso em várias plataformas de CRA para harmonizar os resultados em vários laboratórios e métodos de ensaio. Um conjunto de três anticorpos de controle positivo diferentes inclui anti-CD52, anti-CD3 e anti-CD28 superagonista (SA), que são conhecidos por induzir RSC dose-dependente em pacientes. Cada anticorpo é fornecido com um anticorpo de controle negativo compatível com o isotipo. Este painel de reagentes de referência demonstrou anteriormente ter boa reprodutibilidade interlaboratorial e são controles adequados para aumentar a confiança e a robustez dos dados de segurança de uma variedade de plataformas CRA.
Introdução
A liberação induzida de citocinas pode ser um efeito antecipado e desejado de alguns anticorpos monoclonais imunomoduladores (mAbs). No entanto, a liberação imprevista de citocinas pró-inflamatórias pode resultar em síndrome de liberação de citocinas (RSC) em pacientes caracterizados por febre, fadiga e até falência de múltiplos órgãos1. Portanto, é crucial que novos mAbs imunoestimulantes sejam testados in vitro quanto ao seu potencial de causar RSC, medindo a liberação de citocinas em um ensaio de liberação de citocinas (CRA).
TGN1412 é um anticorpo monoclonal que foi desenvolvido como um potencial tratamento para leucemia linfocítica crônica de células B por atuar como um superagonista CD28 (CD28SA), capaz de ativar linfócitos T por reticulação do receptor co-estimulador CD282. Em 2006, seis voluntários saudáveis que receberam TGN1412 em um ensaio clínico experimentaram efeitos colaterais graves, incluindo RSC, poucas horas após receberemo medicamento. Isso levou à interrupção do estudo e TGN1412 a ser retirado de um maior desenvolvimento. Outros anticorpos que são conhecidos por causar RSC como efeito colateral incluem o mAb anti-CD52, Campath-1H3, e o mAb anti-CD3, Muromonab (OKT3)4. Dada a sua capacidade de induzir RSC dose-dependente em pacientes, TGN1412, OKT3 e Campath-1H são anticorpos de controle positivo adequados para a geração de resultados robustos e confiáveis de uma PCR. No entanto, esses anticorpos de controle não eram facilmente obtidos anteriormente devido aos altos custos ou disponibilidade restrita.
No entanto, um painel de referência liofilizado remanufaturado desses três anticorpos 5,6,7 juntamente com controles negativos com isótipo correspondente foi recentemente disponibilizado pelo Instituto Nacional de Padrões e Controle Biológico (NIBSC). Este painel de reagentes de referência demonstrou anteriormente ter boa reprodutibilidade interlaboratorial8 e é, portanto, um controle adequado para aumentar a confiança e a robustez dos dados de segurança de uma variedade de plataformas CRA. Assim, a lógica por trás do uso desse protocolo juntamente com esses reagentes é melhorar a harmonização da CRA, com a vantagem de esses reagentes terem sido validados em um estudo colaborativo internacional8.
Aqui, descrevemos a melhor forma de usar este painel de reagentes de referência em um CRA PBMC em fase sólida (SP) e um CRA de sangue total (WB) em fase aquosa (AQ) para prever a RSC induzida por anticorpos. Ambos os formatos de CRA são complementares devido ao modo de apresentação de anticorpos (indireto para a fase sólida versus direto para a fase aquosa) e devido ao fato de terem como alvo diferentes grupos de células respondedoras. O mesmo protocolo pode ser adaptado para uso com sangue total diluído (dWB) ou com co-culturas endoteliais: PBMC.
Protocolo
O protocolo a seguir segue as diretrizes do comitê de ética em pesquisa do NIBSC. De acordo com os regulamentos e diretrizes aplicáveis, obtenha o consentimento informado por escrito do doador ou paciente saudável. Use técnicas estéreis para realizar todas as etapas de preparação do protocolo em uma capela de cultura de células de fluxo laminar. Consulte a Tabela de Materiais para obter detalhes sobre todos os reagentes e equipamentos.
1. Preparação de placas revestidas com mAb para ensaio de fase sólida (SP)
- Reconstituir o conteúdo das ampolas do reagente de referência com 1 ml de água destilada estéril. Aguarde 5-10 minutos para reidratação antes de misturar a solução de anticorpos e transferir para um tubo com tampa estéril.
- Após a reconstituição em 1 mL de água, a concentração estoque dos seguintes anticorpos recombinantes será de 200 μg/mL: anti-CD3 (15/162), anti-CD52 (15/178), controle do isotipo IgG1K (15/198) para anti-CD52, controle do isotipo IgG2a (15/218) para anti CD3, controle do isotipo IgG4 (15/232) para anti-CD28SA.
- Após reconstituição em 1 mL de água, a concentração estoque de anti-CD28SA (15/144) será de 100 μg/mL. Para armazenamento de curto prazo até 7 dias, transfira o material reconstituído em um tubo estéril com tampa a 4 ° C.
- Diluir os anticorpos reconstituídos e testar os anticorpos a 10 μg/ml em PBS estéril e revestir os alvéolos de uma placa de microtitulação de polipropileno de 96 poços de fundo em U estéril não tratada com TC com 100 μL de solução diluída de anticorpos (1 μg/alvéolo) e incubar durante a noite a 4 °C.
NOTA: É importante o uso de placas de polipropileno para adsorção de proteínas, pois estas foram utilizadas na validação dos reagentes padrão9.
2. Preparação de PBMC
- Colete um mínimo de 30 mL de sangue total periférico (WB) em tubos contendo heparinizado/heparina e inverta várias vezes para garantir a mistura adequada com a heparina sódica.
- Transferir 15 ml de WB para um tubo separado para ser utilizado posteriormente na preparação do ensaio de sangue total em fase aquosa (passo 3.1)
- Dilua os 15 mL restantes de sangue em uma proporção de volume de 1:1 com PBS ou meio RPMI-1640 sem soro e coloque suavemente o sangue diluído sobre 15 mL de meio gradiente de densidade (por exemplo,., linfoprep, Ficoll-Hypaque) em um tubo de 50 mL.
- Centrifugue o tubo a 500 x g por 20 min à temperatura ambiente em um rotor basculante sem freio e com aceleração reduzida para separar o sangue em seus diferentes componentes.
- Após a centrifugação, o gradiente de densidade se separará como uma camada superior de plasma, seguida por uma fina camada de revestimento leucocitário contendo PBMCs e uma camada inferior contendo glóbulos vermelhos (RBCs) e granulócitos polimorfonucleares, incluindo neutrófilos e eosinófilos. Colha cuidadosamente os PBMCs inserindo uma pipeta diretamente através da camada superior de plasma para os PBMCs. Alternativamente, remova a camada superior antes da coleta de células.
- Ressuspenda suavemente o revestimento leucocitário em 10 mL de PBS ou meio RPMI-1640 sem soro. Centrifugue o tubo novamente a 500 x g por 10 min para pellet as células. Remova o sobrenadante e descarte-o.
- Repita a etapa de lavagem 2.6. e ressuspender o pellet em 2 mL de RPMI com 10% de FCS (RPMI-1640 completo, cRPMI)
- Contar as células utilizando um hemocitómetro10.
- Ajuste os PBMCs para uma concentração de 1 x 106 células / mL em cRPMI.
3. Preparação do ensaio de liberação de citocinas de sangue total (WB) em fase aquosa (AQ)
- Adicione 190 μL de WB aos poços de uma placa de poliestireno de fundo em U de 96 poços. Se ainda não estiver a 100 μg/ml, pré-diluir todos os anticorpos do tratamento e reagentes de referência para 100 μg/ml em PBS.
- Adicione 10 μL de anticorpos diluídos a 190 μL de WB para obter uma concentração final de anticorpos de 5 μg / mL de anticorpos em 95% WB.
- Incubar a placa durante 48 h numa incubadora humidificada a 37 °C.
4. Preparação do ensaio de liberação de citocinas PBMC em fase sólida (SP)
- Com uma pipeta multicanal, remova e descarte a solução de anticorpos das placas revestidas (descritas na etapa 1), encha um reservatório de reagente com PBS e lave a placa 3x com 200 μL de PBS para remover mAbs não ligados.
- Adicione 200 μL da suspensão celular da etapa 2.8 a cada poço. Incubar a placa durante 48 h numa incubadora humidificada a 37 °C, 5% CO2.
5. Coleta de sobrenadante ou plasma
- Após incubação por 48 h com mAbs de controle e teste, centrifugar as placas a 400 x g por 5 min e coletar o meio ou plasma condicionado pela célula, tomando cuidado para não perturbar o pellet celular. Congelar o sobrenadante ou plasma recolhido a -20 °C.
NOTA: Certifique-se de não perturbar o grânulo vermelho ao coletar o plasma.
6. Realização da quantificação de citocinas no sobrenadante ou plasma
- Usando o sobrenadante ou plasma coletado, realize a análise de citocinas das concentrações de IFN-γ, IL-2, TNF-α e IL-6 usando a opção multiplex preferida. Um exemplo de método de análise de citocinas multiplex usando um ensaio citométrico de esferas foi publicado anteriormente11.
NOTA: Consulte a Tabela de Materiais do kit multiplex que foi usado na geração dos resultados representativos.
Resultados
Os resultados do ensaio SP devem demonstrar uma liberação de IL-2, IFN-γ, IL-6 e TNF-α12 na faixa de pg/mL de todos os anticorpos de controle positivo em 48 h e devem ser estatisticamente significativamente maiores do que os controles de isotipo correspondentes. Nossos resultados representativos demonstram que os anticorpos de controle positivo, αCD28, αCD3 e αCD28SA induzem níveis significativamente altos de IFN-γ, IL-6 e TNF-α em comparação com controles de isotipo correspondentes, quando executados no ensaio PBMC SP (Figura 1). Este ensaio também é caracterizado por uma alta mudança de dobra da liberação de IL-2 da estimulação com αCD28SA em comparação com seu isotipo correspondente (859.0). Enquanto αCD3 e αCD52, embora ainda induzam a expressão de IL-2, resultam em menores mudanças de dobra do que αCD28SA (6,2 e 3,3 para αCD3 e αCD52, respectivamente, Figura 2).
No ensaio WB AQ (Figura 3), o nível de citocinas detectáveis é visivelmente menor do que no ensaio PBMC SP, mas é caracterizado por uma maior sensibilidade à estimulação pelo anticorpo αCD52 (Figura 2 e Figura 3) com alterações médias de IL-2, IFN-γ e IL-6 acima de 100.
Um anticorpo de teste para o qual se pode esperar que a primeira dosagem futura em humanos não cause aumentos significativos imprevistos na liberação de citocinas em comparação com os controles de isotipo relevantes. No entanto, em vez de interromper o desenvolvimento de um novo mAb terapêutico, um resultado positivo em uma PCR deve ser considerado como parte do gerenciamento de risco/benefício13. Ao desenvolver uma nova plataforma CRA, o ensaio deve ser repetido usando um conjunto diferente de doadores para garantir a reprodutibilidade da plataforma. Deve-se também dar importância à variabilidade da resposta entre os doadores14 e, portanto, recomenda-se um experimento bem conduzido15. Para entender a amplitude das respostas e obter uma representação completa da variabilidade que pode ser observada nas respostas dos doadores, o ensaio deve idealmente ser realizado com vários doadores individuais, além de testar a terapêutica em experimentos replicados.

Figura 1: Liberação de citocinas do experimento PBMC-SP. Resultados representativos da liberação de IFN-γ, IL-2, IL-6 e TNF-α obtidos de ensaios de liberação de citocinas PBMC-SP (3 experimentos independentes, cada um contendo 5-8 doadores por experimento; n = 8, n = 10, n = 5 [de cima para baixo]) após 48 h ao usar anticorpos reagentes de referência. Abreviaturas: PBMC = células mononucleares do sangue periférico; SP = fase sólida; IFN-γ = interferon-gama; IL-2 = interleucina 2; IL-6 = interleucina 6; TNF-α = fator de necrose tumoral alfa. Clique aqui para ver uma versão maior desta figura.
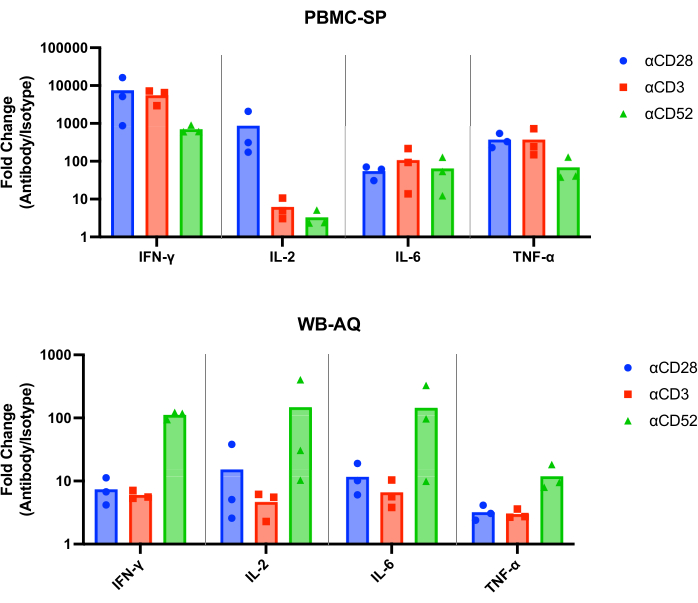
Figura 2: Aumento da mudança de dobra de citocinas dos experimentos PBMC-SP e WB-AQ. Mudança de dobra da liberação de IFN-γ, IL-2, IL-6 e TNF-α de reagentes de referência de anticorpos indutores de SRC em relação aos seus controles de isotipo correspondentes, obtidos de ensaios de liberação de citocinas PBMC-SP e WB-AQ após 48 h. Abreviaturas: PBMC = células mononucleares do sangue periférico; SP = fase sólida; WB = sangue total; AQ = aquosa (fase); IFN-γ = interferon-gama; IL-2 = interleucina 2; IL-6 = interleucina 6; TNF-α = fator de necrose tumoral alfa; RSC = síndrome de liberação de citocinas. Clique aqui para ver uma versão maior desta figura.
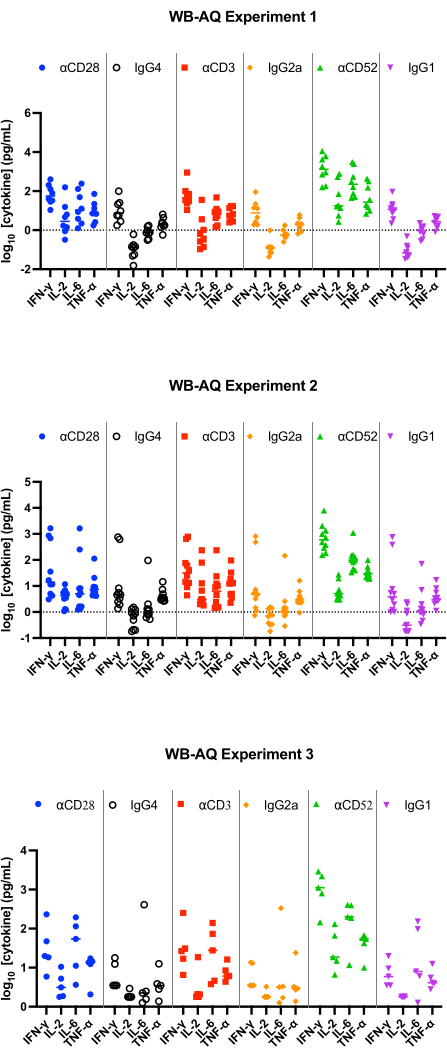
Figura 3: Liberação de citocinas do experimento WB-AQ. Resultados representativos da liberação de IFN-γ, IL-2, IL-6 e TNF-α obtidos de ensaios de liberação de citocinas WB-AQ (3 experimentos independentes, cada um contendo 5-8 doadores por experimento; n = 8, n = 10, n = 5 [de cima para baixo]) após 48 h ao usar anticorpos reagentes de referência. Abreviaturas: WB = sangue total; AQ = aquosa (fase); IFN-γ = interferon-gama; IL-2 = interleucina 2; IL-6 = interleucina 6; TNF-α = fator de necrose tumoral alfa. Clique aqui para ver uma versão maior desta figura.
Discussão
Aqui estão descritos métodos de medição da liberação de citocinas de PBMCs e WB após estimulação mediada por anticorpos de uma placa revestida com anticorpos ou com anticorpos em solução, usando um painel de reagentes de referência para controles positivos e negativos. Cada um desses ensaios tem seus próprios pontos fortes e fracos associados. Os ensaios PBMC e WB são complementares, uma vez que a proporção de várias células imunes, como linfócitos, monócitos e granulócitos, é diferente nas duas matrizes experimentais usadas para CRAs. É interessante observar que, embora um ensaio WB possa representar melhor a condição in vivo em oposição à monocultura de PBMC, a primeira plataforma é menos preditiva do risco de RSC mediada por células T de TGN1412 e OKT315; um resultado da glicoforina A nas hemácias inibindo a expansão de células T mediada por IL-216. No entanto, a predição do risco de RSC a partir de anti-CD52 permanece intacta na PCR de WB, devido à presença de neutrófilos (perdidos durante os métodos convencionais de gradiente de densidade descritos na etapa 2, usados para isolamento de PBMC).
O formato da PCR (apresentação SP ou AQ) é fundamental para a detecção de mecanismos específicos de RSC. Por exemplo, a apresentação da fase aquosa do mAb para linfócitos humanos17,18, empregada durante testes pré-clínicos de segurança in vitro de TGN1412 não conseguiu identificar o risco de RSC provavelmente devido à falta de agrupamento e engajamento de receptores celulares localizados19 e consequente ativação de células T mediada por anticorpo na fase aquosa. De fato, a SRC mediada por TGN1412 só pôde ser detectada com precisão no formato SP que replica artificialmente a reticulação do receptor Fc-gama (FcγR), conforme apresentado aqui, ou por priming dependente de contato na pré-cultura de PBMC em alta densidade e interação Fc com células imunes CD32 + (como células B20 e monócitos21).
Além dessas plataformas, existem outras formas de realizar a ACR com sistemas de cocultura mais complexos. Um exemplo de PCR alternativo aos descritos nesses métodos é a co-cultura de PBMCs com células endoteliais de crescimento sanguíneo autólogo (BOECs)22. Este ensaio foi descrito em 2015 como uma melhoria do então convencional ensaio HUVEC:PBMC de doadores mistos, removendo a incompatibilidade de tecido de confusão. Ele demonstra melhor sensibilidade à RSC anti-CD28SA do que o ensaio WB e também supera a limitação do ensaio de monocultura PBMC ao mimetizar a combinação de células endoteliais e leucócitos presentes in vivo, mas ao custo de etapas processuais mais demoradas que requerem técnicas especializadas de cultura celular22.
Além disso, embora este protocolo se concentre especificamente na liberação de IFN-γ, IL-2, IL-6 e TNF-α, colegas da MHRA já analisaram a IL-12 e outros neste cenário23. A produção de IL-12 é aumentada por esses anticorpos CRS de controle positivo, embora não seja particularmente sensível e, portanto, talvez não seja um grande preditor de CRS nesta modalidade. Algumas citocinas, como IL-15, entre outras, nunca foram testadas, embora as 4 citocinas avaliadas em nosso protocolo forneçam uma boa indicação de risco potencial de RSC. É claro que, dependendo da modalidade e dos anticorpos testados, outras citocinas podem ser avaliadas.
Combinadas, essas observações destacam a importância de observar que, embora o uso de reagentes de referência possa ajudar a identificar o risco de novos anticorpos na RSC, deve-se tomar cuidado para evitar uma plataforma de CRA abaixo do ideal que possa falhar em identificar o potencial da RSC. Crucialmente, o mecanismo de ação previsto de uma terapêutica, seja por meio de sua região Fc ou de sua ação hipotética sobre as células que expressam antígenos, deve corresponder à biologia do ensaio. Portanto, embora as diferenças no mecanismo de ação dos reagentes terapêuticos e de referência discutidos neste artigo possam representar uma limitação potencial de tal forma que um CRA relevante para o anticorpo de teste possa ser incompatível com a biologia dos reagentes de referência, o ensaio fornece uma plataforma robusta e confiável para a identificação de perigos. Os resultados de vários formatos de CRA cobrindo vários mecanismos de ação e subconjuntos de células imunes podem, no entanto, ser necessários para a confiança ideal nos dados de avaliação de segurança.
Divulgações
A EM era anteriormente funcionária da Agência Reguladora de Medicamentos e Produtos de Saúde (MHRA). Os demais autores não têm conflitos de interesse.
Agradecimentos
Este trabalho foi financiado pelo Instituto Nacional de Padrões e Controle Biológico. Agradecemos a Sandra Diebold pela revisão do manuscrito e pelos comentários e sugestões úteis. Também somos gratos a Ka Seng Ieong por filmar o vídeo.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 ml Microcentrifuge Tubes, Natural (Sterile) | Starlab | S1615-5510 | |
| Fetal Bovine Serum, qualified, heat inactivated | ThermoFisher | 10500064 | |
| Heparinized tubes | ThermoFisher | 12967676 | |
| Heracell 150i CO2 Incubator | ThermoFisher | 16406639 | |
| MESO QuickPlex SQ 120 Human Proinflammatory Panel 1 V-PLEX kit | Meso Scale Discovery | K15049 | |
| MESO QuickPlex SQ 120MM | Meso Scale Discovery | AI1AA-0 | |
| Neubauer Improved Haemocytometer Counting Chamber | Hawksley | AS1000 | |
| Panel of lyophilized recombinant antibody controls for Cytokine Release Assays | NISBC | 19/156 | |
| PBS | ThermoFisher | 10010023 | |
| Polypropylene 96-well microtiter plate | Corning | 3879 | |
| Polystyrene 96-well microtiter plate | Corning | 3799 | |
| RPMI 1640 | ThermoFisher | 11875093 | |
| Sorvall ST 40 Centrifuge | ThermoFisher | 75004525 | |
| Sterile water | ThermoFisher | 15230162 |
Referências
- Suntharalingam, G., et al. Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. The New England Journal of Medicine. 355 (10), 1018-1028 (2006).
- Hünig, T. The storm has cleared: lessons from the CD28 superagonist TGN1412 trial. Nature Reviews Immunology. 12 (5), 317-318 (2012).
- Wing, M. G., et al. Mechanism of first-dose cytokine-release syndrome by CAMPATH 1-H: involvement of CD16 (FcgammaRIII) and CD11a/CD18 (LFA-1) on NK cells. Journal of Clinical Investigation. 98 (12), 2819-2826 (1996).
- Gaston, R. S., et al. OKT3 first-dose reaction: Association with T cell subsets and cytokine release. Kidney International. 39 (1), 141-148 (1991).
- Riechmann, L., Clark, M., Waldmann, H., Winter, G. Reshaping human antibodies for therapy. Nature. 332 (6162), 323-327 (1988).
- Kung, P., Goldstein, G., Reinherz, E. L., Schlossman, S. F. Monoclonal antibodies defining distinctive human T cell surface antigens. Science. 206 (4416), 347-349 (1979).
- Ball, C., et al. Antibody C region influences TGN1412-like functional activity in vitro. Journal of Immunology. 189 (12), 5831-5840 (2012).
- Vessillier, S., et al. Development of the first reference antibody panel for qualification and validation of cytokine release assay platforms - Report of an international collaborative study. Cytokine: X. 2 (4), 100042 (2020).
- Findlay, L., et al. Improved in vitro methods to predict the in vivo toxicity in man of therapeutic monoclonal antibodies including TGN1412. Journal of Immunological Methods. 352 (1-2), 1-12 (2010).
- oVE Science Education Database. Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. Journal of Visualized Experiments. , (2023).
- Lehmann, J. S., Zhao, A., Sun, B., Jiang, W., Ji, S. Multiplex Cytokine Profiling of Stimulated Mouse Splenocytes Using a Cytometric Bead-based Immunoassay Platform. Journal of Visualized Experiments. (129), e56440 (2017).
- Murthy, H., Iqbal, M., Chavez, J. C., Kharfan-Dabaja, M. A. Cytokine Release Syndrome: Current Perspectives. Immunotargets Therapy. 8, 43-52 (2019).
- Vidal, J. M., et al. In vitro cytokine release assays for predicting cytokine release syndrome: the current state-of-the-science. Report of a European Medicines Agency Workshop. Cytokine. 51 (2), 213-215 (2010).
- Grimaldi, C., et al. Cytokine release: A workshop proceedings on the state-of-the-science, current challenges and future directions. Cytokine. 85, 101-108 (2016).
- Vessillier, S., et al. Cytokine release assays for the prediction of therapeutic mAb safety in first-in man trials - Whole blood cytokine release assays are poorly predictive for TGN1412 cytokine storm. Journal of Immunological Methods. 424, 43-52 (2015).
- Chu, J. W. K., Sharom, F. J. Glycophorin A interacts with interleukin-2 and inhibits interleukin-2-dependent T-lymphocyte proliferation. Cellular Immunology. 145 (2), 223-239 (1992).
- Stebbings, R., Eastwood, D., Poole, S., Thorpe, R. After TGN1412: recent developments in cytokine release assays. Journal of Immunotoxicology. 10 (1), 75-82 (2013).
- Hanke, T. Lessons from TGN1412. Lancet. 368 (9547), 1569-1570 (2006).
- Stebbings, R., et al. #34;Cytokine storm" in the phase I trial of monoclonal antibody TGN1412: better understanding the causes to improve preclinical testing of immunotherapeutics. Journal of Immunology. 179 (5), 3325-3331 (2007).
- Bartholomaeus, P., et al. Cell contact-dependent priming and Fc interaction with CD32+ immune cells contribute to the TGN1412-triggered cytokine response. Journal of Immunology. 192 (5), 2091-2098 (2014).
- Hussain, K., et al. Upregulation of FcγRIIb on monocytes is necessary to promote the superagonist activity of TGN1412. Blood. 125 (1), 102-110 (2015).
- Reed, D. M., et al. An autologous endothelial cell:peripheral blood mononuclear cell assay that detects cytokine storm responses to biologics. The FASEB Journal. 29 (6), 2595-2602 (2015).
- Eastwood, D., et al. Severity of the TGN1412 trial disaster cytokine storm correlated with IL-2 release. British Journal of Clinical Pharmacology. 76 (2), 299-315 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados