É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Gastrectomia Total Robótica Poupadora de Vago para Tratamento de Mutação do Gene CDH1
Neste Artigo
Resumo
Este artigo se concentra na gastrectomia total robótica poupadora de vago. As técnicas e armadilhas de preservação do vago, esofagojejunostomia suturada, formação de bolsa jejunal e reconstrução em Y de Roux com jejunojejunostomia grampeada são discutidas.
Resumo
O câncer gástrico difuso hereditário (HDGC) causado pela mutação do gene CDH1 é uma síndrome de câncer hereditário que aumenta o risco de câncer gástrico difuso e é quase impossível de detectar por gastroscopia de rastreamento. O tratamento preventivo recomendado é a gastrectomia total. A cirurgia robótica facilita o uso de técnicas cirúrgicas minimamente invasivas (MIS) para anastomoses e preservação do vago posterior para reduzir potencialmente os resultados funcionais adversos. Um homem assintomático de 24 anos com a mutação do gene CDH1 comprovada por testes genéticos e história familiar de um irmão que fez gastrectomia total para HDGC foi tratado com esta técnica. Este relato de caso em vídeo demonstra as técnicas e armadilhas da cirurgia robótica em termos de posicionamento do paciente e colocação da porta, dissecção com preservação do vago posterior, esofagojejunostomia suturada, formação de bolsa jejunal e reconstrução em Y de Roux com jejunojejunostomia grampeada. Embora essas técnicas sejam demonstradas no caso da gastrectomia profilática, muitas delas podem ser aplicadas a outros tipos de cirurgia geral e benigna do intestino anterior e bariátrico. A cirurgia robótica pode facilitar a técnica de MIS do intestino anterior, como descrito neste caso de gastrectomia total com preservação de vago.
Introdução
O câncer gástrico difuso hereditário (HDGC) é caracterizado por uma mutação genética no gene supressor de tumor E-caderina (CDH1), que possui um padrão de herança autossômica dominante1. Esta síndrome de câncer hereditário aumenta o risco de câncer gástrico difuso e câncer de mama lobular (LBC). As diretrizes atuais recomendam o teste de mutações CDH1 em pacientes com clusters familiares de HDGC e LBC, particularmente naqueles com início precoce (antes dos 40 anos de idade)2. De acordo com a maior série relatada de portadores da mutação CDH1, a incidência cumulativa de câncer gástrico ao longo da vida é de 70% (IC 95%, 59% -80%) para homens e 56% (IC 95%, 44% -69%) para mulheres com essa mutação3. No entanto, estudos recentes estimaram que a penetrância do câncer gástrico com essa mutação esteja na faixa de 37% a 42% para homens e 25% a 33% para mulheres1.
A vigilância endoscópica com biópsias é o tipo de vigilância recomendado para aqueles que optam por adiar a gastrectomia profilática; no entanto, é quase impossível detectar câncer gástrico precoce nesta coorte usando a gastroscopia de rastreamento2. O exame endoscópico extenso com luz branca é seguido por um mínimo de 30 biópsias gástricas não direcionadas de cinco áreas separadas do estômago. No entanto, esse método de vigilância tem uma alta taxa de falso-negativos e detecta apenas 20% a 63% dos focos de células ocultas do anel de sinete 4,5.
A gastrectomia total profilática (GTP) é o tratamento preventivo recomendado para qualquer portador da variante CDH1 patogênica ou provavelmente patogênica a partir dos 20 anos de idade, mas não é recomendada além dos 70 anos de idade 1,2. A metástase linfonodal perigástrica é um achado incomum em pacientes assintomáticos, que geralmente apresentam células T1a ou em anel de sinete in situ. A morbidade perioperatória é geralmente baixa e a satisfação do paciente é alta6. Embora a qualidade de vida geral após a cirurgia seja alta, uma vagotomia troncular geralmente é realizada em uma gastrectomia total 7,8. A ressecção do nervo vago acima do nível dos ramos celíaco e hepático leva à desnervação parassimpática da árvore hepatobiliar e do intestino delgado e grosso. A diarreia pós-vagotomia e a síndrome de dumping são complicações de longo prazo bem reconhecidas após o PTG8.
A cirurgia robótica fornece ao cirurgião uma visão tridimensional e ampliada de 10x do campo cirúrgico e oferece um alto grau de liberdade com instrumentos cirúrgicos articulados9. O objetivo da realização dessa técnica é reduzir potencialmente os resultados funcionais adversos por meio da preservação do vago posterior, que é facilitada por técnicas cirúrgicas minimamente invasivas (MIS).
Protocolo
O paciente forneceu consentimento informado para a publicação de informações não identificadas, imagens e documentação em vídeo. O Professor Associado Dr. Michael Talbot (co-autor) é um cirurgião gastrointestinal superior credenciado para realizar gastrectomia em sua instituição. Devido ao risco insignificante deste relato de caso e protocolo, ele foi isento de uma revisão ética de acordo com as diretrizes do conselho de revisão institucional local. A aplicação ética para relatos de casos está isenta de acordo com as diretrizes do conselho de revisão institucional local.
1. Posicionamento do paciente
- Coloque o paciente na posição de Trendelenburg reversa após a administração da anestesia geral.
- Prenda o paciente na posição com uma placa para os pés, uma alça corporal colocada acima dos joelhos e tiras de tornozelo. Rapteie (<90°) os braços e enfaixa-os com crepe nas tábuas dos braços. Coloque um suporte afastador de fígado Nathanson na mesa de operação, cranial à placa do braço esquerdo.
2. Posicionamento da porta (Figura 1)
- Faça uma incisão na pele de 12 mm por meio da abordagem preferida do cirurgião na posição hemiclavicular direita no nível do umbigo ou abaixo dele. Realize uma entrada óptica com um laparoscópio de 8 mm, 0° e com uma porta de 12 mm através desta incisão. Observe que a porta da câmera deve estar a 10-20 cm da anatomia de destino.
- Troque a porta por uma porta robótica (grampeamento) de 12 mm com um redutor de 12-8 mm e troque o laparoscópio por um laparoscópio de 8 mm a 30°. Estabeleça pneumoperitônio de 15 mmHg CO2 com fluxo de 45 mmHg.
- Faça três incisões cutâneas adicionais de 8 mm no plano transumbilical e coloque três portas robóticas de 8 mm. Coloque uma das portas robóticas no umbigo e as outras duas portas robóticas laterais a ele no lado esquerdo. Certifique-se de que haja uma distância de >8 cm entre as portas e uma distância de 10 a 20 cm entre as portas e a anatomia do alvo.
- Coloque outra porta assistente de 12 mm (porta A) no quadrante superior direito. Insira um afastador de Nathanson no epigástrio através de uma incisão de 5 mm e retraia o lobo esquerdo do fígado.
- Coloque o carrinho robótico do paciente sobre o paciente do lado direito do paciente, tomando cuidado para evitar colisão com o afastador de fígado. Encaixe o braço da câmera primeiro usando o posicionamento da porta guiada a laser. Execute uma incisura direcionada ao estômago com um escopo robótico de 8 mm e 30° usando a porta 3.
- Encaixe e arrote as portas robóticas restantes nos braços do instrumento e, em seguida, insira um instrumento bipolar de força de 8 mm (porta 1), um selador de vaso estendido (porta 2) e uma pinça fenestrada basculante (pote 4). Defina o corte automático monopolar e bipolar e a coagulação forçada no efeito 3 e verifique a configuração do sistema.
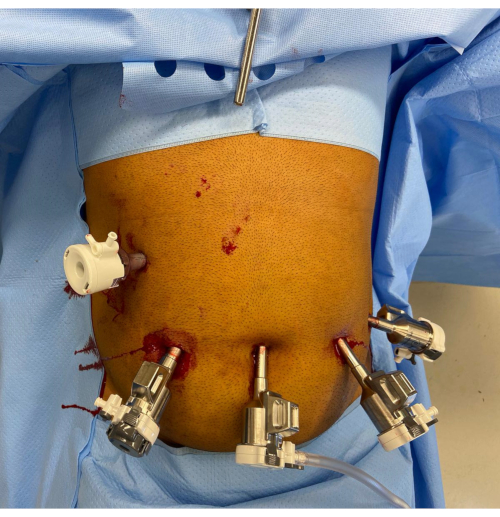
Figura 1: Posicionamento da porta robótica. A alça do afastador de Nathanson é vista no epigástrio. Há uma porta assistente de 12 mm no quadrante superior direito. As portas restantes da esquerda para a direita da imagem são a porta robótica de 12 mm com redutor, a porta de câmera de 8 mm e duas portas robóticas adicionais de 8 mm. Clique aqui para ver uma versão maior desta figura.
3. Dissecção com preservação do vago
- Mobilize a curva maior do estômago através do ligamento gastrocólico do antro para a cárdia e divida em cinco a sete vasos gástricos curtos laterais ao selador de vasos de arcada que se estendem para incluir os nódulos N1. Em seguida, mobilize o lado esquerdo do hiato esofágico.
- Entre no ligamento frenoesofágico e mobilize o lado esquerdo do esôfago distal. Realize a dissecção distal com o selador do vaso e continue até a mobilização da primeira parte do duodeno. Siga a janela supraduodenal através da pars flácida para completar a mobilização esofágica do lado direito, com o plano de dissecção confinando com o esôfago.
- Cruze a primeira parte do duodeno com o grampeador robótico usando uma recarga verde de 60 mm x 4.3 mm com um reforço de contraforte. Divida os vasos gástricos esquerdos perto da parede do estômago usando o selador de vasos. Isso é para garantir que o vago posterior seja deixado indiviso no mesentério ao redor do pedículo gástrico esquerdo.
- Retraia o esôfago e o estômago na direção superolateral e identifique o nervo vago posterior. Varra o nervo posteriormente e preserve-o.
4. Sutura da esofagojejunostomia com bolsa jejunal
- Reconstrução do ligamento frenoesofágico
- Realize a reconstrução do ligamento frenoesofágico no sentido anti-horário contínuo das 5 horas às 9 horas usando uma sutura farpada inabsorvível 2-0 em uma agulha de ponta cônica de 26 mm 1/2 círculo. Passe o esôfago intra-abdominal com o grampeador robótico usando uma recarga verde de 60 mm x 4.3 mm. Mova o estômago descolado para o quadrante superior direito.
- Anastomose esofagojejunal
- Eleve o omento maior cranialmente para identificar a flexura duodenojejunal e traga uma alça jejunal de 50 cm (criando um membro biliopancreático de 40-60 cm após a formação da bolsa jejunal) para o esôfago.
- Sutura uma sutura farpada absorvível 3-0 de 23 cm de comprimento em uma agulha de ponta cônica de 26 mm 1/2 círculo como uma pexia esofagojejunal lateral às 3 horas. Retraia a sutura não cortada lateralmente. Crie uma esofagostomia anterior à linha de grampo usando um gancho de diatermia monopolar com um guia de sonda nasogástrica de 18Fr. Crie uma jejunostomia de tamanho igual ou ligeiramente menor, como feito para a esofagostomia.
- Suturar a parede posterior da esofagojejunostomia com a sutura farpada de forma contínua, no sentido horário, das 3 às 9 horas, incorporando a linha de grampos. Suturar a porção anterior usando outra sutura da mesma para completar a sutura de camada única de espessura total para a anastomose esofagojejunal. Coloque algumas suturas mediais além da anastomose como uma pexia medial.
- Bolsa jejunal
- Tranqueça a alça jejunal proximal a 10 cm da anastomose com um grampeador robótico usando uma recarga branca de 60 mm x 2,5 mm. Crie enterostomias antimesentéricas 10 cm proximais e distais à anastomose esofagojejunal.
- Execute dois disparos do grampeador robótico usando recargas brancas de 60 mm x 2.5 mm para criar a bolsa jejunal. Certifique-se de que o segundo disparo não vá até o encontro com a anastomose esofagojejunal, a fim de preservar o suprimento de sangue para as anastomoses. Feche a enterotomia jejunal de forma contínua com uma sutura farpada absorvível 3-0.
5. Jejunojejunostomia grampeada
- Meça um membro alimentar de 70 cm e coloque uma sutura interrompida de seda 2-0 neste ponto e o membro biliopancreático distal para marcação e retração.
- Formar a jejunojejunostomia usando uma técnica somente de grampeamento, conforme descrito na técnica de grampeamento triplo para bypass gástrico laparoscópico10,11. Use uma recarga branca de 60 mm x 2,5 mm para formar a anastomose e feche a enterotomia.
- Feche os defeitos mesentéricos jejunais e retro-Roux usando suturas farpadas inabsorvíveis 2-0 para reduzir o risco de complicações devido à hérnia interna.
6. Extração e fechamento de amostras
- Remova os instrumentos, o afastador Nathanson e as portas sob visão robótica. Desencaixe o carrinho robótico do paciente do paciente.
- Crie uma minilaparotomia de 5 cm através da extensão da porta umbilical. Entregue a amostra através de um pequeno afastador protetor de ferida O-ring. Feche a laparotomia da maneira usual usando suturas poupadoras de músculo com fechamento fascial contínuo e com uma relação de 1:4 sutura/comprimento da ferida.
Resultados
O tempo operatório total foi de 2 h 50 min, e o paciente teve uma evolução pós-operatória normal. O paciente foi colocado em uma dieta livre de líquidos no dia 1 após a cirurgia e recebeu alta do hospital no dia 4. No acompanhamento de 1 mês e 3 meses, o paciente estava bem e não relatou sintomas de diarreia ou dumping.
A peça foi enviada para exame anatomopatológico e demonstrou cinco áreas de invasão superficial da lâmina própria por adenocarc...
Discussão
Foi selecionado um homem assintomático de 24 anos com a mutação do gene CDH1 comprovada por testes genéticos e história familiar de um irmão que fez gastrectomia total para HDGC. A endoscopia pré-operatória não apresentou nada digno de nota. O caso é usado como uma plataforma para discutir as técnicas e as armadilhas de seus principais aspectos. Isso inclui o posicionamento do paciente e a colocação da porta, dissecção posterior com preservação do vago, esofagojejunostom...
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Os autores agradecem à Upper Gastrointestinal and Metabolic Research Foundation por financiar as taxas de publicação da revista. Os autores também reconhecem o paciente neste caso por seu consentimento para a publicação de suas informações e imagens não identificadas.
Materiais
| Name | Company | Catalog Number | Comments |
| Laparoscopic instruments | |||
| 5 mm optical entry port | Applied Medical | CFF03 | Kii Fios First entry access system. |
| Laparoscopic 5mm 0° camera | Olympus | ENDOEYE HD II | 5 mm, 0° |
| Laparoscopic needle holder | KARL STORZ | Laparoscopic needle holder | |
| Nasogastric tube | Cardinal Health | 8888264960E | 16Fr |
| Nathanson liver retractor | COOK Medical | NLRS-1001/ NLRS-1002 | Large/ Extra-large |
| Robotic instruments | |||
| 12 mm port | Intuitive Surgical | 470375 | |
| 8 mm port | Intuitive Surgical | 470380 | |
| 8 mm reducer | Intuitive Surgical | 470381 | |
| Da Vinci Xi/X Endoscope with Camera, 8 mm, 0° | Intuitive Surgical | 470026 | |
| Da Vinci Xi/X Endoscope with Camera, 8 mm, 30° | Intuitive Surgical | 470027 | |
| Force Bipolar 8 mm | Intuitive Surgical | 470405 | |
| Mega SutureCut Needle Driver | Intuitive Surgical | 470309 | |
| Monopolar hook diathermy | Intuitive Surgical | 470183 | |
| SureForm 60mm stapler | Intuitive Surgical | 480460 | |
| Tip-up fenetrated grasper 8 mm | Intuitive Surgical | 470347 | |
| Vessel Sealer Extend 8 mm | Intuitive Surgical | 480422 | |
| Stapler reloads | |||
| Seamguard buttress 60 mm | GORE | 1BSGXI60GB/12BSGXI60GB | |
| SureForm 60 mm green reload | Intuitive Surgical | 48360G | |
| SureForm 60 mm white reload | Intuitive Surgical | 48360W | |
| Sutures | |||
| 2-0 nonabsorbable barbed suture | Medtronic | VLOCN0644 | 23 cm V-Loc on a 26 mm ½ circle taper point needle |
| 3-0 absorbable barbed suture | Medtronic/ Ethicon (J&J) | VLOCM0644 | 23 cm V-Loc on a 26 mm ½ circle taper point needle (preferred), STRATAFIX (alternate). Catalogue number |
| 2-0 monocryl suture | Ethicon (J&J) | JJW3463 | Cut to 15 cm, taper point needle |
| 2-0 silk suture | Ethicon (J&J) | JJ423H | Cut to 15 cm, taper point needle |
| 1 PDS suture | Ethicon (J&J) | JJ75414 | Fascial closure |
| 3-0 monocryl suture | Ethicon (J&J) | JJY227H | Skin closure |
| Topical Skin Adhesive | Ethicon (J&J) | JJ79025 | Skin closure/ wound dressing |
| Specimen extraction | |||
| Alexis O-ring wound retractor | Applied Medical | C8402 | Medium. For specimen extraction |
| Handheld diathermy | Covidien/ Valleylab | VLE2515 | For specimen extraction |
Referências
- Gamble, L. A., Heller, T., Davis, J. L. Hereditary diffuse gastric cancer syndrome and the role of CDH1: A review. JAMA Surgery. 156 (4), 387-392 (2021).
- Shenoy, S. CDH1 (E-cadherin) mutation and gastric cancer: Genetics, molecular mechanisms and guidelines for management. Cancer Management and Research. 11, 10477-10486 (2019).
- Hansford, S., et al. Hereditary diffuse gastric cancer syndrome: CDH1 mutations and beyond. JAMA Oncology. 1 (1), 23-32 (2015).
- Friedman, M., et al. Surveillance endoscopy in the management of hereditary diffuse gastric cancer syndrome. Clincal Gastroenterology and Hepatology. 19 (1), 189-191 (2021).
- van der Post, R. S., et al. Hereditary diffuse gastric cancer: updated clinical guidelines with an emphasis on germline CDH1 mutation carriers. Journal of Medical Genetics. 52 (6), 361-374 (2015).
- Kaurah, P., et al. Hereditary diffuse gastric cancer: Cancer risk and the personal cost of preventive surgery. Familal Cancer. 18 (4), 429-438 (2019).
- Hejazi, R. A., Patil, H., McCallum, R. W. Dumping syndrome: Establishing criteria for diagnosis and identifying new etiolo gies. Digestive Diseases and Sciences. 55 (1), 117-123 (2010).
- Johnston, D. Operative mortality and postoperative morbidity of highly selective vagotomy. British Medical Journal. 4 (5996), 545-547 (1975).
- Nakauchi, M., et al. Robotic surgery for the upper gastrointestinal tract: Current status and future perspectives. Asian Journal of Endoscopic Surgery. 10 (4), 354-363 (2017).
- Frantzides, C. T., et al. Laparoscopic Roux-en-Y gastric bypass utilizing the triple stapling technique. Journal of the Society of Laparoendoscopic Surgeons. 10 (2), 176-179 (2006).
- Madan, A. K., Frantzides, C. T. Triple-stapling technique for jejunojejunostomy in laparoscopic gastric bypass. Archives of Surgery. 138 (9), 1029-1032 (2003).
- Forrester, J. D., et al. Surgery for hereditary diffuse gastric cancer: Long-term outcomes. Cancers. 14 (3), 728 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados