É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Cirurgia de Bypass Duodenal-Jejunal em Camundongos Diabéticos Obesos Induzidos por Dieta
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
A cirurgia de bypass duodenal-jejunal (DJB) pode melhorar o metabolismo da glicose e reduzir a resistência à insulina. Aqui, apresentamos um protocolo para estabelecer um modelo de mouse estável e confiável de DJB.
Resumo
A prevalência de obesidade e diabetes tipo 2 é um sério problema de saúde global. A obesidade é um importante fator patogênico no diabetes tipo 2, doenças cardiovasculares e alguns tipos de câncer. A cirurgia bariátrica oferece uma opção de tratamento eficaz e de longo prazo para obesidade e diabetes. A gastrectomia vertical (SG) e o bypass gástrico em Y de Roux (BGYR) são amplamente reconhecidos como as cirurgias bariátricas mais populares. Além disso, várias cirurgias bariátricas exploratórias demonstraram efeitos terapêuticos promissores. O bypass duodenal-jejunal (DJB), especificamente adaptado para diabéticos com baixo índice de massa corporal, mostrou resultados metabólicos benéficos. No entanto, seus benefícios metabólicos independentes do peso não são totalmente compreendidos devido a modelos animais limitados. Neste artigo, descrevemos os protocolos de cuidados otimizados e as técnicas cirúrgicas para a realização da cirurgia DJB em camundongos diabéticos obesos induzidos por dieta (DIO). O uso de um modelo de camundongo contribui para uma melhor compreensão da natureza das alterações induzidas pela cirurgia de DJB, facilitando a prática clínica relacionada.
Introdução
A obesidade e o diabetes tipo 2 são as doenças crônicas mais comuns no mundo, e sua prevalência está aumentando entre os jovens1. A cirurgia bariátrica é o tratamento mais eficaz para obesidade e diabetes, facilitando a estabilidade da glicose no sangue a longo prazo, além de melhorar as complicações associadas à obesidade 2,3. Existem vários tipos de cirurgia bariátrica, classificadas por reduzirem o volume gástrico ou a absorção intestinal; estes incluem restritivo, malabsortivo e combinação 4,5.
O bypass duodenal-jejunal (DJB) foi desenvolvido pela primeira vez por Rubino e Marescaux, que demonstraram que o diabetes tipo 2 poderia ser aliviado conectando o duodeno e o jejuno, em vez de reduzir o volume gástrico 6,7. O DJB preserva todo o estômago e contorna todo o duodeno e jejuno proximal. O intestino é dividido em membros biliopancreáticos, digestivos e comuns 6,8. O DJB compartilha algumas semelhanças com as cirurgias bariátricas, incluindo bypass gástrico em Y de Roux (BGYR), minibypass gástrico, bypass biliopancreático, desvio duodenal e gastrectomia vertical com DJBmais 9. Comparado ao BGYR, o DJB não requer anastomose gastrointestinal, o que reduz o tempo operatório e melhora a taxa de sucesso do procedimento. O DBI é semelhante ao BGYR na melhora do metabolismo da glicose, mas não afeta o peso corporal10. Após a cirurgia de DJB, a entrega rápida de alimentos ao intestino delgado distal estimula a secreção do peptídeo-1 semelhante ao glucagon (GLP-1), resultando em melhora do metabolismo da glicose11,12.
O uso de modelos animais é essencial para a compreensão das vias metabólicas, celulares e moleculares. Modelos animais de cirurgia bariátrica têm contribuído para a compreensão dos potenciais mecanismos subjacentes à obesidade e ao diabetes13,14. No entanto, devido às diferenças fisiológicas entre as espécies, é impossível replicar perfeitamente as doenças humanas em modelos animais15. Entre os vários modelos animais disponíveis para fins de pesquisa, o modelo de camundongo com obesidade induzida por dieta (DIO) se assemelha mais à obesidade humana e à síndrome metabólica16. Os camundongos foram selecionados para a cirurgia de DJB para determinar a viabilidade da cirurgia e fornecer técnicas para pesquisas futuras. Este manuscrito fornece um resumo abrangente dos aspectos técnicos e detalhes experimentais da cirurgia DJB.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todas as etapas do protocolo descritas abaixo seguem as diretrizes do Comitê de Cuidados e Uso de Animais do Hospital Geral do Comando do Teatro Sul sob o número de aprovação 2020112501.
1. Preparação geral pré-operatória
NOTA: Trinta camundongos C57BL/6 machos de 6 semanas de idade foram comprados. Os camundongos foram alojados em um laboratório Specific Pathogen-Free (SPF) sob um ciclo claro/escuro de 12 h; temperatura de 22 ± 2 °C; e umidade, 55-65%. Os ratos tiveram acesso gratuito à água e foram alimentados com uma dieta de 60% de gordura por 6 semanas para induzir a obesidade. Uma injeção intraperitoneal de estreptozotocina 40 mg/kg foi administrada por 5 dias para induzir diabetes17. Entre os trinta camundongos, vinte e dois camundongos foram rastreados para glicemia aleatória > 300 mg / dL e aleatoriamente designados para os grupos DJB (n = 15) e cirurgia simulada (n = 7). Oito camundongos foram excluídos do experimento devido à glicemia abaixo do padrão.
- Jejue os camundongos por 8 h antes da cirurgia. Retire a água 2 h antes da cirurgia.
- Administre solução de pentobarbital sódico a 1% (6 mL / kg) e buprenorfina (1 mg / kg) por via intraperitoneal. Toque os dedos dos pés ou caudas dos ratos com uma pinça e certifique-se de que os ratos não apresentem espasmos ou tremores óbvios. Sob anestesia adequada, os camundongos podem respirar livremente sem oxigênio suplementar.
- Colocar os ratinhos em decúbito dorsal sobre um quadro esterilizado e sob um estereomicroscópio. Aplique pomada para os olhos nos olhos. Use um cobertor elétrico para manter os ratos aquecidos durante todo o procedimento. Use procedimentos estéreis, incluindo aventais cirúrgicos, luvas estéreis e instrumentos autoclavados.
- Em camundongos controle simulado, faça as duas incisões respectivamente no duodeno 1 cm abaixo do piloro e no jejuno 5 cm abaixo do Treitz e, em seguida, suture as incisões.
2. Bypass jejunal duodenal: Procedimento cirúrgico
- Aplique a pasta depilatória do xifóide no abdômen para remover os pelos dessa região. Limpe o creme e certifique-se de que a pele esteja limpa. Esfregue a área três vezes com esfoliação alternada de soluções de iodo e álcool.
- Cubra o camundongo com um campo estéril, deixando a área operacional exposta, e faça uma incisão de 2 cm do xifóide ao abdômen.
- Use um afastador abdominal para expor a cavidade abdominal. Afaste a gordura abdominal usando um cotonete úmido e mova o fígado para o lado cefálico para expor totalmente o estômago e os intestinos.
- O estômago e o piloro estão abaixo do fígado, e o ligamento de Treitz está no duodeno distal. Dupla ligação do jejuno, 5 cm distal ao ligamento de Treitz com sutura de seda 6-0 (Figura 1A). Corte o jejuno no ponto médio das duas ligaduras e suture o coto jejunal com uma sutura de seda 10-0 (Figura 1B).
NOTA: Evite torcer os vasos sanguíneos mesentéricos. - Puxe a incisão jejunal proximal 5 cm ao longo do intestino até o jejuno para criar uma anastomose jejunal-jejunal. Alinhe os dois intestinos horizontalmente e, em seguida, use uma sutura de seda 10-0 para criar a anastomose lateral (Figura 1C).
NOTA: Durante a cirurgia, mantenha o intestino úmido com solução salina para reduzir a perda de água. Isso evitará que o intestino se enrole e facilitará a sutura. - Prenda ambas as extremidades do intestino e corte a incisão no mesmo comprimento (Figura 1D). Suturar a segunda camada da parede intestinal posterior com uma sutura contínua de espessura total.
NOTA: O comprimento da incisão é de aproximadamente 0.5-0.6 cm e a distância da agulha é de ~0.5 mm. - Prenda as duas extremidades do intestino e suture a parede anterior do intestino. Suturar a primeira camada da parede anterior com uma sutura contínua simples e a segunda camada com uma sutura horizontal em varo (Figura 1E-F).
NOTA: Limpe o conteúdo intestinal com cotonetes para evitar infecção da cavidade abdominal. - Puxe a incisão jejunal distal no duodeno 1 cm abaixo do piloro para criar uma anastomose duodenal-jejunal (Figura 1G). Suture-o usando o mesmo método das etapas 2.6-2.7 (Figura 1H-K).
NOTA: Verifique a sutura no canto da anastomose para reduzir o vazamento da anastomose. - Ligue o intestino com a micro pinça e corte o intestino com a micro tesoura. Ligar duplamente o duodeno com uma sutura de seda 6-0, a 2 mm da extremidade distal da anastomose duodenal-jejunal. Corte no ponto médio com microtesoura e suture o coto com uma sutura de seda 10-0 (Figura 1L).
NOTA: Os vasos gastroduodenais ramificam-se perpendicularmente à cabeça do pâncreas e são adjacentes ao piloro, exigindo exploração cuidadosa dos vasos na seção transversal. A confluência do ducto colédoco e duodeno foi localizada, tomando cuidado para não danificar o pâncreas ou o ducto colédoco. - Enxágue a cavidade abdominal com solução salina a 30 °C. Retorne o intestino para a cavidade abdominal. Suturar o músculo e a pele separadamente com uma seda 6-0. Em seguida, desinfete a pele com iodóforo.
- Após a cirurgia, injete solução salina a 30 °C (30 mL/kg) por via subcutânea nas costas para evitar a desidratação. Injete penicilina (10 mg / kg) por via intramuscular para prevenir a infecção.
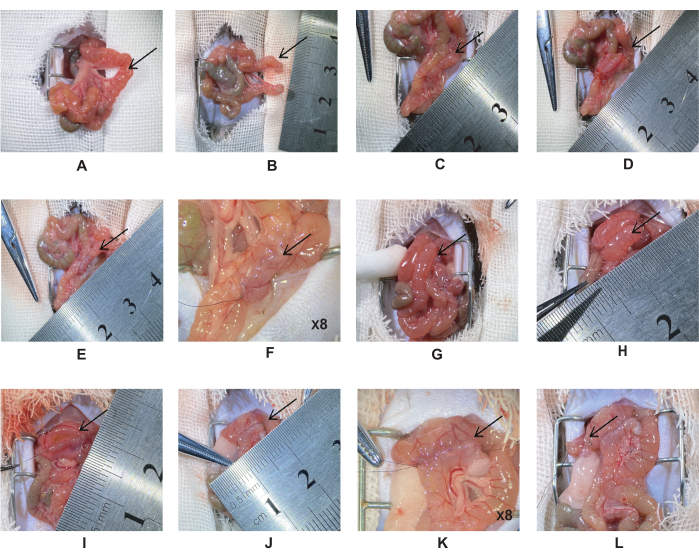
Figura 1: Procedimento de bypass duodenal-jejunal. (A) Localização do jejuno 5 cm distal ao ligamento de Treitz. (B) Ligue duas vezes o jejuno com seda 6-0, cortada no meio da ligadura. (C) Anastomose jejunal-jejunal. (D) Faça uma incisão de 0,5-0,6 cm e suture a parede posterior. (E-F) Anastomose jejunal-jejunal completa. (G) Puxe o jejunal distal para o duodeno 1 cm abaixo do piloro. (H) Anastomose duodenal-jejunal. (I) Corte a anastomose duodenal-jejunal com uma incisão de 0,5-0,6 cm e suture a parede posterior com uma sutura contínua simples. (JK) Anastomose duodenal-jejunal completa. (L) A 2 mm da anastomose distal à duodenal-jejunal, ligar duas vezes o duodeno com seda 6-0 e cortar no meio da ligadura. Clique aqui para ver uma versão maior desta figura.
3. Cuidados gerais pós-operatórios
- Após a cirurgia, coloque os ratos em um cobertor elétrico para evitar hipotermia. Permita que os ratos rastejem livremente até ficarem totalmente acordados antes de retornar às gaiolas.
- No dia pós-operatório, restrinja a comida e a água e injete 2 mL de solução salina por via subcutânea no dorso dos camundongos. No primeiro dia de pós-operatório, administrar 10 mL de glicose a 10% e uma bebida funcional (proporção de 1:1) sem alimentos e injetar 1 mL de soro fisiológico por via subcutânea.
- No segundo e terceiro dias de pós-operatório, alimentar os camundongos com uma mistura de 20 mL de glicose a 10% e uma bebida funcional. Após o quarto dia, dê aos ratos água pura e uma dieta rica em gordura. A alimentação de transição deve ser realizada de acordo com o estado de recuperação pós-operatória na seguinte ordem: solução, semilíquido ou alimento sólido.
- Analgesia pós-operatória: injete buprenorfina (0,1 mg/kg) a cada 12 h dos dias 1 a 3 e, em seguida, uma vez ao dia até o dia 5.
- Após a cirurgia, observe as condições de alimentação, atividade, fezes e cicatrização de feridas dos camundongos.
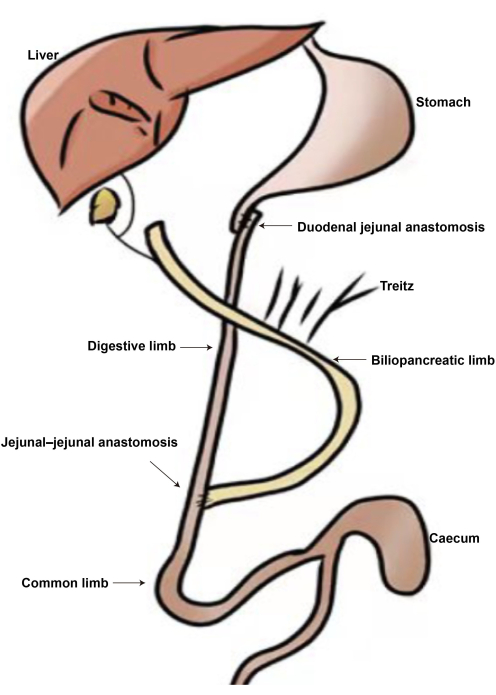
Figura 2: O diagrama da cirurgia DJB. (A) Anastomose duodenal-jejunal. (B) Anastomose jejunal-jejunal. (C) Membro biliopancreático. (D) Membro digestivo. (E) Membro comum. Clique aqui para ver uma versão maior desta figura.
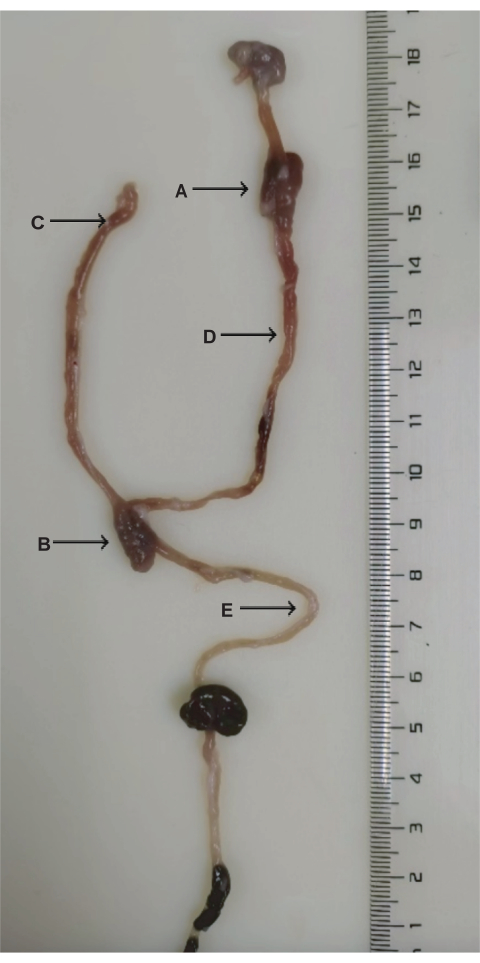
Figura 3: Anatomia da cirurgia de DJB. (A) Anastomose duodenal-jejunal. (B) Anastomose jejunal-jejunal. (C) Membro biliopancreático. (D) Membro digestivo. (E) Membro comum. Clique aqui para ver uma versão maior desta figura.
4. Avaliação pós-operatória dos parâmetros metabólicos
- Medição do peso corporal
- Jejue os camundongos por 8 h antes da medição. Pese os camundongos semanalmente na segunda-feira antes e depois da cirurgia por 8 semanas.
- Medição da ingestão alimentar
- Abriga um rato em cada gaiola. Meça a quantidade de alimento sólido em cada gaiola antes e depois de 24 h. A diferença entre os dois valores representa a ingestão alimentar diária.
- Medição aleatória da glicemia
- Às 8:00 da manhã da segunda-feira semanal de medição, colete uma gota de sangue da ponta da cauda do camundongo e aplique-a em uma tira de glicose inserida no glicosímetro.
- Teste oral de tolerância à glicose
- Oito semanas após a cirurgia de DJB, jejuar os camundongos por 8 h antes do teste oral de tolerância à glicose. Colete uma gota de sangue da ponta da cauda do rato e coloque-a em uma tira de glicose inserida no glicosímetro. Administre uma dose oral de 20% de D-glicose (2 g / kg). Meça os níveis de glicose no sangue em 0, 15, 30, 60, 90, 120, 150 e 180 minutos após a gavagem.
Access restricted. Please log in or start a trial to view this content.
Resultados
Condições gerais
O tempo operatório médio para o procedimento de DJB foi de 84,5 ± 2,6 min. Quinze camundongos foram submetidos à cirurgia de DJB, nove camundongos sobreviveram. Conforme mostrado na Tabela 1, a maioria dos óbitos ocorreu durante a cirurgia ou nos 7 dias seguintes. As causas de morte pós-operatória foram sangramento (n=2) no 1º dia de pós-operatório, vazamento de anastomose (n=1) no 4º dia de pós-operatório, obstrução ...
Access restricted. Please log in or start a trial to view this content.
Discussão
Em 1953, Varco et al.18 realizaram a primeira derivação jejuno-ileal como início da cirurgia bariátrica. Desde então, inúmeras cirurgias bariátricas foram realizadas por cirurgiões. Essas cirurgias resultaram em perda de peso e melhora das complicações metabólicas 4,19,20. Além disso, em 1967, Mason e Ito21 realizaram o primeiro bypass ...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Este estudo foi apoiado por uma bolsa do Projeto de Planejamento de Ciência e Tecnologia da Província de Guangdong, na China (nº 202002020069).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Abdominal retractor | F.S.T | 17000-03 | Colibri Retractor -3cm,retractor range 1.5cm/3cm long |
| 1% sodium pentobarbital solution | Guangzhou Chemical Reagent Factory | / | Dissolved 500mg of pentobarbital sodium powder in 50ml of normal saline to obtain 1% pentobarbital sodium solution. |
| Benzylpenicillin sodium for Injection | North China Pharmaceutical Company Ltd. | F2062121 | Penicillin |
| Buprenorphine | Guangzhou Chemical Reagent Factory | / | Analgesia |
| Buprenorphine | Guangzhou Otsuka Pharmaceutical Co., Ltd | / | Analgesic |
| Citric acid-sodium citrate buffer | LEAGENE | R00522 | Buffer solution |
| Cotton buds | HaoZheng Medical | 60220610 | Cotton swabs |
| Depilatory paste | Veet | AAPR-S222 | Hair removal cream |
| Ear tag | ZEYA | SUS304 | Ear-mark |
| Electric blanket | ZOSEN | ZS-CWDRT | Heat pad |
| Electronic scale | WETTLER TOLEDO | 20060902-6 | Measure the weight |
| Enteral nutritional powder | Abbott Laboratories | / | Nutrition powder |
| Eye ointment | Guangzhou Otsuka Pharmaceutical Co., Ltd | / | Protect the eyes |
| Glucometer | Roche | 6993788001 | Assess blood glucose |
| Graphpad Prism version 9.4.1 | GraphPad Software | version 9.4.1 | Software for statistical analysis |
| High-fat diet (High Fat [60FDC] Purified Rodent Diet) | Dyets | 112252 | 60kcal% High Fat Diet |
| Micro Forceps | Jinzhong Medical | 18-1140 | Micro forceps |
| Micro needle holder | Jinzhong Medical | EMT-160-Z | Needle holder |
| Micro Scissors | Jinzhong Medical | YBC010 | Micro scissors |
| Microscope camera | LAPSUN | E 2000 | Video |
| Ophthalmic scissors | Jinzhong Medical | Y00030 | Surgical scissors |
| Pentobarbital | Guangzhou Chemical Reagent Factory | / | Narcosis |
| Sodium chloride Injection | Guangzhou Otsuka Pharmaceutical Co., Ltd | B21L0301 | NaCl 0.9% |
| Stereo microscope | ZEISS | Stemi 305 | Binocular stereomicroscope |
| Streptozotocin | Sigma | S110910-1g | STZ |
| Suture line | LINGQIAO SUTURE | ZS-LQPMRZ5/0 | Prolene 6/0,Prolene 10/0 |
| Tissue forceps | Jinzhong Medical | H1701 | Surgical forceps |
Referências
- Lascar, N., Brown, J., Pattison, H., Barnett, A. H., Bailey, C. J., Bellary, S. Type 2 diabetes in adolescents and young adults. Lancet Diabetes Endocrinol. 6 (1), 69-80 (2018).
- Song, Y., Zhao, F. Bibliometric analysis of metabolic surgery for type 2 diabetes: current status and future prospects. Updates Surg. 74 (2), 697-707 (2022).
- Cummings, D. E., Rubino, F. Metabolic surgery for the treatment of type 2 diabetes in obese individuals. Diabetologia. 61 (2), 257-264 (2018).
- Buchwald, H. The evolution of metabolic/bariatric surgery. Obes Surg. 24 (8), 1126-1135 (2014).
- Akalestou, E., Miras, A. D., Rutter, G. A., le Roux, C. W. Mechanisms of weight loss after obesity surgery. Endocr Rev. 43 (1), 19-34 (2022).
- Rubino, F., et al. The mechanism of diabetes control after gastrointestinal bypass surgery reveals a role of the proximal small intestine in the pathophysiology of type 2 diabetes. Ann Surg. 244 (5), 741-749 (2006).
- Rubino, F., Marescaux, J. Effect of duodenal-jejunal exclusion in a non-obese animal model of type 2 diabetes: a new perspective for an old disease. Ann Surg. 239 (1), 1-11 (2004).
- Akalestou, E., et al. Establishing a successful rat model of duodenal- jejunal bypass: A detailed guide. Lab Anim. 53 (4), 362-371 (2019).
- Yu, H. H., Hsieh, M. C., Wu, S. Y., Sy, E. D., Shan, Y. S. Effects of duodenal-jejunal bypass surgery in ameliorating nonalcoholic steatohepatitis in diet-induced obese rats. Diabetes Metab Syndr Obes. 12, 149-159 (2019).
- Garciacaballero, M., Navarrete, S., Favretti, F., Celik, A., Del Castillo, D. Diabetes surgery in type 2 BMI 24-29 vs IMC 30-34 diabetic patients: is there differences among restrictive, malabsorptive and gastric bypass procedures. Nutr Hosp. 28 (2), 23-30 (2013).
- Vidal, J., Jiménez, A. Diabetes remission following metabolic surgery: is GLP-1 the culprit. Curr Atheroscler Rep. 15 (10), 357(2013).
- Speck, M., Cho, Y. M., Asadi, A., Rubino, F., Kieffer, T. J. Duodenal-jejunal bypass protects GK rats from {beta}-cell loss and aggravation of hyperglycemia and increases enteroendocrine cells coexpressing GIP and GLP-1. Am J Physiol Endocrinol Metab. 300 (5), E923-E932 (2011).
- Ashrafian, H., et al. Metabolic surgery: an evolution through bariatric animal models. Obes Rev. 11 (12), 907-920 (2010).
- Rao, R. S., Rao, V., Kini, S. Animal models in bariatric surgery--a review of the surgical techniques and postsurgical physiology. Obes Surg. 20 (9), 1293-1305 (2010).
- Im, Y. R., et al. A systematic review of animal models of NAFLD finds high-fat, high-fructose diets most closely resemble human NAFLD. Hepatology. 74 (4), 1884-1901 (2021).
- Kleinert, M., et al. Animal models of obesity and diabetes mellitus. Nat Rev Endocrinol. 14 (3), 140-162 (2018).
- Furman, B. L. Streptozotocin-induced diabetic models in mice and rats. Curr Protoc. 1 (4), e78(2021).
- Buchwald, H., Varco, R. L., Moore, R. B., Schwartz, M. Z. Intestinal bypass procedures. Partial ileal bypass for hyperlipidemia and jejunoileal bypass for obesity. Curr Probl Surg. , 1-51 (1975).
- DeMaria, E. J. Bariatric surgery for morbid obesity. N Engl J Med. 356 (21), 2176-2183 (2007).
- Bolling, C. F., Armstrong, S. C., Reichard, K. W., Michalsky, M. P. Metabolic and bariatric surgery for pediatric patients with severe obesity. Pediatrics. 144 (6), e20193224(2019).
- Mason, E. E. Gastric bypass for morbid obesity. Surg Annu. 11, 99-126 (1979).
- Cheng, Y., et al. Sleeve gastrectomy with bypass of proximal small intestine provides better diabetes control than sleeve gastrectomy alone under postoperative high-fat diet. Obes Surg. 29 (1), 84-92 (2019).
- Rubino, F., et al. The role of the small bowel in the regulation of circulating ghrelin levels and food intake in the obese Zucker rat. Endocrinology. 146 (4), 1745-1751 (2005).
- Zachariah, P. J., et al. Compared to sleeve gastrectomy, duodenal-jejunal bypass with sleeve gastrectomy gives better glycemic control in T2DM patients, with a lower β-cell response and similar appetite sensations: mixed-meal study. Obes Surg. 26 (12), 2862-2872 (2016).
- Jiang, B., et al. Role of proximal intestinal glucose sensing and metabolism in the blood glucose control in type 2 diabetic rats after duodenal jejunal bypass surgery. Obes Surg. 32 (4), 1119-1129 (2022).
- Han, H. F., et al. Duodenal-jejunal bypass increases intraduodenal bile acids and upregulates duodenal SIRT1 expression in high-fat diet and streptozotocin-induced diabetic rats. World J Gastroenterol. 28 (31), 4338-4350 (2022).
- Yan, S., et al. Reduction of intestinal electrogenic glucose absorption after duodenojejunal bypass in a mouse model. Obes Surg. 23 (9), 1361-1369 (2013).
- Arble, D. M., et al. Metabolic comparison of one-anastomosis gastric bypass, single-anastomosis duodenal-switch, Roux-en-Y gastric bypass, and vertical sleeve gastrectomy in rat. Surg Obes Relat Dis. 14 (12), 1857-1867 (2018).
- Liang, Y., et al. Duodenal-jejunal bypass surgery reverses diabetic phenotype and reduces obesity in db/db Mice. Curr Chem Genom Transl Med. 11, 41-49 (2017).
- Barataud, A., et al. Absence of role of dietary protein sensing in the metabolic benefits of duodenal-jejunal bypass in the mouse. Sci Rep. 7, 44856(2017).
- Close-up on lab animal microsurgery. Lab Anim (NY). 35 (1), 43(2006).
- Couceiro, J., Castro, R., Tien, H., Ozyurekoglu, T. Step by step: microsurgical training method combining two nonliving animal models. J Vis Exp. (99), e52625(2015).
- Nasser, K. M., Wahba, H. A., Kamal, E., El-Makhzangy, A. M., Bahaa, N. Animal model for training and improvement of the surgical skills in endolaryngeal microsurgery. J Voice. 26 (3), 351-357 (2012).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados