Method Article
Imaging and Quantification of the Hepatic Vasculature of Mice Using Ultrafast Doppler Ultrasound
Neste Artigo
Resumo
Ultrafast Doppler ultrasound (UFUS) with high spatial resolution (100 μm) and sensitivity represents a suitable noninvasive imaging modality for obtaining a comprehensive qualitative overview of the hepatic vasculature. UFUS also facilitates quantitative measurements of the microvasculature, aiming to enhance our understanding of vascular disease mechanisms.
Resumo
Non-invasive in vivo imaging of the vasculature is a powerful tool for studying disease mechanisms in rodents. To achieve high sensitivity imaging of the microvasculature using Doppler ultrasound methods, imaging modalities employing the concept of ultrafast imaging are preferred. By increasing the frame rate of the ultrasound scanner to thousands of frames per second, it becomes possible to improve the sensitivity of the blood flow down to 2 mm/s and to obtain functional information about the microcirculation in comparison to a sensitivity of around 1 cm/s in conventional Doppler modes. While Ultrafast Doppler ultrasound (UFUS) imaging has become adopted in neuroscience, where it can capture brain activity through neurovascular coupling, it presents greater challenges when imaging the vasculature of abdominal organs due to larger motions linked to breathing. The liver, positioned anatomically under the diaphragm, is particularly susceptible to out-of-plane movement and oscillating respiratory motion. These artifacts not only adversely affect Doppler imaging but also complicate the anatomical analysis of vascular structures and the computation of vascular parameters. Here, we present a qualitative and quantitative imaging analysis of the hepatic vasculature in mice by UFUS. We identify major anatomical vascular structures and provide graphical illustrations of the hepatic macroscopical anatomy, comparing it to an in-depth anatomical assessment of the hepatic vasculature based on Doppler readouts. Additionally, we have developed a quantification protocol for robust measurements of hepatic blood volume of the microvasculature over time. To contemplate further research, qualitative vascular analysis provides a comprehensive overview and suggests a standardized terminology for researchers working with mouse models of liver disease. Furthermore, it offers the opportunity to apply ultrasound as a non-invasive complementary method to inspect hepatic vascular defects in vivo and measure functional microvascular alterations deep within the organ before unraveling blood vessel anomalies at the micron scale levels using ex vivo staining on tissue sections.
Introdução
Preclinical mouse models are widely used to study the onset and progression of hepatic microvascular disease1,2. Longitudinal follow-up is advantageous, as blood capillary alterations occur at an early stage of the disease before inflammation and fibrosis appear, which may result in cirrhosis over time1. To investigate disease progression, powerful imaging tools are essential for visualizing and measuring blood vessel function in vivo. Ultrafast Doppler ultrasound (UFUS) represents a suitable modality due to its low cost, portability, simplicity, and real-time capability, but also because it is a non-invasive and time-saving procedure3. In comparison to conventional Doppler ultrasound, which may reach a similar spatial resolution but is restricted to large blood flow, UFUS allows the detection of slow blood flow down to 2 mm/s from 1 cm/s, allowing to probe the contribution of much smaller vessels4. UFUS improves the sensitivity, which is accomplished through plane wave transmissions with a large field of view in a single insonification to increase the frame rate and thus the number of ultrasound images available5. The high number of temporal samples improves the cancelation of the signal coming from the tissue and enhances the detection of the echoes reflected from the blood scatterers, boosting the sensitivity without requiring contrast agents6. By estimating the energy of blood scatterer echoes through the power Doppler estimation, a quantity is obtained that is proportional to the blood volume in each pixel even if the blood vessels are too small to be resolved in the image7.
UFUS offers a favorable combination of spatial and temporal resolution, making it a suitable tool for the qualitative assessment of the liver vascular architecture. While operating an ultrasound scanner is relatively straightforward, a comprehensive understanding of the liver anatomy is required to navigate through the hepatic vasculature of the different liver lobes in mice. Recent studies have focused on describing murine liver anatomy and the hepatic vascular tree using 3D micro-computed Tomography (µ-CT)8,9. Even though some of the morphological differences between human and mouse livers are well documented10, research performed in rodents often adopts anatomical terminologies relevant to humans, leading to some confusion in the context of quadruped animals. Even recognized standardized nomenclature, such as Nomina Anatomica Veterinaria (NVA), lacks sufficient information about consistent terminologies for rodent hepatic vascular structures11. Beyond the challenge of poorly documented anatomical structures in rodents, even greater difficulties arise in interpreting ultrasound readouts, particularly when a reproducible approach is anticipated.
Obtaining non-invasive functional information on living organs across various spatial scales poses challenges for in vivo imaging3. High-end liver imaging modalities such as CT, magnetic resonance imaging and angiography (MRI/MRA), or conventional Doppler imaging using focused waves are essential for evaluating disease progression, but they fail in capturing most blood flow dynamics with the exception of photoacoustic imaging12,13,14. UFUS has a high sensitivity and can detect slow blood flow in small vessels, which are not limited to flow larger than a centimeter per second4,15. Recently, we developed a customized imaging method based on anatomical considerations using UFUS, enabling reliable measurement of the hepatic blood volume in a mouse model with vascular expansion16.
In this protocol, we outline the procedure for non-invasive UFUS imaging of the liver using a commercially available ultrasound platform originally developed for functional brain imaging. To streamline the process and enhance information retrieval, we offer a comprehensive illustration of the mouse liver with anatomical nomenclature and a complete method of analysis. Additionally, we provide a detailed representation of the acquired imaging readouts as a reference, indicating common anatomical structures and landmarks to assist operator-dependent plane selection. Furthermore, we include a relevant illustration of both qualitative and quantitative analyses of the hepatic vasculature.
Protocolo
All animal experiments were performed under European legislation (Directive 2010/63/EU) and Dutch government guidelines and approved by the Animal Ethical Committee of Leiden University Medical Center.
1. Mouse preparation for UFUS imaging (Timing ~ 10 min)
- Preparation of imaging setup
- Centrifuge ultrasound transmission gel in 50 mL tubes at 100 x g for 3-5 min to prevent air bubble formation.
- Turn on the heating pad and warm up to 35 °C. Fill the 3D-printed water tank with deionized water.
NOTE: Water bubbles or small particles present in the water may disturb the Doppler measurement.
- Anesthetization of the animal
- Weigh the animal. Male and female litter mates that are 8-16 weeks old with a bodyweight of 19-32 g were used. Prepare an anesthesia mix of Ketamine with an administration dose of 100 mg/kg and Xylazine 10 mg/kg in 0.9% NaCl. Prepare the mixture sterile and fresh every day because the mixture is not stable and may lose potency.
NOTE: Preferred animal body weight is between 23-30 g. - Disinfect the injection site, i.e., lower right or left quadrant of the abdomen, using gauze and 70% ethanol. Inject 10 µL/g body weight intraperitoneal (ip) with a 27G needle and a 1 mL disposable syringe or a 30G insulin syringe.
- Place the animal back in a cage on a heating pad without closing the cage lid. Start timer.
NOTE: Deep anesthesia should last for approximately 40 min. If a longer imaging session is desired, consider using reversible anesthesia, such as mixtures of Ketamine 60 mg/kg and Medetomidine 0.4 mg/kg in 0.9% NaCl followed by reversal with subcutaneous injection of Atipamezole 1 mg/kg. Injection anesthesia is preferred over inhalation anesthesia because of the imaging setup. - Check the anesthesia's effectiveness. Confirm whether the anesthesia is working by gently pinching the hind paws after approximately 5 min. If the animal still reacts, wait another 2-3 min to achieve full anesthesia.
- Apply ophthalmic ointment to prevent corneal drying and eye trauma when the animal is deep asleep. Check the reflexes again and begin the procedure only when the animal shows no reaction to pinching.
- Weigh the animal. Male and female litter mates that are 8-16 weeks old with a bodyweight of 19-32 g were used. Prepare an anesthesia mix of Ketamine with an administration dose of 100 mg/kg and Xylazine 10 mg/kg in 0.9% NaCl. Prepare the mixture sterile and fresh every day because the mixture is not stable and may lose potency.
- Preparation of the imaging area (Figure 1)
- Trim the belly of the animal gently with a veterinarian trimmer while it is placed on a heating pad. Perform the trimming very gently without applying compression to the chest or abdomen.
- Apply depilatory cream for no more than 2 min.
CAUTION: Do not extend the incubation time of the depilatory cream, as it may cause skin inflammation. This not only affects imaging quality but also may cause discomfort for the animal. - Remove depilatory cream with some paper tissues and clean gently with warm water.
- Position the animal and imaging setup for Doppler measurements (Figure 2A).
- Position the animal dorsally on a heating pad and gently secure the paws using tape. Moisturize the skin with a small amount of warm water.
- Apply the centrifuged ultrasound transmission gel directly on the shaved skin using a 20 mL syringe.
NOTE: Air bubbles may affect Doppler imaging and cause artifacts. - Place the 3D-printed water tank filled with water above the animal. Ensure the height of the water tank is suitable for the animal, approximately 1 mm above it, and does not squeeze the animal.
- Check for any air between the ultrasound transmission gel and the Polymethylpentene thermoplastic (PMP) of the water tank.
2. Probe operation and plane selection (Timing ~ 10 min)
- Start the software and create an experimental session on the system. Start the scanning software.
NOTE: Scanning software is integrated into the system. - Center the motors by clicking on Yes in the pop-up window. A motorized system is used to remotely control the probe by scanning software. By centering the motors, the probe will automatically move in three directions, that is, vertically, laterally, and rotated. Make sure that no objects hinder the trajectory of the probe to avoid damaging the equipment.
NOTE: It is crucial to center the motors; failure to do so can lead to software dysfunction. - Create a new experimental session by selecting Session from the menu. Fill in the required information in the session panel, including Project, Subject, Session, Username, Comment, and Tag. Click Validate.
NOTE: The session needs to be created before acquiring or saving imaging data. Session information can be changed during the experiment, but keep in mind it will also alter the destination for saving data. - Position the probe. The linear 15 MHz ultrasonic probe with 128 elements is connected to the system through a motorized system composed of a four-axis motor module, that is, three translational and one rotational movement direction.
- Go to the Move probe menu and use the computer-controlled positioning system to move the probe into the water in the 3D-printed water tank. Utilize the control buttons indicated in the Probe position to move the motors, defining the steps in mm for translational movement (X, Y, and Z) or in ° for rotational movement (R). To prevent accidents in the Z direction, define the Z limit in Safety.
NOTE: It is crucial that the probe's elements are in contact with the water. However, avoid moving the probe completely into the water, as this may harm the equipment. If the motors cannot reach the position, a warning Out of workspace is displayed. - Save the coordinates as a reference position by clicking on Set Home. Do not modify translations and rotations concurrently because R is relative to X, Y, and Z. Always click on Set Home prior to modifying R.
- Define imaging and visualization parameters. Go to the Live view menu and click on Play to select the plane of interest.
CAUTION: Launch only a Live view or an acquisition when the elements of the ultrasound probe are surrounded by a medium matching the acoustic impedance to ensure the lifespan of the equipment and to prevent overheating.
- Go to the Move probe menu and use the computer-controlled positioning system to move the probe into the water in the 3D-printed water tank. Utilize the control buttons indicated in the Probe position to move the motors, defining the steps in mm for translational movement (X, Y, and Z) or in ° for rotational movement (R). To prevent accidents in the Z direction, define the Z limit in Safety.
- Chose imaging parameters in Preset.
- Load a 10 ms Doppler ultrasensitive ultrasound sequence with the Load Sequence button, for example, 11 compounded plane waves (angles from -10° to 10°) with an imaging voltage of 25 V and a Doppler framerate of 10 ms.
NOTE: There is no need to use a fast Doppler sequence (e.g., 10 ms) in order to image and filter the respiratory movements of the organ during the analysis. - Define imaging depth between 1 mm and 50 mm, with a maximum imageable depth of 50 mm. The default setting is a depth of 9 mm from 1 mm to 10 mm, with the recommended depth between 2 mm and 12 mm.
NOTE: Depending on the size of the animal and the water tank, imaging depth can be tailored to specific needs.
- Load a 10 ms Doppler ultrasensitive ultrasound sequence with the Load Sequence button, for example, 11 compounded plane waves (angles from -10° to 10°) with an imaging voltage of 25 V and a Doppler framerate of 10 ms.
- Select visualization parameters.
- Choose Doppler to image the vasculature.
NOTE: Pixel intensity in A.U. represents blood volume and should be compared only when using the same probe and sequence. - Choose Averaging for applying temporal averaging to optimize signal-to-noise ratio.
NOTE: Temporally averaging the images increases image quality but reduces the frame rate. Depending on the objective, a suitable trade-off should be made. - Choose Image compression: Logarithmic (high), Square root (intermediate), or Linear (low). Alternatively, adapt the contrast range automatically or manually using sliders for high and low contrast options.
NOTE: Data is not affected by the choice of image compression; it only affects the display of the real-time imaging. - Select the Color Map scale from black to white by checking the Grey option or from reddish-black to yellow by checking Hot.
- Choose Doppler to image the vasculature.
- Plane selection (Figure 2B)
- Select the imaging plane on anatomical landmarks. Switch between the visualization of Doppler and B-mode to familiarize with the anatomy of the liver lobes and vasculature.
- Stop the Live view by clicking on the Stop icon.
- Go to the Move probe menu to navigate the probe and select a plane by clicking on Set Home to save the coordinates as a reference position. Ensure that the vascular tree is well-defined and visible with as little out-of-plane signal as possible.
- Go back to the menu Live view and click on the Stop icon.
3. Doppler scan acquisition (Timing ~ 20 min)
- Launch a Doppler acquisition with a 10 ms framerate.
- Go to fUS 2D menu to image hemodynamic variations over time in a specific position (Figure 3). To increase the contrast, administer a bolus of 50 µL intravenously (iv) injected microbubbles with a concentration of 2 x 108 microbubbles per mL to the tail vein.
- In the Preset tap, define the total recording duration in seconds (30 s). Choose a continuous mode with no pause between the images by setting Time between images to 0 s.
- Press the Record button to start the 2D acquisition. The recording can be canceled by pressing the Stop button. Data may be lost when acquisition is interrupted before completion.
- Visualize and adapt the acquired recording.
- Modify the contrast and colormap if desired in tap Visualization. Replay recording if needed by scrolling through the frames with the slider, which is included in the function Time.
- Save the data.
- Provide a name for the acquired recording to save the file in a .scan format in the session folder. A pop-up window to save the data is automatically proposed at the end of every recording. Data is saved automatically.
- Launch another acquisition by clicking on the Preset tab and repeat from step 3.1.1 onwards.
- Remove the imaging setup and take care of the animal.
- Go to the Move probe menu to vertically move the probe up outside the 3D-printed water tank. Remove the setup and ultrasonic gel and unfix the animal.
- Euthanize the animal when the experimental design reaches the endpoint; otherwise, continue with the following steps.
- Apply some moisturizing cream on the shaved skin area of the animal if longitudinal measurements are intended.
- Place the animal back in the cage and let it wake up from anesthesia under a heat lamp to prevent hypothermia. Monitor the animal while recovering.
- Place the animal back in the individually ventilated cage rack when it walks normally again. Finish the laboratory animal experiments before analyzing the data set.
4. Quantitative analysis (Timing ~ 1 h)
- Open the analysis script gui_analysis.m available in Supplementary File 1.
- Select the scan and set the quantitative parameters in settings: 10 regions of interest (ROIs) with a voxel size of 2 x 2. Choose 40 ms for each frame to perform the Doppler integration.
- Draw the vascular periphery of the organ; the 10 ROIs are automatically prepositioned between clearly visible arteries and can be adjusted manually if needed (Figure 4A). Close the floating dialog box when satisfied with the positioning. Ensure a stable acquisition (Figure 4B) for robust blood volume computation, avoiding acquisitions affected by strong motion artifacts (Figure 4C).
- Quantify mean hepatic blood volume in A.U. of the total 10 ROIs by automatically estimating the mean and standard deviation of the quiet frame values within the 30 s recording (Figure 4D).
NOTE: The data table of intensities of ROIs can be copied/pasted directly to a spreadsheet file. - Repeat analysis for at least two additional planes, -0.3 mm, and -0.6 mm, in a caudal direction. Quantify all the acquisition data before performing the statistical analysis.
- Check the standard deviation of intensities on the entire image and determine a cutoff as the overall mean (µ) with 2 standard deviations (2σ) to objectively exclude measurements susceptible to motion artifacts (Figure 4E).
NOTE: The mean and standard deviation of the quiet frame values estimated over the entire image are provided in the first row of the data table.
CAUTION: Motion artifacts prevent robust quantification and should be objectively identified based on analyzing the entire temporal image. - Take the average of all mean hepatic blood volume quantified over 3 different planes in 30 ROIs per animal in step 4.3 (Figure 4F). Apply the ROUT test 1% in a statistical analysis software to identify outlier ROIs before averaging 30 ROIs per animal. To improve the estimation of the blood volume, record additional planes per animal.
- To administrate vehicle treatment, disinfect the injection site, i.e., lower right or left quadrant of the abdomen, using gauze and 70% ethanol. Inject 20 µL of saline or DMSO ip with a 27G needle and a 1 mL disposable syringe or a 30G insulin syringe or administer 100 µL of (Hydroxypropyl) methylcellulose by gavage using a reusable feeding needle 30G with a round tip. Plot data of 3 cohorts receiving saline or DMSO by ip or oral administration (po) of cellulose (Figure 4G). Perform analysis in a blind way without revealing the condition and/or received treatment.
NOTE: Vehicle administration has no impact on blood volume measurements.
Resultados
Following the protocol, imaging of the hepatic vasculature is facilitated based on the standardization of anatomical structures and corresponding terminology (Figure 1). To propose a standardized nomenclature for researchers using preclinical liver models, we schematically displayed the common liver positioning in the abdominal cavity of mice (Figure 1A), provided the structural arrangement of the different hepatic lobes (Figure 1B), and specified the arterial vascular network (Figure 1C). Equipped with anatomical expertise, in vivo UFUS imaging was performed by utilizing a 3D-printed water tank to reduce movement artifacts (Figure 2A). The acoustic impedance was corrected by introducing the probe into water and applying ultrasound transmission gel directly to the shaved skin of the animal. By adopting this setup, breathing and other movement artifacts are reduced since the probe is not in direct contact with the moving chest and abdomen of the animal. This way, we visualized the vascular structure of the right and left lobes, which are easily accessible by UFUS due to their superficial location (Figure 2B). Other liver lobes, such as the caudate and quadrate lobe, are situated deeper in the body, making it more challenging to anatomically identify the hepatic vasculature properly by UFUS.
Having demonstrated the importance of standardized and commonly accepted anatomical indications and interpretations of vascular structures, we performed multiple Doppler scans in various planes to provide a comprehensive overview of the hepatic vasculature imaged by contrast-enhanced UFUS in mice (Figure 3). We delineated the hepatic arterial network of the individual liver lobes, i.e., left lateral (LL), left medial (LM), right lateral (RL), and right medial (RM) lobes. Moreover, major arteries are labeled, such as the abdominal aorta (AA), hepatic artery (HA), left lateral hepatic artery (LLHA), and right medial hepatic artery (RMHA). It is important to note that liver lobes can be slightly differently positioned depending on the placement and peristaltic movement of the small intestine (SM), as well as the state of the stomach (S) filling. This contrast-enhanced overview of the entire mouse liver vasculature provides a comprehensive vascular atlas for in vivo liver imaging by UFUS.
An accurate selection of anatomical planes is crucial for obtaining a quantitative readout derived from one liver lobe. Robust blood volume measurements can be achieved by manually selecting 10 regions of interest (ROI) per plane (Figure 4A). For reliable blood volume quantification of the microcirculation, a stable acquisition is needed with low variation in mean image intensities. This is determined based on the mean image value (MIV) of the entire image over time (Figure 4B), in contrast to a recording that is susceptible to significant motion artifacts (Figure 4C). To handle motion artifacts, the automatic selection of low MIV was used for reliable quantification of hepatic blood volume measurements (Figure 4D) by plotting the standard deviation of all temporal low MIV of an entire image (Figure 4E). Doppler scans of multiple planes per animal show acceptable intra- and inter-variability within and between mice from 3 different cohorts after outlier treatment on 30 ROIs per animal with ROUT test 1% (Figure 4F). To improve the blood volume estimate per animal, it is recommended to record additional planes or increase the number of ROIs selected per plane. In addition, blood volume readings can be used to monitor drug treatment, specifically targeting microvasculature. By administrating the vehicle through two administration routes, we demonstrated that there is no effect on the hepatic blood volume measurements (Figure 4G). These results indicate that gene deletion or delivery of treatment is not affected by vehicle administration, ensuring a robust experimental design. Overall, an objective and reproducible quantitative protocol is provided for future research to explore hepatic vascular defects in various mouse models.

Figure 1: Anatomy of the murine liver. (A) Schematic overview of liver positioning in the abdominal cavity under the diaphragm of the mouse. (B) Schematic description of the murine liver with four liver lobes, i.e., left, quadrate, caudate, and right lobe, and the portal triad consisting of the portal vein, hepatic artery, and bile duct. (C) Schematic illustration of the arterial network of the haptic vasculature. Identification of hepatic arteries (HA) and branches (ramus) with Latin nomenclature provided. Abbreviation: HA = Hepatic artery. Please click here to view a larger version of this figure.

Figure 2: Ultrafast Doppler ultrasound (UFUS) imaging of the hepatic vasculature in mice. (A) Schematic overview of experimental setup for non-invasive in vivo imaging. (B) Schematic illustrationsof the imaging direction and associated representatives of the right and left medial lobe, as well as the left lateral lobe, imaged by UFUS. Abbreviation: AA = Aorta abdominals, LLL = Left lateral lobe, LML = Left medial lobe, RML = Right medial lobe. Scale bar = 1 mm. Please click here to view a larger version of this figure.
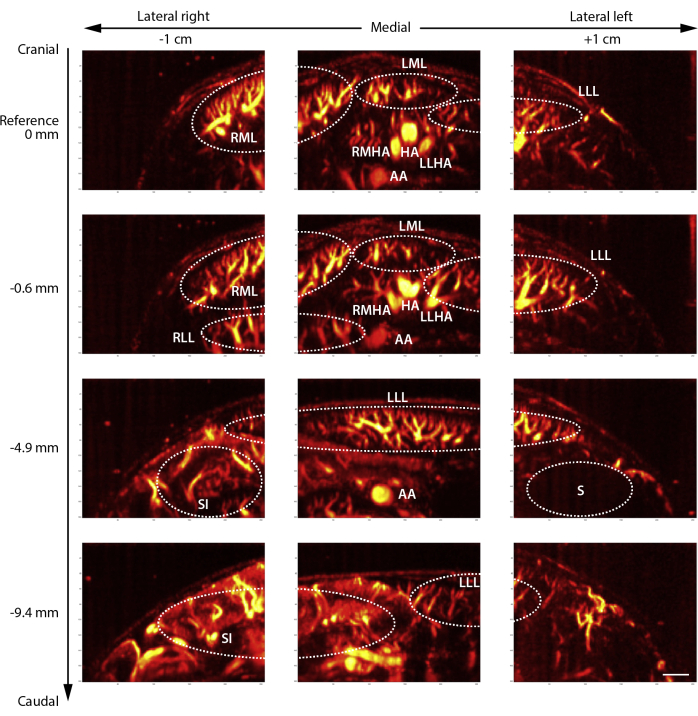
Figure 3: Representative contrast-enhanced ultrafast Doppler ultrasound (UFUS) of the murine hepatic vasculature. An overview of the entire hepatic vasculature of an adult mouse imaged in 3 positions, i.e., lateral right, medial, and lateral left, in 4 planes from cranial towards caudal. Reference is situated directly under the diaphragm imaged in medial and 1 cm lateral on the right and left, with the same planes in a caudal direction. Abbreviation: AA = Aorta abdominals, HA = Hepatic artery, LLL = Left lateral lobe, LLHA = Left lateral hepatic artery, LML = Left medial lobe, RLL = Right lateral lobe, RMHA = Right medial hepatic artery, RML = Right medial lobe, SI = Small intestine, S = Stomach. Scale bar 1 mm. Please click here to view a larger version of this figure.

Figure 4: Ultrafast Doppler ultrasound (UFUS) quantitative measurement of hepatic blood volume. (A) Representatives of the medial lobe (ML) of adult C57BL/6 wildtype control mice in plane 1 selected under the diaphragm, corresponding to 0 mm, plane 2 at -0.3 mm, and plane 3 at -0.6 mm with a selection of 10 regions of interest (ROIs). Scale bar 1 mm. Illustration of Power Doppler of 30s with (B) stable acquisition (grey) and (C) tissue motion (red) based on mean image values in arbitrary units (A.U.) of the whole image for quantitative assessment. (D) Automated recognition of low intensities (A.U.) for quantitative blood volume measurement over time. (E) Standard Deviation (St. Deviation) of low intensities plotted to identify unstable acquisitions (red) caused by motion artifacts indicated by a cut off of overall mean (µ) from number (N) of animals from 3 cohorts with 2 SD (2σ) assessment of standard deviation (SD) of low intensities (A.U.) in physiological condition (gray) in adult C57BL/6 wildtype control mice. (F) Quantification of in vivo measured blood volume changes over time averaging over 3 planes, i.e., 30 ROI in total per animal, are represented as pixel intensity (A.U.). Outlier detection by ROUT test 1%. (G) There is no difference between the type of delivery vehicle and the route of administration. Cohort 1 (n=6) received an intraperitoneal (ip) injection of saline, cohort 2 (n=3) ip injection of DMSO and Cohort 3 (n=6) oral administration (po) of cellulose. One-way ANOVA with Dunnett's multiple comparisons test, ns P > 0.05. Abbreviation: A.U. = Arbitrary units, DMSO = Dimethyl sulfoxide, ip = Intraperitoneal, po = Oral administration, ROI = Region of interest, St. Deviation = Standard Deviation, UFUS = Ultrafast Doppler ultrasound. Please click here to view a larger version of this figure.
Supplementary File 1: Ultrafast Doppler ultrasound (UFUS) quantitative script of hepatic blood volume measurements. Script gui_analysis.m provides a graphical interface for the automatic positioning of the region of interest (ROI) for blood volume measurements. Please click here to download this File.
Discussão
In this protocol, we demonstrate how to perform non-invasive UFUS imaging of the mouse hepatic vasculature. We present a detailed description of the imaging procedure, encompassing animal handling, operation of the ultrasound scanner, and data analysis for computing blood volume changes in vivo. To facilitate ultrasound data interpretation, we provide a comprehensive overview of the anatomical structures that can be clearly visualized by UFUS. Furthermore, we describe a standardized quantification procedure for robust measurements of vascular parameters. Achieving a suitable resolution is possible without the use of a contrast agent, enabling a safe and straightforward quantitative assessment of the hepatic blood volume of the microcirculation. We emphasize the use of standardized anatomical nomenclature to prevent confusion and misinterpretation, particularly when assessing quantitative measurements of microvasculature.
UFUS imaging of murine vasculature has previously been reported, primarily in the field of neuroscience7. Brain imaging is not adversely affected by movement artifacts unlike the liver, which is highly susceptible to breathing motion. Due to its anatomical position under the diaphragm, hair removal in the abdominal region must be performed very gently to avoid introducing irregular breathing by minimizing physical forces on the chest and abdomen region. Moreover, achieving a proper degree of anesthesia is essential to ensure regular oscillating breathing, a factor that can be relatively easily corrected in post-processing steps. The sensitivity of UFUS has been enhanced here by applying a singular value decomposition (SVD) filter to remove motion artifacts6 and by further censoring high motion frames. The high frame rate Power Doppler movies are acquired here at 10 ms to further allow us to visualize and measure the effect of breathing motion on frames that generated high-value peaks due to motion artifacts. The breathing rate could then be identified from the peak in the Fast Fourier transform of the average image signal, and the corresponding peak frames corresponding to the high motion of the organ can be discarded.
Reproducible ultrasound Doppler imaging within a single animal over time, as well as between animals of different body weights, can still face several limitations. Firstly, liver positioning can be influenced by factors such as a highly filled stomach and peristaltic movement of the bowel. This influence is particularly pronounced when selecting the left lateral liver lobe as a reference. Therefore, we recommend choosing the left lateral lobe only in larger animals and prefer the right or left medial lobe in smaller animals. Secondly, heavy non-oscillating breathing motions can occur in distressed animals, resulting in motion artifacts that are challenging to correct and, consequently, cannot be used for blood volume computation. Thus, an appropriate choice of anesthesia, along with a dosage tailored to body weight, is crucial. Lastly, the resolution limit restricts the visualization of the hepatic microvasculature, i.e., blood vessels can be visualized with diameters ranging down to 100 mm3.
The use of contrast agents was recently proposed to acquire a detailed image of the mouse vasculature by tracking microbubbles. Such an approach can achieve high spatial resolution and provide quantitative blood velocity measurements17. However, tracking microbubbles remains highly challenging for moving internal organs especially when acquired in 2D.
Here, we showed that stable hepatic blood volume measurements obtained by ultrafast Doppler could be acquired in control mice from three cohorts receiving different vehicles administered by ip injections or oral gavage. Recently, such blood volume measurements were successfully used in a liver disease mouse model16. To elaborate, vascular expansion was detected on an electron microscopic level and confirmed by quantitative measurements using UFUS. This study emphasized the sensitivity of in vivo assessment to investigate vascular defects on functional and quantitative levels, even with a preserved hepatic angioarchitecture, which is promising for clinical diagnosis and monitoring.
In summary, this protocol serves as a guide for non-invasive qualitative and quantitative studies of the hepatic vasculature in mice. It can be also employed for longitudinal follow-up due to its non-invasive and straightforward procedure. Additionally, it holds the potential to provide functional assessments of blood vessels.
Divulgações
M. Tanter and T. Deffieux are co-founders and shareholders of Iconeus. All other authors have no conflicts of interest to disclose.
Agradecimentos
We thank M.S. Zuurmond (Leiden University Medical Center) for preparing the graphical illustrations. This protocol was derived and adapted from our previously published original work de Haan et al. 202216. This project has received funding from the European Union's Horizon 2020 research and innovation program under the Marie Skłodowska-Curie Grant agreement No. 813839; the Netherlands Organization for Health Research and Development (ZonMw) PTO 446002501 in collaboration with CVON-PHAEDRA Impact; Health Holland (PPS-Match call LUMC Top sector LSH 2020), project NV-STAB; The Novo Nordisk Foundation Centre for Stem Cell Medicine that is supported by a Novo Nordisk Foundation grant (NNF21CC0073729); by the European Innovation Council EIC Pathfinder Program Project MICROVASC n° 101070917; French National Research Agency ANR-17-T171105J-RHUS-0009 project RHU Quid-Nash; French National Research Agency ANR-22-CE19-0034-03, project Peri-fUS; and INSERM (Institut National de la Santé et de la Recherche Médicale) Accelerator of Technological Research in Biomedical Ultrasound.
Materiais
| Name | Company | Catalog Number | Comments |
| (Hydroxypropyl)methyl cellulose HPMC | Sigma-Aldrich | H7509 | 0.5% HPMC |
| Centrifuge ZentriMix 380 R | Hettich | 3200 | |
| Centrifuge Tubes 50 mL conical Sterile Polypropylene | CELLSTAR tubes | 227 261 | |
| Cotton tips | Meditip Clean | G80215 | |
| Deionized water | in house | ||
| Depilatory cream | nearby drugstore | ||
| Dimethyl sulfoxide (DMSO) | Sigma | D2650-5X5ML | sterile |
| Ethanol absolute | FRESENIUS KABI | 010-0622-1 | |
| Feeding needle, reusable | FST Fine Science Tools | 18064-20 | |
| Forceps with fine tip Dumont #5 forceps | FST Fine Science Tools | 11252-00 | |
| Gauze pads 5 x 5 cm | Klinipress | 175 004 | |
| GraphPad Prism | GraphPad Software, Inc | Version 9 | |
| GUI analysis script | Inserm | gui_analysis.m | needs a 10 ms Doppler scan |
| Heating pad 17 x 17 cm, 6 W | ThermoLux Acculux | 461265 | |
| Insulin syringe 30G 0.30 x 8 mm, 0.3 mL and 0.5 mL | BD Microfine + Demi | 25636 | |
| Ketamine Anesketin | Dechra | REG NL 111764 | 100 mg/mL |
| Kimwipes KIMTECH low-lint wiper | ULINE | S-8115 | |
| Lab tape 19 mm x 50 m x 0.125 mm | Stokvis | M451 | |
| MATLAB software | MathWorks | Version R2022b | |
| Moisturizing cream | nearby drugstore | ||
| Needle yellow 30G 0.3 x 13 mm | BD Microlance | 304000 | |
| Ophthalmic ointment Oculentum Simplex | Added Pharma | 220201 | |
| Paper tissues | in house | ||
| Permanent lab marker | VWR | 52877-310 | |
| Physiological salt solution (NaCl 0.9%) | FRESENIUS KABI | B102986 | sterile |
| Sharps disposable container Medical Dispo 2.5 L | APmedical | UN3291 | |
| Sterile safe-lock 1.5 mL tubes | Eppendorf | 0030 120.086 | |
| Syringe 1 mL | BD Plastipak | 303172 | |
| Syringe 20 mL Luer-Lok | BD Plastipak | 300629 | |
| Timer | West Bend | 40053 | |
| Trimmer | Exacta Aesculap | GT416 | |
| Ultrafast ultrasound platform | Iconeus & INSERM 'Biomedical Ultrasound' ART | Iconeus One prototype | with a 10ms sequence |
| Ultrasound transmission gel Aquasonic 100 | Parker Laboratories INC. | BT-025-0037N | |
| Water tank 3D printed 10 x 10 x 1.5 cm polymethylpentene (PMP) 0.125 mm | GoodFellow Cambridge limited | ME311100/2 | CAD file upon request |
| Xylazine Sedamun | Dechra | REG NL 10084 | 20 mg/mL |
Referências
- Poisson, J., et al. Liver sinusoidal endothelial cells: Physiology and role in liver diseases. J Hepatol. 66 (1), 212-227 (2017).
- Gracia-Sancho, J., Caparrós, E., Fernández-Iglesias, A., Francés, R. Role of liver sinusoidal endothelial cells in liver diseases. Nat Rev Gastroenterol Hepatol. 18 (6), 411-431 (2021).
- Deffieux, T., Demene, C., Pernot, M., Tanter, M. Functional ultrasound neuroimaging: a review of the preclinical and clinical state of the art. Curr Opin Neurobiol. 50, 128-135 (2018).
- Macé, E., et al. Functional ultrasound imaging of the brain: Theory and basic principles. IEEE Trans Ultrason Ferroelectr Freq Control. 60 (3), 492-506 (2013).
- Tanter, M., Fink, M. Ultrafast imaging in biomedical ultrasound. IEEE Trans Ultrason Ferroelectr Freq Control. 61 (1), 102-119 (2014).
- Demené, C., et al. Spatiotemporal clutter filtering of ultrafast ultrasound data highly increases Doppler and fUltrasound sensitivity. IEEE Trans Med Imaging. 34 (11), 2271-2285 (2015).
- Deffieux, T., Demené, C., Tanter, M. Functional ultrasound imaging: A new imaging modality for neuroscience. Neuroscience. 474, 110-121 (2021).
- Fiebig, T., et al. Three-dimensional in vivo imaging of the murine liver: A micro-computed tomography-based anatomical study. PLoS One. 7 (2), e31179 (2012).
- Sänger, C., et al. Intrahepatic vascular anatomy in rats and mice - Variations and surgical implications. PLoS One. 10 (11), e0141798 (2015).
- Higashiyama, H., et al. Anatomy of the murine hepatobiliary system: A whole-organ-level analysis using a transparency method. Anat Rec. 299 (2), 161-172 (2016).
- Szklaruk, J., Bhosale, P., Luersen, G. State-of-the-art cross-sectional liver imaging: beyond lesion detection and characterization. J Hepatocell Carcinoma. 2, 101-117 (2015).
- Lv, J., Xu, Y., Xu, L., Nie, L. Quantitative functional evaluation of liver fibrosis in mice with dynamic contrast-enhanced photoacoustic imaging. Radiology. 300 (1), 89-97 (2021).
- Sun, T., et al. In vivo liver function reserve assessments in alcoholic liver disease by scalable photoacoustic imaging. Photoacoustics. 34, 100569 (2023).
- Macé, E., et al. Functional ultrasound imaging of the brain. Nat Methods. 8 (8), 662-664 (2011).
- de Haan, W., et al. Endothelial Zeb2 preserves the hepatic angioarchitecture and protects against liver fibrosis. Cardiovasc Res. 118 (5), 1262-1275 (2022).
- Couture, O., Hingot, V., Heiles, B., Muleki-Seya, P., Tanter, M. Ultrasound localization microscopy and super-resolution: A state of the art. IEEE Trans Ultrason Ferroelectr Freq Control. 65 (8), 1304-1320 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados