Method Article
Isolando células mononucleares do sangue periférico humano de Buffy Coats por meio de separação de esferas imunomagnéticas de alto rendimento
Neste Artigo
Resumo
Este protocolo detalha um método compatível com automação de alto rendimento para isolar células mononucleares do sangue periférico humano para biobancos e outros fins.
Resumo
As células mononucleares do sangue periférico (PBMCs) são uma população heterogênea de monócitos e linfócitos. As PBMCs criopreservadas têm viabilidade estável no armazenamento de longo prazo, tornando-as um tipo de célula ideal para muitos fins de pesquisa a jusante, incluindo citometria de fluxo, imunoensaios e sequenciamento do genoma. Normalmente, os PBMCs são isolados por centrifugação de gradiente de densidade, no entanto, é um fluxo de trabalho de baixo rendimento que é difícil e caro de escalar. Este artigo apresenta um fluxo de trabalho de alto rendimento usando um método de isolamento PBMC baseado em esferas magnéticas que é rápido de implementar. A concentração celular total, a viabilidade e a distribuição populacional com PBMCs obtidas usando isolamento de gradiente de densidade foram comparadas, e a viabilidade celular e a proporção de tipos de células foram comparáveis para ambas as técnicas. As PBMCs isoladas demonstraram mais de 70% de viabilidade até 9 dias após a coleta de sangue, embora o rendimento tenha diminuído pela metade após 5 dias em comparação com as PBMCs processadas dentro de 24 h após a coleta. Em resumo, este artigo descreve um protocolo PBMC que utiliza uma abordagem baseada em esferas para se adaptar a um fluxo de trabalho de alto rendimento e demonstra que os métodos manuais e automatizados baseados em esferas podem aumentar a capacidade de processamento e fornecer flexibilidade para vários orçamentos.
Introdução
O isolamento de células mononucleares do sangue periférico (PBMC) é uma técnica que separa e isola linfócitos e monócitos de outros constituintes do sangue total. Os PBMCs são um tipo de célula versátil usado para inúmeras aplicações, incluindo, mas não se limitando a, imunoterapia, desenvolvimento de vacinas, identificação de alvos ou biomarcadores e desenvolvimento de medicamentos de anticorpos/moléculas pequenas 1,2. Essas células podem ser isoladas de indivíduos saudáveis ou doentes e podem ser usadas imediatamente em processos a jusante ou criopreservadas para pesquisas futuras3. Em alguns casos, o propósito a jusante é conhecido, enquanto em outros, como é comum em biobancos, os PBMCs são isolados e armazenados para futuras aplicações não especificadas4.
A centrifugação por gradiente de densidade é a técnica tradicional para isolar PBMCs 5,6,7 do sangue total, utilizando a separação diferencial dos tipos de células constituintes com base na densidade celular durante a centrifugação. Embora possa haver alguma variação neste método, o sangue total é geralmente diluído com solução salina tamponada com fosfato (PBS), em camadas sobre um meio de gradiente de densidade em um tubo de centrífuga especializado ou padrão e, em seguida, girado. Quatro camadas distintas resultam: a camada superior de plasma é enriquecida com plaquetas, uma fina camada de PBMC está acima do meio de gradiente de densidade e, finalmente, a camada inferior consiste em glóbulos vermelhos (RBCs) e granulócitos. Embora esse método tenha sido anteriormente denominado "padrão ouro"8, existem limitações para o aumento de escala, como longo tempo de processamento, capacidade de centrífuga, dificuldade em aliquotar outros produtos sanguíneos (ou seja, plasma e hemácias) e ser trabalhoso para automatizar. Embora a automação seja possível para este método9, ela requer uma programação abrangente de um manipulador de líquidos (com um módulo de centrifugação totalmente automatizado) e continuaria sendo um processo demorado.
A partir de agora, é apresentado um fluxo de trabalho alternativo que usa a separação de esferas imunomagnéticas com um ímã de oito suportes para processamento manual ou um instrumento para processamento totalmente automatizado. Este método utiliza um coquetel de anticorpos que é adicionado às células e se liga a populações de células indesejadas, neste caso, plaquetas, granulócitos e hemácias. Essas populações indesejadas são subsequentemente removidas por separação magnética, deixando as populações de monócitos e linfócitos na fração negativa que estão prontas para processamento a jusante10. Este método de seleção negativa é mais rápido do que os métodos de seleção positiva, que requerem etapas adicionais para remover o anticorpo e o complexo de esferas magnéticas dos PBMCs. A seleção negativa também é vantajosa, pois foi descrita como uma forma de preservar a funcionalidade celular11,12.
Protocolo
Amostras de sangue de controle de qualidade e dados gerados internamente (como contagem de células, viabilidade e idade da amostra no processamento) foram obtidos de estudos de pesquisa consentidos no NSW Health Statewide Biobank, Royal Prince Alfred Hospital (aprovação HREC: 2019/ETH06776). Amostras de sangue humano adulto processadas (ou seja, com plasma esgotado), não rastreadas e não identificadas foram coletadas em tubos de EDTA. Essas amostras de sangue de controle de qualidade foram processadas menos de 72 h após a coleta e foram usadas para experimentos de isolamento de PBMC comparando o gradiente de densidade e os métodos baseados em esferas. Para o método de separação do gradiente de densidade usado nos resultados representativos, consulte o procedimento no Arquivo Suplementar 1. Os detalhes dos reagentes e do equipamento usado para este estudo estão listados na Tabela de Materiais.
1. Preparação de sangue total
- Inverta suavemente 10 mL de tubos de sangue total (revestidos com ácido etilenodiaminotetracético [EDTA], ácido-citrato-dextrose [ACD] ou heparina de lítio) 10 vezes à temperatura ambiente.
- Opcional: Se for necessário armazenar sangue total, alíquota em criotubos para armazenamento a -80 °C.
- Centrifugar os tubos com um rotor de balde oscilante a 800 x g durante 10 min a 22 °C com o travão ligado (9 acelerações/9 desacelerações).
2. Coleção de casacos Buffy
- Após a centrifugação, coloque as amostras em uma cabine de segurança biológica e verifique as três camadas distintas (conforme mostrado na Figura 1).
NOTA: As hemácias são encontradas na camada vermelha escura inferior do tubo da centrífuga. Uma camada branca opaca contendo glóbulos brancos e plaquetas está localizada acima da camada de hemácias, conhecida como camada leucocitária. A camada amarela superior contém plasma. - Opcional: Se o plasma for armazenado, alíquota do plasma em criotubos para armazenamento a -80 °C.
- Pipete 1 mL de buffy coat (material de partida) de um tubo de sangue de 10 mL e transfira para o tubo especificado e rotulado na etapa 3.1 e na etapa 4.1 para os métodos manual e automatizado, respectivamente. Agite o buffy coat (camada branca opaca) usando a ponta da pipeta e colete o buffy coat por aspiração.
NOTA: Menos de 100 μL de plasma e hemácias são aceitáveis durante a aspiração. Se vários tubos de sangue forem coletados para um participante, os casacos buffy podem ser agrupados; no entanto, isso pode afetar a concentração plaquetária13. - Para processamento manual, vá para a seção 3. Para processamento automatizado, prossiga para a seção 4.
- Opcional: Se as hemácias forem armazenadas, alíquota das hemácias em criotubos para armazenamento a -80 °C.
3. Purificação PBMC - Método manual
NOTA: Até 8 amostras por suporte magnético podem ser processadas por um único operador.
- Rotule os tubos de poliestireno de 3 x 5 mL com as letras A-C.
NOTA: Use a numeração sequencial se estiver executando mais de uma amostra, ou seja, 1A, 1B, 1C, 2A, 2B, 2C. - Adicione 60 μL de EDTA 0,1 M (para uma concentração final de EDTA de 6 mM, pH 8,0, consulte o Arquivo Suplementar 2 para a receita) ao tubo A contendo o revestimento leucocitário transferido na etapa 2.3.
- Adicione 50 μL do tubo de mistura de coquetel (consulte a Tabela de Materiais) ao tubo A, misture pipetando para cima e para baixo pelo menos 3 vezes e incube por 5 min em temperatura ambiente.
- Adicione 890 μL de PBS ao tubo A e misture pipetando para cima e para baixo pelo menos 3 vezes.
- Vortex o tubo magnético do grânulo (ver Tabela de Materiais) por 30 s.
- Adicione 50 μL das esferas magnéticas ao tubo A e misture pipetando para cima e para baixo pelo menos 3 vezes.
- Coloque imediatamente o tubo A no suporte magnético e incube por 5 min em temperatura ambiente.
- Pipete cuidadosamente a suspensão de células enriquecidas para o tubo B, coletando a fração clara sem hemácias (<100 μL) para recuperação ideal de PBMC.
NOTA: Não perturbe as contas presas ao ímã. Recomenda-se uma pipeta de transferência. - Remova o tubo A do suporte magnético e descarte.
- Adicione 50 μL de esferas magnéticas à suspensão da célula no tubo B e misture pipetando para cima e para baixo pelo menos 3 vezes.
- Coloque imediatamente o tubo B no suporte magnético e incube por 5 min em temperatura ambiente.
- Pipetar cuidadosamente a suspensão de células enriquecidas para o tubo C, recolhendo apenas a fracção límpida.
NOTA: Não perturbe as contas presas ao ímã. Recomenda-se uma pipeta de transferência. - Remova o tubo B do suporte magnético e descarte.
- Coloque imediatamente o tubo C no suporte magnético e incube por 5 min em temperatura ambiente.
- Pipete cuidadosamente a suspensão de células enriquecidas em um tubo de centrífuga rotulado e complete até 2 mL com PBS.
- Transfira 50 μL da suspensão de células para um copo de amostra do contador de células automatizado. Para uma contagem de células de diluição de 1:10, adicione 450 μL de PBS. Prossiga para a seção 5 para as etapas de contagem de células.
4. Purificação PBMC - Método automatizado
NOTA: Até 4 amostras podem ser processadas por um único instrumento PBMC automatizado. Vários instrumentos podem ser executados em paralelo por um único operador.
- Rotule 2 tubos de 14 mL com as letras A e B, 1 tubo de centrífuga de 50 mL com a letra C e 1 tubo de centrífuga de 50 mL com "resíduo".
NOTA: Apenas um recipiente de resíduos é necessário para cada execução no instrumento PBMC automatizado. Use numeração sequencial se realizar mais de uma amostra, ou seja, 1A, 1B, 1C, 2A, 2B, 2C. - Adicionar 60 μL de EDTA 0,1 M (para uma concentração final de EDTA de 6 mM) ao tubo A que contém o revestimento leucocitário transferido no passo 2.3.
- Vortex o tubo de esferas magnéticas (ver Tabela de Materiais) por 30 s.
- Ligue o instrumento PBMC automatizado ligando a alimentação na parte frontal do instrumento.
- Na tela inicial do instrumento PBMC automatizado, selecione profile e selecione o protocolo desejado.
NOTA: EasySep Direct Human PBMC isolation 19654 - buffy coat foi o perfil de protocolo selecionado para este isolamento PBMC. Consulte o procedimento padrão do fabricante para este perfil no relatório de protocolo14. - Insira o volume inicial (a quantidade de buffy coat aspirado no tubo A) e repita para cada amostra.
- Selecione todos os quadrantes que usarão o mesmo kit de reagentes.
NOTA: Se o mesmo protocolo for usado para mais de um quadrante, o instrumento PBMC automatizado sugerirá o uso do mesmo kit de reagentes para todos os quadrantes14. - Carregue o carrossel do instrumento com consumíveis rotulados, pontas de filtro e recipiente tampão. O kit de reagentes contendo o tubo de esferas magnéticas e o tubo de mistura de coquetel deve ser carregado no quadrante 1.
NOTA: O instrumento perguntará se o usuário deseja usar 1 kit de reagentes para todos os quadrantes. Selecione 'sim' e destaque todos os quadrantes usando o kit de reagentes. - Quando o carregamento estiver concluído, remova as tampas dos consumíveis e reagentes e selecione executar na tela do instrumento.
- Quando a execução estiver concluída, selecione descarregar e remover samples (contendo suspensão PBMC rotulada no tubo C) do carrossel do instrumento. Armazene o tubo de esferas magnéticas, o tubo de mistura de coquetel e o recipiente tampão a 4 °C. Descarte os tubos rotulados como A, B e resíduos (consulte a etapa 4.1) e as pontas do filtro.
NOTA: Não é necessário recarregar com PBS para o método automatizado, pois a suspensão PBMC produz um volume final de 7 mL. - Transfira 500 μL das células para um copo de amostra para uma contagem de células sem diluição. Prossiga para a seção 5 para contagem de células.
5. Contagem de células
- Realize a contagem e a viabilidade das células usando o método de exclusão do corante azul de tripano, seguindo as instruções do fabricante15.
NOTA: Para os processos internos do autor, a análise de células é realizada usando um contador de células automatizado com as seguintes configurações para adquirir os PBMCs.
Factor de diluição = 10 (para o protocolo manual, se a suspensão da célula for de baixo volume) ou 1 (para o protocolo automatizado)
Tipo de célula: PBMC
Faixa de concentração = 5 x 104 a 1 x 107 células/mL
Faixa de tamanho (diâmetro) = 8 μm a 50 μm
Número de imagens = 50
6. Preparação para criopreservação
- Centrifugar (utilizando um rotor de balde oscilante) os tubos de amostra a 300 x g durante 8 min a 22 °C com o travão ligado (9 acelerações/9 desacelerações).
- Após a centrifugação, coloque as amostras de volta no gabinete de segurança biológica.
- Usando uma pipeta, remova cuidadosamente o sobrenadante. Uma pequena quantidade de sobrenadante pode ser deixada com o pellet PBMC para garantir que não seja perturbado.
- Ressuspenda o pellet em 3 mL de meio de criopreservação a frio. Misture lenta e suavemente a suspensão para cima e para baixo até ficar homogênea.
NOTA: O volume do meio de ciropreservação pode ser ajustado com base na concentração final desejada de PBMC. - Dispense 1 mL do PBMC ressuspenso em um criotubo pré-atribuído e coloque-o dentro de um recipiente de congelamento da taxa de controle por um mínimo de 4 h a -80 ° C.
NOTA: O volume de PBMCs alíquotados para cada criotubo pode ser ajustado com base na preferência do investigador. - Depois de armazenar os criotubos a -80 °C por um período mínimo de 4 h, transfira os criotubos para um tanque de fase de vapor de nitrogênio líquido para armazenamento de longo prazo.
7. Análise estatística de dados
- Os dados representativos dos resultados foram analisados usando software estatístico e gráfico, conforme especificado no Arquivo Suplementar 3.
Resultados
As proporções de linfócitos, monócitos, neutrófilos, eosinófilos e basófilos pré (ou seja, no sangue total) e pós-isolamento de PBMC foram medidas quando as PBMCs foram isoladas usando o método de separação baseado em esferas ou gradiente de densidade. As proporções de linfócitos e monócitos foram significativamente enriquecidas por ambos os métodos (Figura 2A,B). Além disso, as proporções de neutrófilos, eosinófilos e basófilos (ou seja, granulócitos) diminuíram significativamente em PBMCs isoladas pelo método baseado em grânulos (Figura 2C-F). Não houve diferenças significativas nas proporções de linfócitos, monócitos, neutrófilos, eosinófilos, basófilos e granulócitos entre os métodos de gradiente de densidade e baseado em esferas (Figura 2). A porcentagem de recuperação foi calculada adicionalmente para os tipos de células listados acima (ver Figura Suplementar 1). As viabilidades celulares médias foram superiores a 95% para ambos os métodos e não foram significativamente diferentes (Figura 3A). Os PBMCs também foram contados usando uma faixa de tamanho (diâmetro) de 8 μm a 50 μm, onde o método de separação por gradiente de densidade produziu contagens totais de células aproximadamente duas vezes maiores ( Figura 3B ).
Em seguida, o método automatizado baseado em contas foi comparado ao método manual. Não foram identificadas diferenças significativas para a viabilidade celular (Figura 4A) ou contagem total de células (Figura 4B) usando o método manual ou automatizado. O tempo para processar essas 8 amostras foi comparado, incluindo o tempo de não intervenção humana. O tempo total de processamento de 8 amostras foi de 43 min vs. 57 min para o manual vs. o método automatizado. O método automatizado incluiu 35 minutos de processamento sem intervenção (Figura 4C).
O fluxo de trabalho baseado em esferas de isolamento de PBMC (com alíquota de sangue total e plasma) foi testado ao longo de 9 meses, em que 1410 amostras de PBMC foram isoladas de sangue humano não rastreado usando a plataforma manual para os primeiros 820 participantes e, em seguida, usando o método automatizado para os próximos 590 participantes. O processamento foi realizado no mesmo dia ou até 10 dias após a coleta, de acordo com os critérios de aceitação do estudo, com atrasos no processamento em grande parte devido aos tempos de trânsito da amostra. Com o método manual ou automatizado, os PBMCs processados dentro de 24 h após a coleta tiveram a maior viabilidade e recuperação (Figura 5). A viabilidade celular média foi de >90% para PBMCs processadas em 5 dias e >70% para PBMCs processadas em 10 dias (Figura 5A). Os rendimentos médios de PBMC diminuíram 50% após 5 dias em comparação com as amostras processadas em 24 h (Figura 5B).
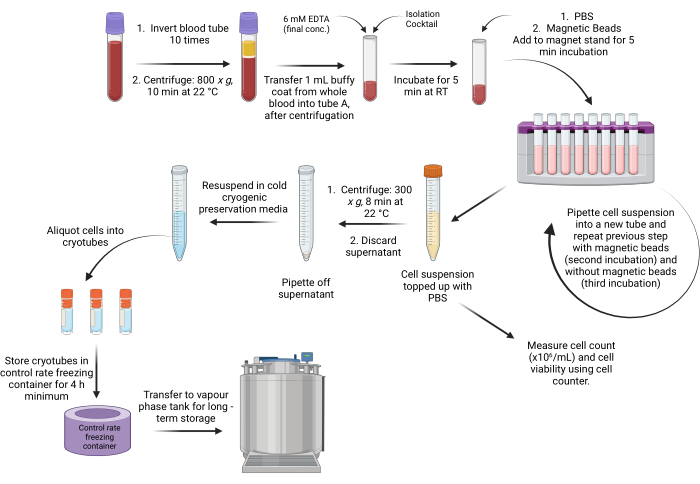
Figura 1: Fluxo de trabalho esquemático do protocolo de isolamento PBMC baseado em esferas do buffy coat. Clique aqui para ver uma versão maior desta figura.
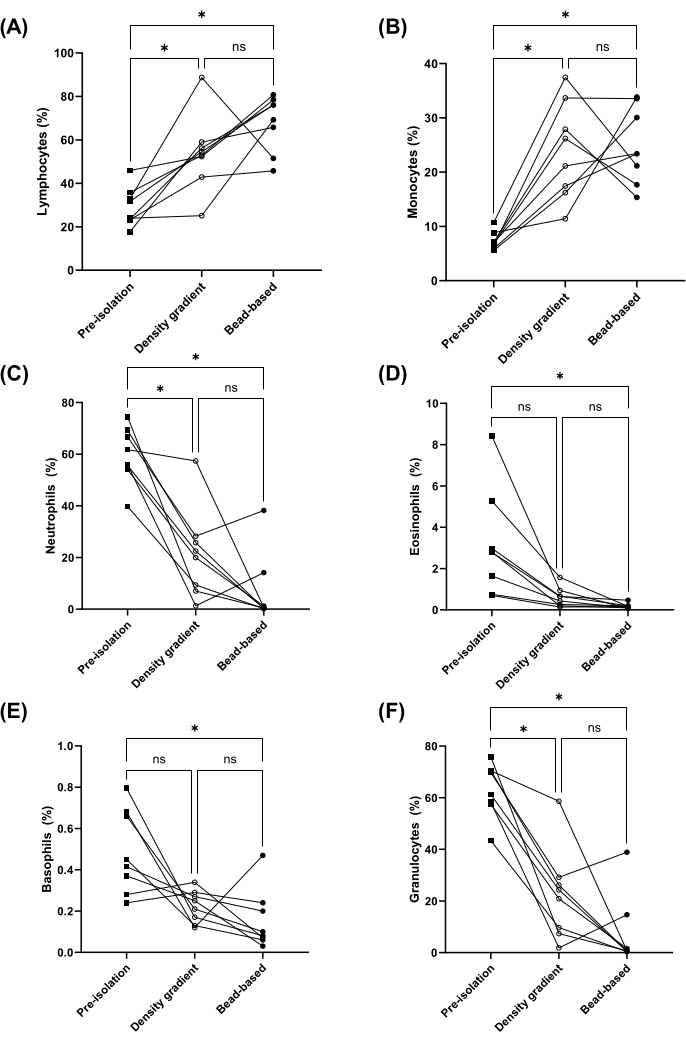
Figura 2: Proporções de linfócitos, monócitos, neutrófilos, eosinófilos, basófilos e granulócitos no sangue total pré e pós-isolamento de PBMC por gradiente de densidade e métodos baseados em esferas. Porcentagem de linfócitos (A), monócitos (B), neutrófilos (C), eosinófilos (D), basófilos (E) e granulócitos (F) em sangue total pareado pré-isolamento de PBMC (quadrados) e em PBMCs pós-isolamento pelo método gradiente de densidade (círculos abertos) ou baseado em contas (círculos fechados) (n = 8). ns = não significativo e *p < 0,05 conforme determinado por One-Way ANOVA (A e B) ou teste de Friedman (C- F). Clique aqui para ver uma versão maior desta figura.
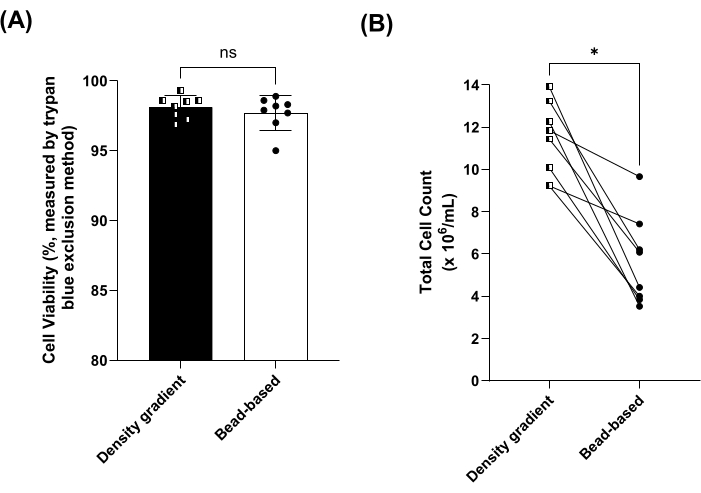
Figura 3: Viabilidade e contagem total de células de PBMC isoladas por gradiente de densidade e métodos baseados em esferas. (A) Viabilidade celular média (± DP) para amostras processadas usando gradiente de densidade (quadrados, barra escura) vs. métodos baseados em contas (círculos, barra aberta) para 8 amostras emparelhadas. ns = não significativo pelo teste t pareado. (B) Contagem total de células para amostras processadas usando gradiente de densidade (quadrados, barra escura) vs. métodos baseados em contas (círculos, barra aberta) para 8 amostras emparelhadas. *p < 0,05 determinado usando um teste t pareado. Clique aqui para ver uma versão maior desta figura.
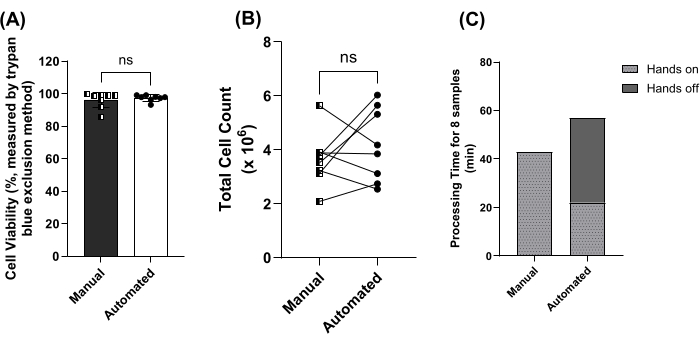
Figura 4: Comparação de métodos manuais e automatizados baseados em contas. (A) Viabilidade celular média (± DP) para amostras processadas usando manual (quadrados, barra escura) vs. métodos automatizados (círculos, barra aberta) baseados em contas para 8 amostras emparelhadas. ns = não significativo pelo teste de Mann-Whitney. (B) Contagem total de células para amostras processadas usando manual (quadrados) vs. métodos automatizados (círculos) baseados em contas para 8 amostras emparelhadas. ns = não significativo pelo teste t pareado. (C) Tempo de processamento para 8 amostras processadas usando manual vs. métodos automatizados, incluindo períodos de tempo hands-on (barra de luz) e hands-off (barra escura). Clique aqui para ver uma versão maior desta figura.
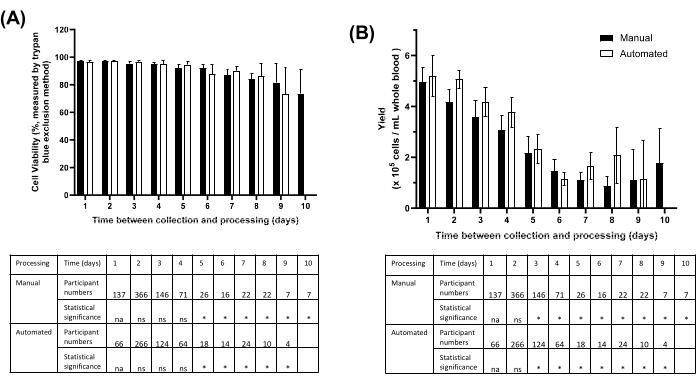
Figura 5: Viabilidade e rendimento de PBMC isolado do método baseado em grânulos manualmente ou usando automação de acordo com o tempo entre a coleta da amostra e o armazenamento do PBMC. (A) Viabilidade celular média (± IC 95%) para amostras de participantes processadas usando manual (barra escura) vs. métodos automatizados (barra aberta) baseados em contas. Tabela detalhando os números dos participantes. ns = não significativo. na = não aplicável. *p < 0,05 pelo teste de comparações múltiplas de Tukey. (B) Contagem total de células para amostras de participantes processadas usando manual (barra escura) vs. métodos automatizados (barra aberta) baseados em contas. Tabela detalhando os números dos participantes. ns = não significativo. na = não aplicável. *p < 0,05 pelo teste de comparações múltiplas de Tukey. Nenhum valor para o Dia 10 Automatizado devido ao número de replicações ser menor que 3. Clique aqui para ver uma versão maior desta figura.
Figura suplementar 1: Figura de recuperação percentual diferencial da célula com o gradiente de densidade e métodos baseados em contas. A porcentagem foi calculada usando contagens absolutas de células pré-isolamento em sangue total e suspensão de células pós-isolamento usando o método do gradiente de densidade (quadrados, barra escura) e método baseado em contas (círculos, barra aberta) (n = 8). ns = não significativo e *p < 0,05 conforme determinado pelo teste t não pareado. Clique aqui para baixar este arquivo.
Arquivo Suplementar 1: Protocolo de gradiente de densidade. Clique aqui para baixar este arquivo.
Arquivo Suplementar 2: Preparação de EDTA 0,1 M, pH 8,0 em PBS. Clique aqui para baixar este arquivo.
Arquivo Suplementar 3: Procedimentos detalhados realizados para gerar os dados representativos. Clique aqui para baixar este arquivo.
Discussão
PBMCs humanos são tipos de células versáteis usados para vários ensaios; no entanto, o rendimento do isolamento costuma ser uma limitação em muitos laboratórios, incluindo biobancos16. Anteriormente, o NSW Health Statewide Biobank isolou PBMCs usando o método de gradiente de densidade. A automação foi investigada para o método de separação de gradiente de densidade para aumentar a capacidade de processamento, mas foram identificadas barreiras à implementação, incluindo (i) o custo de um manipulador de líquidos com uma unidade de centrifugação a ser totalmente automatizada, com a necessidade adicional de uma unidade HEPA para produzir um produto estéril, (ii) pessoal treinado para programação e (iii) tempo necessário para teste de protocolo. Portanto, este estudo explorou métodos alternativos e identificou o kit PBMC humano obtido comercialmente que poderia ser usado para processamento manual e automatizado. A esterilidade é garantida, pois o equipamento necessário para o processamento se encaixa em uma cabine de segurança biológica padrão (comprimento de 1,2 m). Este artigo detalha as modificações feitas no protocolo14 recomendado pelo fabricante, para aumentar a eficiência e reduzir os custos dos reagentes sem sacrificar a qualidade. Além disso, o protocolo do fabricante foi estendido para detalhar as etapas das amostras do biobanco para pesquisas futuras, incluindo sangue total (etapa 1.2), plasma (etapa 2.2) e hemácias (etapa 2.5) alíquotas do tubo de sangue original, bem como contagem de células e criopreservação.
Neste estudo, três protocolos de isolamento PBMC foram comparados: separação por gradiente de densidade, isolamento manual e automatizado baseado em cordão. Foram feitas modificações no protocolo manual baseado em esferas do fabricante, incluindo a remoção da diluição do revestimento leucocitário antes do isolamento de PBMC e a eliminação da exigência de interrupção para centrifugações, permitindo que os investigadores sigam um protocolo de isolamento PBMC adaptável, econômico e de alto rendimento. Primeiro, oito amostras de sangue total combinadas foram usadas para isolar PBMCs para comparar a separação do gradiente de densidade e a técnica manual baseada em esferas. É importante ressaltar que as distribuições da população celular, a viabilidade celular e a recuperação de PBMCs não foram significativamente diferentes entre os dois métodos comparados, conforme mostrado na Figura 2A-F, Figura 3A e Figura Suplementar 1, respectivamente. Nos dados representativos, as contagens de células foram maiores para o método de separação do gradiente de densidade usando o método de exclusão de azul de tripano, mas não quando um analisador de células hematológicas foi usado. As configurações do tipo de célula PBMC no contador de células empregaram uma faixa de diâmetro de célula de 8-50 μm e, portanto, as contagens incluirão PBMCs, bem como granulócitos (aproximadamente 12-15 μm de diâmetro) ao usar o método de exclusão de azul de tripano17. Embora o contador de células hematológicas tenha oferecido maior especificidade do que o método de exclusão do azul de tripano, alguns cálculos de recuperação foram superiores a 100%, refletindo a margem de erro do instrumento (ver Figura 1 suplementar). Recomenda-se, portanto, que os investigadores apliquem uma combinação de técnicas de contagem de células ao comparar os rendimentos dos protocolos de isolamento de PBMC, pois a maioria das técnicas não oferece contagens diferenciais de células específicas e altamente sensíveis. Além disso, não foram realizados ensaios para comparar a atividade funcional das PBMCs produzidas em ambas as técnicas, o que é uma limitação de nossa análise.
Em seguida, os métodos manuais e automatizados baseados em grânulos foram comparados, e nenhuma diferença significativa entre o rendimento ou a viabilidade do PBMC foi identificada em 8 amostras pareadas (Figura 4A, B). As populações de células não foram comparadas individualmente, pois o mesmo coquetel de isolamento de anticorpos foi usado para ambos os métodos. É importante ressaltar que o tempo prático para processar 8 amostras foi reduzido de 43 min para 22 min usando o protocolo automatizado (Figura 4C). Embora o rendimento, a prevenção do esgotamento do técnico e a consistência do processamento de amostras sejam garantidos usando automação, o custo de reagentes e consumíveis é significativamente maior, 3-4 vezes maior do que o método manual baseado em esferas. Isso ocorre depois de fazer modificações no protocolo do fabricante para usar 1 mL de buffy coat (de um volume de sangue total de 10 mL) em vez da faixa recomendada de 2-5 mL (de um volume de sangue total de 10 mL ou mais). Se o orçamento for uma limitação, optar pelo método manual pode reduzir o tempo de processamento em ~25%, mantendo os custos de reagentes e consumíveis comparáveis aos do método de separação por densidade. Recomenda-se processar no máximo 8 amostras por vez por técnico para garantir o escalonamento adequado das amostras (~30 s/amostra) dentro dos períodos de incubação de 5 minutos (etapas 3.7, 3.11 e 3.14).
Tanto no método manual quanto no automatizado, a remoção do revestimento buffy é uma etapa crítica para garantir o isolamento ideal do PBMC. É importante notar que um buffy coat em vez de sangue total é usado neste protocolo, pois o volume de reagentes é baseado nos volumes de material inicial10. A remoção eficaz de todo o volume do revestimento leucocitário pode ser tecnicamente desafiadora. Inicialmente, esse método detalhava a remoção de 0,5 mL de buffy coat, porém foi aumentado para 1 mL para melhorar a recuperação. Para garantir a recuperação adequada e consistente do buffy coat, detalhar esse processo é importante na documentação e no treinamento do protocolo. Recomenda-se girar a ponta de uma pipeta enquanto aspira o revestimento leucocitário, tomando cuidado para não aspirar muitas hemácias da camada abaixo (etapa 2.3). É importante não saturar o coquetel de anticorpos que se liga às células indesejadas (ou seja, granulócitos e glóbulos vermelhos), o que pode afetar o rendimento e a pureza10. Para minimizar as hemácias coletadas durante a extração do revestimento leucocitário, a ponta da pipeta deve estar entre a camada de plasma e o revestimento leucocitário. O volume do revestimento leucocitário pode ser aumentado de 1 mL; no entanto, deve-se tomar cuidado, conforme descrito acima, para garantir que não mais do que 10% do volume coletado contenha hemácias. Alternativamente, um manipulador automatizado de líquidos pode ser usado para coletar buffy coats de forma consistente18. No entanto, as horas dedicadas necessárias para calibrar e solucionar problemas de protocolos de instrumentos de manuseio de líquidos, especialmente considerando a despesa, podem não ser viáveis para a maioria dos laboratórios.
A transição e aplicação do protocolo baseado em esferas de automação foi essencial, dado o objetivo do NSW Health Statewide Biobank de processar 23.000 PBMCs nos próximos 3 anos. Aqui, foi demonstrado que as PBMCs podem ser isoladas de tubos de ACD até 9 dias após a coleta com viabilidades médias >70%. Embora os rendimentos tenham sido ótimos 24 horas após a coleta, o processamento dentro desse período nem sempre é viável, pois as amostras podem precisar ser transportadas. Foi demonstrado que as PBMCs isoladas com o método manual ou automatizado baseado em esferas podem ter rendimentos de >3 x 105 células/mL de sangue total quando isoladas dentro de 4 dias após a coleta e >1 x 10,5 células/mL de sangue total quando isoladas dentro de 10 dias após a coleta. Números baixos para amostras acima de 5 dias são observados como uma limitação desta análise. Além disso, os dados não foram separados com base na idade, sexo e história clínica dos participantes, pois essas informações não foram disponibilizadas. Embora uma análise comparativa seja necessária para examinar os efeitos dos atrasos nos tempos de processamento para ambos os métodos, foi relatado anteriormente que atrasos no isolamento de PBMC usando o método de gradiente de densidade diminuem a qualidade celular e aumentam significativamente a contaminação de hemácias19,20. Além disso, as proporções de granulócitos aumentam se o processamento for retardado e, portanto, espécimes de "idades" semelhantes devem ser agrupados para análises a jusante 20,21,22. É importante notar que este experimento foi realizado usando sangue anticoagulado com dextrose cítrica ácida (ou seja, citrato trissódico, ácido cítrico e dextrose); no entanto, o rendimento e/ou proporção de tipos celulares pode variar se outros anticoagulantes forem usados23; portanto, os investigadores são aconselhados a escolher um anticoagulante apropriado com base nas análises de PBMC a jusante pretendidas.
Em resumo, um protocolo para isolamento de PBMC usando esferas magnéticas que é adaptável a fluxos de trabalho de alto rendimento é detalhado para atender aos requisitos de dimensionamento sem comprometer a viabilidade celular. Tanto o método manual quanto o automatizado podem ser otimizados para produzir concentrações celulares específicas, alterando os volumes inicial e de ressuspensão. O NSW Health Statewide Biobank fez a transição da extração de ~ 60 PBMCs por mês usando a técnica tradicional de separação de gradiente de densidade para ~ 300 PBMCs por mês usando este método baseado em esferas compatível com automação. O próximo objetivo dos autores é usar a plataforma automatizada para processar até 1200 PBMCs por mês e comparar ainda mais PBMCs isolados por técnicas baseadas em esferas magnéticas (manuais e automatizadas) e gradiente de densidade para orientar a implementação dessa técnica para outros laboratórios com foco particular em biobancos.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
O NSW Health Statewide Biobank agradece o apoio da NSW Health Pathology, do NSW Office for Health and Medical Research e do Sydney Local Health District. Além disso, os autores agradecem à Omico e a outros estudos de pesquisa apoiados pelo NSW Health Statewide Biobank por conceder permissão para publicar dados gerados internamente e usar amostras não utilizadas para fins de pesquisa. Os autores agradecem à professora Jennifer Bryne (NSW Health Pathology, University of Sydney) pela liderança crítica e discussões. A Figura 1 foi criada com BioRender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| Cell cryopreservation media CS10, 100 mL (CRYOSTOR) | StemCellTM Technologies | 07930 | |
| Class II Biological Safety Cabinet | Thermo ScientififcTM | 51033311 | |
| CoolCell 1 mL FX | BioTools | BCS-407P | This is the control rate freezing container used. |
| Distilled Water | Bacto Laboratories | 561832 | |
| DxH 500 Hematology Analyzer | Beckman Coulter Life Sciences | B40601 | Referred to as external automated cell counter. |
| EasyEightsTM EasySepTM Magnet | StemCellTM Technologies | 18103 | |
| EasySepTM Direct Human PBMC Isolation Kit | StemCellTM Technologies | 19654 | Kit includes the magnetic bead tube and the cocktail mix tube |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich Pty Ltd | E6758-500G | Instructions to make 0.1M EDTA solution from EDTA salt is located in supplemental file 2. |
| LymphoprepTM Density Gradient Medium | StemCellTM Technologies | 7851 | |
| Megafuge ST4 Plus Centrifuge | Thermo ScientififcTM | THR75009903 | |
| Orion Star A211 pH meter electrode | Thermo ScientififcTM | STARA2110 | |
| Orion™ ROSS Ultra™ Glass Triode™ pH/ATC Combination Electrodes | Thermo ScientififcTM | 8302BNURCA | |
| Phosphate buffered saline (PBS), solution, 1X, 500ml | Life Technologies Australia Pty Ltd | 10010023 | |
| Prism | GraphPad | ||
| RoboSepTM Buffer 1X | StemCellTM Technologies | 20104 | Software used for statistical analysis. |
| RoboSepTM-S | StemCellTM Technologies | 21000 | Fully automated cell separator instrument. |
| RoboSep™ Filter Tips | StemCellTM Technologies | 20125 | |
| SepMateTM-50 (IVD) tubes | StemCellTM Technologies | 85460 | IVD - In vitro diagnostics. Also known as SepMateTM-50 tubes |
| Vi-CELL XR Cell Anlayzer | Beckman Coulter Life Sciences | Internal automated cell counter. Instrument obsolete and no longer available for purchase (as of December 31, 2022). Alternative instrument is the ViCell BLU Cell Viability Analyzer (Product no. C19196). | |
| Vi-CELL XR Quad Pack Reagent Kit | Beckman Coulter Life Sciences | 383722 |
Referências
- Alexovic, M., et al. Human peripheral blood mononuclear cells: A review of recent proteomic applications. Proteomics. 22 (15-16), e2200026 (2022).
- Zhang, M., Huang, B. The multi-differentiation potential of peripheral blood mononuclear cells. Stem Cell Res Ther. 3 (6), 48 (2012).
- Arimilli, S., Damratoski, B. E., Chen, P., Jones, B. A., Prasad, G. L. Rapid isolation of leukocyte subsets from fresh and cryopreserved peripheral blood mononuclear cells in clinical research. Cryo Lett. 33 (5), 376-384 (2012).
- Kleeberger, C. A., et al. Viability and recovery of peripheral blood mononuclear cells cryopreserved for up to 12 years in a multicenter study. Clin Diagn Lab Immunol. 6 (1), 14-19 (1999).
- Ulmer, A. J., Scholz, W., Ernst, M., Brandt, E., Flad, H. D. Isolation and subfractionation of human peripheral blood mononuclear cells (PBMC) by density gradient centrifugation on percoll. Immunobiology. 166 (3), 238-250 (1984).
- Fuss, I. J., Kanof, M. E., Smith, P. D., Zola, H. Isolation of whole mononuclear cells from peripheral blood and cord blood. Curr Protoc Immunol. 7, 711-718 (2009).
- Gautam, A., et al. Investigating gene expression profiles of whole blood and peripheral blood mononuclear cells using multiple collection and processing methods. PLoS One. 14 (12), e0225137 (2019).
- Hamot, G., Ammerlaan, W., Mathay, C., Kofanova, O., Betsou, F. Method validation for automated isolation of viable peripheral blood mononuclear cells. Biopreserv Biobank. 13 (3), 152-163 (2015).
- Coppola, L., et al. Purification of viable peripheral blood mononuclear cells for biobanking using a robotized liquid handling workstation. J Transl Med. 17 (1), 371 (2019).
- Stemcell Technologies. Vol. 27156. STEMCELL TECHNOLOGIES. , 1-4 (2020).
- Hornschuh, M., et al. Negative magnetic sorting preserves the functionality of ex vivo cultivated non-adherent human monocytes. Biology (Basel). 11 (11), 1583 (2022).
- Bhattacharjee, J., Das, B., Mishra, A., Sahay, P., Upadhyay, P. Monocytes isolated by positive and negative magnetic sorting techniques show different molecular characteristics and immunophenotypic behaviour. F1000Res. 6, 2045 (2017).
- Ohlsson, S., Diedrich, B., Uhlin, M., Sandgren, P. Optimized processing for pathogen inactivation of double-dose buffy-coat platelet concentrates: Maintained in vitro quality over 7-day storage. Vox Sang. 113 (7), 611-621 (2018).
- Easysep direct human PBMC isolation kit for processing 100 mL buffy coat. Stemcell Technologies Available from: https://www.stemcell.com/products/brands/easysep-cell-separation.html (2022)
- Vi-cell XR cell viability analyzer instructions for use. Beckman Coulter Available from: https://mbcbiolabs.com/wp-content/uploads/2022/08/Beckman-Coulter-ViCell-Manual.pdf (2017)
- Fuchs, Y. F., et al. Next-generation biobanking: Employing a robotic system for automated mononuclear cell isolation. Biopreserv Biobank. 21 (1), 106-110 (2023).
- Tigner, A., Ibrahim, S. A., Murray, I. V. Histology, white blood cell. StatPearls Publishing. , (2024).
- Mathay, C., Ammerlaan, W., Betsou, F. Automatic buffy coat extract on: Methodology, feasibility, optimization, and validation study. Biopreserv Biobank. 10 (6), 543-547 (2012).
- Golke, T., et al. Delays during PBMC isolation have a moderate effect on yield, but severly compromise cell viability. Clin Chem Lab Med. 60 (5), 701-706 (2022).
- Yi, P. C., et al. Impact of delayed PBMC processing on functional and genomic assays. J Immunol Methods. 519, 113514 (2023).
- Mckenna, K. C., Beatty, K. M., Vicetti Miguel, R., Bilonick, R. A. Delayed processing of blood increases the frequency of activated CD11b+ CD15+ granulocytes which inhibit t-cell function. J Immunol Methods. 341 (1-2), 68-75 (2009).
- Mallone, R., et al. Isolation and preservation of peripheral blood mononuclear cells for analysis of islet antigen-reactive t-cell responses: Position statement of the t-cell workshop committee of the immunology of diabetes society. Clin Exp Immunol. 163 (1), 33-49 (2011).
- Betsou, F., Gaignaux, A., Ammerlaan, W., Norris, P. J., Stone, M. Biospecimen science of blood for peripheral blood mononuclear cell (PBMC) functional applications. Curr Pathobiol Rep. 7 (2), 17-27 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados