Method Article
Identificação de células infectadas por EcoHIV em camundongos transgênicos manipulados por microglia
Neste Artigo
Resumo
Este protocolo descreve como a combinação da infecção por EcoHIV com camundongos Tmem119-EGFP oferece um sistema biológico valioso para investigar alterações microgliais e reservatórios virais em modelos de roedores de distúrbios neurocognitivos associados ao HIV.
Resumo
A terapia antirretroviral combinada (cART) melhorou drasticamente a qualidade de vida das pessoas que vivem com HIV (PVH). No entanto, mais de 4 milhões de PVHA têm mais de cinquenta anos e apresentam distúrbios neurocognitivos associados ao HIV (HAND). Para entender como o HIV afeta o sistema nervoso central, é necessário um modelo confiável e viável de HIV. Anteriormente, um novo sistema biológico usando inoculação quimérica de HIV (EcoHIV) foi desenvolvido em um modelo de rato para investigar deficiências neurocognitivas e disfunção sináptica. No entanto, permanece um desafio significativo no esclarecimento da distribuição neuroanatômica do EcoHIV, particularmente sua expressão diferencial em vários tipos de células no cérebro. No estudo atual, o EcoHIV com marcação de fluorescência mScarlet foi modificado e injetado retroorbitalmente em camundongos knock-in Tmem119-EGFP (que expressam proteína de fluorescência verde aprimorada principalmente na microglia) para determinar se a microglia é o principal tipo de célula responsável pela expressão viral e reservatórios de HIV no cérebro. Os dados atuais mostram que: (1) in vitro, os sinais de fluorescência EcoHIV-mScarlet foram predominantemente localizados em células semelhantes à microglia entre as células cerebrais primárias de roedores; (2) in vivo, a injeção de EcoHIV-mScarlet em camundongos Tmem119-EGFP induziu expressão significativa do HIV no cérebro do camundongo. A co-localização dos sinais mScarlet e EGFP sugere que a microglia é o principal tipo de célula que abriga o HIV no cérebro. No geral, o EcoHIV em roedores oferece um sistema biológico valioso para estudar alterações microgliais, reservatórios virais no cérebro e os mecanismos neurológicos de distúrbios neurocognitivos associados ao HIV.
Introdução
Apesar dos profundos benefícios derivados da terapia antirretroviral, as pessoas que vivem com HIV (PVH) ainda apresentam distúrbios neurocognitivos. Para entender melhor os mecanismos neuronais do transtorno neurocognitivo associado ao HIV (HAND), há uma necessidade crítica de modelos de HIV para elucidar ainda mais o envolvimento específico do tipo de célula no NeuroHIV.
O rato transgênico HIV-1, que tem exposição constitutiva às proteínas virais do HIV-1, é um modelo popular de roedor usado para investigar distúrbios neurocognitivos 1,2,3,4 e alterações neuroanatômicas 5,6,7 associadas à TNM. A deleção funcional dos domínios gag e pol impede a replicação viral, tornando o rato transgênico HIV-1 não infeccioso 8,9. Recentemente, um modelo quimérico de infecção pelo HIV (EcoHIV) em camundongos foi inicialmente relatado por Potash et al.10 e posteriormente estendido a ratos, o que pode ser vantajoso para estudos futuros sobre TNA e transtornos por uso de substâncias11. Neste novo sistema biológico, a infecção sistêmica pelo HIV-1 foi observada juntamente com muitas características clínicas do HIV-1 em humanos, incluindo envolvimento de linfócitos e macrófagos, respostas imunes antivirais, neuroinvasividade e inflamação cerebral.
A microglia desempenha um papel crítico como macrófagos residentes no cérebro especializados na manutenção da função cerebral e da homeostase. Para distinguir a micróglia de tipos de células intimamente relacionados (por exemplo, monócitos sanguíneos, macrófagos perivasculares, macrófagos meníngeos), o estudo atual usou a linha de camundongos knock-in Tmem119-EGFP. Estudos anteriores relataram que a proteína transmembrana 119 (Tmem119) exibe um padrão de expressão exclusivamente específico da micróglia no tecido cerebral de roedores e humanos 12,13,14,15. O sinal EGFP em camundongos knock-in Tmem119-EGFP foi observado em todo o cérebro e localizado especificamente em células microgliais.
No presente estudo, camundongos knock-in Tmem119-EGFP foram inoculados com o vírus EcoHIV-mScarlet, e células positivas para EcoHIV no sistema nervoso central foram identificadas. Aqui, apresentamos um protocolo para inoculação de EcoHIV-mScarlet em camundongos knock-in Tmem119-EGFP , fornecendo um modelo confiável para direcionar terapeuticamente as alterações microgliais no HIV.
Protocolo
O Comitê de Cuidados e Uso de Animais da Universidade da Carolina do Sul aprovou todos os protocolos de animais (número de garantia federal: D16-00028). Todos os experimentos seguiram rigorosamente as diretrizes estabelecidas pelo National Institutes of Health no Guia para o Cuidado e Uso de Animais de Laboratório. Camundongos knock-in Tmem119-EGFP (30 dias de idade, machos, 23-26 g de peso corporal) foram obtidos de uma fonte comercial e alojados em grupo em instalações credenciadas pela AAALAC. Todos os animais foram alojados em um ciclo claro-escuro de 12/12 h com livre acesso a comida e água. Os detalhes dos animais, reagentes e equipamentos usados neste estudo estão listados na Tabela de Materiais.
1. Embalagem EcoHIV-mScarlet em células de 293FT
- Incubar as células de 293 FT num balão pré-revestido com gelatina de 75 cm2 . Mantenha as células crescendo até 30% confluentes na transfecção.
- Realize a transfecção do DNA do plasmídeo (15 μg) de EcoHIV-mScarlet (Arquivo Suplementar 1) usando Lipofectamina 3000 (22,5 μL) seguindo as instruções do fabricante (consulte a Tabela de Materiais).
- Cultive as células em meio DMEM com soro FBS a 10% por 3 dias a 37 °C.
- Colete o meio condicional com suspensão viral. Centrifugue a 500 × g durante 10 min a 4 °C. Transfira o sobrenadante com uma pipeta de 10 ml para um tubo estéril de 50 ml.
- Adicione uma certa quantidade de concentrador Lenti-x (proporção de 1:3) à mistura viral (por exemplo, 8 mL de concentrador com 24 mL de mistura viral). Inverta suavemente o tubo cinco vezes.
- Manter a mistura de concentrador vírus-Lenti a 4 °C durante 2 dias. Centrifugar a 1.500 × g, 45 min, 4 °C. Remova cuidadosamente o sobrenadante o máximo possível usando uma pipeta.
- Ressuspenda o pellet com 200 μL de PBS 100 mM pré-resfriados. Armazene o vírus a -80 °C.
NOTA: Os detalhes do empacotamento EcoHIV-mScarlet em células de 293FT foram descritos em nosso estudo anterior16. Não vórtice ou introduza bolhas de ar na solução viral.
2. Infecção por EcoHIV-mScarlet em células cerebrais primárias de ratos
- Realizar o isolamento primário de células cerebrais de fetos de ratos (18 dias) seguindo o relatório publicado anteriormente16.
- Transfira as células dissociadas para placas pré-revestidas de poli-L-lisina de 12 poços com inserções de vidro contendo 1 mL de meio DMEM / F12 mais 10% de FBS. Substitua o meio no dia seguinte por meio neurobasal por suplemento de B27.
- Cultura de células cerebrais fetais primárias em uma incubadora de CO5% 2 por 3 semanas.
- Adicione EcoHIV-mScarlet (60 μL, 1,26 × 106 TU / mL) no meio de cultura. Incube as células cerebrais cultivadas com EcoHIV-mScarlet por 6 dias.
- Fixe as células com 4% de PFA e realize imunocoloração em células cerebrais infectadas usando anticorpos primários específicos (CD11b / c, Iba1).
- Obter imagens usando objetiva de 40× em um sistema de microscopia confocal.
3. Infecção pelo vírus EcoHIV-mScarlet em células primárias da glia de camundongos adultos
- Anestesiar camundongos adultos com sevoflurano a 5% por 5 min (seguindo protocolos aprovados institucionalmente). Esterilize a pele da cabeça com 70% de EtOH.
- Depois de confirmar que o mouse não responde mais a estímulos nocivos, use uma tesoura afiada esterilizada para realizar a decapitação. Transfira a cabeça para uma nova placa de Petri cheia de 5 mL de HBSS.
- Abra o couro cabeludo e transfira o tecido cerebral para outra placa de Petri contendo 5 mL de HBSS esterilizado. Retire as meninges e transfira o córtex frontal para 2 mL de HBSS.
- Adicione 20 μL de tripsina-EDTA a 0,25% na mistura. Incubar por 15 min em temperatura ambiente; Gire suavemente o tubo a cada poucos minutos.
- Transfira as células dissociadas para um frasco pré-revestido de poli-L-lisina de 75 cm2 contendo 10 mL de meio DMEM / F12 e 10% de FBS.
- Células de cultura a 37 °C, incubadora de CO2 a 5%, até 90% de confluência. Digerir as células cerebrais com 2 mL de tripsina-EDTA a 0,25%.
- Subcultive células cerebrais em placas de fundo de vidro de 35 mm contendo 5 mL de meio de crescimento DMEM/F12 até 80% de confluência.
- Adicione EcoHIV-mScarlet (8 μL, 1,26 × 106 TU / mL) no meio de cultura. Incube as células gliais de camundongos por 2 dias.
- Verifique os sinais de fluorescência vermelhos (mScarlet) diariamente sob um microscópio fluorescente.
4. Injeção retroorbital do vírus EcoHIV-mScarlet em camundongos Tmem119-EGFP
- Use sevoflurano a 3% para anestesiar os camundongos Tmem119-EGFP (camundongos machos e fêmeas aos 30 dias de idade) até que eles não respondam mais a estímulos nocivos.
- Prenda os camundongos em uma posição lateral com o olho de injeção voltado para cima e a respiração através do cone do nariz, que está ligado a um sistema de anestesia. Use um tamanho de cone nasal apropriado para fornecer anestesia contínua.
- Descongele o EcoHIV-mScarlet no gelo. Encha a solução viral em uma seringa injetora intraocular com uma agulha romba de 33 G.
- Coloque o mouse na posição de decúbito lateral direita e mantenha a cabeça voltada para a esquerda. Identifique a localização do canto medial como local da injeção.
- Depois de propor o olho, insira lenta e suavemente uma agulha (ângulo de 45 graus) no canto medial do olho. Insira cuidadosamente a agulha para a frente nos vasos atrás do globo ocular (seio retro-orbital).
- Injete suavemente 6,5 μL de EcoHIV-mScarlet (1,26 × 106 TU / mL, inoculação bilateral-olho) no seio retro-orbital. Remova cuidadosamente a agulha do seio retro-orbital e aplique pressão suavemente nas pálpebras para fornecer hemostasia.
- Aplique lubrificante no olho para evitar que a córnea seque ou se machuque.
- Deixe os ratos se recuperarem em uma câmara de recuperação com uma almofada de aquecimento até que acordem.
NOTA: O bisel da agulha não deve ser posicionado muito fundo para que as artérias não sejam rompidas ou os ossos fraturados. O tempo de infusão viral depende de vários fatores (por exemplo, volume de injeção, título, tamanho do animal). Para a infusão viral de EcoHIV, foi observada expressão significativa uma semana após as injeções retro-orbitais 11,16,17.
5. Visualização de fatias de tecido cerebral
- Anestesiar profundamente os camundongos com sevoflurano a 5%. Passe para a etapa 5.2 quando os camundongos não mostrarem resposta a estímulos nocivos e os reflexos estiverem ausentes.
- Mantenha os ratos em decúbito dorsal dentro de uma capela de exaustão química.
- Abra a pele ao longo da linha média torácica. Separe o diafragma e abra o peito com uma tesoura.
- Insira uma agulha 22 G1 1/2 no ventrículo esquerdo. Abra o átrio direito com uma tesoura.
- Perfundir 50 mL de PBS 100 mM pré-resfriado. Perfundir 100 mL de tampão paraformaldeído a 4% pré-resfriado16.
- Remova todo o cérebro do rato16.
- Fixe durante a noite com paraformaldeído a 4%.
- Prenda o tecido cerebral usando adesivo de tecido na plataforma de metal do vibratome. Corte 50 μm de espessura de seções coronais com lâminas de aço carbono.
- Coloque as fatias de cérebro em lâminas de vidro usando um pincel. Adicione imediatamente 0,1 mL do meio de montagem antidesbotamento a cada seção.
- Coloque uma lamínula de 22 mm x 50 mm sobre as seções do cérebro. Seque as lâminas super-frost no escuro por 1 dia.
- Configure o sistema de microscópio confocal para uma ampliação de 60× (A/1,4, óleo) e defina um intervalo de plano Z de 0,15 μm, com um tamanho de orifício de 30 μm e um raio de orifício retroprojetado de 167 nm.
- Use os comprimentos de onda de 488 nm e 594 nm para adquirir imagens multicanal de regiões cerebrais de interesse.
Resultados
Um fragmento de mScarlet (1858 pb) contendo sítios enzimáticos de "Cla1" na extremidade 3' e "Not1" na extremidade 5' foi inserido no vetor lentiviral pNL4-3-EcoHIV (Figura 1). Para validar a expressão de EcoHIV-mScarlet, células cerebrais primárias isoladas do córtex de embriões E18 de ratos foram tratadas com EcoHIV-mScarlet (60 μL, 1,26 × 106 TU / mL) por 6 dias in vitro. Os dados da Figura 2 mostraram que os sinais fluorescentes vermelhos de mScarlet estavam localizados principalmente em tipos gliais de células com base nas diferentes morfologias celulares. Além disso, a marcação de CD11b/c e Iba1 (marcadores celulares para microglia) mostrou que os sinais mScarlet foram co-localizados com células CD11b/c + e/ou Iba1+. Os dados indicaram que a microglia foi o principal tipo de célula de distribuição EcoHIV-mScarlet in vitro. Não houve infecção neuronal significativa nas células cultivadas (Figura Suplementar 1).
Em seguida, a infecção de EcoHIV-mScarlet foi testada em células gliais mistas primárias de camundongos adultos. Para fazer isso, células gliais mistas foram primeiro isoladas e purificadas de camundongos adultos (2 meses) e infectadas com EcoHIV-mScarlet (8 μL, 1,26 × 106 TU / mL) por 2 dias. As imagens na Figura 3 mostraram que o EcoHIV-mScarlet infectou com sucesso a glia de camundongos adultos.
Para abordar ainda mais o padrão de distribuição do EcoHIV-mScarlet no cérebro do camundongo, especificamente para identificar o tipo de célula infectada, o EcoHIV-mScarlet foi injetado retro-orbital na linha de camundongos knock-in Tmem119-EGFP na qual a microglia foi especificamente marcada com sinais EGFP sem quaisquer outros tipos de conflitos de macrófagos5. Os resultados na Figura 4 (também na Figura Suplementar 2) mostram que os sinais de fluorescência vermelha mScarlet foram observados em células EGFP-positivas, sugerindo a microglia como o principal tipo de célula de expressão de EcoHIV em cérebros de camundongos.
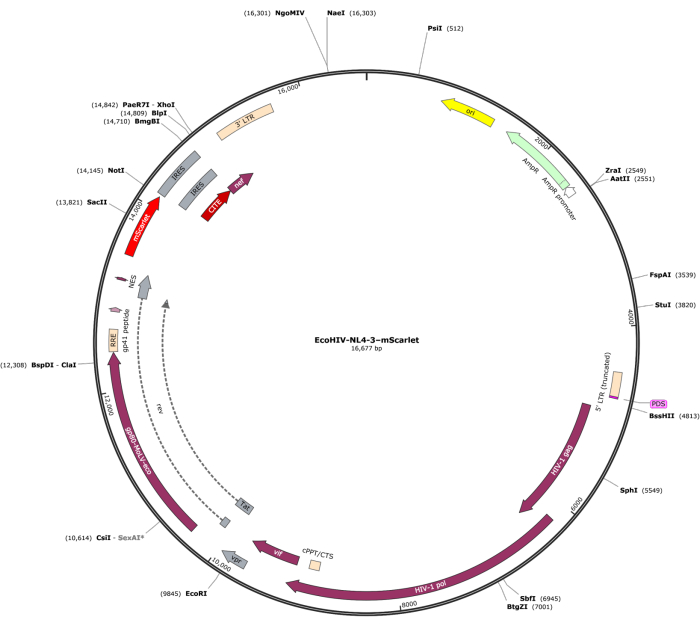
Figura 1: O mapa vetorial do EcoHIV-NL-4-3-mScarlet. Clique aqui para ver uma versão maior desta figura.
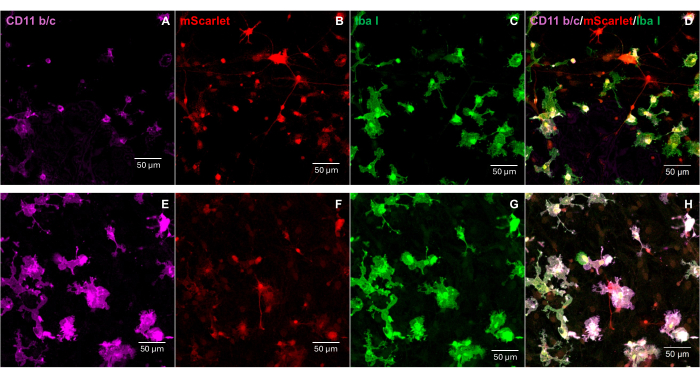
Figura 2: A infecção por EcoHIV-mScarlet em células cerebrais primárias de ratos. (A, E) Imagens representativas da coloração CD11b / c em células cerebrais primárias. As células cerebrais foram isoladas de embriões de ratos E18 e infectadas com o vírus EcoHIV-mScarlet por 6 dias. (B, F) Imagens representativas de sinais fluorescentes mScarlet de células cerebrais in vitro . (C, G) Imagens representativas da coloração Iba1 em células cerebrais primárias. (D, H) Imagens mescladas de marcação tripla de CD11b / c, mScarlet e Iba1. Barras de escala: 50 μm. Clique aqui para ver uma versão maior desta figura.
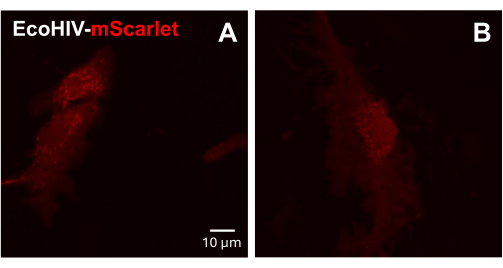
Figura 3: Infecção por EcoHIV-mScarlet em células gliais mistas primárias de camundongos. (A, B) Imagens confocais representativas da distribuição de mScarlet in vitro. As células primárias mistas da glia foram isoladas de camundongos C57BL6 adultos (2 meses de idade) e cultivadas por 2 semanas antes da infecção viral. O EcoHIV-mScarlet foi adicionado ao meio de cultura por dois dias e capturou as imagens sob a objetiva de 60× do microscópio confocal. Barra de escala: 10 μm. Clique aqui para ver uma versão ampliada desta figura.
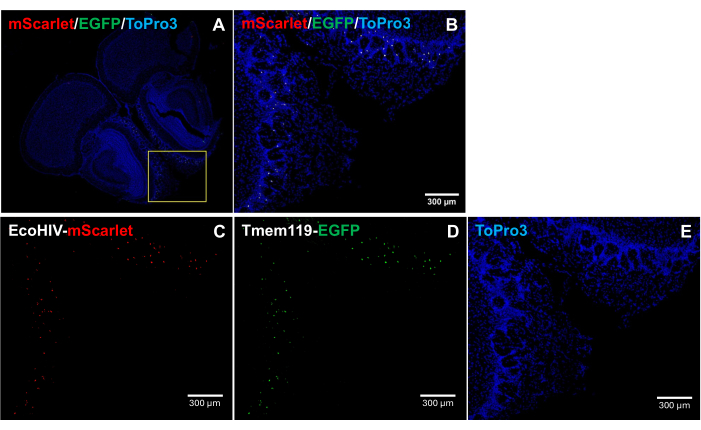
Figura 4: Distribuição de EcoHIV-mScarlet na linha de camundongos knock-in Tmem119-EGFP . (A, B) Imagens mescladas de sinais mScarlet / EGFP / ToPro3 em seções cerebrais. A moldura amarela indica a área de destino de (B). Barra de escala: 300 μm. (C) Imagem representativa da distribuição de mScarlet na camada plexiforme externa da região olfativa da linha de camundongos knock-in Tmem119-EGFP . (D) Imagem representativa da distribuição do EGFP. Os sinais fluorescentes foram localizados em células de microglia na linha de camundongos knock-in Tmem119-EGFP . (E) Imagem representativa da coloração do núcleo TO-PRO-3. Barras de escala: 300 μm. Clique aqui para ver uma versão ampliada desta figura.
Figura suplementar 1: Coloração MAP2 e MOG de células cerebrais primárias de ratos infectadas com o vírus EcoHIV-mScarlet. Barras de escala: 50 μm. Clique aqui para baixar este arquivo.
Figura suplementar 2: Imagens confocais da infecção por EcoHIV-mScarlet na linha de camundongos knock-in Tmem119-EGFP . Barras de escala: 75 μm. Clique aqui para baixar este arquivo.
Arquivo Suplementar 1: Sequência de DNA do plasmídeo EcoHIV-mScarlet. Clique aqui para baixar este arquivo.
Discussão
No presente estudo, verificou-se que (1) o novo EcoHIV-mScarlet infectou com sucesso células cerebrais primárias de ratos in vitro; (2) a marcação tripla de mScarlet, CD11b / c e Iba1 identificou a microglia como o tipo de célula predominante para essa expressão de EcoHIV em células cerebrais de ratos in vitro; (3) células cerebrais primárias de camundongos de adultos in vitro evidenciam ainda mais a infecção por EcoHIV-mScarlet; (4) a distribuição EcoHIV-mScarlet na linha de camundongos knock-in Tmem119-EGFP demonstrou um padrão de distribuição específico da micróglia da infecção por EcoHIV.
Novos estudos sugerem que vários tipos de células cerebrais identificadas no sistema nervoso central (neurônios, astrócitos, microglia, oligodendrócitos, etc.) exibem alterações funcionais e transcriptômicas durante o HIV e distúrbios neurocognitivos associados ao HIV18,19. Por exemplo, os astrócitos contribuem com 30% -70% do cérebro e realizam vigilância para manter a homeostase cerebral20. Os astrócitos também modulam a função imunológica e regulam a secreção de multicitocinas e quimiocinas, especialmente na situação de inflamação cerebral e neurodegeneração no HIV21,22. A infecção pelo HIV da microglia não apenas resulta em uma liberação contínua de proteínas virais e citocinas e quimiocinas pró-inflamatórias, mas também fornece fontes predominantes para reservatórios virais do HIV 23,24,25,26. Além disso, a microglia ativada contribui com uma função imunológica crítica no SNC; no entanto, a ativação prolongada também pode exacerbar a neurodegeneração na progressão do HIV10,27. Os oligodendrócitos também desempenham uma função importante, incluindo a liberação de várias neurotrofinas (como fator de crescimento nervoso, fator neurotrófico derivado do cérebro, etc.)28. Um estudo anterior constatou que o número de oligodendrócitos diminuiu significativamente no cérebro de pacientes com AIDS, o que pode indicar danos diretos aos oligodendrócitos pelas proteínas virais do HIV29. Portanto, um tipo específico de modelo de infecção do HIV manipulado por células deve fornecer meios fundamentais para identificar as funções diferenciais de várias células cerebrais após a infecção. No presente estudo, um sistema biológico foi desenvolvido para imitar as características do HIV-1 por inoculação quimérica do HIV (EcoHIV). Esta inoculação do HIV também foi combinada com a linha de camundongos knock-in Tmem119-EGFP para gerar e validar um modelo de roedor manipulado pela microglia do HIV.
No entanto, as limitações do presente estudo devem ser reconhecidas. Havia algumas células Iba1/CD11b/c negativas que apresentavam sinais fluorescentes mScarlet in vitro. Outros tipos de células cerebrais, como macrófagos cerebrais ou pericitos, podem estar envolvidos na infecção por EcoHIV ou, alternativamente, o ambiente de cultura de células pode promover padrões de infecção aberrantes em relação à inoculação in vivo . Futuros estudos em animais inteiros devem esclarecer ainda mais a função da microglia mScarlet+ no processo de infecção por EcoHIV e definir ainda mais a distribuição regional da microglia mScarlet+EcoHIV no cérebro. Além disso, alterações neurocognitivas que ocorrem como resultado de infecções microgliais também podem ser abordadas neste modelo de roedor. Coletivamente, a inoculação EcoHIV-mScarlet de camundongos knock-in Tmem119-EGFP fornece um novo modelo e estratégia de pesquisa para investigar os mecanismos microgliais de distúrbios neurocognitivos associados ao HIV.
Divulgações
Nenhum dos autores tem conflitos de interesse a declarar.
Agradecimentos
Este trabalho foi financiado por doações do NIH DA059310, DA058586, AG082539 e GM109091. Agradecemos a generosa doação do EcoHIV-NL4-3-EGFP do Dr. Potash da Escola de Medicina Icahn no Monte Sinai.
Materiais
| Name | Company | Catalog Number | Comments |
| 293FT cells | ThermoFisher Scientific | R70007 | |
| 33 G, Small Hub RN Needle, (Point Style: 3, Needle Length: 19.25 mm) | Hamilton | 7803-05 | |
| Antibiotic-Antimycotic solution | Cellgro | 30004CI | 100x |
| C57BL/6-Tmem119em2Gfng/J | The Jackson Laboratory | Strain #:031823 | |
| Corning BioCoat Gelatin 75cm² Rectangular Canted Neck Cell Culture Flask with Vented Cap | Life Technologies | 354488 | |
| Corning DMEM with L-Glutamine, 4.5 g/L Glucose and Sodium Pyruvate | Life Technologies | 10013CV | |
| Cover glass | VWR | 637-137 | |
| Dumont #5 Forceps | World Precision Instruments | 14095 | |
| Dumont #7 Forceps | World Precision Instruments | 14097 | |
| EndoFree Plasmid Maxi Kit (10) | Qiagen | 12362 | |
| Eppendorf Snap-Cap Microcentrifuge Biopur Safe-Lock Tubes | Life Technologies | 22600028 | |
| Feather Double Edge Carbon Steel Blades | Ted Pella, inc. | 121-9 | |
| Fisher BioReagents Microbiology Media: LB Broth, Miller | Fisher Scientific | BP1426-500 | |
| Human recombinant anti-CD11b antibody | Miltenyi Biotec | 130-120-214 | 1:50 dilution |
| Intraocular Injector Syringe (6.5 µL), Removable Needle | Hamilton | 6609071-01 | |
| Invitrogen Lipofectamine 3000 Transfection Reagent | Life Technologies | L3000015 | |
| Invitrogen One Shot TOP10 Electrocomp E. coli | Fisher Scientific | C404052 | |
| Iris Forceps | World Precision Instruments | 15914 | |
| Iris Scissors | World Precision Instruments | 500216 | |
| Lentivirus-Associated p24 ELISA Kit | Cell Biolabs, inc. | VPK-107-5 | |
| Lenti-X Concentrator | Takara | PT4421-2 | |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 11058021 | |
| Paraformaldehyde | Sigma-Aldrich | 158127-500G | |
| Paraformaldehyde | Sigma | P6148 | |
| PELCO easiSlicer Vibratory Tissue Slicer | Ted Pella, inc. | 11000 | |
| PELCO Pro CA44 Tissue Adhesive | Ted Pella, inc. | 10033 | |
| PELCO Pro Specimen Retrievers | Ted Pella, inc. | 101-33 | |
| ProLong Gold | Fisher Scientific | P36930 | |
| Rabbit monoclonal anti-Iba1 antibody | Abcam | ab178847 | 1:500 dilution |
| RN Compression Fitting 1 mm | Hamilton | 55750-01 | |
| Sevoflurane | Merritt Veterinary Supply | 347075 | |
| Sprague Dawley pregnant rat | Inotiv | ||
| SuperFrost Plus Slides | Fisher Scientific | 12-550-154% | |
| To-Pro-3 | ThermoFisher Scientific | T3605 | Nucleus staining kit |
| Trypsin-EDTA (0.25%), phenol red | ThermoFisher Scientific | 25200-056 | |
| Vannas Scissors | World Precision Instruments | 500086 |
Referências
- Vigorito, M., Lashomb, A. L., Chang, S. L. Spatial learning and memory in HIV-1 transgenic rats. J Neuroimmune Pharmacol. 2, 319-328 (2007).
- Moran, L. M., Booze, R. M., Mactutus, C. F. Time and time again: Temporal processing demands implicate perceptual and gating deficits in the HIV-1 transgenic rat. J. Neuroimmune Pharmacol. 8 (4), 988-997 (2013).
- Repunte-Canonigo,, et al. Gene expression changes consistent with neuroAIDS and impaired working memory in HIV-1 transgenic rats. Mol Neurodegener. 9, 26(2014).
- Reid, W., et al. An HIV-1 transgenic rat that develops HIV-related pathology and immunologic dysfunction. Proc Natl Acad Sci USA. 98 (16), 9271-9276 (2001).
- McLaurin, K. A., Li, H., Booze, R. M., Mactutus, C. F. Disruption of timing: NeuroHIV progression in the post-cART era. Sci Rep. 9, 827(2019).
- Roscoe, R. F., Mactutus, C. F., Booze, R. M. HIV-1 transgenic female rat: Synaptodendritic alterations of medium spiny neurons in the nucleus accumbens. J Neuroimmune Pharmacol. 9 (5), 642-653 (2014).
- Denton, A. R., et al. Selective monoaminergic and histaminergic circuit dysregulation following long-term HIV-1 protein exposure. J NeuroVirol. 25 (4), 540-550 (2019).
- Peng, J., et al. The HIV-1 transgenic rat as a model for HIV-1 infected individuals on HAART. J Neuroimmunol. 218 (1-2), 94-101 (2010).
- Abbondanzo, S. J., Chang, S. L. HIV-1 transgenic rats display alterations in immunophenotype and cellular responses associated with aging. PLoS ONE. 9, e105256(2014).
- Potash, M. J., et al. A mouse model for study of systemic HIV-1 infection, antiviral immune responses, and neuroinvasiveness. Proc Natl Acad Sci USA. 102 (10), 3760-3765 (2005).
- Li, H., McLaurin, K. A., Illenberger, J. M., Mactutus, C. F., Booze, R. M. Microglial HIV-1 expression: Role in HIV-1 associated neurocognitive disorders. Viruses. 13 (5), 924(2021).
- Kaiser, T., Feng, G. Tmem119-EGFP and Tmem119-CreERT2 transgenic mice for labeling and manipulating microglia. eNeuro. 6 (4), (2019).
- Bennett, M. L., et al. New tools for studying microglia in the mouse and human CNS. Proc Natl Acad Sci. USA. 113 (12), E1738-E1746 (2016).
- Satoh, J., et al. TMEM119 marks a subset of microglia in the human brain. Neuropathology. 36 (1), 39-49 (2016).
- Li, H., Aksenova, M., Bertrand, S. J., Mactutus, C. F., Booze, R. M. Quantification of filamentous actin (F-actin) puncta in rat cortical neurons. J Vis Exp. (108), e53697(2016).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. A rat model of EcoHIV brain infection. J Vis Exp. (167), e62137(2021).
- Alfar, H. R., et al. Protocol for optimizing production and quality control of infective EcoHIV virions. STAR Protoc. 4 (3), 102368(2023).
- Malatesta, P., Hartfuss, E., Götz, M. Isolation of radial glial cells by fluorescent-activated cell sorting reveals a neuronal lineage. Development. 127 (24), 5253-5263 (2000).
- Parpura, V., et al. Glutamate-mediated astrocyte-neuron signaling. Nature. 369 (6483), 744-747 (1994).
- Wahl, A., Al-Harthi, L. HIV infection of non-classical cells in the brain. Retrovirology. 20 (1), 1(2023).
- Pandey, H. S., Seth, P. Friends turn foe-astrocytes contribute to neuronal damage in NeuroAIDS. J. Mol. Neurosci. 69 (2), 286-297 (2019).
- Minagar, A., et al. The role of macrophage/microglia and astrocytes in the pathogenesis of three neurologic disorders: HIV-associated dementia, Alzheimer's disease, and multiple sclerosis. J Neurol Sci. 202 (1-2), 13-23 (2002).
- Borrajo, A., Spuch, C., Penedo, M. A., Olivares, J. M., Agís-Balboa, R. C. Important role of microglia in HIV-1 associated neurocognitive disorders and the molecular pathways implicated in its pathogenesis. Ann Med. 53 (1), 43-69 (2021).
- González-Scarano, F., Martín-García, J. The neuropathogenesis of AIDS. Nat Rev Immunol. 5 (1), 69-81 (2005).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. Microglia proliferation underlies synaptic dysfunction in the prefrontal cortex: Implications for the pathogenesis of HIV-1-associated neurocognitive and affective alterations. J. Neurovirol. 29 (4), 460-471 (2023).
- Kim, B. H., et al. EcoHIV infection of primary murine brain cell cultures to model HIV replication and neuropathogenesis. Viruses. 16 (5), 693(2024).
- Réu, P., et al. The lifespan and turnover of microglia in the human brain. Cell Rep. 20 (4), 779-784 (2017).
- Jones, J. D. Potential of glial cell modulators in the management of substance use disorders. CNS Drugs. 34 (7), 697-722 (2020).
- Kaalund, S. S., Johansen, A., Fabricius, K., Pakkenberg, B. Untreated patients dying with aids have loss of neocortical neurons and glial cells. Front Neurosci. 13, 1398(2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados