1. Planejamento Pré-Cirúrgico
Embora as orientações não exijam que as cirurgias de roedores sejam realizadas em uma instalação cirúrgica dedicada, a área utilizada deve ser higienizada com um desinfetante de superfície dura adequado, que deve ser utilizado de acordo com as concentrações e horários de contato listados pelo fabricante. A área também deve ser mantida livre de desordem, e não estar na linha direta dos dutos de abastecimento e escape, pois os rascunhos poderiam contribuir para a hipotermia do animal. O acesso à sala deve ser limitado quando os procedimentos cirúrgicos forem realizados. Uma área para preparação cirúrgica (especialmente para a remoção do cabelo do animal), e para recuperação e cuidado pós-operatório, também deve ser designada e próxima, se não dentro da sala de cirurgia. Em geral, se as cirurgias são realizadas rotineiramente em uma área específica, a área não deve ser utilizada para outras atividades.
As preparações pré-operatórias devem incluir um exame físico do paciente cirúrgico para identificar quaisquer condições de saúde subjacentes que possam interferir na cirurgia. Uma vez que os roedores têm uma taxa metabólica tão alta, e reservas de gordura muito limitadas, eles não devem ser jejuados antes da cirurgia. O estado de hidratação do animal deve ser avaliado por um teste de elasticidade da pele. A pele acima dos ombros é suavemente levantada. Em um animal normalmente hidratado, a pele voltará rapidamente ao lugar, enquanto em um animal desidratado, a pele não voltará imediatamente à sua posição normal. A aparência geral, como a postura e a condição do casaco de cabelo, também deve ser notada. Um animal que está exibindo uma postura curvada, ou tem um casaco de cabelo despenteado, pode estar abrigando uma doença. O exame deve ser realizado pouco antes da administração da anestesia, e quaisquer condições anormais devem ser anotadas no prontuário do animal. 2 Por fim, considerações sobre a anatomia e fisiologia do rato ou rato devem ser feitas ao prepará-los para a cirurgia.
2. Plataforma
Ambas as espécies têm uma alta proporção de volume de superfície/corpo, tornando-as suscetíveis à hipotermia durante os procedimentos cirúrgicos, especialmente quando a cirurgia expõe a cavidade corporal. Os esforços para prevenir a hipotermia incluem o uso de uma plataforma cirúrgica aquecida.
A plataforma utilizada para cirurgia de roedores, que geralmente é construída em aço inoxidável ou plástico duro, deve ser coberta com um material isolante ou fonte de calor suplementar para evitar que o calor corporal do animal escape durante o procedimento. As fontes de calor suplementar incluem almofadas de aquecimento que circulam água, cobertores forçados de aquecimento do ar, lâmpadas de calor ou uma camada de estofamento de espuma cobrindo a plataforma cirúrgica. Plataformas cirúrgicas com fonte de calor incorporada estão disponíveis comercialmente. Todas as plataformas devem ser de um material facilmente desinfetado e impermeável à umidade.
Outros métodos de prevenção da hipotermia incluem o uso de isoladores de massa, a colocação de materiais isolantes entre o animal e a plataforma cirúrgica, e o uso de fontes de calor externas. 3 Isoladores em massa prendem o ar dentro de uma matriz de fibras, produzindo "ar parado" que envolve o animal. Cobertores de água quente circulantes podem ser usados sob o paciente. Este equipamento está disponível em vários tamanhos, de roedor a equino, e permite suporte térmico preciso com termostatos embutidos.
Fontes de aquecimento quimicamente ativadas podem ser de uso único ou reutilizáveis. Um tipo consiste em uma bolsa de plástico cheia de uma solução química e um disco de metal, que quando pressionado cria uma reação extermal. Isso faz com que o líquido se solidifique e libere calor. Geralmente, eles têm uma quantidade limitada de calor e são adequados apenas para procedimentos curtos. Outras fontes químicas de aquecimento estão disponíveis como sólidos à temperatura ambiente, mas quando aquecidos, tornam-se líquidos. À medida que um animal é colocado na almofada, o líquido libera calor, e o conteúdo da almofada se solidifica à medida que esfriam. Estes podem liberar calor por um período muito maior. Como benefício, eles não podem exceder a temperatura de ativação (~39°C), eliminando assim a necessidade de um termostato.
As embalagens de água estão disponíveis como garrafas de água quente que consistem em um saco de borracha ou silicone com uma rolha. As embalagens são preenchidas com água quente que emite calor na superfície externa. A embalagem vai gradualmente perder calor à medida que a água esfria. Uma versão mais moderna consiste em uma folha de plástico com tecido permeável à água aderido à parte superior. O espaço entre eles é preenchido com um pó hidrofílico, que absorve água e incha. Pode ser usado como fonte de calor ou como fonte de resfriamento. Dependendo da qualidade dos materiais, ele pode ser reutilizado e reaquecido em um micro-ondas ou encharcado em água quente.
Devem ser tomadas precauções ao utilizar fontes de calor externas. A temperatura corporal deve ser monitorada com uma sonda retal ou um termômetro colocado ao lado do animal na fonte de calor. Todas as fontes de calor externas devem ser verificadas quanto a defeitos antes do uso.
3. Remoção de cabelo
O local cirúrgico deve ser preparado para minimizar a contaminação da incisão. O cabelo deve ser cortado ou removido com um creme depilatório químico, que dissolve o cabelo no folículo. 2,3 Embora o corte de cabelo às vezes possa ser realizado em um animal consciente com contenção manual, a aplicação do creme depilatório só deve ser feita em um animal anestesiado para evitar a ingestão do produto, danos oculares e remoção do excesso de cabelo. Barbear com uma navalha é uma opção se não houver alternativa. Este método requer habilidade técnica, tempo extra e paciência para evitar lacerações na pele. O campo cirúrgico deve ser suficientemente grande para permitir incisão e sutura sem inclusão de pele na ferida cirúrgica, mas o menor possível para evitar a exacerbação da hipotermia.
- Recorte
- Os cabelos podem ser cortados usando cortadores elétricos ou operados por bateria, de preferência com uma lâmina A40 cirúrgica. Deve-se considerar a largura da lâmina. Uma lâmina padrão de 2" pode ser usada para ratos, enquanto uma lâmina de 1/2-1" é mais apropriada para ratos.
- O cabelo é cortado na direção do crescimento. Estique a pele para estabilizá-la, pois os roedores têm fixação solta da pele ao músculo subjacente.
- Deve-se tomar cuidado para evitar cortar ou cortar a pele. A extremidade plana da lâmina é colocada na pele ao cortar o cabelo. A lâmina nunca deve ser usada com os dentes perpendiculares à pele.
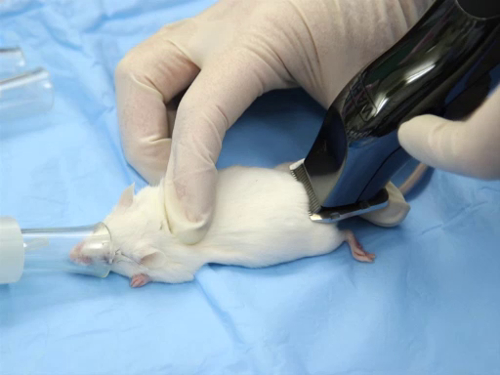
Figura 1. A posição correta de um cortador de cabelo durante a barba.
- Cremes ou loções depilatórias químicas
- Aplique o produto na área do local cirúrgico.
- Após 10 minutos, a pele deve ser completamente enxaguada e limpa de todos os vestígios do depilatório para evitar irritação ou queimaduras químicas na pele.
4. Esfoliação cirúrgica
As soluções de esfoliação cirúrgica a serem utilizadas devem: 1) reduzir substancialmente os micróbios presentes na pele e conter uma preparação antimicrobiana não coirritante; 2) possuir um amplo espectro de propriedades antimicrobianas; 3) ser de atuação rápida; e 4) têm atividade persistente e cumulativa.
As duas soluções de limpeza comumente utilizadas são clorhexidines e iodophors. As soluções de clorexidina são eficazes contra bactérias e vírus mesmo na presença de matéria orgânica. Em contraste, os iodophors têm uma ampla gama de ação microbicida, mas sua eficácia é reduzida na presença de material orgânico; a atividade residual é menor que a das clorhexidinas.
As enxágües utilizadas entre os esfoliantes são água estéril ou álcool. Soluções à base de álcool contendo 60-95% de álcool têm grandes ações antimicrobianas através da desnaturação de proteínas. 2 No entanto, o álcool pode ser um forte irritante da pele. A água estéril é eficaz na lavagem da área, mas não possui propriedades antimicrobianas.
- Use uma esponja de gaze umedeçada para remover detritos brutos, incluindo cabelo e casco.
- A solução de limpeza antisséptica encharcada em uma almofada de gaze é aplicada na pele a partir do local da incisão. A desinfecção deve começar ao longo da linha de incisão e estender-se para fora em um padrão circular.
- A lavagem antisséptica é então aplicada a partir do local da incisão. A pele é varrida em um padrão circular que vai da linha de incisão até a periferia do campo cirúrgico para remover a solução de limpeza.
- Isso se repete três vezes.
- Após uma lavagem final, uma gaze estéril é colocada sobre o campo cirúrgico. Esta gaze pode estar molhada com álcool ou iodo. A gaze será removida assim que o animal for transportado e colocado em posição em uma plataforma cirúrgica ou na mesa/banco cirúrgico.
As áreas do corpo onde os métodos de esfregamento cirúrgico padrão não são utilizados incluem os olhos, a boca e a área anal. Como a superfície do olho seria danificada se as soluções de esfoliação fossem usadas, um esfoliante cirúrgico é feito apenas para as pálpebras depois de incutir uma pomada protetora no olho. Em algumas situações, uma solução salina fisiologicamente equilibrada é usada para lavar o olho para remover detritos brutos e diluir qualquer bactéria a um nível aceitável para que uma cirurgia ocorra. A boca também se mostra difícil de limpar o suficiente para a cirurgia. Pode ser enxaguado com uma solução salina fisiologicamente equilibrada para diluir qualquer bactéria; no entanto, é importante evitar o uso de muita solução salina, o que poderia causar aspiração do fluido. Gengivas, dentes e a língua podem ser limpas com um antisséptico não tosélico. No entanto, a aplicação de soluções para as membranas mucosas pode resultar em absorção sistêmica. Cirurgias na área anal, como a redução cirúrgica de prolapsos retal, não são consideradas cirurgias limpas. O uso de algumas soluções antissépticas pode aumentar os danos teciduais e prevenir ou prolongar a cicatrização. O uso de uma solução salina fisiologicamente equilibrada para lavar a área limpa de detritos brutos é o método preferido de preparação cirúrgica. 2,4
5. Posicionamento
O posicionamento do paciente para procedimentos abdominais envolve a fixação dos membros do animal propenso na plataforma com fita ou ligadura. Ao utilizar uma ligadura para estender os membros, deve-se tomar cuidado para evitar que a circulação dos pés seja comprometida, para evitar a tensão excessiva nos membros e o alongamento extremo dos membros que possam prejudicar as articulações, e evitar o impedimento da respiração. Os laços devem ser uma liberação rápida com apenas meio laço de engate sobre o membro. Algumas plataformas disponíveis comercialmente vêm com retração de membros embutidos que consiste em ganchos ou laços de fio de aço inoxidável ou corrente de esfera, que podem ser ajustados de acordo com o tamanho do animal. Se a fita for usada, deve ser aderida a superfícies secas.
6. Draping
Uma vez que o animal é preparado e posicionado sobre a plataforma cirúrgica, cortinas cirúrgicas são usadas para evitar a contaminação do material de sutura e para manter um campo estéril no local cirúrgico. As cortinas podem ser um material de pano reutilizável, um material descartável de papel ou um material adesivo plástico descartável.
As cortinas de papel descartáveis possuem uma matriz de fibras tecida para a resistência que permite cortar em qualquer forma ou tamanho, incluindo cortar uma fenestração ou abrir na cortina, sem rasgar ou desgastar as bordas cortadas. Eles também são repelentes de umidade. As cortinas descartáveis podem ser compradas pré-embaladas e presterilizadas em uma variedade de tamanhos e formas. As cortinas de pano não foram projetadas para serem cortadas pelo cirurgião para criar uma fenestration. Eles são comprados com uma fenestração de borda pré-cortada e borda amarrada. Cortinas de pano requerem lavagem e esterilização. Quando bem cuidadas, as cortinas de pano podem durar anos, o que as torna um investimento econômico.
Tanto as cortinas de papel quanto as cortinas de pano são mantidas no lugar com grampos de toalha através da pele do animal se for um roedor maior, como um rato adulto. Para roedores menores, a cortina não é afixada na pele, o que requer vigilância e cuidado por parte do cirurgião para não desalojar ou deslocar a cortina uma vez que tenha sido posicionada sobre o animal.
As cortinas adesivas são claras ou opacas. As cortinas claras são preferidas para cirurgias de roedores, pois permitem a visualização direta do animal. Algumas cortinas plásticas são uma combinação de plástico e papel, com a área de plástico sendo diretamente sobre o animal e a área de papel definindo o campo estéril estendido. A porção da cortina que está diretamente sobre o local de incisão cirúrgica foi projetada para aderir à área de incisão. O cirurgião pode então cortar diretamente através do plástico ao fazer a incisão da pele. O envoltório plástico esterilizado foi aceito como um material econômico e útil para cirurgias de roedores. Deve-se tomar cuidado para evitar a constrição do movimento para respirar quando o envoltório é colocado ao redor do paciente. O envoltório conservará o calor corporal, permitirá a visualização do paciente e fornecerá uma barreira de umidade entre o campo estéril e o animal. Também pode servir para auxiliar no posicionamento e retenção do animal para a cirurgia em vez de fixação de membros.
Cortinas de qualquer tipo devem ser cuidadosamente desdobradas para evitar contato com áreas, equipamentos e pessoal não-estér claros; eles nunca devem ser desdobrados por sacudir ou acenar.
- Cortinas de papel: No Método Cortina Única, a cortina é desdobrada para permitir o corte da fenestração se não for pré-cortada.
- O cirurgião colocará a cortina sobre o animal mantendo as mãos na lateral da cortina que não tocarão o paciente.
- A cortina é ajustada para que o campo cirúrgico seja visível através da fenestração.
- A cortina é mantida no lugar com grampos de toalha através da pele do animal no caso de ratos maiores.
- Papel ou plástico com uma janela adesiva
- Uma cortina com uma janela adesiva requer descascamento da área de papel para permitir que a área adesiva grude no campo cirúrgico.
- Ao desdobrar a cortina estéril, a área adesiva é geralmente a região mais alta e é facilmente acessível ao cirurgião.
- Uma vez que o adesivo é descoberto, a cortina é cuidadosamente desdobrada e girada para que o lado pegajoso esteja voltado para o animal.
- É imprescindível que a cortina seja colocada corretamente, pois uma vez que o adesivo entra em contato com o animal, ela não poderá ser ajustada.
- O cirurgião deve pressionar suavemente o adesivo no campo cirúrgico para criar uma vedação com a pele.
- Cortinas de pano
- As cortinas de pano fenestrated não devem ser cortadas, portanto, é responsabilidade do cirurgião selecionar uma cortina com uma abertura suficientemente grande para expor adequadamente a área cirúrgica, mas não tão grande para permitir a exposição de quaisquer superfícies corporais não comportadas e despreparadas.
- A cortina é cuidadosamente desdobrada para revelar a fenestração.
- O cirurgião colocará a cortina sobre o animal, mantendo as mãos na lateral da cortina que não tocarão o paciente.
- A cortina é ajustada para que o campo cirúrgico seja visível através da fenestração.
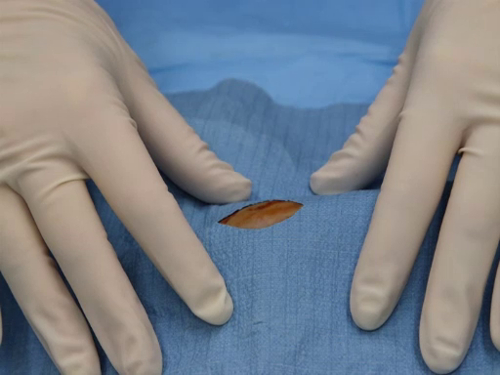
Figura 2. Campo cirúrgico visível através da fenestração de uma cortina corretamente colocada.
- Cortinas adesivas: um material econômico e útil para cirurgias de roedores. 5
- A cortina deve ser retirada do rolo de forma a garantir que a seção que está sendo usada permaneça estéril.
- O assistente cirúrgico abre a caixa e puxa um comprimento do envoltório para fora, tomando cuidado para evitar tocá-lo na caixa ou em qualquer outra superfície.
- O cirurgião agarra o envoltório de cada lado, e o assistente corta a extremidade que eles estão segurando (aproximadamente 3-4 polegadas).
- Depois de descartar a borda de corte, o assistente também corta a seção do resto do rolo.
- O cirurgião agarra um lado do envoltório e coloca sobre o animal.
- As propriedades do envoltório permitem que ele adera a todas as superfícies.
- O cirurgião pressiona o filme para o animal e cria um campo estéril.
- Não há necessidade de usar grampos de toalha ou se preocupar que a cortina mude.
- Deve-se tomar cuidado para evitar a constrição do movimento para respirar. O envoltório conservará o calor corporal, permitirá a visualização do paciente e fornecerá uma barreira de umidade entre o campo estéril e o animal.
7. Monitoramento intraoperatório
Pacientes anestesiados devem ser monitorados para temperatura corporal, respirações e frequência cardíaca até que estejam totalmente recuperados.
A temperatura corporal pode ser monitorada direta ou indiretamente. Para monitoramento direto, deve ser utilizada uma sonda retal projetada especificamente para roedores. Pequenos termômetros retal animal, seja mercúrio ou digital, são muito grandes para uso em camundongos e ratos sem danos ao esfíncter anal e tecidos retal. Em cepas suscetíveis, seu uso poderia precipitar prolapso retal. O monitoramento indireto envolve a colocação de um termômetro ao lado do animal ou sob o corpo em uma fonte de aquecimento externo. Embora isso não dê uma temperatura corporal exata, pode indicar a eficácia da fonte de calor e permitir ajustes para reduzir ou aumentar o calor conforme necessário.
É difícil auscultar a frequência cardíaca e contar as respirações em pequenos roedores sem equipamento especializado.
A maioria dos monitoramentos é visual e só indicará a presença ou ausência de respirações torácicas ou abdominais. As frequências cardíacas são avaliadas como presentes ou ausentes por palpação ou observação visual de bom movimento da parede torácica. Isso pode não ser possível durante uma cirurgia devido ao draping e ao pequeno tamanho do animal.
Um monitoramento adicional pode ser feito através do uso de eletrocardiogramas (ECG) e oxímetros de pulso. O ECG avalia o estado cardíaco de um roedor durante a anestesia e cirurgia. O oxímetro de pulso usa refração de luz vermelha e infravermelha para medir oxigênio no sangue arterial. Esta tecnologia foi adaptada para uso em roedores usando a cauda ou uma pata. Ambos os tipos de medidas não invasivas contínuas dos sinais vitais do paciente são facilmente acessadas com interrupção mínima do campo cirúrgico.
8. Monitoramento pós-operatório
Deve-se considerar o uso de uma almofada de aquecimento sob a gaiola de recuperação pós-cirurgia. Além disso, a analgesia preventiva e pós-operatória deve ser fornecida sempre que possível. As disposições de analgesia são mais eficazes na redução da intensidade da estimulação dolorosa quando dada antes do evento doloroso. As vantagens do uso preventivo de analgésicos incluem a redução da intensidade da estimulação dolorosa, a melhoria do nível de conforto do animal pós-cirurgia, a redução da quantidade de anestesia necessária para manter um plano cirúrgico e uma recuperação mais suave da anestesia assim que o procedimento for concluído. Drogas preventivas e pós-operatórias comumente utilizadas são mostradas na Tabela 1. 6
| Classe de Drogas |
Nome |
Dosagem |
Frequência |
| Anti-inflamatório não esteroide (Substância Não Controlada) |
Cetoprofeno |
2-5 mg/kg ratos SC
5 mg/kg de ratos SC |
a cada 12-24 horas
a cada 12-24 horas |
| Anti-inflamatório não esteroide (Substância Não Controlada) |
Flunixina meglumina |
Camundongos 2,5 mg/kg SC |
a cada 12-24 horas |
| Anti-inflamatório não esteroide (Substância Não Controlada) |
Meloxicam |
5-10 mg/kg ratos PO ou 1-2 mg/kg ratos SC
5-10 mg/kg PO ou 1-2 mg/kg SC ou ratos PO |
a cada 12-24 horas
a cada 24 horas
a cada 12-24 horas
a cada 24 horas |
| Anti-inflamatório não esteroide (Substância Não Controlada) |
Paracetamol |
50 mg/kg SC/IP ou 100 mg/kg ratos PO |
a cada 8-12 horas |
| Opioide (Substância Controlada) |
Butorphanol |
0,5-3,0 mg/kg SC ou 0,2-2 mg/kg ratos IP
2,0 mg/kg SC
0,2-2 mg/kg ratos IP |
a cada 4 horas
a cada 2-4 horas
a cada 4 horas
a cada 2-4 horas |
| Opioide (Substância Controlada) |
Buprenorfina |
0,05-2,5 mg/kg SC ou ratos IP
0,01 – 0,5 mg/kg ratos SC |
a cada 6-12 horas
a cada 8-12 horas |
| Opioide (Substância Controlada) |
Oximofamófina |
0,2-0,5 mg/kg RATOS SC
0,2-0,5 mg/kg Ratos SC |
a cada 6-12 horas
a cada 6-12 horas |
Mesa 1. Comumente usado drogas preventivas e pós-operatórias.
















