Introdução à Titulação
Visão Geral
Fonte: Laboratório do Dr. Yee Nee Tan — Agência de Ciência, Tecnologia e Pesquisa
Titulação é uma técnica comum usada para determinar quantitativamente a concentração desconhecida de um analito identificado. 1-4 Também é chamada de análise volumétrica, pois a medição dos volumes é fundamental na titulação. Existem muitos tipos de titulações baseadas nos tipos de reações que exploram. Os tipos mais comuns são titulações de base ácida e titulações de redox. 5-11
Em um processo típico de titulação, uma solução padrão de titulação em uma burette é gradualmente aplicada para reagir com um analito com uma concentração desconhecida em um frasco de Erlenmeyer. Para titulação ácido-base, um indicador de pH é geralmente adicionado na solução de analito para indicar o ponto final da titulação. 12 Em vez de adicionar indicadores de pH, o pH também pode ser monitorado usando um medidor de pH durante um processo de titulação e o ponto final é determinado graficamente a partir de uma curva de titulação de pH. O volume de titulação registrado no ponto final pode ser usado para calcular a concentração do analito com base na estoquimetria de reação.
Para a titulação ácido-base apresentada neste vídeo, o titrant é uma solução padronizada de hidróxido de sódio e o analito é vinagre doméstico. Vinagre é um líquido ácido que é frequentemente usado como um condimento culinário ou aromatizantes. O vinagre consiste principalmente de ácido acético (CH3COOH) e água. O teor de ácido acético do vinagre comercial pode variar muito e o objetivo deste experimento é determinar o teor de ácido acético do vinagre comercial por titulação.
Princípios
A determinação do ácido acético no vinagre baseia-se no princípio de um método de titulação ácido-base. A reação entre NaOH e CH3COOH é mostrada na Equação 1:
CH3COOH(aq) + NaOH(aq) → H2O(l) + NaCH3CO2(aq) (1)
A solução naOH padronizada é progressivamente adicionada ao vinagre com concentração de ácido acético desconhecido até que o ponto final seja alcançado. Durante a titulação ácido-base, o pH pode ser plotado em função do volume do titante adicionado. O ponto de inflexão na curva, o ponto em que há uma quantidade igual estoquiométrica igual de ácido e base em uma solução, é chamado de ponto de equivalência. A maioria dos ácidos e bases são incolores, sem reação visível ocorrendo no ponto de equivalência. Para observar quando o ponto de equivalência foi atingido, um indicador de pH é adicionado. O ponto final não é o ponto de equivalência, mas um ponto em que o indicador de pH muda de cor. É importante selecionar um indicador de pH adequado para que o ponto final esteja o mais próximo possível do ponto de equivalência da titulação.
No ponto final desta reação, a base conjugada NaCH3CO2 é ligeiramente básica. O indicador phenolphthalein tem uma faixa de pH de trabalho de 8,3-10,0, que é incolor em solução ácida e magenta acima do pH 8.2. Portanto, o fenolfthalein é um indicador preferido, pois mudará de incolor para rosa nesta condição. Ao realizar o experimento, é melhor manter a concentração do indicador de pH baixa porque os próprios indicadores de pH geralmente são ácidos fracos que reagem com base.
O volume de solução naOH padronizada adicionada no ponto final pode então ser usado para calcular as concentrações molares do ácido acético com base na estequiometria da equação acima. Neste experimento, o naoh titante é um alcalino forte e o ácido acético de análise é um ácido fraco.
Antes de realizar o experimento, é importante considerar a natureza higroscópica do NaOH. Esta propriedade requer que sua solução seja padronizada com um padrão primário estável, como o ftalato de hidrogênio de potássio (KHC8H4O4). A concentração molar exata da solução NaOH pode então ser determinada com precisão após a padronização. A reação entre o padrão de ácido primário e o NaOH é mostrada na Equação 2:
KHC8H4O4(aq) + NaOH(aq) → H2O(l) + NaKC8H4O4(aq) (2)
Um protocolo detalhado de titulação passo a passo é apresentado na seção a seguir.
Procedimento
1. Padronização de NaOH com Hidrogênio de Potássio (KHC8H4O4)
- Para começar, o titulante, hidróxido de sódio, deve ser padronizado. Prepare uma solução naOH de estoque dissolvendo cerca de 4 g de pelota NaOH em 100 mL de água desionizada. Observe que o NaOH é um produto químico perigoso que é corrosivo para a pele e irritante aos olhos, seja cauteloso e use equipamentos de proteção pessoal adequados (EPI) para evitar o contato com a pele ou o contato visual.
- Faça uma diluição de 1:10 da solução de hidróxido de sódio adicionando 25 mL da solução de hidróxido de sódio ao frasco de 500 mL. Hidróxido de sódio absorve dióxido de carbono. É importante evitar isso, certificando-se de usar água cozida e deionizada, uma garrafa seca no forno, e tampar a garrafa rapidamente. Faça a solução até 250 mL com a água deionizada e agite para misturar.
- Seque 4-5 g do ácido padrão primário, KHC8H4O4 a 110 °C por 4h em forno de secagem e depois esfrie o sólido em um dessecador por 1 h.
- Dissolva cerca de 4 g de KHC seco8H4O4 em 250 mL de água deionizada. Regisso da massa com precisão. Calcule a concentração molar da solução KHC8H4O4.
- Pipeta 25 mL de KHC8H4O4 em um frasco erlenmeyer limpo e seco. Adicione 2 gotas de fenolfthaleina, e gire suavemente para misturar bem. Note que o fenolfofino é tóxico e irritante, tenha cuidado para evitar o contato com a pele ou o contato visual.
- Limpe uma burette de 50 mL e um funil bem com detergente e água. Lave a burette com água e enxágue 3x com água deionizada. Enxágüe o burette com a solução NaOH diluída 3x, certificando-se de que o NaOH molhe toda a superfície interna e drene os resíduos através da ponta. Monte a burette lavada em um suporte de anéis com um grampo e certifique-se de que ela fique verticalmente.
- Encha o burete limpo com a solução NaOH diluída. Deve-se notar que a quantidade do NaOH diluído não precisa ser exatamente na marca zero, mas deve estar dentro da escala e suficiente para pelo menos uma titulação. Bolhas de ar podem afetar a precisão da leitura de volume. Verifique cuidadosamente as bolhas de ar da burette e bata suavemente no burete para libertá-las e abra a torneira para deixar alguns mL de titulante fluir e, ao mesmo tempo, liberar qualquer ar preso. Leia o volume visualizando a parte inferior do menisco após os 10 s. Registo o volume inicial. Preste atenção aos números significativos da leitura. Registo o valor para duas casas decimais em mL.
- Coloque o frasco de Erlenmeyer contendo ftalato de hidrogênio de potássio (KHC8H4O4) sob a burette e ajuste a altura da burette corretamente. Titule a solução KHC8H4O4 adicionando lentamente a solução NaOH em incrementos de 1 a 2 mL usando uma mão para controlar a taxa de fluxo ajustando a torneira, e a outra girando o frasco.
- Quando estiver perto do ponto final, comece a adicionar o titante gota a gota. O ponto final é alcançado quando a solução vira uma cor rosa fraca e persistente. Registo o volume final do NaOH diluído na burette.
- Repita a titulação pelo menos mais duas vezes para obter dados consistentes. Calcule a concentração molar da solução NaOH diluída.
2. Titulação de Vinagre com Solução padronizada de hidróxido de sódio
- A solução de hidróxido de sódio agora é padronizada e pode ser usada como um titulante para analisar o vinagre. Para reduzir o aroma pungente do vinagre, diluir 10 mL da solução de vinagre a ser testada em uma ração de 1:10 para um volume total de 100 mL.
- Pipeta 25 mL de analito, para um frasco erlenmeyer limpo e seco (anotado como VA). Adicione 2 gotas de fenolfthaleina.
- Encha o burette com a solução NaOH padronizada desde a primeira parte do Procedimento. Regisso volume inicial de titulante (V1).
- Adicione progressivamente a solução naOH padronizada ao vinagre. Quando o volume de titulante se aproximar do valor esperado, ajuste a torneira para adicionar a gota de titulação por gota. Continue girando o frasco com uma mão e mantenha a outra mão pronta para fechar a torneira. Uma vez que a solução de analito muda para a cor rosa clara, gire por alguns segundos para ver se a cor vai desaparecer. Se a cor persistir, a titulação chega ao ponto final. Registo o volume final de titulante (V1'). Se a cor da solução desaparecer, adicione mais uma gota de titulação. Lave a ponta inferior da burete usando a garrafa de lavagem. Colete a mistura lavada e observe a mudança de cor da solução de analito. Continue a titulação até o ponto final. Registo da quantidade de titulante necessário (Vt1 = V1' V1).
- Repita a titulação pelo menos duas vezes até que três valores concordantes que estão dentro de 0,1 mL um do outro sejam obtidos (Vt2 e Vt3).
- Calcule o valor médio do volume de titrant usando os três valores obtidos em três titulações diferentes: Vt = (Vt1 + Vt2 + Vt3)/3. A concentração molar de ácido acético no vinagre pode ser assim calculada usando a Equação 3.
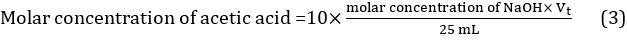
Resultados
| Unidade | Julgamento 1 | Julgamento 2 | Julgamento 3 | |||
| Volume de ácido vinagre diluído (VA) | Ml | 25.00 | ||||
| Concentração molar de NaOH (cNaOH) | mol/L | 0.09928 | ||||
| Leitura inicial de burette de NaOH | Ml | 0.10 | 0. 05 | 1.20 | ||
| Leitura final de burette de NaOH | Ml | 18.75 | 18.60 | 19.80 | ||
| Volume de NaOH dispensado | Ml | 18.65 | 18.55 | 18.60 | ||
| Volume médio de NaOH dispensado (Vt) | Ml | 18.60 | ||||
Mesa 1. Resultados de titulação.
Cálculos amostrais:
Massa de KC8H5O4 = 4,0754 g
Massa molar de KC8H5O4 = 204,22 g/mol
Número de mols de KC8H5O4 em solução padrão de 25,00 mL = 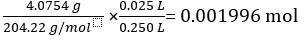
De acordo com a Equação 2,
Concentração da solução NaOH diluída = 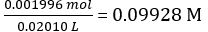
Mols de NaOH dispensado = concentração de NaOH × volume médio de NaOH dispensado = 0,09928 mol/L × 18,60 mL = 1,847 × 10-3 mol
De acordo com a Equação 1,
Número de mols de CH3COOH em 25,00 mL de vinagre diluído = 1.847 × 10-3 mol
Concentração de vinagre diluído = 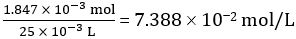
Assim, a concentração de vinagre não diluído = 10 × 7,388 102 mol/L = 0,7388 mol/L
As etapas acima são apresentadas para ilustrar o procedimento de cálculo; podemos simplesmente aplicar a Equação 3 para obter a concentração de vinagre não diluído em um passo.
Portanto, 1.000 L de vinagre não diluído contém 0,7388 mol de CH3COOH.
Volume de CH3COOH=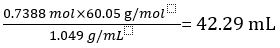
Volume percentual de vinagre =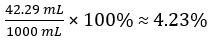
Aplicação e Resumo
A titulação é um importante método químico que é frequentemente aplicado na pesquisa química atual. Por exemplo, a titulação da base ácida é aplicada para determinar o valor de amina ou hidroxíl de uma amostra. O valor de amina é definido como o número de miligramas de KOH equivalente ao teor de amina em um grama de amostra. Para determinar o valor do hidroxila, o analito é primeiro acetilado usando anidrída acético e depois titulado com KOH. A massa em miligramas de KOH corresponde então a grupos de hidroxil em um grama de amostra. 13 Outro exemplo é o teste Winkler, um tipo específico de titulação de redox usado para determinar a concentração de oxigênio dissolvido na água para estudos de qualidade da água. O oxigênio dissolvido é reduzido usando sulfato de manganês(II), que reage com iodeto de potássio para produzir iodo. Uma vez que o iodo liberado é diretamente proporcional ao teor de oxigênio, a concentração de oxigênio é determinada pela titulação do iodo com tiosulfato usando um indicador de amido. 14
Além das aplicações em pesquisas químicas básicas, a titulação também tem sido amplamente adotada no uso industrial e cotidiano. Na indústria de biodiesel, o óleo vegetal residuais (WVO) deve primeiro ser neutralizado para remover ácidos graxos livres que normalmente reagiriam para fazer sabão indesejado. Uma parte do WVO é titulada com uma base para determinar a acidez da amostra, de modo que o resto do lote poderia ser devidamente neutralizado. 15 O método de Bento, um teste para quantificação do nível de glicose na urina, é outro exemplo que mostra a importância da titulação na saúde. Nesta titulação, íons cupéricos são reduzidos a íons cuprous por glicose, que então reagem com tiocianato de potássio para formar um precipitado branco, indicando o ponto final. 16
Referências
- Llc, B. Titration: Ph Indicator, Thermometric Titration, Nonaqueous Titration, Equivalence Point, Acid-Base Titration, Amperometric Titration. General Books LLC, (2010).
- Jacobsen, J. J., Jetzer, K. H., Patani, N., Zweerink, G. & Zimmerman, J. Titration Techniques. J. Chem. Educ. 72, 612, doi:10.1021/ed072p612 (1995).
- Harris, D. C. Quantitative Chemical Analysis. 8th edn, W. H. Freeman, (2010).
- Mattock, G., Taylor, G. R. & Paul, M. A. pH Measurement and Titration. J. Electrochem. Soc. 110, 31C, doi:10.1149/1.2425702 (1963).
- De Levie, R. Aqueous Acid-base Equilibria and Titrations. Oxford University Press, (1999).
- Cannan, R. K. The Acid-Base Titration of Proteins. Chem. Rev. 30, 395-412, doi:10.1021/cr60097a005 (1942).
- Michalowski, T. & Lesiak, A. Acid-Base Titration Curves in Disproportionating Redox Systems. J. Chem. Educ. 71, 632, doi:10.1021/ed071p632 (1994).
- Waser, J. Acid-base Titration and Distribution Curves. J. Chem. Educ. 44, 274, doi:10.1021/ed044p274 (1967).
- Gorbikova, E. A., Vuorilehto, K., Wikström, M. & Verkhovsky, M. I. Redox Titration of All Electron Carriers of Cytochrome c Oxidase by Fourier Transform Infrared Spectroscopy. Biochemistry 45, 5641-5649, doi:10.1021/bi060257v (2006).
- Silverstein, T., Cheng, L. & Allen, J. F. Redox Titration of Multiple Protein Phosphorylations in Pea Chloroplast Thylakoids. Biochim. Biophys. Acta (BBA)-Bioenerg. 1183, 215-220, doi:10.1016/0005-2728(93)90022-8 (1993).
- Lenghor, N., Jakmunee, J., Vilen, M., Sara, R., Christian, G. D. & Grudpan, K. Sequential Injection Redox or Acid-Base Titration for Determination of Ascorbic Acid or Acetic Acid. Talanta 58, 1139-1144, doi:10.1016/S0039-9140(02)00444-7 (2002).
- Mitchell, P., Moyle, J. & Smith, L. Bromthymol Blue as a pH Indicator in Mitochondrial Suspensions. Eur. J. Biochem. 4, 9-19, doi:10.1111/j.1432-1033.1968.tb00166.x (1968).
- Perkins, E. G. Analyses of Fats, Oils and Derivatives. AOCS press, (1993).
- Spellman, F. R. Handbook of Water and Wastewater Treatment Plant Operations. 2 edn, CRC Press, (2009).
- Purcella, G. Do It Yourself Guide to Biodiesel: Your Alternative Fuel Solution for Saving Money, Reducing Oil Dependency, Helping the Planet. Ulysses Press, (2007).
- Nigam. Lab Manual Of Biochemistry. Tata McGraw-Hill Education (2007).
Tags
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados