PH раствор, содержащего кислоту, можно определить с помощью постоянной диссоциации кислоты и ее исходной концентрации. Если раствор содержит две разные кислоты, то его pH можно определить одним из нескольких способов в зависимости от относительной силы кислот и их констант диссоциации.
Смесь сильной кислоты и слабой кислоты
В смеси сильной кислоты и слабой кислоты сильная кислота полностью диссоциируется и становится источником почти всех ионов гидрония, присутствующих в раствор. В отличие от этого, слабая кислота проявляет частичную диссоциацию и производит концентрацию гидрония в пренебрежимый. Высокая концентрация ионов гидрония, образуемых сильной кислотой, еще больше снижает диссоциацию слабой кислоты. Это происходит потому, что, согласно принципу Ле Чателье – “когда химическая система в равновесии нарушена, система смещается в направлении, которое минимизирует возмущение”. Избыточные ионы гидрония, производимые сильной кислотой, нарушают равновесие, и, таким образом, реакция будет двигаться в обратном направлении до тех пор, пока не будет установлено равновесие. Это приводит к уменьшению диссоциации слабой кислоты. Из-за этого снижения pH смеси сильной и слабой кислоты может быть рассчитан только на основе концентрации сильной кислоты. Например, pH смеси с равной концентрацией соляной кислоты (HCl), сильной кислоты и формальной кислоты (HCHO2), слабой кислоты, можно определить только по концентрации HCl. Если концентрация HCl в смеси составляет 0.0020 м, его pH можно рассчитать следующим образом.
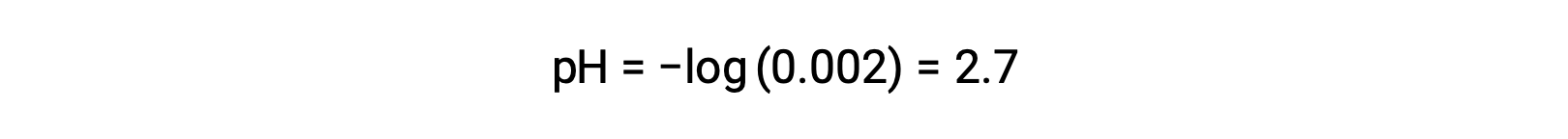
Здесь концентрация ионов гидрония, производимого HCHO2 и автоионизация воды, составляет пренебрежимый, и поэтому ее можно игнорировать.
Смесь двух слабых кислот с различными константами диссоциации
В смеси из двух слабых кислот pH смеси будет определяться более сильной кислотой, если ее константа диссоциации значительно выше, чем более слабая кислота. Например, в смеси с равной концентрацией закиси азота (HNО2) и гипохлорозной кислоты (HClO) HNО2 будет основным определяющим фактором pH смеси, так как ее Ka (4.6 × 10-4) примерно в 10,000 раз выше Ка (2.9 × 10-8) HClO. Согласно принципу Ле Чателье, HClO показывает снижение диссоциации в присутствии HNО2.
Из главы 15:

Now Playing
15.9 : Смеси кислот
Кислоты и основания
19.3K Просмотры

15.1 : Кислоты и основания Бренстеда-Лоури
Кислоты и основания
88.1K Просмотры

15.2 : Кислотно-щелочная сила и константы диссоциации
Кислоты и основания
59.1K Просмотры

15.3 : Вода: кислота и основание Бренстеда-Лоури
Кислоты и основания
48.6K Просмотры

15.4 : шкала pH
Кислоты и основания
66.8K Просмотры

15.5 : Относительные силы конъюгированных кислотно-основных пар
Кислоты и основания
44.4K Просмотры

15.6 : Сильные кислотные и щелочные растворы
Кислоты и основания
30.6K Просмотры

15.7 : Растворы слабой кислоты
Кислоты и основания
36.9K Просмотры

15.8 : Растворы слабых оснований
Кислоты и основания
21.9K Просмотры

15.10 : Ионы как кислоты и основания
Кислоты и основания
22.7K Просмотры

15.11 : Определение pH солевых растворов
Кислоты и основания
42.7K Просмотры

15.12 : Полипротонные кислоты
Кислоты и основания
28.3K Просмотры

15.13 : Кислотная сила и молекулярная структура
Кислоты и основания
30.2K Просмотры

15.14 : Кислоты и основания Льюиса
Кислоты и основания
42.4K Просмотры
Авторские права © 2025 MyJoVE Corporation. Все права защищены