По сравнению с чистой водой растворимость ионного соединения меньше в водных растворах, содержащих общий ион (который также образуется при растворении ионного соединения). Это пример явления, известного как общий ион-эффект, который является следствием закона массового действия, который можно объяснить с помощью принципа Ле Шатье. Рассмотрим растворение йодида серебра:
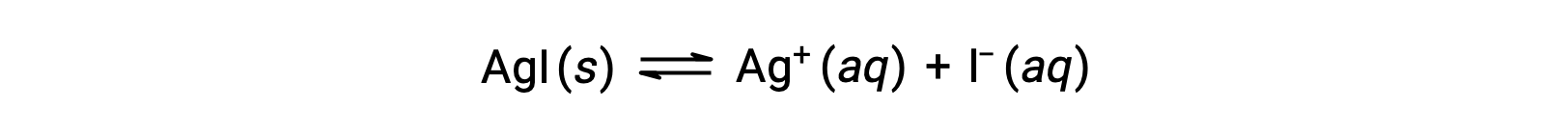
Это равновесие растворимости может быть смещено влево за счет добавления ионов серебра(I) или йодида, что приведет к осадкам AGI и снижению концентраций растворенных AG+ и I–. В растворах, которые уже содержат один из этих ионов, меньше AGI может быть растворено, чем в растворах без этих ионов.
Этот эффект также можно объяснить в терминах массового действия, как показано в выражении продукта растворимости:
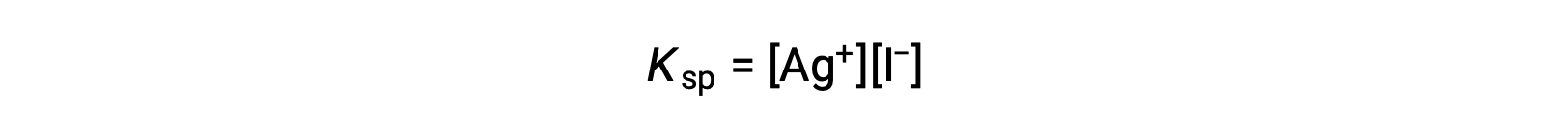
Математическое произведение серебряных (i) и иодид ионных корритетов является постоянным в равновесной смеси независимо от источника ионов, поэтому увеличение концентрации одного иона должно быть сбалансировано пропорциональным уменьшением другого.
Общее ионное воздействие на растворимость
Общий ион влияет на растворимость соединения в раствор. Например, твердые мг(OH)2 диссоциируют с ионами Mg2+и OH- следующим образом:
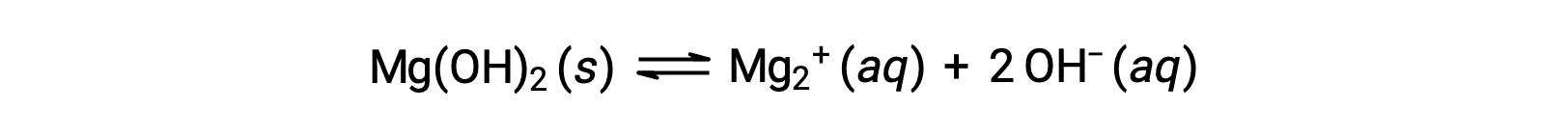
Если MgCl2 добавляется к насыщенному раствор в мг(OH)2, реакция смещается влево, чтобы снять напряжение, создаемое дополнительным ионом Mg2+, в соответствии с принципом Ле Шатье. В количественном выражении добавленный Mg2+ вызывает увеличение коэффициента реакции по сравнению с продуктом растворимости (Q > KSP), а форма Mg(OH)2 — до тех пор, пока коэффициент реакции снова не сравняется с KSP. При новом равновесии [OH–] меньше, и [Mg2+] больше, чем в раствор мг(OH)2 в чистой воде.
Если КОХ добавляется к насыщенному раствор мг(OH)2, реакция смещается влево, чтобы снять напряжение дополнительного OH– иона. Мг(OH)2 образуется до тех пор, пока коэффициент реакции снова не станет KSP. При новом равновесии [OH–] больше, а [Mg2+] меньше, чем в раствор мг(OH)2 в чистой воде.
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 15.1: Осадки и растворение.
Авторские права © 2025 MyJoVE Corporation. Все права защищены