Электричество вырабатывается электронами или ионами, проходящими через раствор или проводящую среду. Этот поток электронов или электрический заряд определяется как электрический ток. Когда электроны проходят через провод, они генерируют электрический ток. Можно напомнить, что в окислительно-восстановительных реакциях электроны теряются и обретают. При спонтанной окислительно-восстановительных реакциях цинкас медью, когда цинк погружается в медный ион раствор, происходит перенос электронов из одного вещества в другое.
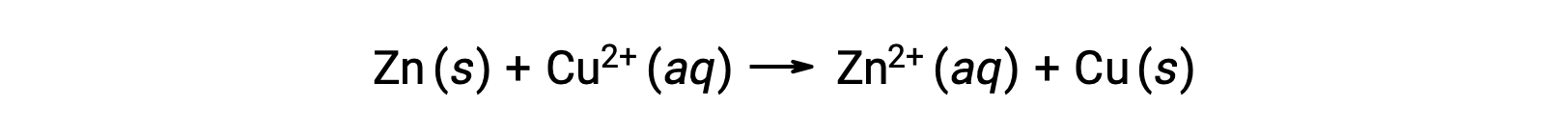
Цинк, имеющий большую склонность к потере электронов, окисляется до ионов цинка, а ионы меди редуцируются до твёрдых меди. Однако такая реакция не приводит к электричеству.
Электрический ток и как движутся электроны
Перенос электронов происходит непосредственно от восстанавливающего вещества к окислителям в раствор. Даже если компоненты полуреакций физически изолированы в отдельных сосудах и соединены через внешний проводник, например провод, тенденция к потере и получению электронов реагенты все еще сохраняется. Однако теперь электроны вынуждены проходить через провод, соединяющий две полуреакции. Этот поток электронов через провод представляет собой электрический ток и может обеспечить питание электронных приборов, таких как лампа-лампа. Электрический ток измеряется в амперах. Один ампер равен потоку одногокулона электрического заряда в секунду и равен 6.24 × 10-18 электронам в секунду.
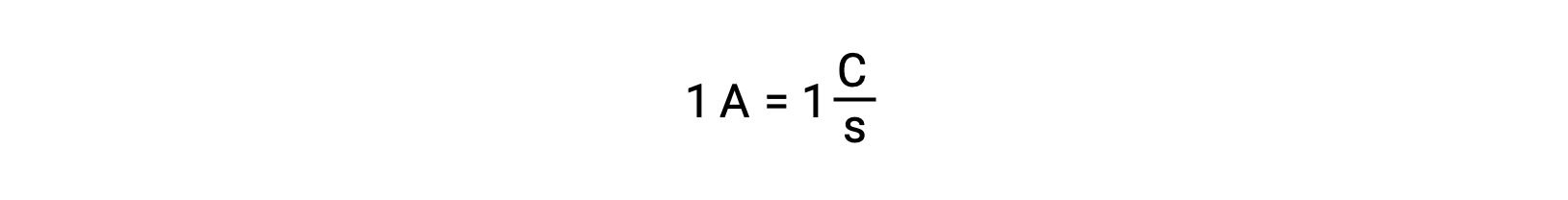
Поскольку электрон имеет заряд 1.602 × 10-19 C, 1 ампер коррелирует с потоком 6.242 × 1018 электронов в секунду.
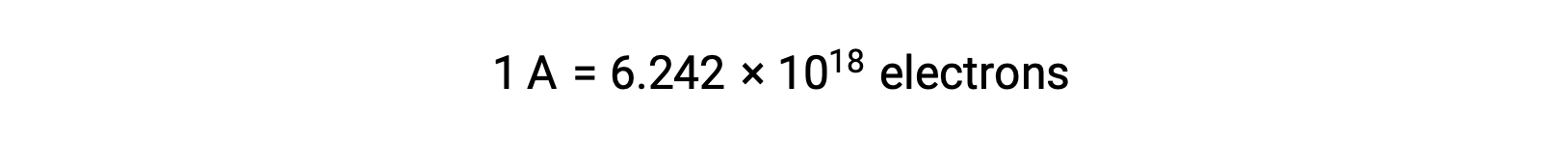
Движущая сила электрического тока, разность потенциалов и ЭМП
Поток электрического тока похож на поток воды, протекающей через водопад. Вода приводится в действие разницей в энергии гравитационного потенциала, в то время как поток электронов определяется разницей энергии электрического потенциала между реагенты. Эта разница в энергии электрического потенциала описывается либо терминами разность потенциалов, электродвижущая сила (эмп), либо клеточный потенциал. эмп является мерой движущей силы между двумя реагенты и тенденцией к передаче электронов.
Некоторые окислительные реакции являются спонтанными, в то время как другие нет. Например, медная проволока подвергается спонтанному окислению ионами серебра(i), но не дает реакции при погружении в раствор ионов свинца(II). Это связано с разницей в окислительной активности двух видов, AG+ (aq) и Pb2+ (aq), по отношению к меди: Серебряный ион спонтанно окисляет медь, но свинцовый ион не окисляет. Это различие в окислительно-восстановительных активях электрохимии можно количественно оценить с помощью термина «клеточный потенциал», также известного как «напряжение».
Потенциал ячейки двух изолированных реагенты измеряется вольтметром, который считывается по напряжению ячейки. Один вольт соответствует одному джоулу потенциальной энергии на один кулон электрического заряда.
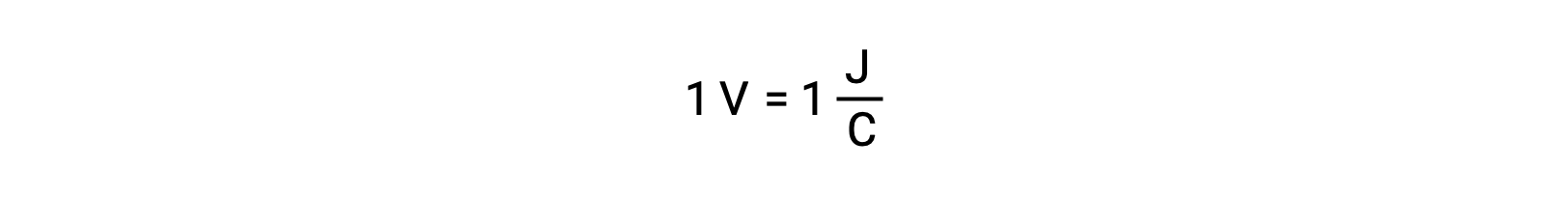
Высокий потенциал клеток указывает на большую движущую силу и большую легкость передачи электронов. Наконец, электродвижущая сила или клеточный потенциал зависят от примоль реагенты, температуры реакции и концентрации ионов, присутствующих в реакции.
Этот текст адаптирован из OpenStax, Химия 2е изд., раздел 17.3: Электродный и клеточные потенциалы.
Авторские права © 2025 MyJoVE Corporation. Все права защищены
