Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Методы для быстрой передачи и локализации патогенов Болезнь Лайма В Tick Gut
В этой статье
Резюме
Лайма исследования медицинских исследований часто требуют поколения клещей инфицированы возбудителем Borrelia burgdorferi, процесс, который обычно занимает несколько недель. Здесь мы показываем, микроинъекции основе тик инфекции процедура, которая может быть выполнена в течение нескольких часов. Мы также продемонстрировать метод иммунофлюоресценции на месте локализации B. burgdorferi в клещи.
Аннотация
Болезнь Лайма вызывается инфекцией с спирохеты Borrelia burgdorferi возбудителя, который ведется в природе клещей грызунов инфекционного цикла 1. Клещевого мышиной модели 2 был разработан для изучения болезни Лайма в лаборатории. Хотя наивная клещи могут быть заражены B. burgdorferi путем подачи их на зараженных мышей, линьки процесс занимает от нескольких недель до месяцев. Таким образом, разработка более быстрой и эффективной тик инфекции методы, такие, как микроинъекции основе процедуры, является важным инструментом для изучения болезни Лайма 3,4. Процедура требует лишь несколько часов для получения инфицированных клещей и позволяет контролировать доставку равные количества спирохет в когорту клещей. Это особенно важно, как и поколение B. burgdorferi инфицированных клещей на естественный процесс кормления на мышах не обеспечивает 100%-ная ставка инфекции и, возможно, приводит к изменению нагрузки возбудителя среди клещей кормили. Кроме того, микроинъекции может быть использована для заражения клещей с Б. burgdorferi изолятов в тех случаях, когда штамм ослабленных не может установить инфекции у мышей и, следовательно, не может быть естественным, приобретенных клещей 5. Этот метод может также использоваться для доставки множества других биологических материалов в клещи, например, специфические антитела или двухцепочечной РНК 6. В этой статье мы покажем, микроинъекции нимф клещей с в пробирке выращенных B. burgdorferi. Мы также будем описывать метод локализации болезни Лайма патогенных микроорганизмов в кишечнике клеща с помощью конфокальной микроскопии иммунофлуоресценции.
протокол
1. Микроинъекции нимф иксодовых клещей scapularis
1. Подготовка иглы
- Изготовление нескольких игл микроинъекции путем нагрева и вытягивания 1 мм стеклянные капилляры (инструменты Всемирного Precision) в стеклянной микропипетки съемник устройства (Narishige). Осторожно снимите хрупкие капилляры.
- Магазин вытащил иглы (с наконечником вверх) на клейкой ленты в чашке Петри.
2. Подготовка B. burgdorferi
- Расти Б. burgdorferi в БСК медиакультуры 7, пока в концентрации около 10 7 клеток на мл. Спирохеты учитываются при темном поле микроскопа с использованием Петрофф-Хауссер счетной камере (Хауссер научных).
- Гранул Б. burgdorferi путем центрифугирования при 3000 мкг в течение 10 минут при комнатной температуре.
- Удалить супернатант и полностью ресуспендируют осадок в БСК СМИ, осторожно, проходящих через 200 мкл стерильной микроострийных в конечной концентрации 10 9 клеток на мл. Так как клетки ресуспендировали при высокой плотности клеток и могут слипаться, клеточной суспензии следует использовать для микроинъекции немедленно.
3. Подготовка клещей
- Место ясно, двусторонняя клейкая лента на предметное стекло.
- Работа на липкой мат, осторожно удалите нимф клещей из контейнера, используя маленькую кисть.
- Место необходимое количество клещей, который будет введен на клейкую ленту, брюшной стороной вверх, смотрят в одном направлении.
4. Потребители инъекционных клещей
- Нагрузка 5 мкл B. burgdorferi культуры в капиллярной вытащил иглу использованием 20 мкл microloader пипетки (Eppendorf). Осмотрите иглу для осталось воздуха и перезагрузить иглу с бактериальной культурой, если это необходимо.
- Посмотреть тик под рассекает бинокулярный микроскоп и сосредоточиться на анальную область диафрагмы клеща. Мягко касайтесь кончиком капиллярной иглой, чтобы сломать трубу, где диаметр немного меньше, чем у анального отверстия клеща, образуя микроинъекции иглы. Этот шаг имеет решающее значение, как любая попытка придать клещей с не соответствующей иглы причины травм и возможной гибели вводят клеща.
- Место иммобилизованных клещей при вскрытии бинокулярный микроскоп и сосредоточиться на анальное отверстие, которое покрывается двумя подвижными анальным пластин. Использование тонких щипцов, мягко коснуться и применяются очень мягкий давление в любой район вблизи анального отверстия. Это позволит разделение анальных пластинок и открытия анального поры, который подключается к кишечнике. Осторожно вставьте кончик иглы немного в анальное отверстие, через принудительное открытие анальной пластинки. Иглы должны быть сведены к минимуму, так как стеклянным наконечником может повредить полупрозрачной кишке, который подключается к прямой кишке. Использование microinjector оснащен автоматизированного управления футов (Eppendorf), вводят B. burgdorferi решение с использованием следующих параметров: 1000 гектопаскалях (гПа) давление впрыска, 0,2 секунды времени впрыска и 8 гПа компенсации давления. Каждый тик получает одну инъекцию.
- После микроинъекции, клещи должны вести себя аналогично предварительного впрыска государства. Например, клещ должен ползать в ответ на раздражители.
- Мы обычно позволяют клещей восстановить в течение 48 часов в экологическом камере установлена на уровне 24 ° С с 16 часов / 8 часов светлый / темный фотопериода режима и 95% влажности. Если камера не доступна, вводят клещей может храниться при комнатной температуре во влажных условиях в герметичном контейнере, например, регулярные камеры эксикаторе. При необходимости, время восстановления клещей также может быть сокращено до нескольких часов прежде, чем использовать для кормления на мышах.
2. B. Локализация burgdorferi с помощью конфокальной микроскопии иммунофлуоресценции
1. Пройдя клещей
- Место капли фосфатным буферным раствором (PBS) на чистую предметное стекло для вскрытия, а другой на поли-L-лизин покрытием слайд (Sigma) для микроскопии. Подготовка другое стекло с двусторонней клейкой лентой.
- Снимите галочку из контейнера и поместите на двусторонней клейкой ленты, используя маленькую кисть.
- Просмотр и сосредоточиться галочку в рассечение микроскопом. Место острое лезвие бритвы на тик между первой и второй пары ног. С усилием нажмите резки тик на две части обеспечения доступа к животу. Сразу же, погрузиться в животе капли PBS.
- Использование очень тонкие щипцы, схватить спинной и брюшной экзоскелет вокруг места разреза. Осторожно вытащите спинной щит вверх и в сторону от клеща подвергая коричневато цветные дивертикулы кишечника. Будьте осторожны, чтобы сохранить рассекает клещей под PBS во все времена.
- Полупрозрачный слюнные железы булочкаdles расположены по обе стороны от передней части кишечника, и может быть удален в этот момент, если это необходимо. Холдинг оставшиеся экзоскелет на месте с помощью щипцов, осторожно вытащите кишки из живота.
- Аккуратно очистите кишечник, удалив все ловушке тканей (например, трахеи).
- Использование кончик тонкой щипцы, быстро передавать тик кишки в капле PBS на поли-L-лизин стекло. Отдельные кишки на более мелкие части с использованием тонких лезвий или мягко нажимая кончиком тонкой щипцами. Тщательно аспирации избыточного PBS вокруг кишки тканей.
- Разрешить кишечнике ткани высохнуть на воздухе при комнатной температуре.
- Fix тик кишки, погружая в ацетоне в течение 10 минут. Дайте высохнуть на воздухе при комнатной температуре. Слайды могут быть сохранены на данном этапе в течение нескольких месяцев при температуре -20 ° С в герметичном контейнере.
2. Окрашивание
- Использование папиросной бумаги, удалите лишнюю влагу вокруг ткани и нарисуйте круг вокруг сушеные кишки тик на ПАП-ручки или любой гидрофобный устройство футеровки барьер. Это поможет сохранить окрашивания решений во время последующих этапов инкубации.
- Обложка тик кишки с одним или несколькими каплями блокирующим буфером (0,05% Твин-20, 5% козьего сыворотки в PBS) в течение 30 минут при комнатной температуре. Сыворотка используется для блокировки зависит от источника животного-хозяина для антител. Не допускать сползания к сухой, с этой точки вперед.
- Медленно аспирата блокирующем буфере. Инкубируйте кишечника с соответствующими первичными и / или вторичных решений антител. Мы используем флуоресцеина изотиоцианат (FITC) - помечены против Б. burgdorferi антител (Киркегор & Perry Laboratories) в разведении 1:100 в блокирующем буфере в течение 1 часа при комнатной температуре. Крышка контейнера с алюминиевой фольгой, чтобы ограничить воздействие света.
- Удалить раствор антитела, осторожно аспирации. Инкубируйте кишки с флуоресцентным красителем для обозначения тик ткани, такие как 4 ',6-diamidino-2-фенилиндола (DAPI) или пропидий йодида. Мы обычно используем 20 мкг / мл пропидий йодида (Sigma) в PBS в течение 5 мин. при комнатной температуре.
- Промыть 3 раза с 0,05% Твин-20 в PBS.
- Горы слайд в буфер содержащие глицерин antifade реагентом, таким как Slowfade (Invitrogen) и тщательно покрывают покровным стеклом. Слайды могут быть сохранены на данном этапе в течение нескольких месяцев при температуре 4 ° С в герметичном контейнере. Изображение и локализации Б. burgdorferi по конфокальной микроскопии.
3. Представитель Результаты
Положение нимф тика по микроинъекции и изображение, представляющее B. burgdorferi локализация в кишечнике клеща представлен на рисунке 1.
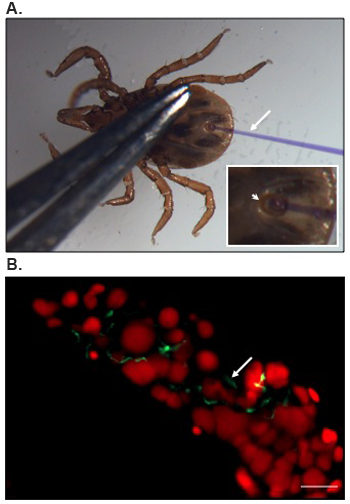
Рисунок 1. Микроинъекция и локализации Б. burgdorferi в тик кишечнике.
(А) Брюшной зрения нимф I. scapularis тик позиционируется для микроинъекции. Анальное отверстие (стрелка) со вставленными микроинъекции иглы (стрелки) показан при увеличении на вставке. Штрафа forcep используется для применения мягкое давление на тело, которое позволило разделения анальных пластинок и открытия анального пор для микроинъекции. Игле заполняется раствором Кумасси бриллиантовый синий, которое улучшает видимость. (В) представитель результатов конфокальной иммунофлюоресценции изображений Б. burgdorferi в тик кишечнике. Передняя область кишечника дивертикула показано. Ядер Гут и спирохеты (стрелка) помечены пропидий йодида (красный цвет) или FITC-сопряженных против Б. burgdorferi (зеленый цвет), соответственно. Bar = 20 мкм.
Обсуждение
Здесь мы показываем, микроинъекции основе процедуры для быстрого и эффективного заражения нимф иксодовых клещей с бактериальным возбудителем B. burgdorferi. Мы также описываем конфокальной иммунофлюоресценции процедура выявления B. burgdorferi в тик кишки на месте. Хотя наша демон...
Раскрытие информации
Благодарности
Мы искренне благодарим членов лаборатории Пал за помощь в подготовке этой демонстрации. Это исследование было поддержано грантами PHS AI076684 и AI080615 из NIH / NIAID.
Материалы
| Name | Company | Catalog Number | Comments |
| Glass capillary tubes | World Precision Instruments, Inc. | TW100F-4 | |
| Vertical glass puller | Narishige International | PC-10 | |
| Petroff-Hausser counting chamber | Hausser Scientific | 3900 | |
| Microloader pipette tips | Eppendorf | 930001007 | |
| Femtojet microinjector | Eppendorf | 920010504 | |
| Foot control FemtJet | Eppendorf | 920005098 | |
| Phosphate buffered saline | Fisher Scientific | BP665-1 | Filter-sterilized |
Ссылки
- Steere, A. C., Coburn, J., Glickstein, L. The emergence of Lyme disease. J Clin Invest. 113, 1093-1101 (2004).
- Barthold, S. W., Diego, C., Philipp, M. T., Samuels, D. S., Radolf, J. D. . Borrelia, Molecular Biology, Host Interaction and Pathogenesis. , 353-405 (2010).
- Pal, U. OspC facilitates Borrelia burgdorferi invasion of Ixodes scapularis salivary glands. J Clin Invest. 113, 220-230 (2004).
- Yang, X. F., Pal, U., Alani, S. M., Fikrig, E., Norgard, M. V. Essential role for OspA/B in the life cycle of the Lyme disease spirochete. J Exp Med. 199, 641-648 (2004).
- Zhang, X., Yang, X., Kumar, M., Pal, U. BB0323 function is essential for Borrelia burgdorferi virulence and persistence through tick-rodent transmission cycle. J Infect Dis. 200, 1318-1330 (2009).
- Pal, U. TROSPA, an Ixodes scapularis receptor for Borrelia burgdorferi. Cell. 119, 457-468 (2004).
- Barbour, A. G. Isolation and cultivation of Lyme disease spirochetes. Yale J Biol Med. 57, 521-525 (1984).
- Narasimhan, S. Disruption of Ixodes scapularis anticoagulation by using RNA interference. Proc Natl Acad Sci U S A. 101, 1141-1146 (2004).
- Narasimhan, S. A tick antioxidant facilitates the Lyme disease agent's successful migration from the mammalian host to the arthropod vector. Cell Host Microbe. 2, 7-18 (2007).
- Broadwater, A. H., Sonenshine, D. E., Hynes, W. L., Ceraul, S., DeSilva, A. Glass capillary tube feeding: a method for infecting nymphal Ixodes scapularis (Acari: Ixodidae) with the Lyme disease spirochete Borrelia burgdorferi. J Med Entomol. 39, 285-292 (2002).
- Policastro, P. F., Schwan, T. G. Experimental infection of Ixodes scapularis larvae (Acari: Ixodidae) by immersion in low passage cultures of Borrelia burgdorferi. J Med Entomol. 40, 364-370 (2003).
- Fuente, d. e. l. a., Kocan, J., M, K., Almazan, C., Blouin, E. F. RNA interference for the study and genetic manipulation of ticks. Trends Parasitol. 23, 427-433 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены