Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
ReAsH / Flash Маркировка и анализ изображений белков Tetracysteine датчика в клетках
В этой статье
Резюме
Biarsenical красителей вспышкой и ReAsH специфично связываются с tetracysteine мотивов в белках и может выборочно этикетке белков в живых клетках. В последнее время эта маркировка стратегия была использована для разработки датчиков для различных конформаций белков или олигомерных государств. Мы описываем маркировки подход и методы количественного анализа связывания.
Аннотация
Флуоресцентные белки и красителей являются необходимыми инструментами для исследования белков торговли людьми, локализации и функции в клетках. Хотя флуоресцентные белки, такие как зеленая флуоресценция белка (GFP), широко использовались в качестве партнеров для слияния белков отслеживать свойства белка интересов 1, последние события с меньшей теги позволяют новых функциональных белков должны быть рассмотрены в клетках, таких как изменение конформации и белково-ассоциации 2, 3. Одна маленькая система включает в себя теги tetracysteine мотив (CCXXCC) генетически вставляется в целевой белок, который связывается с biarsenical красители, ReAsH (красный флуоресцентный) и Flash (зеленый флуоресцентный), с высокой специфичностью даже в живые клетки 2. TC / biarsenical красителя система предлагает гораздо меньше стерических ограничений на хост белка, чем флуоресцентные белки, что позволило несколько новых подходов для оценки конформационных изменений и белок-белковых взаимодействий 4-7. Недавно мы разработали новое применение ТК теги как датчики олигомеризации в клетках, экспрессирующих мутантный Huntingtin, который при мутировал агрегатов в нейронах в Хантингтон болезни 7. Huntingtin была помечена с двумя флуоресцентными красителями, один флуоресцентный белок отслеживать местоположение белка, а второй теги TC которые только связывает biarsenical красителей в мономеров. Следовательно, изменения в колокализации между белком и biarsenical красителя реактивность включен субмикроскопических содержание олигомеров быть пространственно отображается внутри клеток. Здесь мы опишем, как этикетка TC-меткой белков, слитый с флуоресцентный белок (вишня, GFP или CFP) со вспышкой или ReAsH в живых клетках млекопитающих и как количественно два цвета флуоресценции (вишня / Flash, CFP / Flash или GFP / ReAsH комбинации).
протокол
1. Подготовка клеток для маркировки с ReAsH / Flash
- Используя стандартные методы клеточной культуры для вашего клеточной линии интересов, подготовить культуры прилипшие клетки непосредственно в живых изображений слайд клетка готова к трансфекции.
- Трансфекции плазмиды, содержащей вашего ТС с метками интересующего гена в соответствии с вашими трансфекции методом выбора.
Обратите внимание, важно использовать положительный и отрицательный контроль, чтобы оценить степень специфического связывания с TC-теги и оценить для bleedthrough флуоресценции между каналами при сборе конфокальной микроскопии. Таким образом, для двух цветов (например, Flash / Cherry или ReAsH / CFP или ReAsH / GFP комбинаций), убедитесь, образцы подготовлены для одного цвета (например, флуоресцентный белок в одиночку или, если возможно TC-меткой белок связан с Flash / ReAsH но без флуоресцентного белка)
- От одного до двух дней после трансфекции, осторожно промыть клетки с 300 мкл предварительно нагревается (при 37 ° С) HBSS.
- Осторожно погрузите клеток с 1 мкМ Flash (или ReAsH) в 300 мкл предварительно нагретого HBSS и 10 мкМ 1,2-этандитиола (EDT).
Важно, чтобы добавить EDT первых, прежде чем добавлять Flash / ReAsH и сделать буфера непосредственно перед добавлением его в клетки. Инкубировать ровно 30 минут при температуре 37 ° С в культуре ткани инкубатора. По нашему опыту более длительное время инкубации значительно увеличивает фоновой флуоресценции. Новые конструкции также должны быть оптимизированы для маркировки времени и Flash / ReAsH концентрации (0,5-2 мкм).
- Аккуратно аспирата маркировки решение из клеток, а затем заменить на 300 мкл предварительно нагретого HBSS + 250 мкМ 2,3-dimercaptopropanol (БАЛ) в течение 15 минут при температуре 37 ° C.
- Удалить промывочного раствора, осторожно стремление и заменить 300 мкл предварительно нагретого HBSS.
После этого вымыть, клетки могут быть исправлены с помощью параформальдегида (15 мин с 3,2% раствора), хотя мы обнаружили, что это повышает неспецифическую biarsenical флуоресценции красителя. Поэтому мы обычно изображение клетки живут при комнатной температуре. (Заметим, что фиксация клеток перед маркировки предотвращает biarsenical обязательным красителя.)
2. Изображений клеток на конфокальной микроскопии
- На конфокальной микроскопии, настроить параметры для работы с изображениями отдельных флуорофоров (см. таблицу 1) и убедитесь, что есть незначительное bleedthrough между каналами. Это может быть достигнуто путем проверки отдельных флуорофоров (в контрольных образцах) в отношении каждого отдельного люминесцентные настройки приобретение для флуоресценции. Регулировка диапазона длины волны излучения может помочь свести к минимуму bleedthrough (хотя это может также уменьшить сигнал / шум).
- Также регулировать ФЭУ параметры так, чтобы максимально флуоресценции в образце не насыщает детектора. (Это может быть обнаружены с помощью Q-LUT установки на SP2 Leica конфокальной). Как только оптимальные настройки изображения определяется, не меняют любой из них между образцами.
- Другие параметры, которые мы обычно используем (хотя они могут быть оптимизированы) являются скорости сканирования 200 Гц и собрать 4 линии средних и отверстие диаметром 1 Эйри единицы. Отверстие диаметром может быть расширена, если сигнал / шум является проблемой, однако, это может привести к некоторой потере изображения.
- Сбор конфокальных изображений в 12-бит (или выше) формат, если это возможно. 12-битный формат захватывает более широкий динамический диапазон значений (0-4095) для каждого пикселя интенсивностью, чем 8-разрядный (0-255). Это важно для обеспечения богатым набором данных записывается, которая максимизирует качество количественного анализа данных.
- Сбор изображения для флуоресцентной канала белка (вишня, GFP или CFP), а также для biarsenical канале красителя (Flash или ReAsH) для всех образцов.
3. Анализ данных
- Установка программного обеспечения ImageJ на компьютере 8. http://rsbweb.nih.gov/ij/
- Убедитесь, что ваша версия ImageJ имеет следующие модули:
- Открытое ImageJ, и если используете версию старше v1.32c, нажмите на следующие параметры, чтобы включить несколько изображений должен быть открыт в свое время (которое может быть сделано, удерживая нажатой кнопку управления, щелкните на разных файлов):
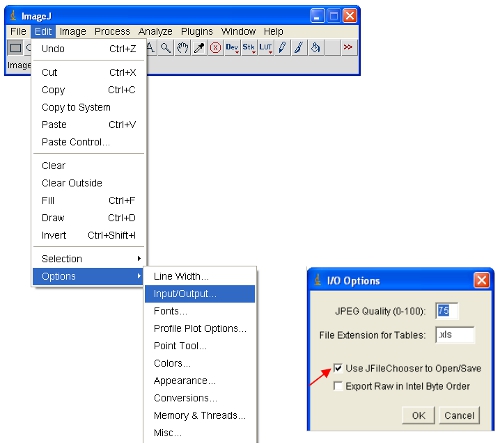
- Открытые изображения интереса к ImageJ.
ImageJ будет автоматически определять максимальные и минимальные интенсивности пикселов, которые отображаются на экране для каждого изображения отдельно. Учитывая, что различные изображения будут иметь гifferent интенсивности пикселей, это означает, отображаемые изображения не являются сопоставимыми, если смотреть. - Чтобы обеспечить открытые изображения все по той же шкале, вы можете физически определить верхнюю и нижнюю интенсивностей пикселей для просмотра (это не изменит фактического содержания данных изображения как бы в некоторых других программ). Эти значения могут быть установлены в следующее меню:
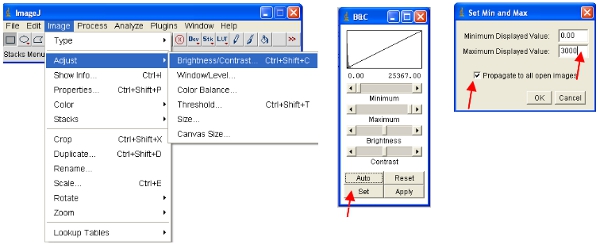
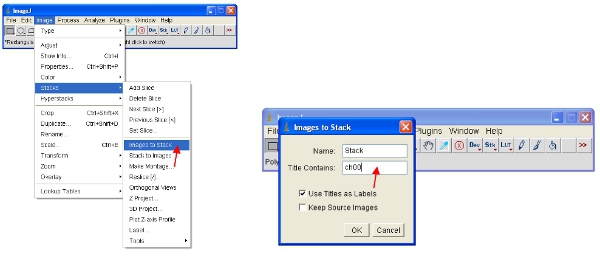
- Альтернативный подход заключается в работе с магазином, который помещает все изображения в один файл и автоматически шкале (для просмотра) всех изображений в стек в том же масштабе. Самый простой способ работы с данными, является преобразование каждого канала для стека. Таким образом, для флуоресцентного белка канал преобразовать все сложить, как показано на рисунке. Вы можете легко выбрать один канал, складывая все изображения, содержащие общее название (например, "ch00») в названии.
- Теперь конвертировать все открытые изображения в 8-битные для анализа. Это на самом деле изменить масштаб просмотра в диапазоне 0-255 диапазон (который определяет 8-бит).
ВАЖНО: Не экономьте на оригинальных 12-бит (или выше) формат, иначе вы потеряете информационное содержание. Заметим, что некоторые пакеты программного обеспечения может отображать только 8-битные изображения, таким образом этот формат является полезной для принятия цифры и т.д.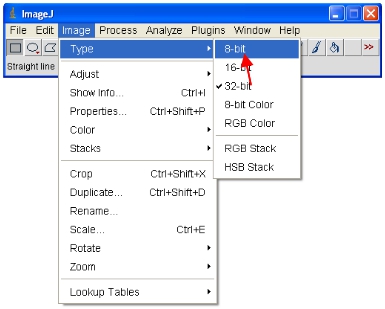
- Сохранить копию в новую папку под названием "8-битные превращается" с помощью "Сохранить как ..." вариант.
- Один из методов для изучения степени biarsenical обязательным красителя в целом изображение для выполнения пикселей участок корреляции интенсивности. Это участки каждого пиксела значения в одном канале относительно соответствующего значения пиксела в второго канала. Следовательно, пиксел позицию высоко в CFP флуоресценции также будет высоким в флуоресценции ReAsH, если существует высокая обязательными.
- Для анализа пикселей со-корреляции, убедитесь, что 8-битный ReAsH и Cerulean / GFP изображений, открытых в ImageJ.
- Откройте «Изображение Correlator" плагин, как указано ниже. Выберите "Image1", как ReAsH или флэш-стек и "image2" в качестве флуоресцентного белка стек.
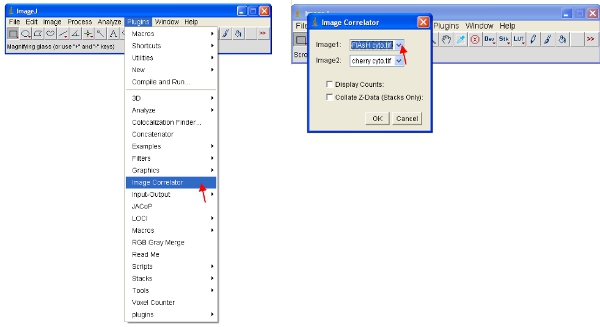
- В результате стек могут не отображать никакой детальной информации - это нормально. Сохранить стек в новую папку под названием "диаграммы рассеяния" и дать ему то же имя файла в качестве образца он относится к (например, "флэш-вишневый корреляции заговор")
- Для просмотра данных осмысленно вы можете сделать одно из двух вариантов. Первое преобразование данных, с тем, что именно в формат журнала. Затем визуально масштабировать данные следующим образом:
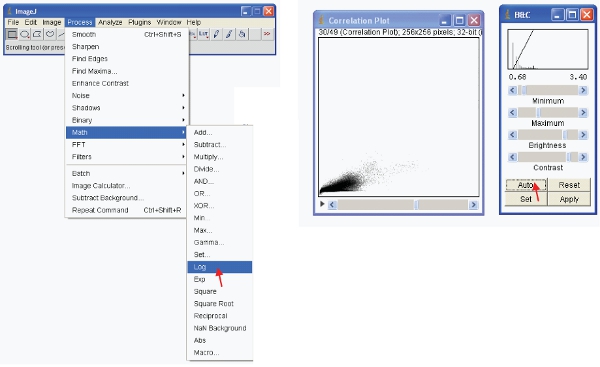
- Кроме того, можно масштабировать данные наглядно показывают только низкие значения (например, 1-255) и отображать данные, используя специальные LUT. LUT (Look Up Table) представляет собой таблицу цветов, которые возложены на величину каждого пиксела в изображении . Это может быть использовано для определения псевдо-схему изображения и полезно для определения некоторых функций в изображении. Чтобы создать пользовательскую кнопку LUT на "LUT редактор" и сделать новую, таких как показано (это могут быть сохранены и использованы в дальнейшем).
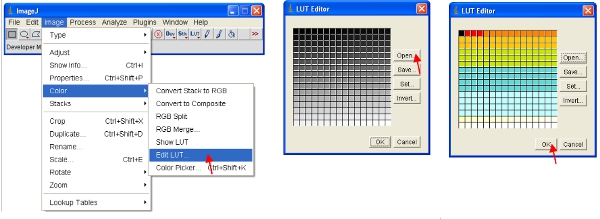
- Установить яркость / контрастность в диапазоне от 0-255 (как описано в пункте 13 выше). Чтобы "зафиксировать" изображение как показанному на экране, изображение может быть преобразовано в RGB-формат, который сохраняет 8-разрядное значение для каждого из красного, зеленого и синего цвета каждого пикселя.
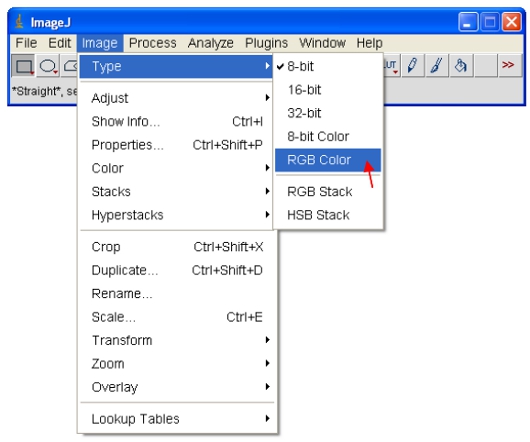
Чтобы копировать и вставлять изображения в другие программы, первый открытый 8-битной или 16-битными изображениями. Как указано в пункте 14 выше, назначить схему LUT цвета изображения. Для CFP, назначить "голубой" LUT, как описано ниже ...
- Выберите изображение и скопировать его в буфер обмена, выберите ...
4. Представитель результаты:
Успех маркировки клеток с biarsenical красителей зависит от нескольких ключевых параметров. Во-первых, сроки маркировки с красителями имеет решающее значение. Мы обнаружили, что длительное маркировки (более 30 мин) приводит к высокому уровню неспецифический фон окрашивания. Рис 1 показан типичный результат для дикого типа форме фрагмента Huntingtin (25Q), слитый с CFP производных Cerulean содержащие теги TC, как описано выше 7. Этот пример был залит в течение 30 мин с ReAsH и есть минимальный опыт работы в образце отсутствуют теги ТС. Мы обнаружили, что фиксация клеток с фоном параформальдегида увеличивается, а фиксация с метанолом отменяет флуоресценции флуоресцентного белка теги. Следовательно, где возможно, мы изображение клетки живут. Важно также отметить, что до фиксациик маркировке с biarsenical красителей предотвращает их обязательными, предположительно из-за модификаций ТС мотив.
Другим важным фактором для последовательного результатов плотность клеток. Мы нашли это важно для изображения клеток, которые свободно распространяются и также, что обширные наносить удар может привести к неравномерной окраски biarsenical красителей в разных клетках.
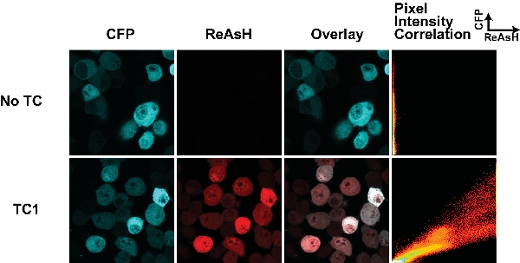
Рисунок 1. Tetracysteine теги и ReAsH окрашивания в живых клетках, трансфицированных Huntingtin (exon1-25Q)-Лазурная слияний. Теги ТС находится на стыке Huntingtin-Лазурная синтеза (как описано в разделе 7). Пиксель участка корреляции интенсивности позволяет оценить различия в ReAsH обязательную силу на всей клетке и может быть использован для отображения изменений в ReAsH обязательными из-за конформационных изменений или лиганд.
Обсуждение
Подход к этикетке локализации белка с флуоресцентным белком и конформационные свойства со вторым красителем предлагает большой потенциал для отображения, где разные конформации белков накапливаются в клетках и события, которые изменяют динамику конформации белка. ReAsH / Flash был впервы...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа финансировалась за счет грантов для ДМГ и TDM (NHMRC проекту гранты). ДМГ является Гримвад сотрудник, финансируемый Miegunyah Trust.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
|---|---|---|---|
| 8-и μ-слайды | Ibidi | 80826 | Мы находим эти камерные слайды должны быть особенно полезно для культивирования клеток для работы с изображениями. |
| TC-Flash II В-клеток Обнаружение тегов Tetracysteine Kit * зеленая флуоресценция * для живого-клеточного изображения | Invitrogen | T34561 (Flash) или T34562 (ReAsH) | |
| Сбалансированный Соль Хэнкса Решение | Invitrogen | 14175-103 | |
| 2,3-Dimercapto-1-пропанол | Sigma-Aldrich | D1129-5мл | |
| 1,2-этандитиола | Sigma-Aldrich | 02390-25МЛ |
Ссылки
- Tsien, R. Y. The green fluorescent protein. Ann. Rev. Biochem. 67, 509-544 (1998).
- Griffin, B. A., Adams, S. R., Tsien, R. Y. Specific covalent labeling of recombinant protein molecules inside live cells. Science. 281, 269-2672 (1998).
- Uttamapinant, C. A fluorophore ligase for site-specific protein labeling inside living cells. Proc. Natl. Acad. Sci. USA. 107, 10914-10919 (2010).
- Ignatova, Z., Gierasch, L. M. Monitoring protein stability and aggregation in vivo by real-time fluorescent labeling. Proc. Natl. Acad. Sci. USA. 101, 523-528 (2004).
- Coleman, B. M. Conformational detection of prion protein with biarsenical labeling and FlAsH fluorescence. Biochem. Biophys. Res. Commun. 380, 564-568 (2009).
- Luedtke, N. W., Dexter, R. J., Fried, D. B., Schepartz, A. Surveying polypeptide and protein domain conformation and association with FlASH and ReAsH. Nat. Chem. Biol. 3, 779-784 (2007).
- Ramdzan, Y. M. Conformation sensors that distinguish monomeric proteins from oligomers in live cells. Chem. Biol. 17, 371-379 (2010).
- Abramoff, M. a. g. e. l. h. a. e. s., PJ, S. J. R. a. m. Image processing with ImageJ. Biophotonics International. 11, 36-42 (2004).
- Hearps, A. The biarsenical dye Lumio exhibits a reduced ability to specifically detect tetracysteine-containing proteins within live cells. J. Fluor. 17, 593-597 (2007).
- Adams, S. R. New biarsenical ligands and tetracysteine motifs for protein labeling in vitro and in vivo: Synthesis and biological applications. J. Am. Chem. Soc. 124, 6063-6076 (2002).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Meth. 2, 905-909 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены