Method Article
Изображений адгезии лейкоцитов к эндотелия сосудов при высоких внутрипросветного давления
В этой статье
Резюме
Это метод для визуализации адгезии лейкоцитов к эндотелию в заготовленных под давлением. Техника позволяет изучать сосудистой адгезии при сдвиге потоков с различными внутрипросветного давления до 200 мм рт.ст. Таким образом имитировать-ING патофизиологических условиях высокого кровяного давления.
Аннотация
Worldwide, hypertension is reported to be in approximately a quarter of the population and is the leading biomedical risk factor for mortality worldwide. In the vasculature hypertension is associated with endothelial dysfunction and increased inflammation leading to atherosclerosis and various disease states such as chronic kidney disease2, stroke3 and heart failure4. An initial step in vascular inflammation leading to atherogenesis is the adhesion cascade which involves the rolling, tethering, adherence and subsequent transmigration of leukocytes through the endothelium. Recruitment and accumulation of leukocytes to the endothelium is mediated by an upregulation of adhesion molecules such as vascular cell adhesion molecule-1 (VCAM-1), intracellular cell adhesion molecule-1 (ICAM-1) and E-selectin as well as increases in cytokine and chemokine release and an upregulation of reactive oxygen species5. In vitro methods such as static adhesion assays help to determine mechanisms involved in cell-to-cell adhesion as well as the analysis of cell adhesion molecules. Methods employed in previous in vitro studies have demonstrated that acute increases in pressure on the endothelium can lead to monocyte adhesion, an upregulation of adhesion molecules and inflammatory markers6 however, similar to many in vitro assays, these findings have not been performed in real time under physiological flow conditions, nor with whole blood. Therefore, in vivo assays are increasingly utilised in animal models to demonstrate vascular inflammation and plaque development. Intravital microscopy is now widely used to assess leukocyte adhesion, rolling, migration and transmigration7-9. When combining the effects of pressure on leukocyte to endothelial adhesion the in vivo studies are less extensive. One such study examines the real time effects of flow and shear on arterial growth and remodelling but inflammatory markers were only assessed via immunohistochemistry10. Here we present a model for recording leukocyte adhesion in real time in intact pressurised blood vessels using whole blood perfusion. The methodology is a modification of an ex vivo vessel chamber perfusion model9 which enables real-time analysis of leukocyte -endothelial adhesive interactions in intact vessels. Our modification enables the manipulation of the intraluminal pressure up to 200 mmHg allowing for study not only under physiological flow conditions but also pressure conditions. While pressure myography systems have been previously demonstrated to observe vessel wall and lumen diameter11 as well as vessel contraction this is the first time demonstrating leukocyte-endothelial interactions in real time. Here we demonstrate the technique using carotid arteries harvested from rats and cannulated to a custom-made flow chamber coupled to a fluorescent microscope. The vessel chamber is equipped with a large bottom coverglass allowing a large diameter objective lens with short working distance to image the vessel. Furthermore, selected agonist and/or antagonists can be utilized to further investigate the mechanisms controlling cell adhesion. Advantages of this method over intravital microscopy include no involvement of invasive surgery and therefore a higher throughput can be obtained. This method also enables the use of localised inhibitor treatment to the desired vessel whereas intravital only enables systemic inhibitor treatment.
протокол
1. Изоляция сонных артерий
- Euthanase10 неделя Sprague Dawley крыс с помощью CO 2 / O 2 удушья.
- Акцизный левой и правой общей сонной артерии с аорты и сердца обеспечения минимального растяжения сосудов.
- В ледяном холодном буфера Кребса отдельных сонных артерий от аорты и сердца и выполнять близкие рассечение.
- Имейте в изолированных сосудов Кребса на льду перед монтажом.
Приблизительный время = 45 минут
2. Грунтовка судно камеры
- В проксимальных и дистальных разъемы судно камеры заподлицо Кребса буфера поддерживаться при физиологических рН вливая карбогена газа (95% O 2, 5% СО 2) в буфере при 37 ° C.
- Обеспечить труб и канюли сбрасываются полностью и приведены в соответствие.
- Флеш Кребса буфера через P1 (проксимальный) и P2 (дистальный) преобразователей. Закрыть краны, чтобы убедиться в отсутствии пузырьков воздуха в преобразователями.
- Подключение датчиков к соответствующим разъемам и снова заподлицо более Кребса буфера гарантируя, что ни пузырьков воздуха. Закрыть краны на камеру.
Приблизительный время = 15 минут
3. Давления в камере судна
- Включите оборудование под давлением: давление серворуль, датчик давления, перистальтического насоса (рис. 1).
- С перистальтического насоса от давления и давления сервопривода на автоматических буфера запустить Кребса через трубы на 20 мм рт.ст. (наберите в 1), гарантируя, что ни пузырьков воздуха.
- Подключите трубку к закрытым датчик P2. Давление станет стабильным.
- Открытый P2 нажмите, чтобы судно камеры, чтобы избавиться от любых пузыри затем закрыть.
- Заполните ванну с буфером Кребса (5 - 7 мл).
Приблизительный время = 10 минут
4. Монтаж судно
- Под микроскопом рассекает место черные галстуки полиэстера на каждый канюли (рис. 2).
- Перемещение канюли и канюли держателей друг от друга и горе ¼ судна (дуга аорты конца) на P1 канюли. Обеспечить, чтобы не разорвать сосуд.
- Использование шприц с буфером Кребса мягко флеш избыток крови из сосуда через P1 преобразователя. Близко от Р1 к камере.
- Безопасность судна P1 канюли с полиэфирной галстук.
- Перемещение канюли / канюли держателей ближе для монтажа на P2 канюли.
- Горы дистального конца сосуда (~ ¼ длины) на дистальных канюли. Крепится с помощью полиэфирной галстук.
Приблизительный время = 20 минут
5. Поддержания давления судно
- Отрегулируйте канюли держателей чтобы убедиться в отсутствии согнуть или растянуть в сосуде.
- С P1 и P2 закрыта для камеры переключатель давления сервопривода с автоматического на ручной. Проверьте давление сервопривода нет постоянного уменьшения давления в течение 10 секунд. Если есть, то утечка происходит и соединения и датчики должны быть закреплены в месте.
- Отрегулируйте давление сервопривода в автоматический затем открыть Р2 к камере. Под микроскопом наблюдать судно расширяются, когда кран открыт для камеры.
- Переключатель давления сервопривода в ручной режим. Снова проверка для постоянного снижения давления в течение 10 секунд. Если есть утечка, то система не является жесткой и давление там, вероятно, будет отверстие в сосуде.
- Вернитесь к автоматической открытой Р1 к камере. На ручной настройки убедитесь, что давление остается стабильным.
- Если нет утечки, на ручную набрать увеличение параметра 2 (40 мм рт.ст.).
- Настройка автоматической и наблюдать судно под микроскопом. Если необходимо, отрегулируйте держатель канюли чтобы убедиться в отсутствии изгиба vessel.Check на предмет утечек на ручную настройку.
- Повторите действия 5,6 - 5,7 увеличение набора на 3 (60 мм рт.ст.), 4 (80 мм рт.ст.) и так далее, пока желаемое давление достигнуто.
Приблизительный время = 15 - 30 минут
6. Инкубация давлением судно
- Подключите заданной температуры контроллер до 37 ° C.
- Со вторым перистальтического насоса заливать Кребса буфера (1 мл / мин) в ванну камере судна.
- Подключите аспиратор в камеру обеспечения только верхний слой баню удаляют.
- Инкубируйте давлением судна при 37 ° С в течение 1 часа с давлением задан автоматически.
- Проверьте давление не протекает (переход на ручное) периодически.
- Влияние различных фармакологических вмешательств можно наблюдать, просто добавляя соединения к ванне во время инкубации.
Приблизительный время = 1 час
7. Перфузии под давлением сосуд с цельной крови
- Во время инкубации получить не менее 7,5 мл цельной крови человека / судно внутреннего плавания, собранных в 40 U гепарина / мл крови. Инкубируйте в 50 мл сокола при температуре 37 ° C.
- За 10 минут до конца тон инкубации этикетке крови VybrantDil (1:1000) в течение 10 минут при температуре 37 ° С в темноте.
- Через 10 минут сбора крови в шприце стирать все пузырьки и приложите на шприцевой насос с тепловой куртке установлена на уровне 37 ° C.
- Близко от P1 датчик на камеру / судно внутреннего плавания и соединить шприц и сточных труб.
- Чистка крови в 1000 мкл / мин через отходов трубы, чтобы удалить пузырьки.
- Открытое Р1 к камере. Давление серво будет регулироваться автоматически для поддержания требуемого давления.
- Заливать кровью при 100 мкл / мин.
- Использование флуоресцентного микроскопа связан с цифровой камерой запись двух областях перфузии судно в течение 15 секунд на 1, 3, 5, 7,5 и 10 минут.
- Сообщение перфузии эндотелиальных целостности и функции могут быть оценены с помощью фармакологических методов, таких как myograph и выражения молекул адгезии можно определить по иммуногистохимии для дальнейшей проверки воспалительной реакции.
Приблизительный время = 15 минут
8. Представитель Результаты:
Схема установки камеры давления показана на рисунке 1. С цифровой камерой соединен с флуоресцентным микроскопом результаты могут быть визуализированы мгновенно через живые записи видео. Представитель изображения видео показано на рисунке 3, где лейкоцитов считается приверженцем эндотелия, если они оставались неподвижными в течение 10 секунд. С видео-записи на непрерывном цикле придерживался клетки может быть расценено как средняя на поле. Хотя и низкой (рис. 3А) и высокой (рис. 3В) давление вызовет некоторое количество адгезии существенное увеличение адгезии лейкоцитов в высших внутрипросветного давления видел, и это также продемонстрировало количественно (рис. 4).
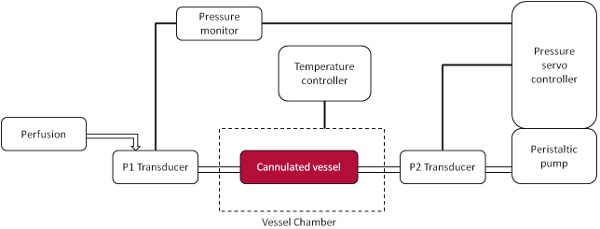
Рисунок 1. Под давлением естественных бывший судно камеры схеме. Канюлированные судна подключены к проксимальным (P1) датчика и дистального (Р2) преобразователи, что позволяет кровяное давление, чтобы манипулировать внутри судна. Перфузии через датчик P1 и давление поддерживается с помощью P2 преобразователя.

Рисунок 2. Cannuala со связями. Черного связей полиэстера прилагаются к каждому канюли.

Рисунок 3. Представитель видеоизображения. Динамическое клеточной адгезии (красная стрелка) при флуоресценции при 80 мм рт.ст. () и 120 мм рт.ст. (В) после 10 минут перфузии.
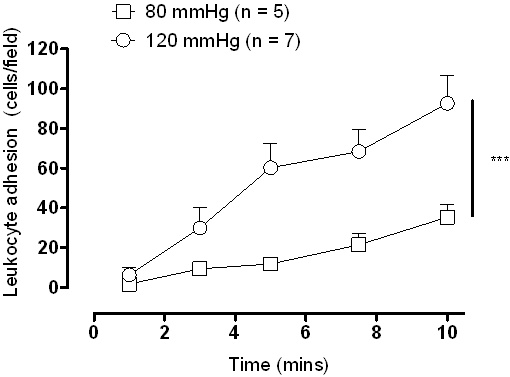
Рисунок 4. Адгезии лейкоцитов в Sprague Dawley сонных артерий через 1 час инкубации при низкой (80 мм рт.ст.) и высокого давления (120 мм рт.ст.). *** Р <0,001, как проанализированы 2-полосная повторных измерений ANOVA использованием Бонферрони постфактум тест.
Обсуждение
Это модифицированный метод изучения адгезии лейкоцитов к эндотелию в интактных изолированных кровеносных сосудов под давлением условиях в реальном времени. Перфузии судна камеры только позволяет быстро проверки провоспалительных штаммов больших мышей и крыс судов. Включение давление манипуляции обеспечивает динамическое взаимодействие ячейки, которые должны соблюдаться от низких до очень высоких внутрипросветного давления, тем самым лучше имитировать ING-физиологических и патофизиологических условиях. Диаметр суда также может быть измерена с помощью достаточного клеточной визуализации программы и, следовательно, сдвигового течения и скорость может быть определена и, следовательно, манипулировать.
С его возможностями myograph, фармакологических вмешательств помещен в ванну добавить новое измерение в экспериментальных условиях возможно с этой модели позволяют исследовать механистического и сигнальных путей. Хотя эндотелиальные сохранения не могут быть подтверждены в ходе манипуляции давления, реакции на АХ и PE может быть проведена после перфузии 9.
Следует отметить, что эта установка демонстрирует последствия внутрипросветного давления на клетки к межклеточных взаимодействий не эффект пульсирующего потока крови, ни систолического и диастолического давления. Кроме того, в то время как резкие изменения давления на адгезии лейкоцитов наблюдалось, эта установка может быть также использована, чтобы смотреть на хроническое воздействие давления (т.е. увеличение времени инкубации и использовании модели хронического животных давления). Sprague Dawley общей сонной артерии, продемонстрированный в этом созданы, но и другие штаммы и виды могут быть использованы с соответствующей корректировки размера канюли. В самом деле, важно отметить, что возраст и вес животных влияет на размер судна и, таким образом, что создали должно быть индивидуальным для каждого судна. Закрыть и тщательного вскрытия соединительной ткани может улучшить визуализацию лейкоцитов безмерно.
Раскрытие информации
Протокол исследования был одобрен Альфред медицинских исследований и образования участковых животных Комитет по этике и Альфред больнице Комитета по этике.
Благодарности
Это исследование было поддержано частично OIS викторианской правительством программы, национального здравоохранения и медицинских исследований Совета Австралии программ и проектов, грантов (ССПМ Чин-Удаление пыли) и аспирантов стипендии (D Мичелл).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента / оборудование | Компания | Номер в каталоге | Комментарии |
|---|---|---|---|
| Микроскоп | Carl Zeiss, Inc | STEREO Discovery V.20 | |
| PHD 2000 шприцевой насос | Гарвардский аппарата | 70-2016 | |
| Цифровая камера и контроллер | Hamamatsu ORCA-ER | C4742-95 | |
| Флуоресценция Системы освещения | Динамика Lumen | X-Cite 120 | |
| Судно палаты | Живые системы Инструментарий | CH/1/SH | |
| Регулятор давления сервопривода и перистальтические насосы | Живые системы Инструментарий | PS - 200 | |
| Монитор перфузионного давления | Живые системы Инструментарий | PM - 4 | |
| 2 х Датчик давления | Живые системы Инструментарий | PT - F | |
| Регулятор температуры | Живые системы Инструментарий | ТС-01 | |
| Перистальтический насос | Instech Laboratories, Inc | P720 | |
| VybrantDil клеточной маркировке решение | Invitrogen | V-22 885 | Используйте 1:1000 |
Ссылки
- Lopez, A. D., Mathers, C. D., Ezzati, M., Jamison, D. T., Murray, C. J. Global and regional burden of disease and risk factors. Lancet. 367, 1747-1757 (2001).
- Szczech, L. A. Acute kidney injury and cardiovascular outcomes in acute severe hypertension. Circulation. 121, 2183-2191 .
- Rodriguez-Garcia, J. L., Botia, E., de La Sierra, A., Villanueva, M. A., Gonzalez-Spinola, J. Significance of elevated blood pressure and its management on the short-term outcome of patients with acute ischemic stroke. Am J Hypertens. 18, 379-384 (2005).
- Levy, D., Larson, M. G., Vasan, R. S., Kannel, W. B., Ho, K. K. The progression from hypertension to congestive heart failure. JAMA. 275, 1557-1562 (1996).
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat Rev Immunol. 7, 678-689 (2007).
- Riou, S. High pressure promotes monocyte adhesion to the vascular wall. Circ Res. 100, 1226-1233 (2007).
- Ley, K., Gaehtgens, P. Endothelial, not hemodynamic, differences are responsible for preferential leukocyte rolling in rat mesenteric venules. Circ Res. 69, 1034-1041 (1991).
- Bernhagen, J. MIF is a noncognate ligand of CXC chemokine receptors in inflammatory and atherogenic cell recruitment. Nat Med. 13, 587-596 (2007).
- Woollard, K. J. Pathophysiological levels of soluble P-selectin mediate adhesion of leukocytes to the endothelium through Mac-1 activation. Circ Res. 103, 1128-1138 (2008).
- Eberth, J. F. Importance of pulsatility in hypertensive carotid artery growth and remodeling. J Hypertens. 27, 2010-2021 (2009).
- Cooke, J. P., Rossitch, E., Andon, N. A., Loscalzo, J., Dzau, V. J. Flow activates an endothelial potassium channel to release an endogenous nitrovasodilator. J Clin Invest. 88, 1663-1671 (1991).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены