Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Моделирование и обработка изображений 3-мерная коллективной Вторжение сотовый
В этой статье
Резюме
Модели инвазии опухоли клетки в трехмерном внеклеточного матрикса лучше отражать В естественных условиях Ситуацию, чем двумерные анализов подвижности. Использование матрицы вторжения тестов в сочетании с конфокальной микроскопии флуоресцентно-меченых клеток, подробную информацию о вторжении режимы и конкретный вклад ведущих против следующих клетки могут быть получены.
Аннотация
Определяющей характеристикой рака злокачественности инвазии и метастазирования 1. В некоторых видов рака (д г. Глиомы 2), местной инвазии в окружающие здоровые ткани является основной причиной болезни и смерти. Для других видов рака (д г. Молочной железы, легких и т.д..), То процесс метастазирования, в котором клетки опухоли перейти от основной массы опухоли, колонизировать дистальных участках и в конечном счете способствовать отказу органов, которые в конечном итоге приводит к заболеваемости и смертности 3. Было подсчитано, что инвазии и метастазирования несут ответственность за 90% смертей от рака 4. В результате, наблюдается повышенный интерес в выявлении молекулярных процессов и критических посредников белка инвазии и метастазирования в целях улучшения диагностики и лечения 5.
Задача ученых рака является развитие вторжения анализов, которые достаточно похожи в естественных условиях ситуациячтобы точного моделирования болезни 6. Двумерные анализов клеточной подвижности носят информативный об одном аспекте вторжения и не принимают во внимание внеклеточного матрикса (ECM), белка ремоделирования, который также является важным элементом. В последнее время исследования изысканные наше понимание опухолевой инвазии клеток и показали, что отдельные клетки могут перемещаться по удлиненные или округлые режимах 7. Кроме того, было оценить ее вклад коллективного вторжения, при котором клетки вторгнуться в нити, листы и кластеры, особенно в наиболее дифференцированных опухолей, которые поддерживают эпителиальных характеристики, распространение рака 8.
Мы представляем более совершенный метод 9 для изучения вклада кандидата белков коллективного вторжения 10. В частности, на основе технического отдельные пулы клеток, чтобы выразить различные флуоресцентные белки, можно молекулярно анализировать деятельность и Протейнс требуется в ведущих клетки против тех, которые требуются в следующих клеток. Использование РНК-интерференции обеспечивает молекулярный инструмент для экспериментально разбирать процессы, связанные с отдельными вторжения клеток, а также в различных положениях коллективного вторжения. В этой процедуре, смеси флуоресцентно-меченых клеток высевали на нижней части вставки Transwell ранее заполненную белка Матригель ECM, то разрешено вторгаться "вверх" через фильтр и в Матригель. Реконструкция Z-серии изображений стеки, полученные конфокальной микроскопии, в трехмерных представлений позволяет для визуализации коллективно вторжения пряди и анализ представления флуоресцентно-меченых клеток в сравнении с ведущими следующие позиции.
протокол
1. Ретровирусные маркировки клеток с флуоресцентными белками
- Пластина ретровирусных клетки тары (например Phoenix) из уровне 0,25 х 10 6 клеток на лунку 6-а блюдо в 10% эмбриональной телячьей сыворотки (FBS) / DMEM.
- Трансфекции клеток с ретровирусной ДНК через 48 часов клетки, используя Effectene в соответствии с инструкциями производителя.
- Промыть скважин в два раза со средней через 24 часа, затем добавьте 1,5 мл 10% FBS / DMEM на лунку.
- Сбор упакованных вирусов в культуре ткани средой через 48 часов с помощью пипетки и передачи до 2 мл пробирок микроцентрифужных.
- Центрифуга при 1600 оборотов в минуту в течение 5 мин для осаждения любой клетки.
- Удалить супернатант в чистую пробирку и хранить при температуре -80 ° C.
- Клетки должны быть retrovirally трансдуцированных высевают из на уровне 1,5 х 10 5 клеток на лунку 6 хорошо блюдо и помещен в увлажненном инкубаторе при температуре 37 ° С в течение ночи.
- На следующий день, удаление информации из клетки и объявленияг 1 мл вируса фондовом дополнена 4 мкл polybrene (2 мг / мл) в каждую лунку. Замените пластин в инкубаторе.
- После инкубации в течение 5-6 часов, добавляют 2 мл 10% FBS / DMEM в каждую лунку и плиты заменяются в 37 ° C inbubator ночь.
- На следующий день, заменить средства массовой информации и позволяют клеткам 24 часов перед добавлением соответствующих селективных средах.
- При сливной (которая зависит от скорости роста клеток, а эффективность ретровирусной трансдукции, но обычно занимает от 4-14 дней), trypsinize клеток и сортировки для флуоресценции с использованием не-трансдуцированных клетки в качестве эталона, собирать и объединять ячейки с флуоресценции больше, чем не трансдуцированных клетки и заморозить порциями при температуре -80 ° C для дальнейшего использования.
2. Обратные вторжения Матригель анализа
- Медленно оттепели аликвоту полный Матригель (т.е. содержащие факторы роста) на льду (рис. 1А).
- Как только размороженные, развести Матригель 1:1 в ледяной PBS (наряду с любыми другими дополнительнымипроцедуры в 2 раза концентрации в PBS до разведения, рисунок 1В). Чтобы было легче обращаться Матригель до полимеризации, все Пластик (например, советы, трубы и т.д.) должна быть ледяной.
- Вставить как многие 8 микрон поры диаметром 6,5 мм без покрытия Transwells по мере необходимости в лунки 24-луночного планшета культуры ткани, затем осторожно пипеткой по 100 мкл разбавленного Матригель в лунки и оставить для инкубации в течение ~ 30 минут при 37 ° С укрепить (рис. 1в).
- За это время подготовить один или несколько флуоресцентно меченных клеточные суспензии составляет от 1 до 4 х 10 5 клеток на мл, в зависимости от клеточной линии, каждая из предварительно обработанных условие (е г. МиРНК, лечение) в их нормального роста средой (рис. 1D).
- Когда Матригель укрепил, инвертировать Transwells и пипетки 100 мкл клеточной суспензии на лицевой стороной вверх нижней фильтра (рис. 1E).
- Осторожно крышка Transwells с базой 24 и тканикультуры пластины, соприкасающиеся с каждой капли суспензии клеток (рис. 1F).
- Инкубируют пластинки в перевернутом состоянии в течение 4 часов, чтобы позволить для сотовых вложений (рис. 1С).
- После этого времени, включите пластинами лицевой стороной вверх и мыть каждый Transwell путем последовательного погружения в 2 х 1 мл сыворотки среде без (рис. 2A).
- Оставьте Transwells в третьей скважины, содержащие любые лекарства или процедур, необходимых (рис. 2В).
- Аккуратно пипетки 100 мкл 10% FBS / DMEM плюс хемоаттрактант (e. г. ЭФР при 25 нг / мл) в Transwell поверх затвердевшего Матригель / PBS смеси, закрыть крышкой и выдержать в течение 3-5 дней при температуре 37 ° C с 5% CO 2 (рис. 2С).
3. Окрашивание и визуализации
- Клетки, экспрессирующие флуоресцентные белки можете пропустить шаги до конфокальной микроскопии
- Чтобы создать образ не-флуоресцентные клетки вторжения Матригель, Transwells место в свежем 24 также блюда и пипетки 1 мл 4 мкМКальцеин AM пятно решение на верхней части каждой Матригель разъем, что позволяет ему перекинуться сторон и пятна от верхней и нижней. Кальцеин AM (ацетоксиметил эфир кальцеин) является живой красителем ячейки, пятна все клетки зеленой и не требует фиксации.
- Инкубируйте 1 час при 37 ° С в 5% CO 2 влажной атмосфере, после чего клетки полностью окрашенных и готовы для включения в образ с помощью конфокальной микроскопии.
- Кроме того, не-флуоресцентные клетки вторжения Матригель может быть фиксированным и окрашивают, как описано ниже в 3,5 до 3,9.
- Передача каждого Transwell на свежем 24-луночного планшета. Наложение 1 мл 4% para-formaldehyde/0.2% Triton-X 100.
- Инкубируйте при комнатной температуре в течение 0,5 часа.
- Удалить фиксатор и промыть 3 раза с 1 мл PBS.
- Удалить цитоплазматической РНК с 30 мин РНКазы лечение с использованием 100 мкг / мл РНКазы. Мыть 2 раза с PBS.
- Для визуализации добавить 0,01 мг / мл пропидия йодидом (PI) разводят в PBS и оставить при комнатной температуре в датк в течение 0,5 часа. Промыть 3 раза PBS. На данном этапе, П. И. окрашенных transwell может храниться при комнатной температуре в темном месте не менее 1 месяца.
- Точные методы визуализации с помощью конфокальной микроскопии зависит от имеющихся ресурсов. Использование перевернутого конфокальной микроскопии, место Transwell с небольшим количеством остаточного PBS на большие покровное (убедиться в отсутствии пузырьков присутствуют) по непогружения 20 X объективных и захвата оптических срезов каждые 10-15 мкм со дна Матригель вилку. Индивидуальные оптические ломтиками могут быть использованы для количественной степени инвазии (рис. 3А) или строить в 3-мерных объектов с помощью соответствующего программного обеспечения, таких как Volocity (рис. 3В).
4. Представитель Результаты
Пример Z-серия оптических ломтиками показан на рисунке 3А. В этом случае клетки окрашивали кальцеин утра и количество клеток до вторжения из фильтра можно увидеть уменьшается с расстоянием. Количественная оценка вvasion можно сделать, анализируя отношение кальцеин уверен пикселей к негативным пикселей в каждом интервале, либо с помощью фиксации / окрашивания методом описано выше и подсчет PI положительных ядер в каждом положении. Одним из преимуществ кальцеин AM окрашивания в том, что 3-мерных реконструкций клеточных вторжения могут быть собраны с использованием программного обеспечения, таких как Volocity, давая визуальной информации о способе вторжения (рис. 3В). Если клетки помечены выражение флуоресцентные белки, то позиции каждого цвета ячейки могут быть визуализированы в 3-мерной реконструкции, либо сбоку (рис. 3C) или путем рассекает реконструкции (рис. 3D).
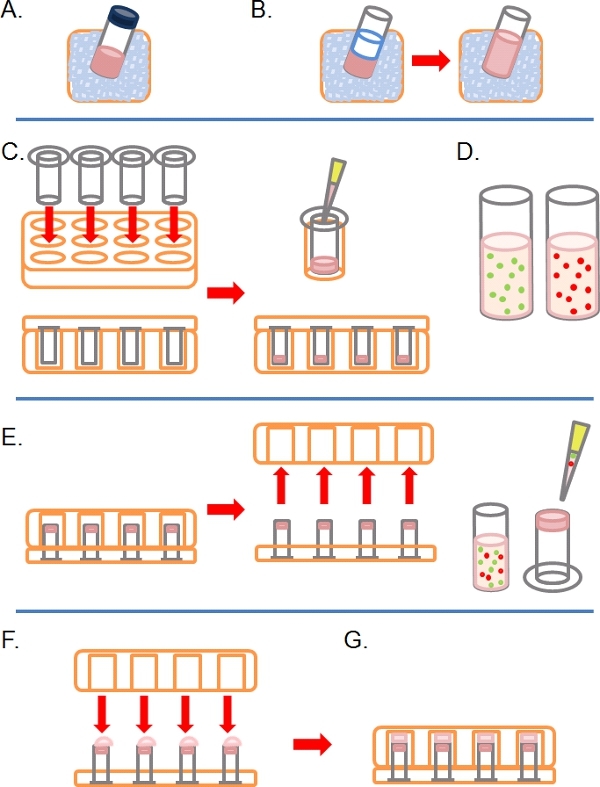
Рисунок 1. Принципиальная схема этапов в создании обратной анализа вторжения. ) Матригель ECM талых на льду. Б) Матригель разводят 1:1 с PBS, содержащий любой лекарственной терапии, в два раза конечной концентрации. С) Transwell вставки помещаются в пластинах многоямного и Матригель пипеткой в каждую. D) Суспензии клеток, принятых на желаемой концентрации. Е) После Матригель установил, пластины инвертируется и удаляются, клетки высевают на нижней фильтр вставки Transwell. F) в перевернутом положении, многослойные пластины осторожно помещают над вставками Transwell, что делает контакт с клеточной суспензии. G) Клетки имеют право придерживаться фильтра в течение 4 часов.
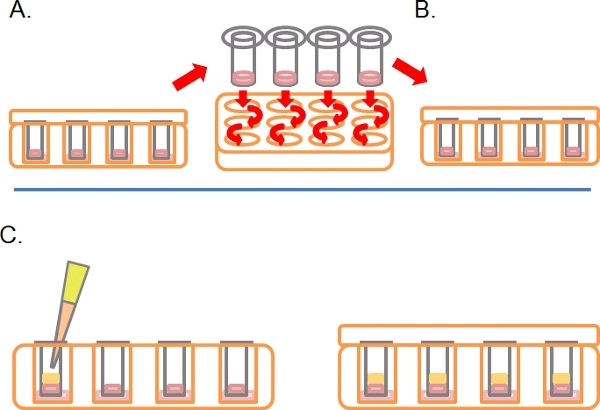
Рисунок 2. Продолжение схема для обратного анализа вторжения. А) Как только клетки присоединились, окуните каждый Transwell в бессывороточной СМИ дважды, чтобы удалить свободные клетки. Б) Место мыть Transwell в окончательном хорошо средах плюс процедуры по мере необходимости. C) Среды, содержащие хемоаттрактант (например, 10% эмбриональной телячьей сыворотки) с лечения в соответствии с требованиями тщательно слоистых на Матригель.
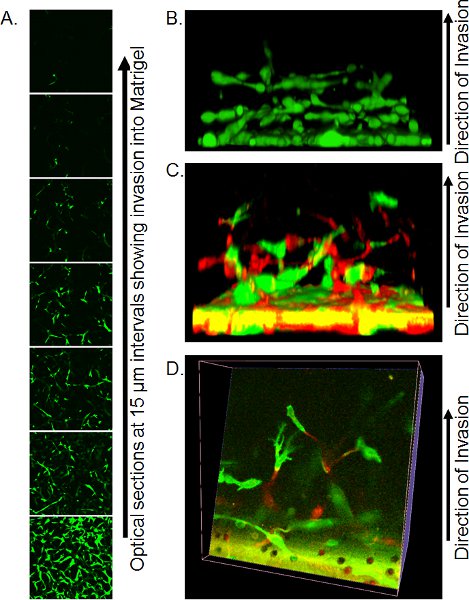
Рисунок 3. Представителю изображения результатов анализа обратной вторжения. ) Оптический участки клеток, окрашенных кальцеин AM вторжения Матригель, принятые на 15 мкм интервалы с помощью конфокальной микроскопии. Б) Реконструкция 3-мерной реконструкции ячейки вторжения из стопки конфокальной Z-серии изображений, смотреть со стороны. Перепечатано из ссылки 10. C) Трехмерная реконструкция GFP и RFP-меченых клеток вторжения Матригель смотреть со стороны. D) оптический срез через 3-мерной реконструкции GFP и RFP-меченых клеток. Перепечатано из ссылки 10.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Анализы Матригель вторжения традиционно были созданы с клетками помещали на слой внеклеточных белков матрицей с хемоаттрактант вызванных моторики навстречу и через фильтр, в нижней части. Инвазивности был забит как функция, сколько ячеек можно было пересчитать по нижней стороне филь...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Финансирование данного исследования от исследований рака Великобритании.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | |
|---|---|---|---|
| DMEM (Medium Дульбеко изменения Орла) | GIBCO | 21969 | |
| Эмбриональной бычьей сыворотки | ПАА | А15-101 | |
| Пенициллин Стрептомицин | GIBCO | 15140 | |
| 200 мМ L-глутамина (100x) | GIBCO | 25050-032 | |
| Пуромицин | Sigma-Aldrich | P8833 | |
| 0,05% трипсина ЭДТА | GIBCO | 25300 | |
| Polybrene | Sigma-Aldrich | AL-118 | |
| Lipofectamine 2000 реагентов | Invitrogen | 11668019 | |
| 6,5 мм Transwells, 8,0 мкм размер пор | Гранулирование | 3422 | |
| Полное Матригель | BD Biosciences | 354234 | |
| Кальцеин AM | Invitrogen | C1430 | |
| РНКазы | Qiagen | 19101 | |
| Пропидия йодидом | Sigma-Aldrich | P4864 | |
| Конфокальной microcope | Leica | SP2MP |
Ссылки
- Olson, M. F., Sahai, E. The actin cytoskeleton in cancer cell motility. Clin. Exp. Metastasis. 26, 273-287 (2008).
- Hoelzinger, D. B., Demuth, T., Berens, M. E. Autocrine factors that sustain glioma invasion and paracrine biology in the brain microenvironment. J. Natl. Cancer. Inst. 99, 1583-1593 (2007).
- Chaffer, C. L., Weinberg, R. A. A perspective on cancer cell metastasis. Science. 331, 1559-1564 (2011).
- Hanahan, D., Weinberg, R. A. The Hallmarks of Cancer. Cell. 100, 57-70 (2000).
- Francia, G., Cruz-Munoz, W., Man, S., Xu, P., Kerbel, R. S. Mouse models of advanced spontaneous metastasis for experimental therapeutics. Nat. Rev. Cancer. 11, 135-141 (2011).
- Hooper, S., Marshall, J. F., Sahai, E. Tumor cell migration in three dimensions. Methods. Enzymol. 406, 625-643 (2006).
- Croft, D. R., Olson, M. F. Regulating the conversion between rounded and elongated modes of cancer cell movement. Cancer Cell. 14, 349-351 (2008).
- Wolf, K. Multi-step pericellular proteolysis controls the transition from individual to collective cancer cell invasion. Nat. Cell. Biol. 9, 893-904 (2007).
- Hennigan, R. F., Hawker, K. L., Ozanne, B. W. Fos-transformation activates genes associated with invasion. Oncogene. 9, 3591-3600 (1994).
- Scott, R. W. LIM kinases are required for invasive path generation by tumor and tumor-associated stromal cells. J. Cell. Biol. 191, 169-185 (2010).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены