Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Кожный лейшманиоз в спинной Кожа Хомяков: Полезная модель для скрининга Antileishmanial наркотикам
В этой статье
Резюме
Оптимизация экспериментальной модели хомяка для кожного лейшманиоза на внутрикожных инъекций Leishmania Promastigotes на спинной кожи. Этот подход полезен во время прививки, наблюдения, характеристика повреждений, применение процедур и получения клинических образцов. Передвижение, в поисках пищи и воды, игры и общественной деятельности сохранились.
Аннотация
Традиционно, хомяки экспериментально привиты в морду или разбойник. Однако в этих местах язвы не всегда происходит, измерение поражение размер жесткого порядка и животных показывают, трудности есть, дышать и двигаться, потому что поражения. В целях оптимизации хомяк модель кожного лейшманиоза, молодой взрослый мужчина и женщина золотистых хомячков (Mesocricetus рыбки) вводили внутрикожно в спинной кожи с 1 до 1,5 х l0 7 promastigotes видов Leishmania и прогрессирования последующего поражения были оценены до 16 недель после заражения. Хомяк золотой был выбран потому, что она считается адекватной биологической модели для оценки препаратов против Leishmania как они восприимчивы к заражению различных видов. Кожные инфекции хомяков приводит к хронической, но контролируемый поражения и клинического течения с признаками аналогичных тем, которые наблюдаются у людей. Таким образом, учреждение ое такой степени заражения путем измерения размеров повреждения в зависимости от области уплотнений и язвы возможно. Этот подход доказал свою универсальность и простоту управления во время прививки, развития и характеристика типичных поражений (язвы), применение лечения с помощью различных способов и получения клинических образцов после различных методов лечения. При использовании этого метода качество жизни животных в отношении передвижения, в поисках пищи и воды, игры и общественной деятельности isalso сохранились.
протокол
1. Заражение хомяков
1. Животные
Инбредных женских и мужских золотистых хомячков (Mesocricetus рыбки), 6-8 недель, весом 140-160 г используются. Они размещены на животных объекта в контролируемой температурой жилье, кормили стандартной грызунов сушеные фрукты и обеспечены водой без ограничений. Все процедуры, связанные с животными утверждаются институциональный комитет по этике для экспериментального использования животных. Перед экспериментальной инфекции дерматотропный Leishmania паразитов животных сексуальны, отмеченные и взвешенных в соответствии со стандартными процедурами. Для определения пола, животных на предмет наличия отличительных особенностей, таких как визуализация молочной линии и короткого ано-генитальный расстояние у женщин, или визуализация яички и большее расстояние между анусом и крайней плоти у мужчин. Затем животных отмечены прокалывание ушей или окрашивания участок кожи с тампона, смоченногоВ пикриновой кислоты. Для уха перфорация, после того, как чистый 70% спирт ухо прокалывается с помощью ушного удар для грызунов. Регион с кровеносными сосудами следует избегать. Торможение или наркоз смесью 9:01 кетамина (50 мг / кг) и Xilacine (20 мг / кг) внутрибрюшинно в объеме 260 300 мкл 25-G иглу рекомендуется. Наконец, животных взвешивали, помещая их в ловушку, или поле, в расчете на точность баланса.
2. Паразиты
Promastigotes из дерматотропный видов Leishmania, таких, как Л. amazonensis, культивируют в двухфазных Ново-MacNeal-Николь (NNN) культуральной среде при температуре 26 ° C. Метациклические (стационарный) этап promastigotes (5 дней) areused заразить хомяков. Короче говоря, паразиты собирают, промывают дважды использовании фосфатный буфер солевом растворе (PBS), подсчитываются и доводят до 1 х 10 7 (для мужчин) или 1,5 х 10 7 (для женщин) паразитов в 0,1 мл PBS для прививки мужчина или женщина, соответственно,Однако, inoculums размер может варьироваться в зависимости от Leishmania видов (процедура не показана на видео).
3. Экспериментальное заражение
Кожа области побрился перед прививкой. Короче говоря, анестезии животных находятся в положении лежа и с помощью ножниц, волосы удаляются в двух дюймах от основания хвоста. После очистки побрился области стерильным физиологическим раствором посевной паразит вводят внутрикожно до папулы образуется.
4. Клинические следить за
Животные контролируется каждые 7 дней до 4 - 6 недель после прививки появления поражения. Вскоре животные иммобилизованных в ловушку и привиты участок кожи пальпируется. Потом, уплотнение площадь образовавшейся язвы очерчены, а ширина и длина кишки измеряется с цифровой суппорта.
2. Лечение хомяков
1. Админрации соединений
Схема лечения начинается тогда, когда животные разработали изъязвлений поражений (4-6 недели после заражения). Животные распределяются в группы по 5-6 животных для каждого соединения должны быть проверены. Соединения могут быть введены актуальные, орально, внутримышечно или Intralesional маршрутов. Перед применением лекарственных препаратов, хомяки анестезии и поражения область чистить солевой раствор или PBS. Когда соединение применяется по актуальным или Intralesional, хомяки закреплены ловушки, которые позволяют выявить области для лечения в то время, когда соединение вводят перорально или внутримышечно хомяков надежно закреплены в основании шеи. а) Местное применение: соединение isapplied на поражение и через несколько минут животное возвращается в cage.b) для внутримышечных инъекций, препарат вводят внутривенно (200 мкл максимум) через полусухожильной или полуперепончатой мышц задних конечностей. в) Для орального административныхконцентрации, препарат предоставляется животных (200 мкл максимум) через орально-желудочного зонда 14G подключения к 1 мл шприц. г) Для Intralesional инъекции препарата (100 мкл максимум) постепенно вводили в базу язва помощью иглой 26G с коническими размещены вниз. Всей площади поражения покрыта вращения иглы. Процедуры назначаются ежедневно в течение 10-20 дней, в соответствии с определенной терапевтической схемы.
2. Клинические следить за
Потому что в этой экспериментальной модели эффективности новых antileishmanial соединений определяется в соответствии с заживления и рубцевания поражений после лечения, клинический мониторинг каждого животного осуществляется еженедельно в конце применение соединений и до трех месяцев. В ходе мониторинга, тип поражения описаны и уплотнение и язву области измеряется с цифровой суппорта. Наличие повреждений в различных регионахпрививка сайта, а также появление рецидивов поражения также описаны и зарегистрированы. Каждые две недели, животные являются взвешенными и поражения на рисунке. Животные наблюдаются ежедневно контролировать: а) внешний вид (волосы, координации, температура, глаза, положение ушей, уход, дефекация, наличие жидкости асцитической, агитации и обезвоживания) и б) поведение (бодрствования, предупреждения, любопытная , остается с группой, надеется на еду и питье, и трудно поймать). Сайт применения соединений наблюдается также на наличие гиперемии, воспаления и кусаться и удаления волос.
Хомяки также кровь на 45 день после окончания лечения для определения гематологических и серологических значений, которые могут быть связаны с токсичностью соединений (см. ниже).
Эффективность каждого курса лечения оценивается сравнением размеров поражения до и после лечения, используя следующую оценку систEm: вылечить (лечение на 100% площади и полное исчезновение поражения), клиническое улучшение (уменьшение размеров поражения в> 50% площади); клинической недостаточности (увеличение размера поражения), на рецидив поражения после лечения). В конце исследования животных умерщвляют путем ингаляции СО2 предыдущие анестезии. После смерти, необходимые образцы для паразитологических, гистологических и серологических анализа берутся.
3. Паразитологии экзамены
Наличие Leishmania в пробах из кожи (повреждение или рубец), печени, селезенки и почек определяется непосредственно путем изучения мазков окрашивают Гимза 1 и гистопатологические рассмотрения этих тканей (см. ниже).
Паразит бремя поражения сайт оценивается анализа разведение предел в соответствии с Титом и его коллеги (1985) 2. Короче говоря, небольшой кусочек ткани удаляетсяУ каждого животного, взвешивают и гомогенизируют в холодный раствор PBS помощью шприца. Полученную суспензию центрифугировали при 600g в течение 10 мин при 4 ° C. После этого супернатанты отбрасываются и гранулы ресуспендировали в RPMI 1640 с добавлением 1% антибиотиков и 10% эмбриональной телячьей сыворотки. Сто л суспензии передаются на каждом из 96 скважин на иммунологических планшет содержащие NNN накладной среду с 50 мкл среднего Шнайдер и выдерживали при 26 ° C. Количество жизнеспособных паразитов в каждом образце определяется наибольшее разведение, при котором promastigotes могут быть обнаружены путем исследования под инвертированным микроскопом каждую неделю в течение одного месяца.
4. Гистологическое исследование поражения кожи (или рубец) и других тканей
Третья часть биопсии, взятых из кожи, печени и почек, фиксируется в 10% формалине и заливали в парафин. Образцы из селезенки и сердца также могут быть обработаны. Fив микрон разделов фиксированной ткани окрашивали haemotoxilin-эозином и изучены под оптическим микроскопом использованием 200X, 400X и 1000X иммерсионного масла для изучения микро-архитектуре, характеристиках клеточного инфильтрата, а также наличие или отсутствие паразитов. Микрофотографии принимаются и цифровых снимках.
5. Оценка токсичности лечение
Токсичные активность соединения на основе физических и поведение состояние животных в соответствии с параметрами контроля в течение клинических наблюдения (см. выше). Токсичность также определяется в зависимости от гематологических и метаболических параметров в образцах крови и гистопатологические изменения наблюдаются в срезах ткани окрашиваются haemotoxilin-эозином, как описано выше.
Пробы крови взяты из сердца, преимущественно желудочков. Для гематологических тестов, кровь передается ЭДТА антикоагулянтом труб и обрабатываются в соответствиистандартизировать протоколы для анализа крови. Для серологических тестов, кровь передается до 1,5 Эппендорф флаконов и центрифугировали для получения сыворотки для анализа метаболических креатинина, мочевины и ALT уровня измеряется с помощью Kodak Ektachemdry химии 3.
6. Анализ данных
Данные из обработанных и необработанных животных сравнивали с помощью теста ANOVA в. Значение устанавливается при р <0,05.
4. Представитель результаты
Резюме
Хомяк модель кожного лейшманиоза был усовершенствован с целью использования этой модели в скрининга препаратов эффективности. Поражение развития и паразитологические параметры изучались при первичной инфекции в кожу кожные хомяков. Инбредных женских и мужских золотистых хомячков (Mesocricetus рыбки), 6-8 недели, вводили внутрикожно с 1 х 10 7 (для мужчин) или 1,5 х 10 7 (для женщин) metacyclIC (стационарная фаза) promastigotes Л. amazonensis. Узлы появились 20 - 35 дней пи, с язвами формирование через 4-6 недель после заражения пи было установлено, что эффективность пятивалентной сурьмы (ПСК) в двух дозах evalauted. Хомяки были рандомизированы на три группы по 5 животных в каждой и обрабатывают антимониат меглумина на 80 или 120 мг ЗСО / кг в сутки в течение 10 дней внутримышечно. Третья группа лечилась внутримышечно PBS в качестве плацебо. Группа из трех животных были необработанными и используются в качестве отрицательного контроля. Ответ на каждое обращение последовало через 3 месяца после окончания лечения.
1. Течение после L. amazonensis инфекции золотого хомячка (Mesocricetus рыбки)
Хомяки инфицированных в спинной кожи постоянно развивается клинически очевидным изъязвлением эпидермиса в течение 4-6 недель после заражения. Поражение начинается с маленьких узелков и кончая язвами, чтоувеличиваются в размерах в зависимости от времени после заражения и достигают того, что считается оптимальным размером для оценки влияния экспериментальных препаратов на четвертый-шестой неделе после заражения (18,99 на 54,7 мм 2 на 4 недели 35,55 до 92,71 мм 2 на 6 недель) (Figures1, 2). Поражения в дальнейшем поддерживать очевидно язвы до 20 недель после заражения, после чего эксперименты были прекращены (рисунок 1).
Заражение L. amazonensis не влияет на вес тела хомяков, которые варьировались от 104,9 до 124,69 г и 129,71 до 134,02 гр в незараженных и зараженных хомяков, соответственно (р> 0,05, ANOVA). Животные получили в среднем 25,58 ± 5,98% от массы тела во время исследования. Серик значения креатинина и аланин трансферазы (АЛТ) и параметры гемограммы были похожи на ссылки значения в неинфицированных и инфицированных Leishmania хомяков. Только азота мочевины булочка (АМК) уровень былugmented в 60% зараженных животных.
Гистопатологические анализ повреждений у хомяков, инфицированных L. amazonensis показал различия, связанные с тем, незараженных животных. В общем, биопсии кожи от хомяков неинфицированных не показывают воспалительной реакции или гистологических изменений (рис. 3а), а те, инфицированных L. amazonensis развивать гранулематозный дерматит и обильное присутствие макрофагов проникают в дерму (рис. 3б). Гистопатологические анализ тканей из хомяков, инфицированных L. amazonensis и обрабатывают меглумина антимониат в дозах 80 и 120 мг ЗСО / кг / сут в течение 10 дней показал, изменения, связанные с инфекцией процесс, аналогичный тем, которые наблюдались в контрольной группе (инфицированных и необработанные). В общем, образцы кожи хомяков показало небольшой уровень плазматических (20%) и ПМН (80%) клеток сопровождается умеренной инфильтрацией лимфоцитами (80%) и легкой (20%) или тяжелой (80%) infiltrЦ И А Ц макрофагов (табл. 2). Эти наблюдения соответствуют диагностики гранулематозный дерматит, воспалительные случае, ставит под угрозу дермы и нижележащих мышц. Это главное поражение, связанные с инфекцией, которая совместима с тяжелым проявлением кожного лейшманиоза у всех животных в исследовании. Эта ассоциация была статистически коррелирует, когда хи-квадрат Пирсона, которая дала р <0,05. Почки образцы 60-100% животных показали умеренную гиперплазию в почечных клубочков мозга и сопровождается небольшим атрофии почки у 75% животных. Эти наблюдения совместимы с мембраной пролиферативной glomerulonefritis, диагноз, который был ранее связан с инфекцией заражение других видов Leishmania. Статистическая ассоциация была большая с хи-квадрат Пирсона р <0,05. Печень 40-100% животных во всех группах показали небольшое вакуолярной изменения в гепатоцитах, что может быть, свяред в физиологических процессах, таких как гепатоцитов накоплению гликогена. Другие ткани печени, аномалии, такие как жировая дистрофия, фиброз и перегрузки соответствуют инфекционного процесса. Другие наблюдения, такие как вакуоли изменения гепатоцитов, cardiomegalies, наличие включений внутрицитоплазматических эозинофилов, а также вакуолизация клеток в почечных труб статистически не связаны (р> 0,05) к токсическим действием соединения проверены и, вероятно, в связи с физиологическими процессами в хомяков.
2. Терапевтическая эффективность антимониат меглумина в хомяка модель
Клинический фенотип зараженных хомяков в различные моменты времени после лечения представлены в таблице 1. Лечение внутримышечного меглумина антимониат в дозе 120 мг ЗСО / кг / сут в течение 10 дней, вес был очень эффективным вызывающие полный регресс L. amazonensis поражения у всех животных (рис. 4). Процент излечения составил 100% в течение 2 и 8 недель после лечения. Тем не менее, через три месяца после рецидива повреждения наблюдалась в 20% хомяков. Когда меглумина антимониат вводили 80 мг ЗСО / кг массы тела, полное излечение наблюдалось лишь в 3-х животных. В двух других животных поражения уменьшились на 33,9 и 69,0% соответственно (рис. 5). Через три месяца, Л. amazonensis остался присутствует в коже всех животных, получавших антимониат меглумина в дозе 80 мг ЗСО / кг / день и только одно из животных, получавших 120 мг ЗСО / кг / день антимониат меглумина. Лечебные дозы внутримышечно 120 мг ЗСО / кг / сут в течение 10 дней была определена.
Использование предельного разбавления пробы, оценочное число паразитов показали значительное снижение за лечение группы с антимониат меглумина по сравнению с отрицательной (без лечения) контроль и транспортных средств (плацебо) группе терапии (р <0,001). Жизнеспособных паразитов (от 0,4 до 1, 6 паразитов в мг ткани кожи) были обнаружены в месте поражения необработанных животных и у пациентов, получавших PBS. Паразиты были лишь отдельные из этих животных, которые не ответили на лечение меглумина антимониат: одно животное получавших 120 мг / кг / сут (рис. 5б) и двух хомяков получавших 80 мг / кг / сут (рис. 5в). Никакой разницы не наблюдалось в паразитную нагрузку хомяков, которые не вылечить после получения меглумина антимонита по сравнению с теми животными необработанные или обработанные с PBS.
В гистопатология биопсии кожи от хомяков получавших внутримышечные меглумина антимониат 120 мг ЗСО / кг / сут не паразиты наблюдаемых; несколько макрофаги и лимфоциты проникают в дерму видны (рис. 6а, 6б). В Наоборот, когда хомяков лечили меглумина антимониат 80 мг ЗСО / кг / сут, гранулематозный дерматит с обильным присутствием макрофагов проникают в дерму широко наблюдается (рис. 6в, 6г).
3. ТоксичностьИспользуя те же терапевтические схемы для исследования эффективности, токсичности меглумина антимониат на 80 и 120 мг ЗСО / кг массы тела был оценен. Общее состояние здоровья и вес тела наблюдались до 3-х месяцев после последнего приема препарата. Лечение не влияет на вес тела хомяков, которые варьировались от 104,9 до 124,69 г и 129,71 до 134,02 гр в незараженных и зараженных хомяков, соответственно. Животные получили в среднем 27,59 ± 4,22% от массы тела во время лечения и 28,74 ± 2,26% в течение последующих (р> 0,05, ANOVA). Потеря веса не наблюдается в любой группе лечения (данные не представлены). Серик значения креатинина и аланин трансферазы (АЛТ) и параметры гемограммы были похожи на ссылки значения в необработанном и меглумина антимониат лечение хомяков. Только булочка мочевины азота (мочевины) уровня была увеличена на 20% подопытных животных.
Histopathological анализ тканей из хомяков, инфицированных L. amazonensis и обрабатывают меглумина антимониат в дозах 80 и 120 мг ЗСО / кг / сут в течение 10 дней не показали изменений, связанных с наркотиками токсичности.

фосфатный буфер солевом, б дней после лечения.
Таблица 1. Клинический фенотип L. amazonensis экспериментально зараженных хомяков после лечения меглумина антимониат
Эффективность каждого лечения оценивалась сравнением размеров поражения до и после лечения, используя следующие системы оценка: лечение (лечение на 100% площади и полное исчезновение поражения), клиническое улучшение (уменьшение размеров поражения в> 50% области), клинической недостаточности (увеличение размера поражения); рецидивов (возобновления поражения после лечения).

: Отсутствует знак, NA: не применяется; м: мягкая, M: умеренная, S: тяжелые, ПМН: полиморфноядерных нейтрофилов, NSL: нет значительного поражения, GDM: гранулематозный дерматомиозит; ПГД: Pyogranulomatous дерматит. 1. Лимфангиэктазия 2. Минерально-подобный материал.
Таблица 2. Гистопатология кожи хомяков экспериментально инфицированных L. amazonensis и обрабатывают меглумина антимониат
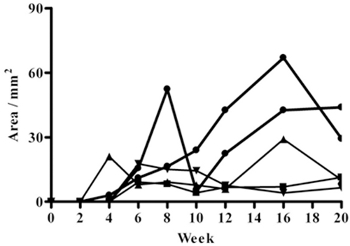
Рисунок 1. Курс кожи развития поражения после заражения у хомяков, привитых внутрикожно с 1-1,5 х 10 7 L. amazonensis метациклическая (стационарная фаза) promastigotes в течение 20 недель. Ось у представляет язва области в мм.
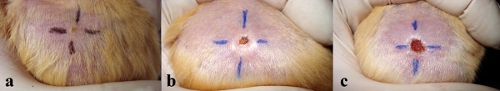
Рисунок 2. Photographyic истории развития язвы поражением спинного коже золотистый хомяк после внутрикожной прививки 10 х 10 7 на 2 недели (а), 4 недель (б) и 6 недель (с).

Рисунок 3 биопсии кожи из (а) хомяк неинфицированных и необработанной. Не воспалительной реакции ни значительных гистологических изменений не наблюдается, (б) хомяк инфицированных и необработанные: гранулематозный дерматит с наличием многоядерных гигантских клеток (стрелка плюс звездочка) и обильные паразитов (черный стрелки) и макрофаги (белые стрелки) проникают в дерму. Гематоксилин-эозином 400x.

Рисунок 4. Фотографическая история клинического ответа хомяков, инфицированных L. amazonensis и обрабатывают внутримышечного меглумина антимониат 120 мг ЗСО / кг / сут Дарина г 10 дней. Фотографии показывают появление поражения до лечения (а), в конце лечения (10 день), (б), и в течение последующих: 30-й день (с), 60 (г) и 90 (е) после лечение.
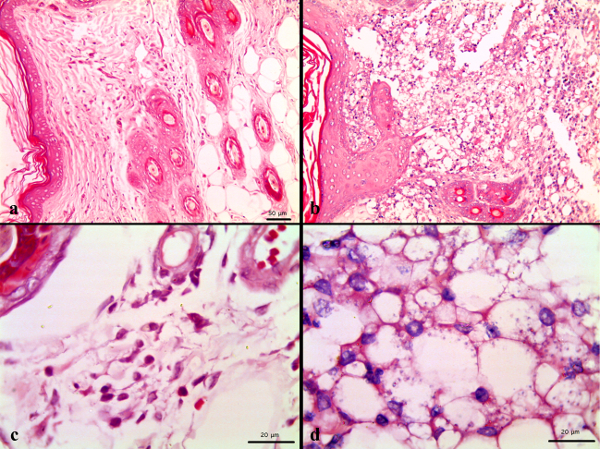
Рисунок 5. Эффективность антимониат меглумина в лечении кожного лейшманиоза в хомяков. Золотые хомяки были заражены L. amazonensis в спинной кожи. Через 6 недель после инфицирования были необработанными (а) или лечение внутримышечно в течение десяти дней с PBS в одиночку (б), меглумина антимониат 120 мг ЗСО / кг / сут (с) или 80 мг ЗСО / кг / сут (г). Графики показывают процент снижения размера поражения в конце лечения (день 0), и в дни 15, 30, 60 и 90 последующих после окончания лечения. р <0,001 для 120 или 80 мг ЗСО / кг / сут по сравнению с транспортным средством, а не лечения.
"/>
Рисунок 6. Биопсии кожи из хомяков, инфицированных и относиться с antinmoniate внутримышечного megumine 120 мг ЗСО / кг / сутки (б) и 80 мг ЗСО / кг / сут (в, г). Наличие ограниченных макрофаги и лимфоциты проникают в дерму. Нет паразитов наблюдается. Гематоксилин-эозином пятно 200x (а), 1000x (с) гранулематозный дерматит с обильным присутствием макрофагов проникают в дерму широко (с);. Пенистые макрофаги с фагоцитируются паразитов. Гематоксилин-эозином пятно 200x (б), 1000x (г).
Обсуждение
Кожный лейшманиоз является эндемическим в тропиках и Неотропики. Это часто называют группу заболеваний, в связи с разнообразным спектром клинических проявлений, которые варьируются от небольших кожных узелков к валовому слизистой разрушение ткани. Большинство доступных препаратов ?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Это исследование было поддержано грантами комитета по исследованию Университета Антиокия (CODI), Колумбийского института развития науки и техники - COLCIENCIAS и Центр развития продуктов против тропических болезней - CIDEPRO.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Тип | Компания | Номер по каталогу |
| Кетамин | Реагент | Холлидей-Скотт SA | |
| Xilacine | Реагент | Синтез | |
| PBS | Реагент | GIBCO | 14190-136 |
| Цифровой суппорт | Оборудование | Рыбак | 15-077-958 |
| Гимза | Реагент | SIGMA | GS1L-1L |
| Формалин | Реагент | Новая лаборатория | 11273 |
| Парафин | Реагент | Pechiney пластиковой упаковки | PM-996 |
| Haemotoxilin | Реагент | Новая лаборатория | 10870103 |
| Эозин | Новая лаборатория | 10870203 | |
| Kodak Ektachem сухой химии | Оборудование | Kodak Ektachem | DT-60 |
| меглумина антимониат | Реагент | Aventis | |
| Микроскопия | Оборудование | Nikon | YS2-T |
Ссылки
- WHO. Control of the leishmaniasis. Report of a Meeting of the WHO Expert Committee on the Control of Leishmaniasis WHO. 949, (2010).
- Titus, R. G., Marchand, M., Boon, T., Louis, J. A. A limiting dilution assay for quantifying Leishmania major in tissues of infected mice. Parasite Immunol. 7, 545-555 (1985).
- Reynolds, K. M. The Kodak Ektachem dry layer technology for clinical chemistry. Upsala. J. Med. Sci. 91, 143-146 (1986).
- Handman, E., Ceredig, R., Mitchell, G. F. Murine cutaneous leishmaniasis: disease patterns in intact and nude mice of various genotypes and examination of some differences between normal and infected macrophages. Australian J. Exp. Biol. Med. Sci. 57, 9-29 (1979).
- Hanson, W., Chapman, W., Waits, V., Lovelace, J. Development of Leishmania (Viannia) panamensis lesions and relationship of numbers of amastigotes to lesion area antimony-treated and untreated hamsters. J. Parasitol. 77, 780-783 (1991).
- Henao, H. H., Osorio, Y., Saravia, N. G., Gómez, A., Travi, B. Efficacy and toxicity of pentavalentantimonials (Glucantime and Pentostam) in an American cutaneous leishmaniasis animal model: luminometry application. Biomédica. 24, 393-402 (2004).
- Travi, B. L., Martinez, J. E., Zea, A. Antimonial treatment of hamsters infected with Leishmania (Viannia) panamensis: assessment of parasitological cure with different therapeutic schedules. Trans. R. Soc. Trop. Med. Hyg. 87, 567-569 (1993).
- Hommel, M., jaffe, C. L., Travi, B., Milon, G. Experimental models for leishmaniasis and for testing anti-leishmanial vaccines. Ann. Trop. Med. Parasitol. 89, 55-73 (1995).
- Travi, B. L., Osorio, Y., Saravia, N. G. The inflammatory response promotes cutaneous metastasis in hamsters infected with Leishmania (Viannia) panamensis. J. Parasitol. 82, 454-457 (1996).
- Travi, B. L., Osorio, Y. Failure of Albendazole as an alternative treatment of cutaneous Leishmaniasis in the hamster model. Memorias Instituto Oswaldo. 93, 515 (1998).
- Travi, B. L., Osorio, Y., Melby, P. C., Chandrasekar, B., Arteaga, L., Saravia, N. G. Gender is a major determinant of the clinical evolution and immune response in hamsters infected with Leishmania spp. Infect Immun. 70, 2288-2296 (2002).
- Osorio, Y., Melby, P. C., Pirmez, C., Chandrasekar, B., Guarín, N., Travi, B. L. The site of cutaneous infection influences the immunological response and clinical outcome of hamsters infected with Leishmania panamensis. Parasite Immunol. 25, 139-148 (2003).
- Osorio, Y., Bonilla, D. L., Peniche, A. G., Melby, P. C., Travi, B. L. Pregnancy enhances the innate immune response in experimental cutaneous leishmaniasis through hormone-modulated nitric oxide production. J. Leukoc. Biol. 83, 1413-1422 (2008).
- Espitia, C. M., Zhao, W., Saldarriaga, O., Osorio, Y., Harrison, L. M., Cappello, M., Travi, B. L., Melby, P. C. Duplex real-time reverse transcriptase PCR to determine cytokine mRNA expression in a hamster model of New World cutaneous leishmaniasis. BMC Immunol. 22, 11-31 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены