Method Article
Nucleofection из грызунов нейробласты по изучению нейробласта миграции
В этой статье
Резюме
Нейробласта миграция является важным шагом в послеродовой нейрогенеза. Протокол, описанный здесь, может использоваться, чтобы исследовать роль регуляторов кандидатов нейробласта миграции, используя ДНК / маленький шпильки РНК (shRNA) nucleofection и 3D миграции анализа с нейробластах выделенных из грызунов послеродовой ростральной миграционного потока.
Аннотация
Субвентрикулярной зоне (СВЗ), расположенный в боковой стенке боковых желудочков играет фундаментальную роль во взрослом нейрогенеза. В этом ограниченном участке мозга, нервные стволовые клетки размножаются и постоянно генерировать нейробласты, которые мигрируют по касательной в цепях по ростральной миграционного потока (RMS), чтобы достичь обонятельной луковицы (OB). После того как в OB, нейробласты переключиться на радиальной миграции, а затем дифференцируются в зрелые нейроны в состоянии включить в существовавшие ранее нейронной сети. Правильное миграция нейробластов является фундаментальным шагом в нейрогенеза, обеспечения правильного функционального созревания новорожденных нейронов. Учитывая способность СВЗ-производных нейробластах целевой раненых области в мозге, исследуя внутриклеточные механизмы, лежащие их подвижность не только улучшить понимание нейрогенеза но может также способствовать развитию neuroregenerative стратегий.
Эта рукопись описывает подробныйпротокол для трансфекции первичных грызуна RMS послеродовые нейробласты и анализ их подвижности с помощью 3D в пробирке миграции анализа Резюмируя свой способ миграции наблюдается в естественных условиях. Обе крысы и мыши нейробласты может быть быстро и эффективно трансфицируют с помощью nucleofection либо с плазмидной ДНК, небольшой шпильки (SH) РНК или короткое вмешательства (SI) РНК олигонуклеотиды ориентации представляющих интерес генов. Для анализа миграции, nucleofected клетки reaggregated в «висячей капли», а затем вложить в трехмерной матрице. Nucleofection по себе существенно не нарушает миграцию нейробластов. Фармакологическое лечение nucleofected и reaggregated нейробластах также может быть выполнена в изучение роли путей, вовлеченных в нейробласта миграции сигнализации.
Введение
В послеродовом млекопитающих мозга, генерации новых нейронов (нейрогенез) происходит в течение всей жизни и ограничивается двумя нейрогенных ниш: субвентрикулярной зоне (СВЗ) боковых желудочков и зернистым зоне зубчатой извилины гиппокампа 1. Несколько недавних исследований показали важную роль взрослого нейрогенеза в содействии обучения и памяти задачи 2,3. Кроме того, свидетельством распространения и вербовки нейронных клеток-предшественников следующих травму головного мозга 4-7 поднимает возможность фармакологической активации нейрогенеза в нервной ремонта.
Послеродовая нейрогенез строго регулируется на всех его этапах, в том числе нервной пролиферацию предшественников, миграцию, дифференцировку, выживание, и окончательный синаптической интеграции новорожденных нейронов 8. Нервные клетки-предшественники (нейробласты), полученные из стволовых клеток в СВЗ мигрировать на большое расстояние через ростральной миграционныхпоток (RMS) к обонятельной луковице (OB), где они созревают в функциональные нейроны 9. Миграционные нейробласты преимущественно однополярный, с удлиненным телом клетки, проходящей один из ведущих процесс. Эти клетки перемещаются в цепях в коллективном порядке, скользя по одной другой 10. Миграция является важным шагом для последующего созревания СВЗ-производных предшественников на функциональные нейроны 11 и управляется несколькими факторами и молекул наведения включая: Полисиалилированный нейронной молекулы клеточной адгезии (PSA-NCAM) 12, Ephrins 13, Интегрины 14, Разрезы 15, факторы роста 16 и нейротрансмиттеров 17, однако молекулярные механизмы, лежащие в основе этого процесса полностью не поняты. Исследуя внутриклеточные сигнальные пути, регулирующие нейробластов миграции не только обеспечит лучшее понимание взрослого нейрогенеза, но и будет способствовать развитию нового терапевтическогоподходы, позволяющие развивать ремонт мозга.
Эта рукопись описывает подробный протокол для изучения роли регуляторов кандидатов нейробласта миграции в пробирке с использованием nucleofection и 3D миграции анализа. Nucleofection представляет собой метод трансфекции клеток на основе усовершенствованного метода электропорации. Сотового типа конкретных электрический ток и nucleofection решение позволит передача полианионных макромолекул, таких как ДНК и shRNA векторов и миРНК олигонуклеотидов непосредственно в ядро клетки и разрешения трансфекции медленно деления или митотически неактивные клетки, как эмбриональных и млекопитающих нейроны 18. Это быстрый, относительно легко выполнить и приводит к высокой воспроизводимостью трансфекции широкого диапазона типов клеток, включая первичные нейробластов и нейронов 19-21.
Диссоциация RMS ткани позволяет изолировать мигрирующих нейробластов, который может быть успешно nucleofected с ДНК / SHRН.А. векторы или миРНК олигонуклеотиды ориентации интерес гены. После nucleofection, нейробласты reaggregated в висячей капли, а затем вложить в трехмерном Matrigel матрицы. Эти условия позволяют нейробласты мигрировать из клеточных агрегатов Резюмируя режим миграции наблюдается в естественных условиях, обеспечивая тем самым отличную модельную систему для расследования сигнальных путей, участвующих в нейробласта миграции и оценить влияние фармакологических методов лечения на подвижности этих клеток.
протокол
Эта процедура в соответствии с МВД Великобритании Положения (Закон Животное научных мероприятиях, 1986). Ученые должны следовать принципам, установленным и утвержденным их институциональных и национальных регулирующих организаций животных.
1. Вскрытие и диссоциация Rat RMS нейробласты
- Подготовьте решения, необходимые для RMS вскрытия и диссоциации:
Вскрытие среда (100 мл)
Сбалансированный солевой раствор Хэнка (HBSS) - 98,5 мл
5 М HEPES рН 7,4 - 0,5 мл
Пенициллин-стрептомицин (10000 единиц / мл и 10000 мкг / мл) - 1 мл
Разобщенность среда (2 мл)
ССРХ - 1,760 мл
10x Трипсин (2,5%) - 200 мкл
DNAse1 (1 мг / мл) - 40 мкл
Дульбекко изменения Игла (DMEM) + 10% фетальной сыворотки теленка (FCS) (40 мл)
DMEM -36 мл
ФТС - 4 мл
Полная среда (12 мл)
Neurobasal средний - 11,46 мл
B27 Дополнение - 250 мкл
L-глютамин (200 мм) - 125 мкл
Глюкоза (45%) - 165 мкл
2. Фильтр-стерилизовать DMEM + 10% FCS и полной среды и preequilibrate их в 37 ° С / 5% СО 2 инкубатора.
- Рассечение
- Пожертвуйте крысы мусор P6-P7 (около 12 щенков) путем смещения шейных позвонков и обезглавить ножницами.
- Сделать передне-заднего разрез в коже вдоль середины стреловидного шва от носа до мозжечка с лезвие скальпеля. Очистите кожу с и повторить ту же надрез вдоль черепа.
- Аккуратно удалите черепные закрылки пинцетом и аккуратно снимите мозг с помощью шпателя, заботясь, чтобы включить обонятельные луковицы.
- Разрежьте наиболее хвостовой треть мозга и выбросьте его.
- Чоп-еэ ткани мозга в 1,4 мм толщиной корональных ломтиками, используя ткани вертолет.
- Поместите ломтики в блюдах, содержащих холодной рассечение среды и осторожно отделить их с помощью иглы.
- Номинальная появляется как треугольные, полупрозрачной области в центре ОВ секциях и как небольшой, круглой области в более каудальных срезах мозга. Разрежьте RMS из каждого среза с микрохирургической ножом, стараясь не допустить включая окружающие ткани. В P7 крысят, как правило, ~ 8 самых Ростральные ломтики (включая OB) содержат RMS.
- Соберите фрагменты RMS с пластиковой пипетки Пастера и поместите их в небольшое блюдо, содержащей холодной рассечение среды на льду.
- Когда рассечение завершена, передавать фрагменты RMS в 15 мл трубки с пластиковой пипетки. Оставьте фрагменты оседают на дне пробирки.
- Диссоциация
- Замените рассечение среду с 2 мл диссоциации среды.
- Растирают фрагменты RMS, осторожно рipetting подвеску фрагмент вверх и вниз примерно в 10 раз, используя P1000 пипетки.
- Оставьте трубку с фрагментами тканей в C водяной бане 37 ° в течение 2 мин.
- Внесите решение снова 10x и убедитесь, что фрагменты в отрыве (подвеска должна мутнеет).
- Инактивации трипсина путем добавления 5 мл предварительно нагретого DMEM + 10% FCS.
- Центрифуга клеточной суспензии в 433 х г в течение 5 мин.
- Тем временем аликвотой необходимое количество миРНК / ДНК в пробирки Эппендорф (обычно 3-5 мкг ДНК / shRNA или 5-9 мкг миРНК олиго за nucleofection, однако количество ДНК / миРНК может потребовать оптимизации).
- Удалите излишки среды и ресуспендируют осадок клеток, осторожно пипеткой в 5 мл нагретого DMEM + 10% FCS.
- Выполните число клеток. Ожидайте ~ 1 х 10 6 клеток на крысят мозг. Минимум 2,5 х 10 6 клеток, необходимых для каждой nucleofection, в то время какОптимальные результаты достигаются при использовании 3-4 х 10 6 клеток на nucleofection.
- Центрифуга клеточной суспензии в 433 х г в течение 5 мин. Убедитесь в том, чтобы удалить столько среду, насколько это возможно.
2. Nucleofection
- Сразу ресуспендируют осадок клеток в крысы или мыши (при использовании клетки мыши) нейронов nucleofection раствор предварительно инкубируют при комнатной температуре. Используйте 100 мкл на nucleofection Примечание:. Обычно крыса помет из 12 щенков достаточно выполнить 4 nucleofections и помет мыши (12 щенков) достаточно выполнить 2 nucleofections.
- Трансфер 100 мкл клеточной суспензии в каждую пробирку Эппендорф, содержащей миРНК / ДНК и аккуратно перемешать 2-3x с помощью пипетки с P200 пипетки.
- Добавить образец (cell-DNA/siRNA суспензи), в нижней части nucleofectioncuvette, избегая пузырьков.
- Nucleofect помощью программы G-013 (для крыс клетки) или O-005 (дляклетки мыши). Один nucleofection занимает около 5 сек.
- Быстро добавить 1 мл нагретого DMEM + 10% FCS в nucleofected образца.
- Повторите шаги 2.4 и 2.5 для всех других образцов. Примечание: для достижения оптимального результата, вся процедура nucleofection должны длиться не более 5 мин.
- Передача каждого образца в 15 мл пробирку, содержащую 5 мл предварительно нагретого DMEM + 10% FCS с помощью пластиковой пипетки, представленную комплекта nucleofection. Избегайте передачи любой распада клеток к трубе.
- Центрифуга образцов при 433 мкг в течение 5 мин.
- Осторожно снимите все лишние среды и ресуспендируют осадок в 25-30 мкл нагретого DMEM + 10% FCS с использованием P20 пипетки. Не используйте более 30 мкл среды.
- Пипетки подвеску в виде капли на внутренней стороне посудомоечной p35 крышкой.
- Переверните крышку над p35 блюдо с 2 мл полной среды (см. также рисунок 1).
- Оставьте в инкубаторе (37 ° C / 5% СО 2) в течение нене менее 5 ч и до 7 часов. Более длительное время инкубации позволяет лучше реагрегация клеточных кластеров.
- Перенесите висячей капли с крышки в полной среде в блюдо с использованием P1000 пипетки с вырезом чаевых.
- Инкубировать при 37 ° C / 5% CO 2 в течение 24 ч в течение nucleofections ДНК и 48 часов для миРНК / shRNA nucleofections.
3. Встраивание
- Подготовить всю среду (25 мл) и preequilibrate его при 37 ° C / 5% CO 2 в течение нескольких часов.
- Выньте замороженные аликвоты базальной мембраны матрицы от -80 ° C морозильник и таять на льду в холодной комнате.
- Для каждого nucleofection подготовить чашку диаметром 6 см, содержащую до восьми 13 мм стерильные coverlips.
- Поместите посуду на лед коробки покрыта пищевой пленкой. Важно, чтобы держать покровные здорово, чтобы предотвратить затвердевание матрицу во время процедуры вложения.
- Для поддержания влажности, поместите полоску влажной ткани внутри 15 см блюдо, что шплохо быть использован для хранения до трех 6 см блюд, содержащих встроенные нейробласты.
- Добавить полной среды в талой матрицы в соотношении 1:03. Например, смешайте 40 мкл полной среды с 120 мкл матрицы с помощью пипетки. Это количество матрицы достаточно для встраивания агрегатов на восьми 12 мм покровные.
- Перенесите кластеры reaggregated клеток к 15 мл трубки и центрифуге при 433 мкг в течение 5 мин.
- Удаление избытка среды и ресуспендируют осадок в 10 мкл полной среды.
- Поместите 2 мкл клеток совокупного подвески на каждый стерильной покровного и добавить 18 мкл матрицы / полного среднего смеси. Используйте пипетки распространять матрицу по всей покровное.
- Сразу же место 6 см блюдо, содержащее покровные в 15 см блюдо и оставить в инкубаторе (37 ° C / 5% СО 2) в течение 15-20 мин. Когда матрица укрепил, мягко добавить 5 мл полной среды для каждого 6 см ухода блюдо принимая нажатьвниз любой плавающей покровного с кончика пипетки.
- Инкубировать в течение 24 часов при 37 ° C / 5% CO 2, чтобы нейробласты мигрировать из клеточных агрегатов.
4. 3D Анализ миграции
- Подготовьте решения, необходимые для иммунной окраски.
- Подготовьте блок решение:
Коза блок раствор (50 мл)
Забуференный фосфатом физиологический раствор (PBS) - 5 мл
Коза сыворотки - 7,5 мл
10% Triton X-100 - 1,5 мл
БСА - 50 мг
H 2 O - 36 мл - Фильтр и хранить при температуре 4 ° C.
- Подготовьте крепежную решение:
Фиксирующим раствором (100 мл)
Параформальдегид (PFA) - 4 г ВНИМАНИЕ: всегда обращаться PFA под капотом
Сахароза - 20 г (по желанию)
PBS до 100 мл - На горячей плите и при постоянном перемешивании растворить PFA в 80 мл PBS при 65 ° C.
- После того, как PFA растворится, добавить 20 г сахарозы.
- Отрегулируйте рН до7,4 (обычно путем добавления ~ 60 мкл 1 М NaOH на 100 мл раствора).
- Подогреть до общего объема 100 мл с PBS.
- Подготовьте блок решение:
- Иммуноокрашивание
- Наведите покровные в 24-луночный планшет.
- Промыть покровные с PBS 2х.
- Fix нейробласта агрегаты RMS с фиксирующим раствором в течение 45 мин при комнатной температуре.
- Промыть покровные с PBS 3 раза (5 мин / мыть - на качающейся платформе).
- Блок в течение 30-60 мин с козел блока решения.
- Развести первичных антител в блоке решения козьего и инкубировать в течение ночи при 4 ° С. (При желании флуоресцентный фаллоидином (1:400) и Hoechst краситель (1:10000) также может быть добавлен к раствору первичного антитела для визуализации нитчатые актина и ядер).
- Промыть покровные с PBS 3 раза (5 мин / стирки).
- Развести вторичных антител в растворе блока козы и инкубировать в течение 2 ч при комнатной температуре.
- Промыть coversliпс с PBS 3 раза (5 мин / стирка)
- Гора покровные с флуоресцентным монтажной среды и оставить для высыхания на ночь при комнатной температуре.
- Анализ миграции
- Захват изображения фиксированных RMS нейробластов агрегатах с флуоресцентным микроскопом с использованием объектива 10х. Включают в себя бар накипи в выборочной изображения.
- Чтобы настроить масштаб для количественного, измерить бар масштабный в изображении, выбрав 'прямой линии' инструмент на панели ImageJ инструмента.
- Выберите опцию 'Анализ' и нажмите 'установленной шкале ".
- В окне шкалы установить 'известное расстояние' и отметьте "глобального" флажок, чтобы сохранить те же настройки для всех измерений.
- Используйте "сегментированные строки 'инструмент на панели ImageJ инструмента, чтобы измерить расстояние от края совокупности к самой дальней мигрировали нейробласта в 6 различных секторов за всей совокупности (рис. 3В). Рассмотрим только изолированными НПgregates для анализа.
- Рассчитать среднее расстояние миграции из 6 значений, полученных для каждого агрегата.
- Измерьте 10-20 агрегатов для каждого условия в каждом независимом эксперименте и бассейн результатов как минимум трех независимых экспериментов. Всегда включайте управления nucleofection (например. GFP или управляющий ш / миРНК).
Результаты
Нейробластов может быть успешно выделен из расчлененный RMS ткани (рис. 1А) и заливали в трехмерной матрице. Клетки, выделенные из каждой крысы или мыши послеродовых RMS являются иммунопозитивные мигрирующих нейробластов маркеров, таких как doublecortin (DCX), βIII тубулина или PSA-NCAM (фиг. 1B-C).
Диссоциированные нейробласты может быть эффективно nucleofected с ДНК (например,. В GFP-кодирования плазмиды, рисунок 2) или shRNA плазмиды (рис. 4) для достижения истощение белка, который можно оценить вестерн-блот анализа (рис. 4В) или иммунофлюоресценции (не показан) .
Клетки nucleofected с GFP-кодирования плазмид мигрируют радиальном направлении reaggregated кластеров нейробластов (рис. 3А). Количественное определение относительной мигрированного расстояние 24 часами сообщению вложения (рис. 3б) не показывает разницу в миграции между GFP-POSIT ив клетки и GFP-отрицательный, nonnucleofected клетки (рис. 3в), указывая, что nucleofection по себе не нарушает миграцию. Там также нет существенного различия в степени миграции между nucleofected нейробластах и нейробластах непосредственно мигрирующих из RMS эксплантов (данные не показаны).

Рисунок 1. Рассечение RMS нейробластах. (А) Схематическое изображение RMS нейробласта вскрытия. Подробное описание см. в тексте. (В) Изолированные крыса RMS клетки иммунопозитивных для перелетных производителей нейробластов DCX и βlll тубулина. Бар, 20 мкм. (С) Клетки, мигрирующие из мыши RMS эксплантатах выразить миграционная нейробластов маркеры DCX и PSA-NCAM. Бар, 20 мкм.0989/50989fig1highres.jpg "целевых =" _blank "> Нажмите здесь, чтобы посмотреть увеличенное изображение.
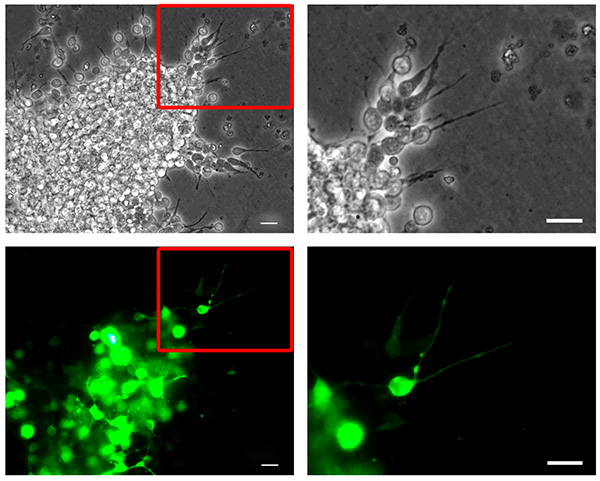
Рисунок 2. Мышь нейробластов nucleofection. Диссошиэйтед мыши RMS нейробласты были nucleofected с Pmax-GFP, reaggregated, встроенные в трехмерной матрице и позволил перенести в течение 6 часов. Нейробласты мигрирующие из reaggregated кластера клеток (сверху, фазовый контраст изображения) показывают высокую эффективность трансфекции (дно, GFP каналов фото). Правые панели колонки показывают большее увеличение картинки, соответствующие вставками, выделенном на панели столбцов. Бары, 20 мкм. Нажмите здесь, чтобы увеличить изображение .
ontent-ширина = "6 дюймов" Первоначально "/ files/ftp_upload/50989/50989fig3.jpg" ширина = "500px" />
Рисунок 3. 3D анализ миграции. (A) крысы были нейробласты nucleofected с Pmax-GFP (GFP) или pCAG-IRES-EGFP 22 (EV), reaggregated, встроенный в матрице слева и мигрировать в течение 24 часов. Затем клетки фиксированной и иммуноокрашиванию для GFP (зеленый) и βIII тубулина (красный). Бар, 50 мкм. (В) Измерение расстояния миграции с использованием ImageJ. Reaggregated клеток кластер разделен на 6 равных секторов. Расстояние между краем кластера (пунктирная линия) и самым дальним мигрировали клетки измеряется для каждого сектора. (C) Количественный анализ относительного расстояния мигрировали на nucleofected клеток (GFP-положительных) и контрольные клетки, nonnucleofected (GFP-отрицательные) . Нажмите здесь, чтобы увеличить изображение .
"Рисунок 4" FO: контент-ширины = "6 дюймов" Первоначально "/ files/ftp_upload/50989/50989fig4.jpg" ширина = "500px" />
Рисунок 4. Мониторинг нейробластов миграции после shRNA nucleofection. (А) Крыса нейробласты были nucleofected с контрольной shRNA вектора (PCA-б-EGFPm5 глушитель 3, которая также выражает EGFP 23) или же вектором, содержащим shRNA ориентации fascin, актин-комплектации белок 24. Клетки reaggregated более 48 ч, встроенный в матрице слева и мигрировать в течение 24 часов. Агрегаты затем фиксировали и иммуноокрашиванию для GFP (зеленый) и βIII тубулина (красный). Бар, 50 мкм. (В) Эффективное fascin истощение могут быть обнаружены 50 часа после shRNA nucleofection Вестерн-блот анализе. Актина показан здесь в качестве контроля загрузки (С) количественный анализ относительного расстояния миграции, показывающий, что fascin истощение существенно ухудшает нейробластов миграции. (Среднее ± SEM; ** р <0,01; п = 3 независимых экспериментов). Нажмите здесь, чтобы посмотреть увеличенное изображение.
Обсуждение
Миграция нейробластах вдоль RMS до конечного месте в OB является фундаментальным шагом в послеродовой нейрогенеза. Однако молекулярные механизмы, контролирующие этот сложный процесс еще далеко не полностью изучены.
Экспериментальная процедура, описанная здесь позволяет изучать нейробласта миграции в пробирке. Мы адаптировали ранее опубликованный протокол для выделения RMS нейробласты с раннего послеродового мыши или крысы 25. Для достижения оптимальных результатов важно освоить шаг рассечение, так как очень важно, чтобы держать интервал времени между рассечения и nucleofection к минимуму. После nucleofection, нейробласты можно reaggregated, встроенные в трехмерной матрице и оставил мигрировать над часами период 24. Кроме того, в целях, отличных миграции (например иммунофлюоресценции или вестерн-блот анализ) целей, клетки могут быть немедленно покрытием после nucleofection на polyornithine/laminin-покрытием покровные, где они выживают до 4-5 дней. Мыши и крысы нейробласты мигрировать в Матригель в такой же степени, однако клетки мыши, кажется, есть более сильное тенденцию мигрировать в цепях, чем крысы клеток.
В зависимости от цели исследования, нейробласты можно nucleofected с различными плазмид, кодирующих флуоресцентные белки или дикого типа / мутантных белков, представляющих интерес. Для получения оптимальных плазмид экспрессии белка с CAG промоутер (β-актин промотора с ЦМВ усилитель и β-глобина поли-хвост) 26 рекомендуется. Кроме того, миРНК олигонуклеотиды или shRNA плазмиды могут быть nucleofected в нокдаун целей, представляющих интерес. Эффективное истощение белок могут быть визуализированы с помощью иммунофлуоресценции или помощью вестерн-блоттинга (обычно лизиса встроенные агрегаты от 1 крысы щенка с 50 мкл стандартного буфера для лизиса).
Nucleofection является относительно простой метод для трансфекции первичных нейробласты, предлагает более простой и быстрой альтернативой VIRAL вектор-опосредованной трансфекции, и может достичь высокого (~ 70-80%) эффективность трансфекции. Очень важно работать быстро во время процедуры nucleofection, после ухода нейробласты в nucleofection решения в течение длительного времени резко снижает жизнеспособность клеток.
Средняя урожайность клеток от RMS вскрытия является относительно низким для мышей P7 (~ 5 х 10 5 клеток / мозга) по сравнению с P7 крыс (~ 1 х 10 6 клеток / мозг) и не менее 3 х 10 6 клеток на nucleofection требуются для достижения трансфекции с ~ эффективности 50%. Кроме того, крысы нейробласты появляются противостоять лучше nucleofection сравнению с нейробластах мыши. Таким образом, ранняя послеродовая (P6-P7) крысят может представлять удобный источник нейробластов, также учитывая, что организация крыс и мышей RMS удивительно СимиЛар 27 и что степень крысы и мыши нейробласта миграции в пробирке также сопоставимы. Желательно не держать reaggregated кластеры nucleofected нейробластах в виде суспензии в течение более 48 часов, чтобы исключить возникновение излишних воздействие на морфологию клеток и миграции (наши неопубликованные данные).
3D анализа, описанного здесь, могут использоваться для количественного нейробластов миграции в фиксированной точке времени после погружения в матрице (например. 24 ч). Агрегаты разных размеров могут быть использованы при анализе, так как нет существенной корреляции между размером агрегатов и расстояния миграции (наши неопубликованные данные). Для визуализации и далее исследовать динамику нейробласта миграции, покадровой обработки изображений могут быть использованы. Рекомендуется проводить анализ миграции в 24 час интервала после встраивания, так как скорость нейробластах появляется, что значительно снижает при более длительных (наши неопубликованные наблюдения).
Есть некоторые ограничения в этом протоколе. Во-первых, nucleofection сих пор могут быть использованы для раннего постнатального нейробластах грызунов, в то время как инфекция с вирусными векторами остается наиболее эффективным методом трансфекции для взрослых нейробластах 28. Во-вторых, в пробирке миграции анализ не в полной мере воспроизвести сложную архитектуру RMS, наблюдаемых в естественных условиях. Действительно, хотя нейробласты поддерживать способность мигрировать в аналогии с их партнерами в естественных условиях, в экспериментальной установке, описанной здесь им не хватает взаимодействия с другими компонентами, такими как RMS астроцитов и кровеносных сосудов, которые также способствуют регулировать свою подвижность 9,29, 30. Этот вопрос может быть решен в будущем путем оптимизации трехмерных сокультивирования модельных системах.
В заключение, сочетая nucleofection с 3D анализа миграции представляет собой ценный инструмент, чтобы лучше понять молекулярные механизмы, лежащие в основенейробластов миграции. Это экспериментальная процедура обеспечивает начальный, быстрый и относительно простой способ оценить роль регуляторов кандидатов нейробласта миграции, которые могут быть дополнительно подтверждена другими подходами, как в естественных условиях послеродового электропорации и покадровой визуализации мозга срез культуры 28,31,32 .
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Эта работа финансировалась по Wellcome Trust Project гранта, предоставленного для ПД и GL (089236/Z/09/Z). С.Г. поддержали биотехнологии и биологических наук Исследовательского Совета PhD студенчества. Мы благодарим Матье Vermeren за любезное дар вектора shRNA и Дженнифер Shieh за ценные советы по нейробласта nucleofection.
Материалы
| Name | Company | Catalog Number | Comments |
| Hank’s Balanced Salt Solution (HBSS) | Invitrogen Life Technologies | 14175129 | |
| HEPES | Sigma-Aldrich | H3375-25G | |
| Penicillin-Streptomycin | Invitrogen Life Technologies | 15140-122 | |
| 2.5% Trypsin-EDTA (10x) | Gibco | 15090-046 | store 200 µl aliquots at -20 °C |
| DNAse I Vial (D2) | Worthington | LK003170 | ≥1,000 units per vial; store 50 µl aliquots at -20 °C |
| Dulbecco Modified Eagle's Medium (DMEM) | Gibco | 11960-044 | |
| Fetal Calf Serum (FCS) | Hyclone | SH3007902 | |
| Neurobasal medium | Gibco | 21103-049 | |
| B27 supplement | Invitrogen Life Technologies | 17504044 | |
| L-Glutamine (200 mM) | Invitrogen Life Technologies | 25030-081 | |
| D-(+)-Glucose solution (45%) | Sigma-Aldrich | G8769 | |
| Matrigel Basement Membrane Matrix, Growth Factor Reduced (GFR), Phenol Red-free, 10 ml, LDEV-Free | BD Biosciences | 356231 | prepare 120 µl aliquots at 4 °C, then store at -80 °C |
| PFA | Sigma-Aldrich | 441242 | |
| Sucrose | BDH | 102745C | |
| Goat serum | Sigma-Aldrich | 69023 | |
| Triton X-100 | VWR International Ltd. | 306324N | |
| BSA | Fisher Chemical | BPE9701-100 | |
| Dako fluorescence mounting medium | Dako | S3023 | |
| Rat neuron nucleofection kit | Lonza | VPG-1003 | |
| Mouse neuron nucleofection kit | Lonza | VPG-1001 | |
| Microsurgical knife | Angiotech | 7516 | |
| McIlwain tissue chopper | The Mickle Laboratory Engineering Company | ||
| Nucleofector II | Lonza |
Ссылки
- Ming, G. L., Song, H. J. Adult Neurogenesis in the Mammalian Brain: Significant Answers and Significant Questions. Neuron. 70, 687-702 (2011).
- Alonso, M., et al. Activation of adult-born neurons facilitates learning and and memory. Nat. Neurosci. 15, 897-U127 (2012).
- Lazarini, F., Lledo, P. M. Is adult neurogenesis essential for olfaction?. Trends Neurosci. 34, 20-30 (2011).
- Arvidsson, A., Collin, T., Kirik, D., Kokaia, Z., Lindvall, O. Neuronal replacement from endogenous precursors in the adult brain after stroke. Nat. Med. 8, 963-970 (2002).
- Jin, K. L., et al. Evidence for stroke-induced neurogenesis in the human brain. Proc. Natl. Acad. Sci. U.S.A. 103, 13198-13202 (2006).
- Kim, Y., Szele, F. G. Activation of subventricular zone stem cells after neuronal injury. Cell Tissue Res. 331, 337-345 (2008).
- Massouh, M., Saghatelyan, A. De-routing neuronal precursors in the adult brain to sites of injury: Role of the vasculature. Neuropharmacology. 58, 877-883 (2010).
- Pathania, M., Yan, L. D., Bordey, A. A symphony of signals conducts early and late stages of adult neurogenesis. Neuropharmacology. 58, 865-876 (2010).
- Lois, C., Alvarez-Buylla, A. Long-Distance Neuronal Migration in the Adult Mammalian Brain. Science. 264, 1145-1148 (1994).
- Lois, C., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Chain migration of neuronal precursors. Science. 271, 978-981 (1996).
- Belvindrah, R., Nissant, A., Lledo, P. M. Abnormal Neuronal Migration Changes the Fate of Developing Neurons in the Postnatal Olfactory Bulb. J. Neurosci. 31, 7551-7562 (2011).
- Battista, D., Rutishauser, U. Removal of Polysialic Acid Triggers Dispersion of Subventricularly Derived Neuroblasts into Surrounding CNS Tissues. J .Neurosci. 30, 3995-4003 (2010).
- Conover, J. C., et al. Disruption of Eph/ephrin signaling affects migration and proliferation in the adult subventricular zone. Nat. Neurosci. 3, 1091-1097 (2000).
- Mobley, A. K., McCarty, J. H. beta 8 Integrin is Essential for Neuroblast Migration in the Rostral Migratory Stream. Glia. 59, 1579-1587 (2011).
- Nguyen-Ba-Charvet, K. T., et al. Multiple roles for slits in the control of cell migration in the rostral migratory stream. J. Neurosci. 24, 1497-1506 (2004).
- Garzotto, D., Giacobini, P., Crepaldi, T., Fasolo, A., De Marchis, S. Hepatocyte growth factor regulates migration of olfactory interneuron precursors in the rostral migratory stream through Met-Grb2 coupling. J. Neurosci. 28, 5901-5909 (2008).
- Platel, J. C., Stamboulian, S., Nguyen, I., Bordey, A. Neurotransmitter signaling in postnatal neurogenesis: The first leg. Brain Res. Rev. 63, 60-71 (2010).
- Dityateva, G., et al. Rapid and efficient electroporation-based gene transfer into primary dissociated neurons. J. Neurosci. Meth. 130, 65-73 (2003).
- Shieh, J. C., Schaar, B. T., Srinivasan, K., Brodsky, F. M., McConnell, S. K. Endocytosis Regulates Cell Soma Translocation and the Distribution of Adhesion Proteins in Migrating Neurons. PloS One. 6, (2011).
- Viesselmann, C., Ballweg, J., Lumbard, D., Dent, E. W. Nucleofection and Primary Culture of Embryonic Mouse Hippocampal and Cortical Neurons. J. Vis. Exp. , e2373 (2011).
- Gartner, A., Collin, L., Lalli, G. Nucleofection of primary neurons. Method Enzymol. 406 (06), 374-388 (2006).
- Causeret, F., et al. The p21-Activated Kinase Is Required for Neuronal Migration in the Cerebral Cortex. Cereb. Cortex. 19, 861-875 (2009).
- Bron, R., Eickholt, B. J., Vermeren, M., Fragale, N., Cohen, J. Functional knockdown of neuropilin-1 in the developing chick nervous system by siRNA hairpins phenocopies genetic ablation in the mouse. Dev. Dynam. 230, 299-308 (2004).
- Sonego, M., et al. Fascin regulates the migration of subventricular zone-derived neuroblasts in the postnatal brain. J. Neurosci. 33, 12171-12185 (2013).
- Ward, M., Rao, Y. Investigations of neuronal migration in the central nervous system. Methods Mol. Biol. 294, 137-156 (2005).
- Niwa, H., Yamamura, K., Miyazaki, J. Efficient Selection for High-Expression Transfectants with a Novel Eukaryotic Vector. Gene. 108, 193-199 (1991).
- Peretto, P., Giachino, C., Aimar, P., Fasolo, A., Bonfanti, L. Chain formation and glial tube assembly in the shift from neonatal to adult subventricular zone of the rodent forebrain. J. Comp. Neurol. 487, 407-427 (2005).
- Khlghatyan, J., Saghatelyan, A. Time-lapse Imaging of Neuroblast Migration in Acute Slices of the Adult Mouse Forebrain. J. Vis. Exp. , e4061 (2012).
- Bozoyan, L., Khlghatyan, J., Saghatelyan, A. Astrocytes Control the Development of the Migration-Promoting Vasculature Scaffold in the Postnatal Brain via VEGF Signaling. J. Neurosci. 32, 1687-1704 (2012).
- Whitman, M. C., Fan, W., Rela, L., Rodriguez-Gil, D. J., Greer, C. A. Blood Vessels Form a Migratory Scaffold in the Rostral Migratory Stream. J. Comp. Neurol. 516, 94-104 (2009).
- Sonego, M., Ya, Z., Oudin, M. J., Doherty, P., Lalli, G. In vivo Postnatal Electroporation and Time-lapse Imaging of Neuroblast Migration in Mouse Acute Brain. J. Vis. Exp. , (2013).
- Feliciano, D. M., Lafourcade, C. A., Bordey, A., lique, Neonatal Subventricular Zone Electroporation. J. Vis. Exp. , e50197 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены