Method Article
В естественных условиях допроса центральной нервной системы Translatome по Polyribosome фракционирования
В этой статье
Резюме
Этот протокол иллюстрирует существенные модификации polyribosome фракционирования в целях изучения translatome из естественных условиях образцов в ЦНС. Это позволяет глобальную оценку регуляции трансляции и транскрипции через изоляцию и сопоставления общей РНК в рибосоме связанной РНК фракций.
Аннотация
Несколько процессов участвуют в экспрессии генов, включая транскрипции, трансляции и стабильность мРНК и белков. Каждый из этих шагов жестко регулируется, влияющие окончательные динамику белка изобилии. Существуют различные механизмы регулирующие на этапе перевода, что делает уровни мРНК один ненадежный показатель экспрессии генов. Кроме того, местные регулирование трансляции мРНК была особенно вовлечены в нейронных функций, сдвигая "translatomics" в центре внимания в нейробиологии. Представленный метод может быть использован для мостовых транскриптомику и протеомики.
Здесь мы опишем основные изменения в технике polyribosome фракционирования, которая опрашивает translatome на основе объединения активно переведенных мРНК к нескольким рибосом и их дифференциальной седиментации в градиенте сахарозы. Традиционно, работать с естественных условиях образцов в, особенно в Centraл нервной системы (ЦНС), оказался непростым из-за ограниченных количеств материала и наличием компонентов жировой ткани. Для решения этого, описан протокол специально оптимизирован для использования с минимальным количеством материала ЦНС, как показано с помощью одной мыши спинного и головного мозга. Вкратце, ЦНС ткани извлекаются и перевод рибосомы обездвижены на мРНК с циклогексимида. Миелин флотации Затем выполняется для удаления липидов богатые компоненты. Фракционирование проводили на градиенте сахарозы, где мРНК разделены согласно их рибосомной загрузки. Изолированные фракции подходят для целого ряда последующих анализов, в том числе новых генома широкий технологий анализа.
Введение
Экспрессия генов определяется совместным действием транскрипции, трансляции и стабильности мРНК и белков, с перевод принимая наиболее распространенных эффект 1. Теперь очевидно, что каждый из этих шагов является строго регулируется. Микро-РНК, образование РНК гранул, альтернативы и цитоплазматической полиаденилирование некоторые примеры посттранскрипционной регуляции экспрессии генов 2,3. Каждый из этих механизмов отсоединяет транскрипцию с переводом и влияет на протеом в биологической системе, представляющей интерес. Таким образом, неудивительно, уровни мРНК одних только несовершенный отсчет уровней белка 4. Количественный протеомика обеспечивает наиболее прямой оценки экспрессии генов, однако, несмотря на недавние успехи, все еще имеются значительные ограничения на чувствительности и разрешения последовательности белка. Поэтому обращаясь к translatome, репертуар переводе мРНК, предлагает отличный компромисс между изучениятранскриптома и протеома. Это точнее, чем транскриптомику в оценке выражения окончательного гена, и обеспечивает как высокую охват и разрешение последовательности, чем протеомики.
В системах млекопитающих, большинство событий перевода начинают через кэп-зависимой инициации. Группа эукариотических факторов инициации вместе с 40S небольшой субъединицы рибосомы собрать на 5'шапкой мРНК. Комплекс затем сканирует мРНК и по достижении стартовый кодон августа, вербует 60-х годов большой рибосомной субъединицы, чтобы сформировать полный 80S рибосомы. Удлинение стадия протекает с рибосома движется вдоль мРНК, с факторы элонгации содействие включению аминокислот из загруженных тРНК к зарождающейся пептидной цепи. Несколько рибосомы могут идти по одной мРНК одновременно и число связанных с ними рибосом было показано, коррелирует со скоростью синтеза белка 5,6. Это делает рибосомной загрузки надежное указание на переходовslation и позволяет отделить активно переводить мРНК, основанные на скорости оседания. В дополнение к количественному определению перевод мРНК, информацию о последовательности могут быть получены идентифицировать мотивы, участвующих в регуляции трансляции. Кроме того РНК связывающих белков и других факторов перевода могут быть выделены из различных фракций, облегчая изучение и открытие соответствующих регуляторных белков.
В нервной системе, поступательное управления была связана с процессами, такими как мРНК хранения, транспортировки и синтеза локального белка. Конусы роста, как было показано в гавань определенную локализованную пул мРНК, отличных от остальной части аксона 7. Кроме того, аксоны обладают способностью локально синтезируют белки 8,9. В результате, местное управление перевода стала важнейшей темой исследования в области нейробиологии. Потенциал polyribosome фракционирования для решения этой проблемы было проиллюстрировано в нескольких исследованиях, в которых методика была использована дляисследовать аксонов в развитии спинного мозга, и продемонстрировал активно-зависимый перевод BDNF в 10,11 мозга.
протокол
Все эксперименты на животных были проведены в соответствии с институциональными руководящими принципами DKFZ.
Внимание: В целях предотвращения РНКазы загрязнения образцов, принять основные меры для предотвращения загрязнения РНКазы и подготовить все буферы с DEPC обработанных водой.
1. Получение градиентах сахарозы
- Подготовка 17,5, 25,6, 33,8, 41,9 и 50% растворы сахарозы (см. таблицу 1). Начать подготовку градиенты, медленно добавляя 2 мл 50% раствора сахарозы в нижней части polyallomer ультрацентрифужную пробирку. Замораживание слой, помещая пробирки в течение 20 мин при -80 ° С.
- Добавить последующие слои на снижение сахарозы проценты с шагами замораживания между ними, в конечном итоге до 17,5% сахарозы. Хранить градиенты на льду во время добавления растворов сахарозы, чтобы предотвратить оттаивание нижележащих слоев.
- Подготовка сахарозы градиенты недавно за один день до использования и хранить при температуре 4 ° C. Alternativelу, подготовить градиенты заранее, хранить при -80 ° С и оттаивания при 4 ° С в ночь перед экспериментом.
2. Подготовка ткани (спинного мозга и / или головного мозга)
- Обезболить мышь путем передозировки Xylazin и кетамин в NaCl и транскардиально заливать 20 мл сбалансированного солей раствор Хенка (HBSS), содержащей 200 мкг / мл СНХ который обездвиживает рибосомы на связанных транскриптов. Подтверждение надлежащего обезболивания неисполнением отзывчивости до пят пинчах.
- Извлечение ткани быстро. Откройте черепа дорсально и извлечь мозг. Выполните ламинэктомии всего грудного и поясничного позвоночника и извлечь спинной мозг. Использование весь мозг (~ 400 мг) или 4 см кусок спинного мозга (~ 90 мг), соответственно.
- Трансфер ткани в ледяную гомогенизации буфера А (см. Таблицу 1) (спинного мозга: 1 мл; мозг: 4 мл) и кости на мелкие кусочки с чистой скальпелем, чтобы позволить повышенное поглощение циклогексимида. Перфогт все дальнейшие шаги на льду.
- Инкубировать в течение 15 мин и гомогенизации ткани механически с помощью гомогенизатора Даунса. Тщательно контролируется гомогенизации необходимо обеспечить, что ядра остаются нетронутыми. Лечить всех образцов точно так же для обеспечения сопоставимости. Примечание: для мозговой ткани: сорвать ткань на 5 ударов с плотно пригнанной пестиком. Для ткани спинного мозга: нарушить по 5 ударов с свободно закрывающейся пестиком, а затем еще в течение 5 ходов с плотно пригнанной пестиком.
- Возьмите аликвоты (400 мкл для мозга и 200 мкл для спинного мозга), флэш-замораживание и хранить при температуре -80 ° С в течение полной изоляции РНК.
- Удаление ядра и бесперебойное клеток и фрагментов ткани центрифугированием при 500 х г в течение 10 мин при 4 ° С. Низкая скорость центрифугирования предотвращает потерю рибосом.
- Лизируют мембранные фрагменты в ядрах свободного супернатанта в течение 30 мин, добавляя NP-40 и дезоксихолат натрия моющие средства (каждый в конечной концентрации 1%).
3. Миелин флотации
- Этот шаг удаляет жирные компоненты из образца, который в противном случае будет маскировать сигнал в профиле polyribosome. Во-первых, предварительно охлажденные ультрацентрифуг ведра и ротора при 4 ° С и подготовить 2 м, 1,1 м и 0,9 M растворы сахарозы (см. Таблицу 1).
- Смешайте лизата с 1,22 объемов 2 М раствора сахарозы и передать в полиэтилен ультрацентрифужную пробирку. Заполнение всех труб в равном объеме 10 мл 1,1 М раствора сахарозы, после чего наложить его тщательно с 0,9 М растворе сахарозы.
- Наведите ультрацентрифуге трубки в предварительно охлажденной Ультрацентрифуга ведра. Центрифуга в течение 3 ч при 100 000 мкг при 4 ° С. Во время этого процесса рибосом стать хранение в осадке, тогда как жирные компоненты всплывают и остаются в супернатанте.
4. Градиента сахарозы Фракционирование
- Удалить супернатант и растворить осадок в гомогенизации буфера В (см. таблицу 1 ). Измеряют поглощение при 260 нм для каждого образца с помощью NanoDrop или эквивалентный аппарат и нормализовать количество загрузить в соответствии со значением оптической плотности.
- Наведите сахарозы градиенты (получение описано в предыдущем разделе) в предварительно охлажденной Ультрацентрифуга ведра. Образцы слоев тщательно на верхней части градиента. Добавьте одну пустую сахарозы градиент в качестве технического контроля.
- Отрегулируйте вес каждого ведра с буфере для гомогенизации. Центрифуга образцов для 1,5 часа при 285000 х г при 4 ° C.
- Начните подготовку Isco фракционатор 30 мин до конца центрифугирования. Если используется другая модель ректификационной колонны, следовать протоколу производителя.
- Установите необходимый чувствительность (0,2 AUFS для мозга или 0,05 AUFS для спинного мозга) для УФ-лампы и включите его для разогрева. Соберите трубки пирсингу, подключить его через прокатки насоса до 60% раствора сахарозы через трубку пирсингу.
- Проверьте настройку, насосных сахарозы (потока крысуе: 1 мл / мин), в частности убедитесь нет утечки в насосно-компрессорных труб, которые введут пузырьков в градиент.
- Пустой фон поглощение вручную насосных градиент буфера в УФ-детектора и коррекции базовой линии.
- Осторожно снимите ультрацентрифуге ведра, содержащие сахарозы градиенты с осажденных образцов из ротора и разместить их на льду. Избегайте натыкаясь градиентов, чтобы предотвратить потерю разрешения.
- Запуск градиенты на ректификационной колонны. Запустите пустые градиенты первый анализа справочной поглощение и обеспечить надлежащее техническое установки.
- Присоединить градиент к УФ-детектором и прокалывают нижнюю часть трубы с трубной прошивного стана. Начните перекачку 60% сахарозы, которая будет вытеснять градиент с осажденных образцов вверх через УФ-детектора и в раскрывающемся дозатора.
- Поглощение при 260 нм документирована для генерации профиля поглощения для образца, с пиками, указывающими sedimentaции мРНК связанных с рибосомных субъединиц, monosomes и впоследствии все большее число рибосом.
- Соберите образцы на 20 фракций с помощью раскрывающегося дозатором (600 мкл каждый, в 2 мл пробирки).
5. Выделение РНК из отдельных фракций
- Добавить 10% SDS до конечной концентрации 1% в отдельных фракций и хорошо перемешать, чтобы разворачиваться белки и диссоциации рибосомы. В этот момент образцы могут быть заморожены при температуре -80 ° С. В зависимости от вопроса, которые будут рассмотрены, фракции могут быть объединены в соответствии с профилем абсорбции.
- Изолировать РНК с кислотной экстракции фенолом / хлороформом, который также удаляет загрязняющие следы ДНК.
- Добавить один объем кислой фенол / хлороформ (подогретую до комнатной температуры) к каждому образцу, тепло течение 10 мин при 65 ° С и давлении выпуска под вытяжном шкафу впоследствии.
- Центрифуга образцов течение 20 мин при 17 000 мкг при комнатной температуре. Тщательно передачи водную фазу к новой 1,5 млтрубка. Будьте в курсе инверсии фазы в более плотных сахарозы фракций, где водная фаза может быть на дне после центрифугирования.
- Добавить один объем изопропанола, 1/9 объема ацетата натрия (рН 5,2) и 1 мкл GlycoBlue к каждому образцу, чтобы осадить РНК. Держите образцы по крайней мере 1 час при температуре -80 ° С.
- Центрифуга течение 30 мин при 17000 х г и 4 ° С. GlycoBlue обеспечивает визуализацию таблетки. Удалить супернатант, мыть гранул раз ледяной холод 80% этанола и воздушно-сухой гранул. Растворите таблетку в РНКазы свободной воды.
- Количественная количество РНК на NanoDrop и анализировать целостность РНК чипом Bioanalyzer. РНК, которая получается по представленному протоколу подходит для всех современные высокой пропускной анализов в том числе микрочипов и глубокого секвенирования.
Результаты
Рисунок 2 показывает репрезентативные профили polyribosome после фракционирования. Профили головного и спинного мозга показывают кривые характеристическое поглощение, как описано выше для клеточных линий. мРНК, связанные с малых рибосомных субъединиц (40С) отложений на более легкие фракции и появляются сначала в качестве пика на профиле, а затем большой субъединицы рибосомы (60S) и monosome (80S) связанные мРНК. мРНК, связанные с несколькими рибосом осадок на более тяжелые фракции, с более поздние пики указанием большее число связанных рибосом. Глобальный перевод может быть оценена из профиля. В качестве примера ткань мозга имеет более высокую polyribosome в monosome соотношение чем ткани спинного мозга, что указывает на более активный перевода.
РНК экстрагировали из отдельных фракций оценивали по Bioanalyzer, показывающий распределение 18S и 28S рРНК. 18S рРНК появляется раньше в профиле, в соответствии с маленькие рибосомные субъединицы осаждающихся в легкой сукр OSE фракции. Типичные выходы из общей РНК 10-20 мкг для мозга и 2-4 мкг на спинной мозг. Выходы РНК из отдельных фракций до 4 мкг и 0,8 мкг на головном и спинном мозге соответственно, в зависимости от фракции. Пустой градиенте сахарозы уже показывает некоторые базовые поглощение при 260 нм, в связи с наличием DTT. На этом фоне могут быть вычтены в процессе анализа данных с целью нормализации значений выборок. Лечение ЭДТА рухнул polyribosome пики, демонстрируя профиль оседания происходит из-за перевода.
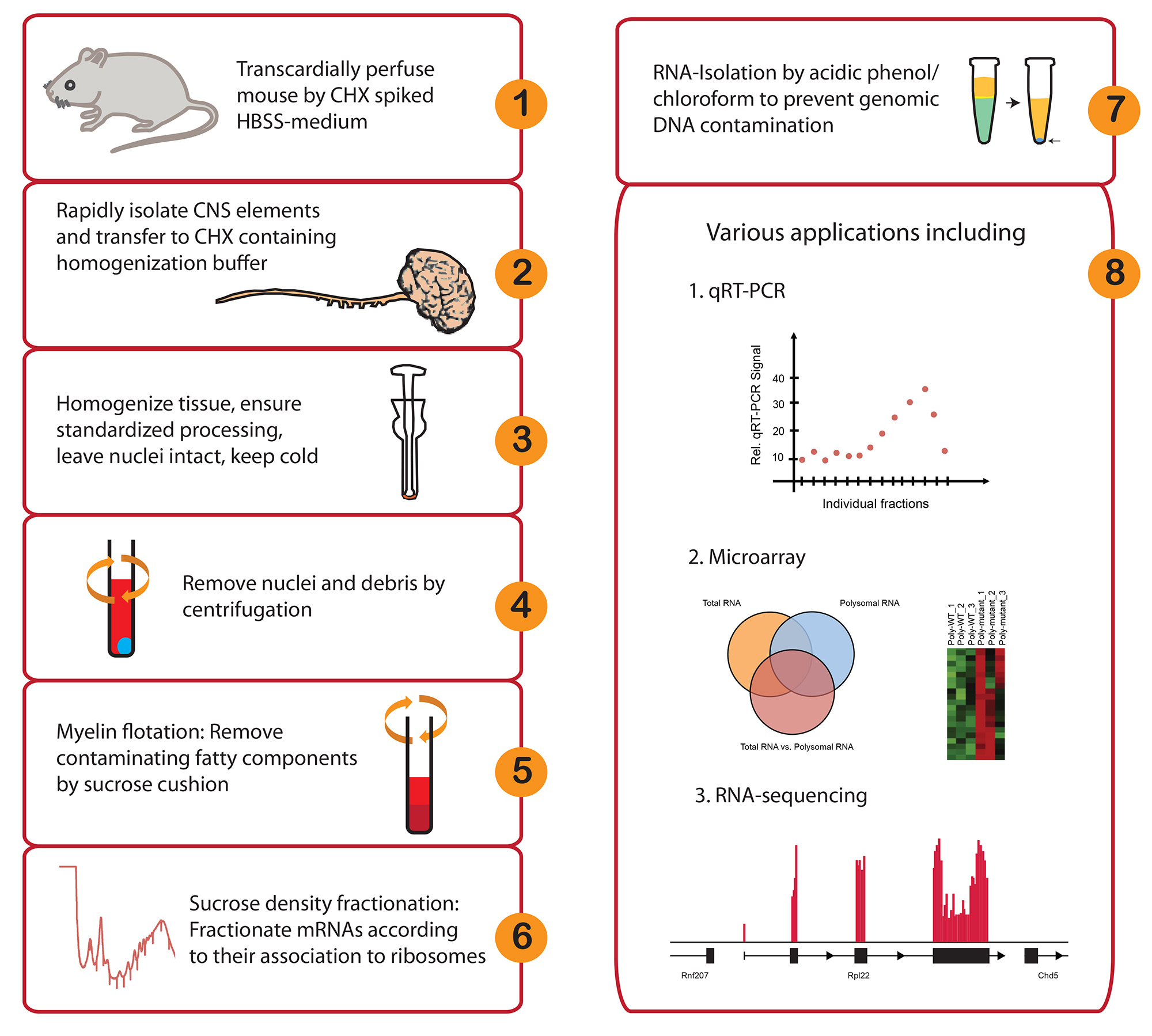
Рисунок 1. Рабочий процесс и возможности применения в естественных условиях polyribosome фракционирования.> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
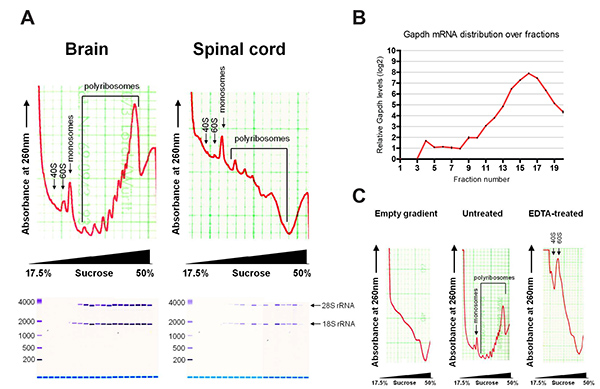
Рисунок 2. (А) Типичные профили polyribosome из головного и спинного мозга, с оценкой извлеченного РНК с помощью Bioanalyzer. (B) Распределение мРНК GAPDH в течение фракций с помощью Qrt-PCR. (C) Polyribosome профили пустой градиент и головного мозга с и без лечение ЭДТА. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
| 1.1 | 2x градиент буфера | 30 мМ Трис-HCl, рН 7,4, 30 мМ MgCl2, 600 мМ NaCl, 200 мкг / мл циклогексимида (CHX), 2 мМ дитиотреитола (DTT) | |
| 1.1 | раствор сахарозы 17,5% | 8,67 г сахарозы, 25 мл градиента 2x буфера до 50 мл DEPC H 2 0 | |
| 1.1 | раствор сахарозы 25,6% | 12,8 г сахарозы, 25 мл градиента 2x буфера до 50 мл DEPC H 2 0 | |
| 1.1 | раствор сахарозы 33,8% | 16,9 г сахарозы, 25 мл градиента 2x буфера до 50 мл DEPC H 2 0 | |
| 1.1 | раствор сахарозы 41,9% | 20,95 г сахарозы, 25 мл градиента 2x буфера до 50 мл DEPC H 2 0 | |
| 1.1 | раствор сахарозы 50% | 25 г сахарозы, 25 мл градиента 2x буфера до 50 мл DEPC H 2 0 | |
| 2.3 | гомогенизациибуфер | 0,25 М сахароза, 50 мМ Трис / HCl, pH 7,4), 5 мМ MgCl 2, 25 мМ KCl | 200 мкг / мл CHX, 1x Roche полный ингибитор протеазы, 1 мМ ДТТ, 1 мМ phenylmethanesulfonylfluoride (PMSF), 100 ед / мл RNasin |
| 3.1 | 2M раствор сахарозы | 68,4% сахарозы, 50 мМ Трис-HCl, рН 7,4, 5 мМ MgCl 2, 25 мМ KCl | 100 мкг / мл CHX, 1x Roche полный ингибитор протеазы, 1 мМ ДТТ, 1 мМ PMSF |
| 3.1 | 1.1M раствор сахарозы | 38,5% сахарозы, 50 мМ Трис-HCl, рН 7,4, 5 мМ MgCl 2, 25 мМ KCl | 100 мкг / мл CHX, 1x Roche полный ингибитор протеазы, 1 мМ ДТТ, 1 мМ PMSF |
| 3.1 | 0.9M раствор сахарозы | 30,8% сахарозы, 50 мМ Трис-HCl, рН 7,4, 5 мМ MgCl 2, 25 мМ KCl | 100 мкг / мл CHX, 1x Roche полный ингибитор протеазы, 1 мМ ДТТ, 1 мМ PMSF |
| 4.1 | часomogenization буфер B | 0,25 М сахароза, 50 мМ Трис / HCl, pH 7,4, 5 мМ MgCl 2, 25 мМ KCl, 1% NP-40, 1% дезоксихолат натрия | 200 мкг / мл CHX, 1x Roche полный ингибитор протеазы, 1 мМ DTT, 1 мМ PMSF, 100 ед / мл RNasin |
Таблица 1. Список Буферы и растворы.
Обсуждение
Хотя polyribosome фракционирования не роман техника, она остается особенно сложным. На основе исходного материала, существенное оптимизация может быть необходимым. Это особенно характерно для естественных условиях ЦНС образцов в, где количество материала часто является ограничением, и жирные компоненты тканей препятствуют изоляцию переводе мРНК. Часто публикуемые протоколы фракционирования дело с дрожжей или линии клеток млекопитающих, и есть установленные протоколы для мозга 12,13,14. В противоположность этому, существуют только любые публикации, описывающие фракционирование спинной мозг, и предыдущие протоколы требуют спинной мозг из большого числа животных должны быть объединены 15. По этим причинам, несколько существенных изменения были сделаны для адаптации протокол фракционирования для ЦНС тканей, в том числе одним щелчком спинного мозга. Рибосомы иммобилизация с циклогексимида выполняется во животных перфузии, чтобы избежать диссоциации рибосом Даринаг длительный процесс извлечения тканей. Впоследствии полисомной РНК экстрагируют определенным образом, чтобы максимизировать выход polyribosome. Во-первых, контролируемое гомогенизации ткани douncing, сохраняет ядро неповрежденными и предотвращает загрязнение ДНК. Ядро затем удаляют центрифугированием надежно. Сочетание моющих средств NP-40 и дезоксихолата натрия обеспечивает лизис эндоплазматического ретикулума и выпуска его мембранных связаны рибосом. Кроме того, компоненты поглощающие УФ-излучение в пределах богатой липидами миелина скрывать профили polyribosome. Миелин флотации Поэтому необходимо, где плотные соединения, такие как полирибосом осаждают и более легкие соединения, такие как миелина поплавком и удаляются 16. Полирибосом затем осаждали в течение 17,5% до 50% градиенте сахарозы в. Вместо ручного слоев и замораживание каждый слой сахарозы, градиенты могут быть также получены с использованием градиентного смесителя. Экстракция РНК из фракции с использованием кислотного фенол / хлороформ дает DNA быть удалены с минимальной потерей РНК. Однако инверсии фаз может происходить в плотных сахарозы фракции (фракции выше 16).
Этот протокол обеспечивает преимущества по сравнению с другими традиционными методами, которые направлены на уровень перевода. Например, как измерение фосфорилированным S6 (видный маркера перевод), а также маркировка растущих цепей с радиоизотопов дать информацию о глобальном уровнях перевода, но раскрыть немного от того, что конкретно в настоящее время переводится. Polyribosome фракционирование, с другой стороны, позволяет не только оценка глобального перевода, но и о личности переводе мРНК и соответствующих регуляторных белков. Количественный ПЦР в реальном времени могут быть выполнены на изолированных РНК для быстрого считываются из выбранных мРНК, и микрочипы и следующее поколение РНК последовательности может быть выполнена для генома широких исследований. Оптимизации, представленные здесь, позволяют техника, которые будут использоваться с минимальным количеством ЦНС тканей, поэтому сократитьING количество животных, необходимых и улучшение общего экспериментальную качество за счет сокращения времени обработки тканей. С другой стороны, этот метод не может отличить застрявшие рибосомы от перевода из них. Стенограммы несущие зашедших в тупик рибосомы будет оседать в тяжелых фракций, и это следует иметь в виду, при интерпретации данных.
Есть последнюю отчетную методы, а именно RiboTaq и ловушка, в которой рибосомы, меченные эпитопных тегов или репортеров соответственно определенным образом типа клеток и связанных мРНК, выделенных иммунопреципитацией 17,18. Эта техника может быть соединен с polyribosome фракционирования предложить высокое разрешение зачитать для конкретных клеточных популяций. Рибосомы футов печать еще один новый метод, который включает в нуклеазе пищеварение генерировать небольшие фрагменты, или "следы", мРНК, защищенных рибосом. Библиотеки Затем из этих следов и секвенировали. Этот метод провIDES целый анализ генома кодонов конкретного по переводу и способен идентифицировать зашедших в тупик рибосомы, не август начать кодонов и небольшие вверх по течению открытые рамки считывания, которые не могут быть достигнуты к polyribosome фракционирования 19. Тем не менее, polyribosome фракционирование может быть соединен с рибосомами профилирования для выделения переваренных фрагментов, содержащих одиночные рибосомы, таким образом обогащения для молекулярных частиц, необходимых для библиотеки препарата, в котором часто требуется высокая чистота образца. Взятые вместе, polyribosome фракционирование представляет собой гибкий метод с продолжительностью значение и может быть соединен с различных последовательных применений, в том числе генома широких анализов, таких как следующего поколения секвенирования.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана Федеральным министерством образования и научных исследований (BMBF), в системной биологии сигнализации в Раке (Гельмгольц Альянс на системной биологии) и онкологический научный центр немецкой (DKFZ).
Материалы
| Name | Company | Catalog Number | Comments |
| Hank’s balanced salts solution | Gibco | 14170-138 | |
| Tube, Thinwall, Polyallomer, 14 ml, 14 x 95 mm | Beckman Coulter | 331374 | |
| Diethylpyrocarbonate | Sigma | D5758 | caution |
| Cycloheximide | Sigma | C7698 | danger |
| Dithiothreitol | Sigma | 43815 | warning |
| Complete Protease Inhibitor Cocktail Tablets | Roche | 11697498001 | |
| Phenylmethanesulfonyl fluoride solution | Sigma | 93482 | danger |
| RNasin Plus RNase Inhibitor | Promega | N2611 | |
| Nonidet P-40 | Roche | 11332473001 | danger |
| Sodium deoxycholate | Sigma | D6750 | warning |
| Acid-Phenol:Chloroform, pH 4.5 (with IAA, 125:24:1) | Ambion | AM9722 | danger |
| GlycoBlue | Invitrogen | AM9516 | |
| Equipment | |||
| Dounce Tissue Grinder, 1 ml/7 ml | Wheaton | 357538/357542 | |
| Nanodrop 2000 | Thermo Scientific | ||
| SW 40 Ti Rotor, Swinging Bucket, Titanium, 6 x 14 ml, 40,000 rpm, 285,000 x g | Beckman Coulter | 331302 | |
| Density Gradient Fractionator | Teledyne Isco | ||
| 2100 Bioanalyzer | Agilent Technologies |
Ссылки
- Schwanhäusser, B., et al. Global quantification of mammalian gene expression control. Nature. 473 (7347), 337-342 (2011).
- Lau, A. G., et al. Distinct 3'UTRs differentially regulate activity-dependent translation of brain-derived neurotrophic factor (BDNF). Proceedings of the National Academy of Sciences of the United States of America. 107 (36), 15945-15950 (2010).
- Piqué, M., López, J. M., Foissac, S., Guigó, R., Méndez, R. A combinatorial code for CPE-mediated translational control. Cell. 132 (3), 434-448 (2008).
- Ingolia, N. T., Ghaemmaghami, S., Newman, J. R. S., Weissman, J. S. Genome-wide analysis in vivo of translation with nucleotide resolution using ribosome profiling. Science. 324 (5924), 218-223 (2009).
- Grolleau, A., et al. Global and specific translational control by rapamycin in T cells uncovered by microarrays and proteomics. The Journal of Biological Chemistry. 277 (25), 22175-22184 (1074).
- Rajasekhar, V. K., Viale, A., Socci, N. D., Wiedmann, M., Hu, X., Holland, E. C. Oncogenic Ras and Akt signaling contribute to glioblastoma formation by differential recruitment of existing mRNAs to polysomes. Molecular Cell. 12 (4), 889-901 (2003).
- Zivraj, K. H., et al. Subcellular profiling reveals distinct and developmentally regulated repertoire of growth cone mRNAs. The Journal of Neuroscience. 30 (46), 15464-15478 (2010).
- Brittis, P. a, Lu, Q., Flanagan, J. G. Axonal protein synthesis provides a mechanism for localized regulation at an intermediate target. Cell. 110 (2), 223-235 (2002).
- Tcherkezian, J., Brittis, P. a, Thomas, F., Roux, P. P., Flanagan, J. G. Transmembrane receptor DCC associates with protein synthesis machinery and regulates translation. Cell. 141 (4), 632-644 (2010).
- Colak, D., Ji, S. -J., Porse, B. T., Jaffrey, S. R. Regulation of axon guidance by compartmentalized nonsense-mediated mRNA decay. Cell. 153 (6), 1252-1265 (2013).
- Lau, A. G., et al. Distinct 3'UTRs differentially regulate activity-dependent translation of brain-derived neurotrophic factor (BDNF). Proceedings of the National Academy of Sciences of the United States of America. 107 (36), 15945-15950 (2010).
- Del Prete, M. J., Vernal, R., Dolznig, H., Müllner, E. W., Garcia-Sanz, J. A. Isolation of polysome-bound mRNA from solid tissues amenable for RT-PCR and profiling experiments. RNA. 13 (3), 414-421 (2007).
- Esposito, A. M., et al. Eukaryotic polyribosome profile analysis. J. Vis. Exp. (40), (2010).
- Sampath, P., Lee, Q. Y., Tanavde, V., et al. Identifying translationally regulated genes during stem cell differentiation. Current Protocols in Stem Cell Biology. Schlaeger, T. 1, (2011).
- Chiu, F. C., Smith, M. E. Studies on rat spinal cord polysomes: postnatal development and experimental demyelination. Journal of Neurochemistry. 31 (4), 835-844 (1978).
- Larocca, J. N., Norton, W. T., et al. Isolation of myelin. Current Protocols in Cell Biology. Bonifacino, J. S., et al. Chapter 3, (2007).
- Heiman, M., et al. A translational profiling approach for the molecular characterization of CNS cell types. Cell. 135 (4), 738-748 (2008).
- Sanz, E., Yang, L., Su, T., Morris, D. R., McKnight, G. S., Amieux, P. S. Cell-type-specific isolation of ribosome-associated mRNA from complex tissues. Proceedings of the National Academy of Sciences of the United States of America. 106 (33), 13939-13944 (2009).
- Ingolia, N. T., Brar, G. a, Rouskin, S., McGeachy, A. M., Weissman, J. S. The ribosome profiling strategy for monitoring translation in vivo by deep sequencing of ribosome-protected mRNA fragments. Nature Protocols. 7 (8), 1534-1550 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены