Method Article
Инкапсуляция Бесклеточные транскрипции и трансляции в машинный Пузырьки, для построения клеточных Mimics
В этой статье
Резюме
Здесь мы описываем простые методы получени везикул, инкапсуляции транскрипции и трансляции техники, а также мониторинга производства белка. Полученную бесклеточных системах можно использовать в качестве отправной точки, от которой можно создавать более сложные сотовой имитаторов.
Аннотация
По мере роста интереса смещается от отдельных молекул к системам молекул, все большее число лабораторий стремились наращивать снизу вверх сотовой мимика, которые лучше представляют сложность клеточной жизни. На сегодняшний день существует целый ряд путей, которые могут быть приняты для создания обособленных сотовой мимике, в том числе эксплуатация вода-в-масле, микрожидкостных устройств, и пузырьки. Каждый из предложенных вариантов имеет определенные преимущества и недостатки. Например, вода-в-масле, дают высокую эффективность инкапсуляции но не имитируют хорошо барьер проницаемости живых клеток. Основное преимущество описанных здесь способов является то, что все они легко и дешево в реализации. Транскрипция-перевод машины инкапсулирован в фосфолипидных везикулах через процесс, который использует общий приборов, таких как центробежные испаритель и экструдер. Реакции контролировали с помощью флуоресцентной спектроскопии. Протоколы могут быть адаптированы для экспрессии рекомбинантного белка, строительство сотовой мимика, исследование минимальные требования к клеточной жизни, или сборка генетической схемы.
Введение
Бесклеточные, в пробирке транскрипции-трансляции реакций и генерации пузырьков из синтетических липидов нет ничего нового. Однако сочетание двух в сотовой имитировать значительно более challenging1-6. E. кишечной клеточных экстрактов с или без РНК-полимеразы Т7 может быть использован в качестве источника транскрипции-трансляции машины 7,8. Клеточные экстракты выгоду от наличия дополнительных клеточных компонентов, которые могут способствовать экспрессии белка и складывания. Альтернативно, соединение очищен индивидуально РНК и белковые молекулы, т.е. PURE система 9, могут быть использованы посредником внутрипузырной синтез белка 4,10-14. Чистая система позволяет на строительство полностью определены сотовой мимики и не страдает от активности нуклеаз найдены в клеточных экстрактах. Практически это означает, что гораздо меньше ДНК-матрицы требуется, тем самым облегчая процессы с низкой эффективностью инкапсуляции 11 . Хотя и не столь часто используемые, сотовая мимика могут быть построены с клеточных экстрактов, полученных из эукариотических cells15. До сих пор, генетически закодированы инкапсулированные каскады и сотовой мимика, которые воспринимают окружающую среду было зарегистрировано 16-18.
Самый простой способ для контроля транскрипции-трансляции реакции заключается в измерении флуоресценции или люминесценции генетически кодируемых элементов. Как правило, люциферазы светлячка 19 или GFP используются, хотя в пробирке реакции часто измеряется радиоактивной метки. Флуоресценции дополнительно позволяет для мониторинга популяции везикул 20,21 цитометрии через методы, основанные, тем самым предлагая некоторое представление о стохастический характер, как биологические процессы. Эти методы мониторинга были использованы для определения небольшого набора правил проектирования и библиотеку частей, из которых строить с, включая набор флуоресцентные белки, которые совместимы с ян пробирке транскрипции-трансляции 22, влияние генетической организации по выражению 22, активность фактора сигма 16, а эффективность терминаторы транскрипции 23. Тем не менее, еще многое, что должно быть сделано, чтобы расширить возможности создания предсказуемой в пробирке, генетически кодируемых устройств.
Есть много методов, чтобы сделать пузырьки. Наиболее распространенные методы зависеть от размера тонкую липидную пленку на поверхности стекла последующим повторным суспендированием в водном solution24. Если водный раствор содержит транскрипции-трансляции техники, например, то часть пузырьков сформированный будет содержать необходимые компоненты для продукции белка. Тем не менее, эффективность инкапсуляции таких методов является низким, это означает, что только небольшая часть пузырьков активны. Многие альтернативные методы характеризуются значительно выше инкапсуляции эффiciency использовать преобразование вода-в-масле капель эмульсии пузырьков. Хотя вполне вероятно, что такие методы станут привычным делом в будущем, в настоящее время эти методы страдают от необходимости специализированного оборудования и дать пузырьки с измененной композиции мембраны 25. Явное преимущество вода-в-масле в пузырек методов является возможность контролировать мембраны ламеллярность. Метод, описанный здесь, основана на тонкой липидной пленки протокол описывается Yomo лаборатории 11 с небольшими модификациями, включая дополнительную стадию гомогенизации. Этот метод прост, дешевый, надежный и дает пузырьки хорошо подходит для инкапсуляции транскрипции-трансляции техники.
протокол
1. Подготовка шаблона ДНК
- Очисти плазмиды из стандартного лабораторного штамма Е. палочка, такие как E. DH5a палочка или Нова Синий с коммерческого набора. Кроме того, линейный продукт ПЦР может быть аналогичным образом очищали с помощью коммерческого набора. Элюции ДНК с H 2 O только.
- Фенол-хлороформ извлечения раствора ДНК 26.
- Определить концентрацию ДНК и чистоты, например, с помощью УФ-поглощения или другими подходящими способами. Важно использовать очень чистой ДНК для эффективной транскрипции-трансляции.
2. Подготовка тонкой пленки липидов
- Взвесьте сухой порошок липидов и растворяются в растворителе. За 1-пальмитоил-2-олеоил-Sn-глицеро-3-фосфохолин (POPC), растворы готовят в хлороформ при концентрации 40 мг / мл.
Примечание: Органические растворители всегда должны быть обработаны с стеклянных пипеток и бутылками. Другими словами, пластик не должны быть использованы. Магазин сТок решения в герметично, устойчивых к растворителю янтарная стеклянных бутылках при температуре -20 ° С, предпочтительно в атмосфере аргона. - Алиготе 12 мкмоль POPC (220 мкл 40 мг / мл маточного раствора) в 5 мл круглодонную колбу.
- Растворитель выпаривают на роторном испарителе (рис. 1) для получения тонкой липидной пленки.
- Возможность надежного крепления круглодонную колбу в дистилляционную трубы с круглым зажимом и начать вращение колбы.
- Инициировать циркуляции воды через теплообменник. С помощью тепловой ванны не нужно, потому что хлороформ имеет низкую температуру кипения 61,2 ° С при нормальном атмосферном давлении.
- Убедитесь, что система открыта в атмосферу, проверяя, что кран открыт. Включите вакуумный насос и медленно закрывать запорный кран, чтобы применить вакуум в системе.
- Тонкая пленка липидов осаждается на стенках круглодонной колбе в течение роторном испарителе формирования непрозрачная пленка, которая видна невооруженным глазом. Пусть роторного испарителя продолжают в течение 0,5-2 часов. Чтобы остановить процесс, медленно отпустите вакуумного давления, остановить вращение, и удалить круглодонную колбу.
3. Ресуспендирование липидов и везикул гомогенизации
- Добавляют 1 мл 18,2 МОм H 2 O к тонкой липидной пленки непосредственно в круглодонную колбу. Энергично вихревого решением с максимальной скоростью, примерно 3200 оборотов в минуту, пока липидная пленка не отделяется от стекла, которое можно наблюдать визуально.
- Передача липидов дисперсии в 2 мл микроцентрифужных трубки.
- Установки кольца стоят провести гомогенизатор с 5 мм чаевые. Наведите микроцентрифужные стенд ниже гомогенизатора чтобы надежно удерживать липидов дисперсии. Промыть диспергирующий элемент гомогенизатор путем погружения наконечника в 18,2 МОм H 2 O и работает в течение нескольких секунд.
- Поместите диспергирующего элемента непосредственно в липидные дисперсии обеспечение гона кончике не касается нижней части трубки микроцентрифужных. Гомогенизации в течение 1 мин при уровне мощности 4 или 14 000 оборотов в минуту.
4. Экструзионные пузырька и Лиофилизация
- Сборка частей мини-экструдер (рис. 2), которая состоит из внешнего корпуса и держателя гайки, где находится два тефлоновым внутренним мембрана поддерживает, два уплотнительных кольца, и один тефлон подшипника.
- Поместите два уплотнительных кольца в пазы внутренние опоры мембран. Предварительно смочите два фильтра и один 400 нм мембраны. Фильтры будут помещены против тефлон внутрь уплотнительные кольца с мембраной между ними.
- Поместите мембрана поддерживает в экструдер внешнего корпуса с мембраной окружении два фильтра между уплотнительными кольцами. Поместите подшипник тефлоном внутри корпуса и прикрепите фиксатор гайки и затяните вручную.
- Промыть два шприца и заполнить один с 18,2 МОм воды. Вставьте иглы шприца в небольшую чОлесь в тефлоновой на любом конце сборке экструдера. Иглы должны задвигается легко, не заставит игл. Закрепите экструдер со шприцами в экструдер жилья и закрепить.
- Проход воды через экструдер, медленно толкает воду из одного шприца в другой. Это представляет собой один проход. Повторить в общей сложности из трех проходов обеспечения, что нет никаких утечек нет. Удалите шприц воды и избавиться от воды.
- Заполните один шприц с образцом, придают в экструдер и медленно проходит везикул раствор через мембрану, как описано выше в пункте 4.3. Повторите 10 раз в общей сложности 11 проходов. Как поступления процесса экструзии, образец станет менее мутной и проще нажать на мембране. Резкое уменьшение сопротивления, однако, как правило, указывает разрыва мембраны.
- Передача экструдированного решение пузырька и составит 40 мкл аликвоты везикул в микроцентрифужные труб.Флэш заморозить каждой аликвоте либо сухим льдом или жидким азотом.
- Лиофильной сушке каждой аликвоты с центробежным испарителе в течение ночи при 30 ° С. Хранить лиофилизированный пустые пузырьки при -20 ° C.
5. Инкапсуляция транскрипции-трансляции машины
- Смешать компоненты транскрипции-трансляции реакции и добавляют 20 единиц ингибитора РНКазы. Инкубируют на льду.
- Добавить ДНК. Для управления реакцией, 250 нг плазмиды mVenus кодирования или подобный флуоресцентный белок за Т7 промотор транскрипции и сильной E. палочка сайт связывания рибосомы рекомендуется.
- Принесите конечный объем до 25 мкл РНКазы без воды.
- Гидрат аликвоту лиофилизированный пузырьков (с шагом 4,6) с 10 мкл реакционной собранный на шаге 5.3. Кратко вихрь смесь, пока пузырьки не ресуспендированы. Это должно занять менее чем за 30 сек.
- Инкубируйте реакции на льду в течение 30 мин, чтобы позволить везикул к набуханию.
- Развести везикул смесь 20-кратного до конечного объема 30 мкл добавлением 1,5 мкл пузырьков в 27,0 мкл 50 мМ Трис-HCl, 50 мМ NaCl, рН 7,4, и 1,5 мкл 20,2 мг / мл протеиназы К. ДНКазы и РНКазы также могут быть добавлены в этот момент в качестве альтернативы протеиназы К деградировать extravesicular материала.
- Инкубируют в течение по крайней мере 2,5 часа при 37 ° С.
6. Микроскопия
- Изучите пузырьков и ход производства флуоресцентных белков в различные моменты времени. Пузырьков будет иметь больший диаметр, чем 400 нм с размером пор мембраны используются для везикул экструзии.
- Подготовить образец камеры путем размещения 20 х 5 мм кремниевых Spacer на стандартную стекло микроскопа. Пипеткой 10 мкл пузырьков в камере для образца. Наведите силиконизированных покровного стекла на камере.
- Соблюдайте пузырьки с маслом 63X-дисперсионная OR аналогичную цель на светлом поле и флуоресцентной микроскопии с использованием соответствующего набора фильтров для эксплуатируемых флуоресцентный белок.
Результаты
Флуоресцентная микроскопия показывает, что флуоресценция наблюдается только внутри пузырьков, потому extravesicular материал ферментативной деструкции (рис. 3). Для экспрессии mVenus, внутрипузырной флуоресценции начинает наблюдаться через 1,5 ч при 37 ° C и достигает максимума интенсивности флуоресценции в течение 6 часов. Оптимальная температура и время инкубации может варьировать в зависимости от конкретных используемых конструкций. Например, различные флуоресцентные белки зрелых совершенно по-разному в зависимости от температуры образом. Другими словами, наблюдение за продукцию белка зависит не только от после синтеза белка и складной но и на хромофора. Общая синтез белка может быть увеличена за счет включения пор мембранного белка, чтобы обеспечить приток обедненного компоненты, необходимые для транскрипции и трансляции 27.
Рекомендуется проводить аналогичные транскрипции-трансляцииния реакции в отсутствии пузырьков, чтобы эксплуатируемые генетический конструкт функциональным. Этот контроль реакцию легче контролировать с помощью флуоресцентной спектроскопии, а не микроскопии. 4 показан в пробирке транскрипции-трансляции реакции конструкции mVenus кодирования. Неинкапсулированных реакции дают гораздо более высокую общую интенсивность флуоресценции, чем аналогичные внутрипузырном реакций. Это обусловлено эффективность инкапсуляции и потому, что общий объем внутрипузырной намного меньше, чем объем extravesicular (т.е. эффекта разбавления).

Рисунок 1. Роторный испаритель и вакуумный насос. Кликните здесь, чтобы посмотреть увеличенное изображение .

Рисунок 2. Корпус и части экструдера показаны отдельно. Слева направо, шприц, фиксатор гайки, тефлон подшипник, внутренняя мембрана поддерживает с черными уплотнительными кольцами лицом друг к другу, экструдер внешнего корпуса, и второй шприц. Кликните здесь, чтобы посмотреть увеличенное изображение .
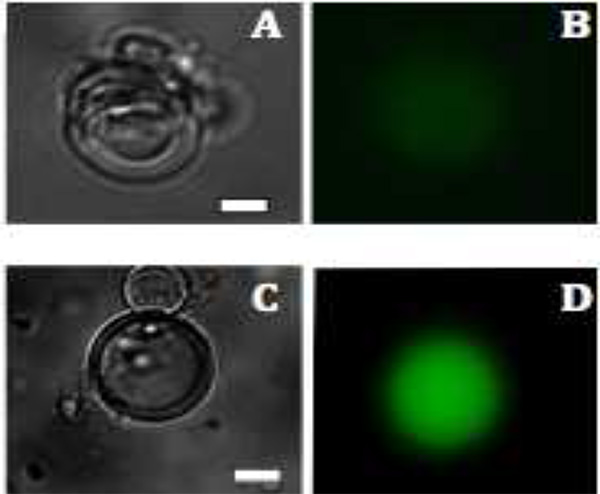
. Рисунок 3 флуоресцентные изображения mVenus производства белков в липосомы и C:.. Яркие образы поля многослойных везикул через 1,5 часа и 2,5 часа и B &# 160; D: производство mVenus визуализируется флуоресценцию (зеленого цвета), после 1,5 и 2,5 ч соответственно. Шкала бар составляет 20 мкм. Кликните здесь, чтобы посмотреть увеличенное изображение .
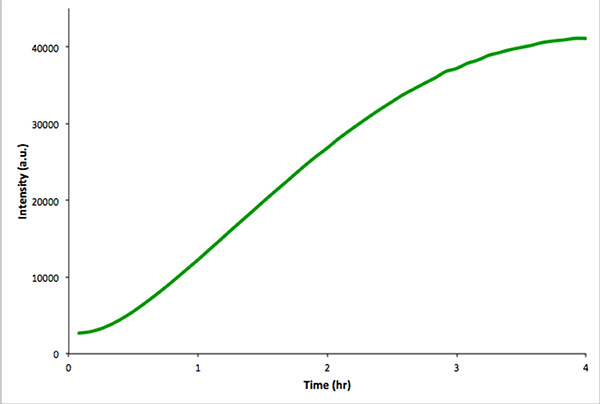
Рисунок 4. В пробирке контроль реакции неинкапсулированных в пробирке транскрипции и трансляции mVenus. Интенсивность флуоресценции измеряли каждые 5 мин в течение 4 час. Данные были получены с Real-Time PCR инструмента. Кликните здесь, чтобы посмотреть увеличенное изображение .
Обсуждение
Хотя бесклеточном синтетическая биология все еще находится в зачаточном состоянии, успехи заложили фундамент, на котором все более сложные клетки-подобные системы могут быть сделаны. Восстановление транскрипции-трансляции техники из полностью определены 9 компонентов внутри пузырьков 28 был особенно значительным в содействии позже усилия в построении искусственного экологические требования cells17, 18. Кроме того, искусственные клетки исследований были использованы для исследования эволюционных процессов 4,29,30, механистический детали синтеза РНК и белка 22,31, влияния метаболических load32, 33, и сборка вирусных частиц 34. Важно отметить, что достаточно знаний существует в настоящее время, что основные клеточные функции могут быть восстановлены внутри пузырьков в лаборатории следующие предыдущих докладов и протоколов, описанных в данном документе.
Помимо того, что легко, описанные инкапсуляции PRocedure имеет ряд преимуществ. Например, многие пустым, лиофилизированный аликвоты везикул могут быть сделаны заранее и хранили при -20 ° С для последующего использования. Протокол не предмет биологических молекул к органическим растворителям, резкими перепадами температуры или длительный период диализа. Мы ожидаем, что мягкость процедура будет способствовать включению дополнительных компонентов по мере необходимости. Мы также не отмечено побочных эффектов для изменения липидного состава мембраны на инкапсуляции или транскрипции-трансляции эффективности. Поэтому, липиды более пригодными для включения мембранных белков, конкретные морфологии, или визуализация, вероятно, может быть использована.
Основным недостатком описанного метода является то, что в результате пузырьки не являются однородными по размеру, ни ламеллярность. Для многих приложений, эти трудности не мешают интерпретацию данных. Тем не менее, при необходимости, дополнительные шаги могут быть включены в узком йэлектронной распределение размеров и снижению слоев мембраны, такие как дальнейших раундов экструзии после инкапсуляции, замораживания-оттаивания или диализ 35. Несомненно лучше методы, которые обойти эти и другие проблемы будут разработаны. До тех пор, пока не найдем Протокол, описанный здесь, хорошо подходит для построения клеточных мимика.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Авторы признают, Armenise-Гарвардского фонда Марии Кюри Трентино COFUND (ACS), Автономной провинции Тренто (ECOMM) и CIBIO для финансирования.
Материалы
| Name | Company | Catalog Number | Comments |
| Quick Spin Mini-prep kit | Qiagen | 27104 | |
| Spectrometer | NanoDrop 1000 | NDB767ND | |
| POPC | Avanti Polar Lipids | 770557 | MW 760 g/mol Transition Temp -2 °C CAS# 26853-31-6 |
| Ethanol | Sigma Aldrich | 459836 | Anhydrous, >99.5% |
| Phenol-choloroform-isoamyl alcohol 25:24:1, for molecular biology use | Sigma Aldrich | P3803-100mL | Saturated with 10 mM Tris, pH 8.0, 1 mM EDTA |
| Chloroform | Biotech Grade Fluka | 496189-1L | Contain ethanol at 0.5-1.0% v/v as stabilizer |
| Brown amber glass bottles | VWR | 89043-518 | 55X 48 mm |
| Rotary evaporator | Buchi Rotovapor R-210/Sigma | Z563846EU-1EA | With jack and water bath, 29/32 joint 240 V |
| Analog vortex mixer | VWR | 945300 | Speed 1,000-3,200 rpm |
| Homogenizer | IKA T10 Basic Ultra-Turbax | 3420000 | |
| Mini-extruder | Avanti Polar Lipids | 610020 | |
| Extruder filters | Whatman | 610014 | drain disc 10 mm |
| Extruder polycarbonate membrane 400 nm | Whatman | 61007 | nuclepore polycarbonate |
| Speed vacuum | Labconco | 7970011 | Centritrap DNA concentrator |
| PURExpress kit | New England Biolabs | NRM #E6800S | |
| RNAse inhibitor (40,000 U/ml) | New England Biolabs | #M0307S | |
| Proteinase K (20.2 mg/ml) | Fermentas | #EO0491 | |
| Microscope | Zeiss Observer Z1with a AxioCam MRm camera | ||
| RealTime | CFX96 Real time PCR Detection System (Biorad) | ||
| Silicon press to seal -Molecular Probe | Life Technologies | P18174 | Resistant from -25-30 °C |
| Siliconized glass circle cover slides | Hampton Research | HR3-231 | Diameter= 22 mm |
| ImageJ | NIH |
Ссылки
- Forster, A. C., Church, G. M. Towards synthesis of a minimal cell. Mol. Syst. Biol. 2, 1-10 (2006).
- Noireaux, V., Maeda, Y. T., Libchaber, A. Development of an artificial cell, from self-organization to computation and self-reproduction. Proc. Natl. Acad. Sci. U.S.A. 108, 3473-3480 (2011).
- Harris, D. C., Jewett, M. C. Cell-free biology: Exploiting the interface between synthetic biology and synthetic chemistry. Curr. Opin. Biotech. 23, (2012).
- Nishikawa, T., Sunami, T., Matsuura, T., Yomo, T. Directed Evolution of Proteins through In Vitro Protein Synthesis in Liposomes. J. Nucleic Acids. 2012, 1-11 (2012).
- Forlin, M., Lentini, R., Mansy, S. S. Cellular imitations. Curr. Opin. Chem. Biol. 16, 586-592 (2012).
- Chiarabelli, C., Stano, P., Anella, F., Carrara, P., Luisi, P. L. Approaches to chemical synthetic biology. FEBS Lett. 586, 2138-2145 (2012).
- Noireaux, V., Shin, J. Efficient cell-free expression with the endogenous E. Coli RNA polymerase and sigma factor 70. J. Biol. Eng. 4, 1-9 (2010).
- Fujiwara, K., Nomura, S. -. i. M. Condensation of an Additive-Free Cell Extract to Mimic the Conditions of Live Cells. PLoS ONE. 8, e54155 (2013).
- Shimizu, Y., et al. Cell-free translation reconstituted with purified components. Nat. Biotechnol. 19, 751-755 (2001).
- Hosoda, K., et al. Quantitative Study of the Structure of Multilamellar Giant Liposomes As a Container of Protein Synthesis Reaction. Langmuir. 24, 13540-13548 (2008).
- Sunami, T., Matsuura, T., Suzuki, H., Yomo, T. Synthesis of Functional Protiens Within Liposomes. Methods Mol. Biol. 607, 243-256 (2010).
- Murtas, G., Kuruma, Y., Bianchini, P., Diaspro, A., Luisi, P. L. Protein synthesis in liposomes with a minimal set of enzymes. Biochem. Biophys. Res. Commun. 363, 12-17 (2007).
- Pereira de Souza, T., Stano, P., Luisi, P. L. The Minimal Size of Liposome-Based Model Cells Brings about a Remarkably Enhanced Entrapment and Protein Synthesis. ChemBioChem. 10, 1056-1063 (2009).
- Caschera, F., et al. Programmed Vesicle Fusion Triggers Gene Expression. Langmuir. 27, 13082-13090 (2011).
- Noireaux, V., Bar-Ziv, R., Godefroy, J., Salman, H., Libchaber, A. Toward an artificial cell based on gene expression in vesicles. Phys. Biol. 2, P1-P8 (2005).
- Shin, J., Noireaux, V. An E. coli Cell-Free Expression Toolbox: Application to Synthetic Gene Circuits and Artificial Cells. ACS Synth. Biol. 1, 29-41 (2012).
- Kobori, S., Ichihashi, N., Kazuta, Y., Yomo, T. A controllable gene expression system in liposomes that includes a postive feedback loop. Mol. Syst. Biol. 9, 1282-1285 (2013).
- Martini, L., Mansy, S. S. Cell-like Systems with Riboswitch Controlled Gene Expression. Chem. Commun. 47, 10734-10736 (2011).
- Noireaux, V., Bar-Ziv, R., Libchaber, A. Principles of cell-free genetic circuit assembly. Proc. Natl. Acad. Sci. U.S.A. 100, 12672-12677 (2003).
- Sunami, T., et al. Detection of Association and Fusion of Giant Vesicles Using a Fluorescence-Activated Cell Sorter. Langmuir. 26, 15098-15103 (2010).
- Saito, H., et al. Time-Resolved Tracking of a Minimum Gene Expression System Reconstituted in Giant Liposomes. ChemBioChem. 10, 1640-1643 (2009).
- Lentini, R., et al. Fluorescent Proteins and in Vitro Genetic Organization for Cell-Free Synthetic Biology. ACS Synth. Biol. , (2013).
- Du, L., Villarreal, S., Forster, A. C. Multigene Expression In Vivo: Supremacy of Large Versus Small Terminators for T7 RNA Polymerase. Biotechnol. Bioeng. 109, 1043-1050 (2011).
- Trochilin, V. P., Weissig, V. . Liposomes: A Practical Approach. , (2003).
- Walde, P., Cosentino, K., Engel, H., Stano, P. Giant vesicles: preparations and applications. ChemBioChem. 11, 848-865 (2010).
- Sambrook, J., Russell, D. W. . Molecular Cloning. , (2001).
- Noireaux, V., Libchaber, A. A vesicle bioreactor as a step toward an artificial cell assembly. Proc. Natl. Acad. Sci. U.S.A. 101, 17669-17674 (2004).
- Yu, W., et al. Synthesis of Functional Protein in Liposome. J. Biosci. Bioeng. 92, 590-593 (2001).
- Caschera, F., et al. Stable vesicles composed of monocarboxylic or dicarboxylic fatty acids and trimethylammonium amphiphiles. Langmuir. 27, 14078-14090 (2011).
- Pereira de Souza, T., Steiniger, F., Stano, P., Fahr, A., Luisi, P. L. Spontaneous crowding of ribosomes and proteins inside vesicles: a possible mechanism for the origin of cell metabolism. ChemBioChem. 12, 2325-2330 (2011).
- Niederholtmeyer, H., Xu, L., Maerkl, S. J. Real-Time mRNA Measurement during an in Vitro Transcription and Translation Reaction Using Binary Probes. ACS Synth. Biol. 10, (2012).
- Stögbauer, T., Windhager, L., Zimmer, R., Rädler, J. Experiment and mathematical modeling of gene expression dynamics in a cell-free system. Integr. Biol. 4, 494-501 (2012).
- Lazzerini-Ospri, L., Stano, P., Luisi, P., Marangoni, R. Characterization of the emergent properties of a synthetic quasi-cellular system. BMC Bioinformatics. 13, 1-10 (2011).
- Shin, J., Jardine, P., Noireaux, V. Genome Replication, Synthesis, and Assembly of the Bacteriophage T7 in a Single Cell-Free Reaction. ACS Synth. Biol. 1, 408-413 (2012).
- Zhu, T. F., Szostak, J. W. Preparation of Large Monodisperse Vesicles. PLoS ONE. 4, 1-4 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены