Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Генерация и очистка человека INO80 хроматина комплексов и подкомплексов
В этой статье
Резюме
Этот протокол описывает процедуру для генерации и очистки дикого типа и мутантных версий человеческого INO80 хроматина комплекса. Эпитопов помечены варианты субъединиц INO80 стабильно экспрессируются в клетках НЕК293, и полные комплексы и комплексы, не имеющие конкретные наборы субъединицы очищают иммуноаффинной хроматографии.
Аннотация
INO80 хроматина комплексы регулируют нуклеосом динамику и доступность ДНК катализирует АТФ-зависимый нуклеосом ремоделирования. Человеческие комплексы INO80 состоять из 14 белковых субъединиц, включая Ino80, в SnF2-как АТФ-азы, которая служит и как каталитической субъединицы и эшафот для сборки комплексов. Функции других подразделений и механизмы, с помощью которых они вносят вклад в хроматина деятельности INO80 комплекса остаются плохо понятыми, частично в связи с проблемой генерации INO80 узлы в клетках человека или гетерологичных системах экспрессии. Этот протокол JOVE описывает процедуру, позволяющую очистку человека INO80 хроматина подкомплексов, которых не хватает субъединицу или подмножество субъединиц. N-терминальной ФЛАГ эпитоп помечены Ino80 кДНК стабильно вводится в человеческой эмбриональной почки (НЕК) 293 клеточных линий с использованием Flp-опосредованной рекомбинации. В том случае, если подмножество субъединиц INO80 комплекс бэ удален, один выражает вместо мутантные белки Ino80, которые не имеют платформу, необходимую для сборки этих субъединиц. В случае индивидуальный субъединица, будут исчерпаны, один transfects миРНК в интересах этой субъединицы в НЕК 293 клеточной линии, стабильно экспрессирующие FLAG помечены Ino80 АТФазы. Ядерные экстракты получают, и FLAG иммунопреципитацию выполняется для обогащения белковые фракции, содержащие производные Ino80. Композиции очищенной INO80 подкомплексов затем могут быть проанализированы с использованием таких методов, как иммуноблоттинга, окрашиванием серебром и масс-спектрометрии. В INO80 и INO80 подкомплексы генерируемые в соответствии с этим протоколом можно дополнительно проанализированы с использованием различных биохимических анализов, которые описаны в протоколе сопроводительной Юпитера. Методы, описанные здесь, могут быть адаптированы для исследований структурных и функциональных свойств любого млекопитающего мульти-субъединицы хроматина и модифицирующих комплексов.
Введение
Эволюционно консервативные SnF2 семейные хроматина комплексы являются ключевыми регуляторами организации хроматина и ДНК доступности 1. Эти ремоделирования комплексы всегда включать в себя центральный SNF2-как АТФазную субъединицы, которая, в некоторых случаях, собирает с различными вспомогательными белками и образует макро-молекулярных ансамблей из множества субъединиц. Для изучения молекулярных детали процесса ремоделирования хроматина АТФ-зависимой, важно понять вклад заданных подмножеств субъединиц и / или доменных структур в деятельности комплексов. Такие анализы требуют способность генерировать высокоочищенные мутантные комплексы, которые не имеют особых белковых субъединиц или доменные структуры.
Предыдущие исследования структурно-функциональной организации АТФ-зависимых ремоделирования хроматина комплексов широко сосредоточены на дрожжи модельной системы в связи с повышенной манипулируемости генома дрожжей (см, например, в работах 1-4). Учитывая сохранениеСостав субъединицы и функциональность среди ортологичных ремоделирования комплексов, исследования структуры и функции дрожжей ремоделирования комплексов, стал важным вкладом в их коллегами в высших эукариот. Тем не менее, заметные конкретным видам различия между ремоделирования комплексов существуют, в результате прибыль или убыток от конкретного вида субъединиц, прибыль или убыток от видовой определенных доменов сохраняющихся субъединиц, и изменчивости последовательности внутри консервативных областей сохраняющихся субъединиц. Такие различия могут быть в принципе обусловлена необходимостью для высших эукариотических клеток адаптироваться к новым молекулярных и клеточных средах. Таким образом, понимание того, как подразделения высших эукариот ремоделирования комплексов способствовать нуклеосомнои процесса ремоделирования является ценным, потому что это не только проливает свет на основные механизмы АТФ-зависимый процесс ремоделирования хроматина, но и могут предоставить ценную информацию о механизмах, с помощью которых структура хроматина и экспрессии генов в теплицаее эукариоты регулируются.
До сих пор, там были только ограничены структурные и функциональные исследования нескольких субъединиц млекопитающих ремоделирования хроматина комплексов, отчасти с трудностями в получении биохимически определенные хроматина комплексов и подкомплекса. Мы частично обойти эти трудности с процедурами, описанными ниже, в которых очистка иммуноаффинная используется для подготовки нетронутыми INO80 или INO80 подкомплекса из человеческих клеток, стабильно экспрессирующих N-терминальной ФЛАГ эпитоп помечены дикого типа или мутантные версии Ino80 5-7 (Рисунок 1) . Чтобы получить интактные INO80 комплексов из клеток человека, FLP-опосредованной рекомбинации используется для генерации трансгенных клеточных линий HEK293, стабильно экспрессирующих эпитоп FLAG с тегом кДНК, кодирующие субъединицы комплекса INO80 8-10. Потому что над-выражение INO80 субъединиц может быть ядовиты, необходимо изолировать и поддерживать клонированных клеточных линий под селективного сотрудничестваnditions обеспечить стабильную экспрессию трансгена в течение многих пассажей, необходимых для расширения культур крупномасштабных клеток. Для получения более мелких подкомплекса INO80, которые содержат только подмножество субъединиц, мы успешно использовали два подхода (2А, Б). В первый, мы генерируем HEK293 Flp-в клеточных линиях, стабильно экспрессирующие мутантные версии Ino80, которые не имеют домены, необходимые для взаимодействия с конкретными подразделениями 5. Кроме того, миРНК-обусловленный нокдаун используется истощать нужный субъединицы от клеток, экспрессирующих соответствующий FLAG-меткой INO80 субъединицы (неопубликованные данные). Наконец, для очистки комплексов INO80 человека, флаг агарозы на основе хроматографии 11 используется для обогащения в INO80 фракцию, содержащую от нуклеарных экстрактов, посредством этого эффективно уменьшая присутствие загрязняющих цитозольных белков в конечном фракции, содержащие очищенный INO80 или INO80 подкомплексов.
протокол
1 поколение и культура НЕК293 стабильных клеточных линий, экспрессирующих Full Length или мутантного версий FLAG эпитопа с метками Ino80 или другие INO80 Комплексные Подразделения
- Клон кДНК, кодирующей полную длину или мутантный человеческий Ino80 АТФазы или другой INO80 субъединицы в вектор млекопитающего выражение pcDNA5 / FRT с в рамке, N терминала ФЛАГ эпитопной меткой.
- Подтвердите последовательность вставленных кДНК путем секвенирования ДНК, прежде чем приступить.
- Для выполнения трансфекции, растут FLP-В клеток НЕК293 в 10 см чашки для культивирования тканей в среде, содержащей DMEM (среда Игла в модификации Дульбекко), 5% глутамина, и 10% FBS (фетальная бычья сыворотка).
- Когда клетки достигают ~ 70% слияния, добавить в каждую чашку для культивирования тканей смесь 40 мкл реагента для трансфекции FuGENE6, 0,5 мкг соответствующей pcDNA5 / FRT плазмиды экспрессии, и 9,5 мкг pOG44, который кодирует Flp рекомбиназу, в общем объеме 800 мкл.
- 48 час спустя, Trypsinize и сПлит клетки в соотношении 1:30 на 10 блюд см, и вырастить их в DMEM с 5% глютамина, 10% FBS, и 100 мкг / мл гигромицина в течение 3 - 4 недель. Измените культуральной среды, когда она начинает желтеть (как правило, каждые 3 - 5 дней).
- Для выявления положительных клонов, которые выражают высокий уровень FLAG-меткой белка, выберите индивидуальный гигромицина устойчивых колоний и передавать их в одном лунку 24-луночного планшета.
- После того, как клетки достигают 80% слияния, урожай клеток из каждой лунки в ~ 1 мл PBS и гранул путем центрифугирования при 1000 х г в течение 5 мин.
- После удаления супернатанта, ресуспендируют осадок клеток в 60 мкл SDS-PAGE образца буфера.
- Тема половина ресуспензированной осадка клеток к SDS странице и вестерн-блоттинга для мониторинга экспрессии ФЛАГ помечены приманки белка; сохранить другую половину для будущего анализа.
- Если нет FLAG-меткой человеческий белок Ino80 не обнаружено в клеточных лизатов, расширить первоначальный клональную попу клетокнодательство в дальнейшем путем посева клеток из отдельных лунках 24-луночного планшета в 15 см чашки для культивирования тканей.
- Для уборки клетки от 15 см чашки, ресуспендируют ближайшем сливающихся клеток в лед холодной PBS и переносят в 50 мл коническую трубку.
- Довести до конечного объема 50 мл путем добавления дополнительного PBS.
- Гранул клетки при 1000 х г в течение 5 мин, и удалить как можно больше супернатанта.
- Ресуспендируют осадок клеток в 1 мл Lys450 буфере (20 мМ HEPES-NaOH рН 7,9, 450 мМ NaCl, 0,5% Тритон Х-100, 10 мМ KCl, 4 мМ MgCl2, 0,2 мМ ЭДТА, 10% глицерина, 1 мМ ДТТ, 200 мкМ PMSF, и 1: 1000 ингибитор протеазы коктейль).
ПРИМЕЧАНИЕ: здесь и в других местах, всегда добавить DTT, PMSF, и коктейль ингибиторов протеаз в буферов непосредственно перед началом эксперимента. - Иммуно-осадок FLAG-меткой белки из полученного всей клеточного лизата с помощью 20 мкл анти-FLAG агарозном геле, и анализировать флаг элюаты от вестерн-блоттинга. [Для получения дополнительной информации о ImmunПроцедура oprecipitation см шаг 5]
- Подготовьте замороженные запасы желаемых клональных клеточных линий 12 и не хранить их в жидком азоте до использования.
2. Растущие HEK293 Клеточные линии в роллер-флаконах
Для крупномасштабного из INO80 комплексов, культуры клеток в 10 - 20 вращающихся флаконах; Типичный выход из каждой бутылки ролика составляет ~ 1 мл эритроцитарной.
- Для каждого флакона роликового, добавьте 200 мл DMEM, 5% глутамина и 10% сыворотки теленка, не гигромицину В.
- Перевести все клетки из одного почти сливной 15 см блюдо в каждой бутылке ролика
- Место бутыли в 37 ° бутылки инкубатора C ролика и повернуть на 0,2 оборотов в минуту.
- После того, как клетки достигают ~ 70% слияния, слейте и выбросьте среду.
- Добавить ~ 50 мл охлажденного льдом PBS в каждую бутылку. Проведение бутылки горизонтально, нежно вихревой ослабить клеточный монослой.
- Трансфер ресуспендированные клетки до 250 мл пластмикросхемы конические бутылки и место на льду.
- Промыть роликовые бутылки с дополнительной PBS и передача его последовательно от бутылки к бутылке. Когда промывочный раствор уже не ясно (как правило, после того, как используется для полоскания около 5 бутылок), добавить его к клеточной суспензии.
- Гранул клетки центрифугированием при 400 мкг в течение 10 мин.
- Аккуратно ресуспендирования клеток в PBS, объединить их в единый 250 мл коническую бутылки, а не держать на льду до дальнейшей обработки.
3 миРНК опосредованного Нокдаун INO80 субъединиц в клетках, экспрессирующих другим флагом с метками INO80 субъединицу
Для получения INO80 подкомплекса недостающие одного субъединицы, использование FLAG-иммуноочистки очистить INO80 комплексы из миРНК обработанных клеток или клеток, стабильно экспрессирующих ShRNA. "Обратный" миРНК (малых интерферирующих РНК) протокол трансфекции описано здесь оптимизирован для НЕК293, растущих в 15 см чашки. Протокол для одного 15 см чашку клеток и ShoÜLD быть расширены, соответственно, в зависимости от числа клеток, необходимых. Чтобы подготовить биохимически полезные количества INO80 комплекса с миРНК обработанных клеток, следует увеличить до культур, выращенных в 40 см чашки 15; это получается примерно 2 - 4 мл упакованных гранул клеток.
- Grow клеток НЕК293, стабильно экспрессирующих желаемый субъединицу INO80 комплекса почти до слияния в 15 см чашки.
- Добавить объем миРНК ресуспендирующего буфера (20 мМ KCl, 6 мМ HEPES, рН 7,5-и 0,2 мМ MgCl2), достаточных для получения 50 мкМ исходного раствора миРНК в пробирку, содержащую лиофилизированную миРНК. Внесите решение вверх и вниз несколько раз, и инкубировать на nutator в течение 30 мин при комнатной температуре, чтобы обеспечить миРНК полного растворения.
- Подготовьте трансфекции коктейль, содержащий миРНК и реагента для трансфекции. Смешайте 10 мкл 50 мкМ миРНК раствора с 32 мкл Lipofectamine RNAiMAX и добавить его в 4 мл Opti-MEM Снижение сыворотки среде с очень осторожного перемешивания; альНизкие все реагенты для уравновешивания до комнатной температуры перед использованием.
- Выдержите смесь при комнатной температуре в течение 30 мин.
- Подготовка FLP-В клеток НЕК293, стабильно экспрессирующих желаемый INO80 субъединицу для трансфекции.
- При инкубации Шаг 3,4, мыть клетки в 15 см чашки один раз РТ PBS.
- После удаления PBS, лечить клетки с 1 мл трипсина просто пока они не начинают отрываться от пластины.
- Сразу добавляют 10 мл полной среды (DMEM + 5% глютамин + 10% FBS), чтобы трипсинизируют клетки и аккуратно перемешать. Собирают клетки центрифугированием при 1000 х г в течение 5 мин при комнатной температуре.
- Ресуспендируют осадок клеток в ~ 4 мл полной среды, и подсчитать клеток ресуспендирование помощью гемоцитометра.
- Развести клетки с полной среде до концентрации ~ 5,4 × 10 6 / мл.
- Для каждого 15 см блюдо, добавить 15 мл полной среды культуры с последующим 4 мл трансфекции коктейля. Вихревой аккуратно, чтобы обеспечить средний и трансфекции коктейль Thoroughly смешиваются. Наконец, добавьте один мл клеточной суспензии и снова вихревой нежно разогнать клетки равномерно.
- После 60 часов культуры в 37 ° C, 5% CO 2 инкубаторе, аккуратно удалите среду, Ресуспендируют клеток в лед холодной PBS, и немедленно приступить к подготовке ядерных экстрактов.
4 Получение ядерных экстрактов
Эта процедура была модифицирована из протокола Dignam 13 и можно масштабировать вверх или вниз в зависимости от размера исходного осадка клеток. Как правило, 1 мл упакованных урожайности осадок клеток в 1 мл конечного ядерного экстракта. Все буферы должны быть ледяным, и все шаги должны быть выполнены в холодном помещении или на льду, если подходящий холодно номер не доступен.
- Выделение ядер:
- Аккуратно перенести клетки с соответствующим размером (15 или 50 мл) градуированный коническую трубку и спина при 1000 х г в течение 10 мин при 4 ° С.
- Удалить супернатант, и измерить объем упакованного клеток PELпусть. 1 мл эритроцитарной соответствует ~ 3 х 10 8 НЕК293.
- Добавить 5 упакованных клеток объемов буфера (10 мМ HEPES, рН 7,9, 1,5 мМ MgCl 2, 10 мМ KCl и недавно добавляли 1 мМ ДТТ, 200 мкМ PMSF, и 1: 1000 ингибитор протеазы коктейль). Ресуспендируют осадок клеток осторожно пипеткой.
- Выдержите на льду в течение ровно 10 мин.
- Гранул клетки при 1000 х г в течение 10 мин при 4 ° С, и удалить надосадочную жидкость.
- Размер клеточного осадка следует увеличить до 2-кратного во время инкубации в буфере А.
- Ресуспендируют клеток в двух объемах упакованных клеток в буфере А, и передачи клеточной суспензии соответствующего размера тканевом гомогенизаторе Даунса. Если, начиная с менее чем 2 мл эритроцитарной, использовать 7 мл гомогенизатора; для 2 - 4 мл, упакованных клеток, использовать 15 мл гомогенизатора; и в течение 10 или более мл упакованных клеток, используют 40 мл гомогенизатора.
- Гомогенизируют клеточной суспензии с рыхлой стеклянным пестом в Dounce гомогенизатора ООНсезам, 90% клеток окрашиваются положительно с 1% трипанового синего.
- Трансфер суспензии в 45 мл высокоскоростного центрифужную пробирку и спина при 25000 мкг в течение 20 мин при 4 ° С в JA-17 или аналогичного ротора (см таблицу материалов / оборудования).
- Из ядерного гранул, удалить супернатант, который содержит цитозольных белков или белков, которые вытекать из ядра в ходе фракционирования.
- Извлечение ядра с солью:
- Добавить буфера С (20 мМ HEPES, рН 7,9, 25% глицерина, 1,5 мМ MgCl2, 0,2 мМ ЭДТА, и недавно добавляли 1 мМ ДТТ, 200 мкМ PMSF и 1: 1000 коктейль ингибитора протеазы) в ядерной гранул; использовать 2,5 мл буфера C на каждые 3 мл начиная гематокрита (~ 1 х 10 9 клеток).
- Использование стеклянной палочки или пипетки, сместить ядерного осадок от стенки трубы и передать всю смесь в гомогенизатор Dounce соответствующего размера.
- Ресуспендируют ядра путем гомогенизации йэ смесь с двух ударов рыхлого пестиком.
- Передача ресуспендировали ядерной фракции в охлажденный стакан. Выбор стакан таким образом, что подвеска будет заполнить стакан по крайней мере, 0,5 см в глубину.
- Чтобы извлечь ядерные белки из хроматина или других нерастворимых структур, постепенно увеличивать концентрацию соли в суспензии 0,42 М NaCl добавлением по каплям 5 М NaCl при осторожном перемешивании в суспензию с помощью пипетки или стеклянной палочкой на льду; Как только все 5 М NaCl был добавлен раствор должен стать очень вязкой или гелеобразный. Рассчитать объем 5 М NaCl необходимо довести раствор до конечной концентрации 0,42 М NaCl в соответствии со следующей формулой:
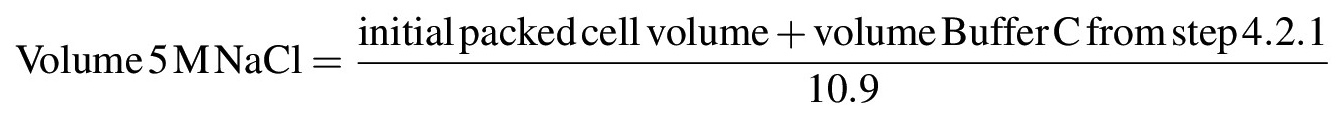
- Тщательно передачи вязкой суспензии в 10 мл поликарбонатные пробирки для Type 70,1 Ti ротора (или эквивалент) или 70 мл бутыли из поликарбоната для Тип 45 Ti Oг аналогичный ротор (см таблицу материалов / оборудования). Плотно прилегают парафильмом при использовании 10 мл пробирок или с крышкой сборки при использовании 70 мл бутылки.
- Медленно рок запечатанные пробирки при 4 ° С в течение 30 мин с использованием nutator.
- Спин образцов в Тип 45 Ti или 70,1 Ti роторе в течение 30 мин при 120000 х г при 4 ° С.
- Передача супернатант к одной пластиковой трубки или бутылки. Этот супернатант ядерный экстракт и осадок содержит хроматин и другие атомные мусора.
- Разделите ядерного экстракта в подходящего размера аликвоты, заморозить его в жидком азоте, и хранить его при температуре -80 ° C.
5 Иммуноаффинная Очистка человека INO80 или INO80 подкомплексов
- Для размораживайте ядерного экстракта, место трубки не содержащие экстракт на настольных или рулонных труб между руками, пока замороженного материала становится взвесь. Затем поместите пробирки на лед или в холодную комнату, пока экстракт не полностью тhawed.
- Передача талой ядерного экстракта до 10 мл поликарбонат ультрацентрифуге труб, и спина при 100000 х г в течение 20 мин при 4 ° С в 70,1 Тип Ti ротора или его эквивалент, чтобы удалить осадок, который может образоваться во время цикла замораживания-оттаивания.
- Перенести супернатант в 15 мл коническую пробирку. Добавить свежий ДТТ, PMSF и ингибитор протеазы коктейль до конечных концентраций 1 мМ ДТТ, 200 мкМ PMSF, и 1: 1000 ингибитор протеазы коктейль.
- Для подготовки анти-FLAG агарозы для иммуноочистки, передать 200 мкл 50% суспензии анти-FLAG агарозы в 1,5 мл микроцентрифужных трубки с помощью P200 или аналогичную пипетку с наконечником из которого конец был отрезан с чистого скальпеля или лезвие бритвы.
- Гранул бусы центрифугированием в настольной микроцентрифуге в 8000 мкг в течение 30 сек. Удалить супернатант и мыть шарики ресуспендированием бусинки в 1 мл Lys450 буфера, и осаждения бусы на 8000 мкг в течение 30 сек. Вымойте бEADS еще два раза.
- Ресуспендируют вымытые анти-FLAG агарозном бисером в около 100 мкл ядерной экстракта с помощью P200 или аналогичный регулируемый объем пипетки с наконечником из которого конец был отрезан с чистой скальпелем или бритвенным лезвием и, используя тот же наконечник, передачи ресуспендированные шарики к 15 мл коническую пробирку, содержащую экстракт. Повторите несколько раз, пока все бусины не были переданы в 15 мл трубки.
- Инкубируют экстракт / шарик смесь в течение 4 ч при 4 ° С с медленным вращением в лабораторном ротатора. ДОПОЛНИТЕЛЬНО: Включить Benzonase в концентрации 25 ед / мл, чтобы удалить загрязнения ДНК.
- Соберите FLAG агарозы путем центрифугирования при 1000 мкг в течение 5 мин при 4 ° С.
- Ресуспендируют в 10 мл Lys450 мыть, инкубировать 5 мин при 4 ° С с нежным качалки на nutator. Гранул бусы на 1000 мкг в течение 5 мин при 4 ° С.
- Ресуспендируют в 100 - 150 мкл Lys450 и передачи шарики до 1,5 мл микроцентрифужных трубки. Continue не полоскать 15 мл коническую трубку с 100 - 150 мкл Lys450, пока все шарики были переданы в микроцентрифужных трубки.
- Спин вниз шарики в 8000 х г в течение 30 сек при 4 ° С в микроцентрифуге. Промыть три раза больше 1 мл Lys450 и один раз 1 мл EB100 буфере (10 мМ HEPES рН 7,9, 10% глицерина, 100 мМ NaCl, 1,5 мМ MgCl2, 0,05% Тритон Х-100, и недавно добавляли 1 мМ ДТТ, 200 мкМ PMSF , и 1: 1000 ингибитор протеазы коктейль).
- Для элюирования связанные белки, добавьте 200 мкл EB100 буфер, содержащий 0,25 мг / мл 1x FLAG пептид. Выдержите 30 минут при 4 ° С каждого на nutator.
- Гранул шарики в 8000 х г в течение 30 сек при 4 ° С в микроцентрифуге. Передача супернатант, который содержит элюированной INO80 комплекс, в свежую пробирку микроцентрифужных.
- Повторите элюирование еще четыре раза, и объединить все супернатанты в одной пробирке.
- Для удаления остаточного FLAG-агарозном бисером из элюированной фракции белка,пройти элюата через пустой колонке спина.
- Концентрат элюированной фракции белка ~ 10 раз с помощью ультра центробежного устройства фильтра (50000 молекулярная масса отсечки).
- Снять флаг пептид, пройти концентрированной фракции белка последовательно через две колонки обессоливания.
- Разделить очищенный, обессоливают белковую фракцию в 20 мкл аликвоты, замораживали в жидком азоте и хранили при -80 ° C.
- Анализ субъединицы состав INO80 или INO80 подкомплексов на серебряных окрашенных гелей или вестерн-блоттинга, и оценить их концентрации на полуколичественного Вестерн-блоттинга с использованием препаратов рекомбинантных INO80 субъединиц с известной концентрацией в качестве стандартов.
Результаты
На рисунке 1 показана блок-схема с кратким процедуры, используемые для генерации, очистить, и характеризуют человека INO80 АТФ-зависимых хроматина комплексов.
Как показано на рисунках 2 и 3, эти процедуры позволяют получать излучение как дикого т?...
Обсуждение
Структурные и функциональные исследования нескольких субъединиц млекопитающих ремоделирования хроматина комплексов из высших эукариот были мешали трудности подготовки биохимически полезные количества таких комплексов, содержащих мутантные субъединицы или вообще отсутствуют нек...
Раскрытие информации
Авторы заявляют, что они не имеют конкурирующие финансовые интересы.
Благодарности
Работа в лаборатории авторов поддерживается грантом Национального института общих медицинских наук (GM41628) и грантом на Stowers института медицинских исследований от Фонда Хелен Нельсон медицинских исследований в Общественный фонд Greater Канзас-Сити.
Материалы
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagle Medium | Cellgro | 10-013-CV | |
| Glutamax-I (stablized glutamine) | Life Technologies | 35050-079 | |
| Fetal Bovine Serum | SAFC | 12176C | |
| FuGENE6 transfection reagent | Promega | E2312 | |
| Hygromycin B, sterile in PBS | AG Scientific | H-1012-PBS | |
| pcDNA5/FRT vector | Life Technologies | V6010-20 | |
| Flp-In HEK293 cells | Life Technologies | R780-07 | |
| pOG44 Flp-Recombinase Expression Vector | Life Technologies | V600520 | |
| EZview Red ANTI-FLAG M2 Affinity Gel | Sigma | F2426 | |
| calf serum | SAFC | 12138C | |
| TARGETplus SMARTsiRNA pool | Dharmacon / Thermo Scientific | various | |
| 5x siRNA resuspension buffer | Dharmacon / Thermo Scientific | #B-002000-UB-100 | |
| Lipofectamine RNAiMAX | Life Technologies | 13778 | |
| Opti-MEM Reduced Serum Medium | Life Technologies | 51985-091 | |
| PBS | Cellgro | 45000 | VWR |
| TrypLE (trypsin) | Life Technologies | 12604 | |
| 1x FLAG Peptide | Sigma | F3290 | |
| Micro Bio-Spin Chromatography Column | Bio-Rad | 737-5021 | |
| Amicon Ultra Centrifugal Filter Device (50k MWCO) | Amicon | UFC805024 | Fisher Scientific |
| Zeba Desalting Columns | Thermo Scientific | 89882 | |
| Anti-FLAG M2 antibody, mouse | Sigma | F3165 | |
| Anti-FLAG M2 antibody, rabbit | Sigma | F7425 | |
| Protease Inhibitor Cocktail | Sigma | P8340 | |
| benzonase | Novagen | 70664 | |
| Equipment | |||
| JS-4.2 rotor in a J6 centrifuge | Beckman-Coulter | 339080 | |
| JA-17 rotor | Beckman-Coulter | 369691 | |
| 10 ml polycarbonate tubes | Beckman-Coulter | 355630 | |
| 70 ml polycarbonate bottles | Beckman-Coulter | 355655 | |
| Type 45 Ti rotor | Beckman-Coulter | 339160 | |
| Type 70.1 Ti rotor | Beckman-Coulter | 342184 | |
| BD Clay Adams Nutator Mixer | BD Diagnostics | 15172-203 | VWR |
| Glas-Col Tube/Vial Rotator | Glas-Col | 099A RD4512 | |
| PCR thermal cycler PTC 200 | MJ Research | PTC 200 | |
| roller bottle incubator | Bellco biotechnology | 353348 | |
| Immobilon-FL Transfer Membrane 7 x 8.4 | Millipore | IPFL07810 | |
| lubricated 1.5 ml microcentrifuge tubes | Costar | 3207 | |
Ссылки
- Clapier, C. R., Cairns, B. R. The biology of chromatin remodeling complexes, Annual Review of Biochemistry. 78, 273-304 (2009).
- Szerlong, H., Hinada, K., Viswanathan, R., Erdjument-Bromage, H., Tempst, P., Cairns, B. R. The HSA domain binds nuclear actin-related proteins to regulate chromatin-remodeling ATPases. Nature Struct. Mol. Biol. 15 (5), 469-476 (2008).
- Shen, X., Mizuguchi, G., Hamiche, A., Wu, C. A chromatin remodelling complex involved in transcription and DNA processing. Nature. 406 (6795), 541-544 (2000).
- Shen, X., Ranallo, R., Choi, E., Wu, C. Involvement of actin-related proteins in ATP-dependent chromatin remodelling. Mol. Cell. 12, 147-155 (2003).
- Chen, L., et al. Subunit organization of the human INO80 chromatin remodeling complex: an evolutionarily conserved core complex catalyzes ATP-dependent nucleosome remodeling. Journal of Biological Chemistry. 286 (13), 11283-11289 (2011).
- Sauer, B. Site-specific recombination: developments and applications. 5 (5), 521-527 (1994).
- Gorman, S., Fox, D. T., Wahl, G. M. Recombinase-mediated gene activation and site-specific integration in mammalian cells. Science. 251 (4999), 1351-1355 (1991).
- Jin, J., et al. A mammalian chromatin remodeling complex with similarities to the yeast INO80 complex. Journal of Biological Chemistry. 280 (50), 41207-41212 (2005).
- Cai, Y., et al. YY1 functions with INO80 to activate transcription. Nature Structural and Molecular Biology. 14 (9), 872-874 (2007).
- Yao, T., et al. Distinct Modes of Regulation of the Uch37 Deubiquitinating Enzyme in the Proteasome and in the Ino80 Chromatin-Remodeling Complex. Mol.Cell. 31 (6), 909-917 (2008).
- Brizzard, B. L., Chubet, R. G., Vizard, D. L. Immunoaffinity purification of FLAG epitope-tagged bacterial alkaline phosphatase using a novel monoclonal antibody and peptide elution, Biotechniques. 16 (4), 730-735 (1994).
- Barker, K. . At the Bench: A Laboratory Navigator. 10, 207-245 (2005).
- Dignam, J. D., Lebovitz, R. M., Roeder, R. G. Accurate transcription initiation by RNA polymerase II in a soluble extract from isolated mammalian cell nuclei. Nucleic. Acids. Res. 11 (5), 1475-1489 (1983).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены