Method Article
EPA Метод 1615. Измерение энтеровирус и Норовирус встречаемости в воде культуры и РТ-КПЦР. II. Итого культивируемых Вирус Анализ
В этой статье
Erratum Notice
Резюме
Here we present a procedure to measure total culturable viruses using the Buffalo Green Monkey kidney cell line. The procedure provides a standardized tool for measuring the occurrence of infectious viruses in environmental and drinking waters.
Аннотация
A standardized method is required when national studies on virus occurrence in environmental and drinking waters utilize multiple analytical laboratories. The U.S Environmental Protection Agency’s (USEPA) Method 1615 was developed with the goal of providing such a standard for measuring Enterovirus and Norovirus in these waters. Virus is concentrated from water using an electropositive filter, eluted from the filter surface with beef extract, and then concentrated further using organic flocculation. Herein we present the protocol from Method 1615 for filter elution, secondary concentration, and measurement of total culturable viruses. A portion of the concentrated eluate from each sample is inoculated onto ten replicate flasks of Buffalo Green Monkey kidney cells. The number of flasks demonstrating cytopathic effects is used to quantify the most probable number (MPN) of infectious units per liter. The method uses a number of quality controls to increase data quality and to reduce interlaboratory and intralaboratory variation. Laboratories must meet defined performance standards. Method 1615 was evaluated by examining virus recovery from reagent-grade and ground waters seeded with Sabin poliovirus type 3. Mean poliovirus recoveries with the total culturable assay were 111% in reagent grade water and 58% in groundwaters.
Введение
Энтеровирусы представляют собой разнородную группу вирусов, поражающих кишечную систему человека и которые передаются через фекально-оральным путем. Эти вирусы попадают поверхностные и грунтовые воды через очистные сооружения и септических сточных вод цистерн, неправильно спроектированных или сломанных септиков, разбитых канализационных линий, комбинированных переполнением канализационных и других точечных и рассредоточенных источников 1-4. Человеческие инфекции и болезни от вирусов, передающихся через воду происходит через потребление загрязненного или недостаточно обеззараженной воды или через рекреационного контакта с водой. Симптомы заболевания могут быть связаны с легкой до тяжелой гастроэнтерита; конъюнктивит; лихорадка; верхних дыхательных путей бедствия; рука, ящур; миокардит; асептический менингит; энцефалита; паралич; сепсис 5-8, и смерть 9,10.
Метод USEPA 1615 предусматривает процедуру для измерения инфекционных кишечных вирусных частиц в окружающей среде и питьевой воды. Эти воды могут содержатьсмесь инфекционных и неинфекционных вирионов, а только инфекционные частицы представляют собой потенциальную опасность для здоровья. Инфекционные вирусные частицы теряют инфекционность в течение долгого времени в окружающей среде и питьевых вод от потери целостности белков капсида, повреждение нуклеиновых кислот из - за УФ - излучения от солнечного света, а также повреждения из - за каких - либо дезинфицирующих средств , которые могут присутствовать 11-13. Общая процедура культивируемых вируса при условии, в методе основан на производстве цитопатического эффекта (CPE) в клеточной линии Буффало почки зеленой мартышки (BGM). Эта клеточная линия была выбрана из - за его широкого использования в полевых условиях 14,15 экологической вирусологии, даже несмотря на то диапазон инфекционных типов вирусов , обнаруженных в основном ограничены определенным энтеровирусов 15. Целью данной работы является описание Method 1615 в процедуры элюирования пятидюймовыми фильтров электроположительны картриджей, вторичной концентрации, и измерение общей культивируемых вирусов. Оценка изВ целом метод описан в Cashdollar и др. 16.
протокол
Примечание: Пожалуйста, смотрите раздел дополнительного материалы S1 для списка определений. Процедуры по контролю качества, связанные с ЮСЕПА Method 1615, описаны в разделе S2 дополнительные материалы.
1. Фильтр Элюирование Процедура
- Первый Элюирование
- Поместите 500 мл забуференного 1,5% мясного экстракта, рН 9,0, нагревают до комнатной температуры в градуированный цилиндр. Открыть фильтр корпус картриджа и добавить достаточное количество говяжьего экстракта, чтобы полностью покрыть электроположительную фильтр. Заменить крышку корпуса фильтра и залить оставшейся говяжьего экстракта в стерильный стакан.
- Через 1 мин после времени контакта, пройти раствор экстракта говядины в корпусе вместе с тем, оставаясь в стерильном стакане медленно через фильтр с использованием контейнера под давлением или перистальтического насоса. Соберите элюат в стеклянный стакан 2 л.
- Во-вторых элюирования
- Повторите шаги 1.1 с использованием дополнительно 500 мл забуференного 1,5% говяжьего экстракта, Но увеличивает время контакта на шаге 1.1.2 до 15 мин.
- Добавьте экстракт говядины из второго элюции до 2 л стакан, содержащий, что с первого элюирования. Добавьте стерильную мешалку в стакан.
2. Органические Флокуляция Процедура Концентрация
- Стерилизовать рН-электрод комбинированного типа с 0,525% раствором гипохлорита натрия в течение не менее 5 мин. Ополосните электрод стерильной дН 2 O , а затем дехлорирования с 0,05 М раствором тиосульфата натрия. Калибровка рН-метр с использованием рН 4 и 7 стандартов.
- Поместите химический стакан, содержащий элюата на мешалке. Включите пластину и увеличить скорость перемешивания до тех пор, пока вихрь формируется.
- Доводят рН элюата до 3,5 ± 0,1, медленно по каплям добавлением 1,2 М HCl в элюат. Добавьте HCl по каплям, потому что быстрое добавление инактивирует вирус. За это время элюат станет облачный как осадок начинает формироваться.
- Снизить смешивания спее изд к медленному размешать и затем продолжать контролировать и поддерживать рН элюата при 3,5 ± 0,1 при комнатной температуре в течение 30 мин.
- Налейте осажденного экстракт говядины суспензии в одну или несколько центрифуг бутылок и центрифуги в течение 15 мин при 2500 мкг при 4 ° С. Удалить бутылки из центрифуги и либо аспирата или медленно сливают надосадочную жидкость, чтобы предотвратить потерю осажденной осадка. Удалите супернатант.
ПРИМЕЧАНИЕ: Там может быть значительные различия между говяжьего экстракта партиями в количестве и качестве осадка. Осадок получают из некоторых партий будет растворяться быстро в то время как из других партий растворяется с трудом. - Добавить 30 мл 0,15 М фосфата натрия в центрифуге бутылку, содержащую осадок.
- С помощью 0,15 М фосфат натрия, рН 9,0 для осаждается из говядины экстракта партий, которые растворяют в течение 5 мин. Смесь перемешивают в течение 10 мин после того, как осадок полностью растворяется, а затем сразу перейти к этапу 2.7.
- С помощью 0,15 М фосфата натрия, рН 7,0-7,5 для всех остальных преципитатов. Смесь перемешивают в течение 10-15 мин, чтобы растворить, или для более сложных преципитатов, разбить их с помощью стерильного шпателя, Повторным извлечением раствора вверх и вниз во время перемешивания с пипеткой, при встряхивании осадок при 160 оборотах в минуту на орбитальном шейкере, или с помощью комбинации этих процедур.
ПРИМЕЧАНИЕ: При использовании более одной центрифуги бутылку, объединить осаждается с использованием менее 30 мл фосфата натрия, а затем использовать оставшуюся часть 30 мл, чтобы ополоснуть бутылки после объединения осаждается в одну бутылку или стакан. - Если объединенный осадок в плоским дном бутылки центрифуге, добавьте мешалку к бутылке. Переходите к этапу 2.6.5.
- Если объединенный осадок в центрифуге бутылки с коническим дном, перенести его в маленький стекл нный стакан и добавить мешалку в стакан.
- Поместите бутылку или стакан на магнитной мешалкой, и размешать до прecipitate растворится полностью.
- Повторно стерилизовать рН электрода комбинационного типа с 0,525% раствором гипохлорита натрия и дехлорирование с тиосульфатом натрия 0,05 М, как описано в шаге 2.1. Калибровка рН-метр с использованием рН 7 и 10 стандартов. Медленно довести рН полностью растворенного осадка до 9,0 1 М NaOH, а затем перемешивали в течение 10 мин.
- Снимите мешалку и центрифугировать растворенного осадка в течение 10 мин при 4,000-10,000 XG и 4 ° С.
- Осторожно вылить надосадочную жидкость в стеклянный стакан, не нарушая гранул. Добавьте мешалку в стакан и выбросить осадок.
- Стакан помещают на магнитную мешалку, и перемешивать раствор. Добавить 1,2 M HCl по каплям для доведения рН до 7,0-7,5.
- Фильтр стерилизовать жидкости над осадком путем пропускания через стерилизующий фильтр, содержащий предварительный фильтр, который предварительно обрабатывали 15 мл говяжьего экстракта 1,5%, 0,05 М глицина, рН 7.0-7.5.
- Анализ образца Volumе (б) расчеты:
- Используйте Уравнение 1 для вычисления S для всех испытательных образцов, за исключением лаборатории Укрепленный Бланк и лабораторию реагентного бланка,
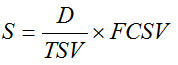 Уравнение 1
Уравнение 1
где D (объем исходного образца Water, проанализированных) составляет 500 л для грунтовых вод, TSV (Общий Объем образца) является объем поля образца, прошедшего через 5-дюймового электроположительны картриджа фильтра, полученного в лаборатории, и FCSV (Final Концентрированный Объем образца) является объем после фильтрации в шаге 2.10. Пример приведен в дополнительном разделе материалы S4.1. - Вычислить S для лаборатории укрепленных Blank (LFB, то есть положительный контроль качества с использованием посеяны воды класса реагентов) и Lab реагентного бланка (LRB, то есть отрицательного контроля качества с использованием реагента класса воды) путем умножения FCSV на 0,3.
- Используйте Уравнение 1 для вычисления S для всех испытательных образцов, за исключением лаборатории Укрепленный Бланк и лабораторию реагентного бланка,
- Разделите FCSV в THREе подвыборки.
- Подготовьте подвыборках 1 и 2 с объемом , равным 1,04 раза пробирной Объем образца. Замораживание этих подвыборок на уровне или ниже -70 ° С, если они не могут быть проанализированы с помощью общего культивируемых анализа вируса (подвыборки 1, стадия 4), или обработанные для молекулярных анализов (не показаны) в течение 24 ч; в противном случае, проводить при температуре 4 ° С.
- Замораживание оставшийся объем (подвыборки 3) на уровне или ниже -70 ° C.
- Вычислить объем посевного материала путем деления S на 10.
3. Общая культивируемых Вирус квантовом Анализ
Примечание: Для всех шагов всегда добавляют решения осторожно, чтобы не нарушать клеточный монослой.
- Слейте или аспирата средств массовой информации из испытательных сосудов, содержащих монослой клеток BGM на 3-6 суток от расщепления, а затем добавить объем сбалансированного солевого раствора, равного средства массовой информации удалены.
- Слейте или аспирата сбалансированный солевой раствор из клеточной культуры тэй сосуды используются, а затем прививают испытательные сосуды культуры клеток
- Привить 10 тестовых сосудов для каждого испытуемого образца с объемом подвыборки 1 равен объему посевного материала наряду с общим культивируемых вируса управления анализа квантовых (дополнительные материалы раздела S2.4).
- Для LFB и Lab крепленое Образец матрицы (LFSM, то есть высевают воды матрица образца), готовят 5-, 25- и 125-кратное разбавление с использованием подвыборки 3 и 0,15 М фосфата натрия, рН 7,0-7,5 в качестве разбавителя. Пример процедуры для изготовления разведений приведено в дополнительном материалы раздела S3. Инокулируйте 10 промытых испытательными сосудами культивирования клеток для каждой серии разведений с использованием Volume посевного материала на каждом испытательном сосуде , в дополнение к судам , привитых неразбавленного подвыборки 1 на этапе 3.2.1.
- Для любого испытуемого образца из стадии 3.2.1 (кроме тех, которые высевали на этапе 3.2.2), который имеет ЦПЭ во всех 10 повторах после 14 дней инкубации (см Шаг 3.3), предварительностричь 5-, 25- и 125- и 625-кратные разведения подвыборки 3. Инокулировать 10 промывают испытательные сосуды культуры клеток для каждой серии разведений с использованием Volume инокулята на каждом испытательном сосуде вместе с новым набором общего культивируемых вируса квантовом управления анализа (дополнительные материалы раздела S2.4).
- Распределить прививочный материал по поверхности клеточных монослоев путем наклона сосуды назад и вперед. Выдержите в испытательные сосуды при комнатной температуре в течение 80-120 мин на механической качающейся платформе при 1-5 колебаний / мин или с качанием сосудов каждые 15-20 мин, чтобы позволить любому вирусу присутствует адсорбироваться на клетках.
- Добавить предварительно нагретую среду технического обслуживания, а затем инкубировать испытательные сосуды при 36,5 ± 1 ° C.
- Посмотрите на появление ЦПЭ в каждом испытательном сосуде с помощью микроскопа ежедневно в течение первых 3 дней, а затем изучить их каждые 2-3 дня до дня 14. Передача любых испытаний судов, которые показывают ≥75% ЦПЭ в морозильной камере установлен на уровне илиниже -70 ° C. Заморозить все остальные культуры и общее число культивируемых вируса квантовом управления опробования на уровне или ниже -70 ° C после изучения судов в последний день.
- Разморозить все культуры и фильтровать ≥15% от измеряемой среды от каждого CPE-положительного испытательного сосуда через стерилизующий фильтр 0,2 мкм. Если указанный объем не может быть пропущен через фильтр из-за закупоривания, центрифугу среды в течение 10 мин при 1,500-18,000 XG и 4 ° С перед фильтрацией.
- Выполните второй проход всех 1 - й тест прохода судов с использованием отмытых тестовых сосудов фоновой музыки.
- Привить новые тестовые сосуды с объемом модифицирования, что составляет 10% от талой среды от всех негативных испытаний сосудов и из фильтруемой среды из положительных сосудов.
- Повторите шаги 3.2.4-3.4.3, но заморозить любой испытательный сосуд , который был отрицательным на 1 - й проход и положительный результат на 2 - й , как описано в шаге 3.3. Выполните 3 - й проходвозраст , как описано для 2 - го прохода с использованием только отрицательных контролей этого анализа и клеточных культур , которые были отрицательными в течение 1 - го прохода и положительным во 2 - й проход.
- Определение индивидуальных испытаний сосудов как вирус положительной , когда они показывают ЦПЭ в обоих 1 - го и 2 - го каналов или, в случае , когда CPE не происходит до 2 - го прохода в обоих 2 - й и 3 - й каналы.
- Используйте наиболее вероятное число Калькулятор с информации ЮСЕПА настройки программы по умолчанию , установленные , как показано в таблице S2 для расчета вирусные титры всех тестовых образцов.
- Введите число вирусных положительный тест дублирующих сосудов с шагом 3.6 для каждого испытуемого образца в калькулятор , чтобы определить значение / мл MPN (М мл) и верхний (CL УЯМ) и более низкие 95% доверительные пределы значений (CL LML) / мл ,
- Оbtain в / значение L MPN (M L) соответствующего испытуемого образца с использованием уравнения 2.
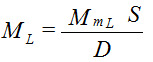 Уравнение 2
Уравнение 2
M мл является значение / мл MPN на шаге 3.7, S является пробирного Объем образца, а D является объем исходного образца Water , проанализированных. - Вычислить верхний доверительный предел / L, подставив значение CL УЯМ для значения M мл. Вычислить нижний доверительный предел / L, подставив значение CL LML для значения M мл. Расчет Пример показан в дополнительном разделе материалы S4.2.
- Значения Отчет M мл 0 , как ≤ 1 / D. Например, ≤ 0,002 MPN / л (≤ 1/500 L) для проб подземных вод.
- Вычислить предел достоверности значения MPN и 95% для каждой лаборатории крепленое Бланк и Lab Reагент Blank сначала умножением значения / мл , полученные в калькуляторе по S , а затем разделив результат на 0,3.
Результаты
Вирус концентрировали из источника подземных вод трех очистки питьевой воды растений и частных колодцев с использованием электроположительных фильтров. Два образца наборы, состоящие из образца поля и управления LFSM, были собраны из очистных сооружений в отдельных случаях, и один набор образец был собран из частного колодца. В целом восстановление вируса определяли с использованием образцов LFSM из двух растений и частной скважины (двух образцов из одного растения и одного образца из другой были исключены из расчета, так как значение MPN семени, используемого при каждом образце не может быть точно определен из-за к аномальным результатам CPE между воспроизводимо в колбах). Среднее значение полиовируса из проб подземных вод в среднем на 58% с коэффициентом вариации 79% (рисунок 2) 16. Ни один культивируемых вирус не был обнаружен ни в одном из дублирующих Unseeded пробы грунта полевых воды.
Метод производительности также была измерена с помощью LFB samples была изменена с помощью двух различных уровней семян. А "низкий" титр 300 MPN полиовируса был использован для оценки производительности на уровне меньше, чем "стандарт" 500 уровня MPN LFB используется в ЮСЕПА Метод "высокий" титра 1615. А из 1000 MPN полиовируса был использован для тестирования производительности на уровень управления LFSM. Эти средства управления осуществляется аналогично со средним восстановлением 111% и коэффициент вариации в размере 100% (рисунок 2). Все ЛРБ образцы были отрицательными , и все образцы LFB осуществляется в пределах диапазона приема (дополнительные материалы Таблица S1).
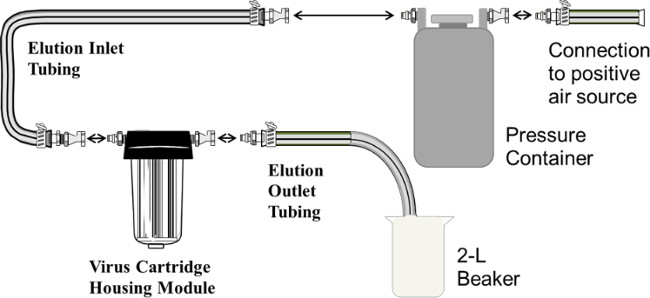
Рисунок 1. Фильтр элюирования. Схема использования контейнера давления для фильтра картриджа элюции показан. давление Положительный воздух используется, чтобы подтолкнуть говяжий раствора экстракта в емкости под давлением через корпус картриджа Conсодержащих электроположительной патронный фильтр. Перистальтический насос может быть заменен на контейнер под давлением, с впускным отверстием насоса помещением в контейнер, содержащий раствор экстракта говядины.
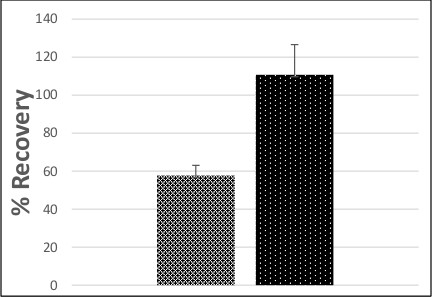
Рисунок 2. Среднее полиовируса восстановления (%) от земли и Реагент-Grade воды. Восстановление Средний процент показан полиовируса от земли (  ; п = 4) и хч воды (
; п = 4) и хч воды (  ; п = 12) образцов. Двенадцать х.ч. пробы воды включены шесть затравку 300 MPN и шесть затравку 1000 MPN полиовируса. Столбики ошибок обозначают стандартные ошибки.
; п = 12) образцов. Двенадцать х.ч. пробы воды включены шесть затравку 300 MPN и шесть затравку 1000 MPN полиовируса. Столбики ошибок обозначают стандартные ошибки.
Обсуждение
Метод USEPA 1615 был разработан для использования во время третьего цикла мониторинга нерегулируемого Загрязняющими Monitoring Правилу - х годах (UCMR3) 17 и предназначен в первую очередь для измерения появления вирусов в подземных водах. Он разделяет ряд общих шагов с помощью метода Сбор информации Правило (ICR), 15,18 , но имеет две незначительные отличия. Оба используют квантовую анализы для измерения вируса, которые производят CPE на монослоев BGM клеток с количественному основываясь на наиболее вероятное число (НВЧ) расчетов. Метод 1615 позволяет использовать более новый электропо- фильтр для концентрирования вирусов из различных матриц воды и уменьшает количество клеточных культур испытательного сосуда размножается в разведении от 20 до 10. Как незначительные изменения сократить общие затраты на метод. Уменьшение числа повторностей уменьшает рабочую силу, но приводит к несколько более низким пределом обнаружения. Хотя грунтовые воды должны иметь более низкие концентрации вируса , чем поверхностные воды, 19,20 - йе количество образца анализировали в пять раз больше, чем поверхностные воды, компенсируя отчасти для различий. Использование меньшего количества повторов будет достаточно для большинства поверхностных вод, но некоторые из них требуют разведения образца.
Метод 1615 имеет несколько важных шагов и ограничений. Говядина экстракты варьируются от партии к партии. Каждая партия должна быть проверена на эффективность вируса элюирования и способности к концентрации вируса через вторичные стадий концентрирования, как это описано в разделе дополнительные материалы S2.3. Метод использует точные формулы для расчета количества образца для инокуляции на культурах клеток BGM и определить титр вируса. Неточные результаты будут генерироваться, если эти формулы не строго следуют. Правильная асептики должны быть использованы для поддержания клеточных культур. Неинфицированные BGM управления для культивирования клеток, которые показывают бедствия в течение инкубационного периода 14 дней, вероятно, указывают на проблемы с поддержанием клеточной культуры. Большое внимание также должно быть такен во время пипеткой шаги, связанные с посевом и среднего дополнение к клеточной культуре колб, чтобы избежать перекрестного загрязнения. Элементы управления качества, описанные в дополнительном материалы раздела S2 должны быть строго соблюдены. Раздел S2 также предоставляет рекомендации по устранению неполадок по вопросам качества.
Основным механизмом адсорбции вируса на электроположительны фильтров является взаимодействие зарядов связано с силой положительного заряда на фильтре и силе отрицательного заряда персистенции , связанные с его изоэлектрической точкой и рН воды тестируемой 21. Элюирование из фильтров также зависит от силы этих взаимодействий. Поскольку они изменяются среди типов вируса и даже среди штаммов в пределах одного типа, элюирование из фильтров не является равномерным. Это означает, что любой результат может привести к недооценке фактического уровня вируса, присутствующего в окружающей среде вод. Использование одной линии клеток BGM также занижает возникновение вирусов. Диапазонэнтеральной вируса , который может производить ЦПЭ в этой клеточной линии , в основном ограничена до полиовируса и видовых серотипов энтеровирусов В, а также некоторых реовирусы 14,15,22. не будут обнаружены и другие типы инфекционного вируса.
Полиовируса извлечения из почвы и хч вод соответствовали ЮСЕПА Метод 1615 критерии приемлемости производительности как для эффективности оценки (PE, то есть образцы высевают хч воды с титрами неизвестным аналитика, которые используются для оценки производительности аналитика до начала из исследования) и образцов LFB (дополнительные материалы Таблица S1). Восстановление 58% из подземных вод с использованием методики культивирования аналогична сообщалось другими с использованием водопроводной воды 23,24. Среднее значение из образцов LFB на 111% с коэффициентом вариации (CV) 100% также удовлетворяет критериям приемлемости производительности метода, даже если они выше, чем наблюдаемое для образцов ПЭ дурьИНГ МЦР. ICR означают межлабораторное восстановление было 56% с коэффициентом вариации (CV) 92% в то время как средние внутрилабораторной возмещений варьировалась от 36 до 85% (ППО 58 до 131%, неопубликованные данные из базы данных ICR PE). Более высокие восстановление наблюдались в этом исследовании для низких семенных образцов LFB, чем для более высоких образцов семян (122 по сравнению с 42%). В то время, что МЦР было запланировано, ожидается, что PE образцы, получающие низкие значения семян будет иметь более низкое восстановление, что тех, кто получает высокие семена. Подобно тому, что здесь наблюдается для образцов LFB, восстановление полиовируса для образцов ICR PE были 71% (CV 100%), 54% (CV 69%), и 44% (CV 71%) для исходных значений ≤300 MPN, 300- 1500 MPN, и> 1500 MPN, соответственно.
Есть много методов для измерения инфекционного вируса в пробах воды 25. Этот метод имеет большое значение в отношении к другим методам в степени стандартизации. Стандартизация не только включает в себя качества и производительности управления,но также использует определенные объемы и формулы, чтобы гарантировать, что все аналитические лаборатории выполняют метод одинаково. Без стандартизации, трудно сравнивать результаты разных лабораторий, и, следовательно, стандартизация имеет важное значение при проведении крупномасштабных исследований в нескольких аналитических лабораторий. С помощью встроенного в области стандартизации, этот метод может быть расширен в будущем включать в себя дополнительные типы вирусов и клеточных линий. Ведутся исследования с целью получения данных для включения аденовируса в метод.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
The authors thank Dr. Mark Borchardt, U.S. Department of Agriculture, Marshfield, WI, for supplying the Sabin poliovirus serotype 3 used in this study; Mary Jean See, Nancy Schable, and Jenifer Jones of Dynamac Corporation for preparation of BGM cultures; Nichole E. Brinkman, Shannon M. Griffin, Brian R. McMinn, Eric R. Rhodes, Eunice A. Varughese, Ann C. Grimm, Sandhya U. Parshionikar, and Larry Wymer for contributions in the overall evaluation of USEPA Method 1615; Gretchen Sullivan for technical assistance; and local private well owners and utilities for allowing us to collect water samples. Although this work was reviewed by USEPA and approved for publication, it may not necessarily reflect official Agency policy. Mention of trade names or commercial products does not constitute endorsement or recommendation for use.
Материалы
| Name | Company | Catalog Number | Comments |
| Beef extract, desiccated powder | BD Bacto | 211520 | |
| Cryogenic tubes | Thermo Fisher | 3775/945373 | |
| Hank’s balanced salt solution | Invitrogen | 14170-112 | |
| Mechanical rocking platform | Daigger | EF4907G | |
| Orbital shaker | Thermo Fisher | 14-285-729 | |
| Sterilizing filter with prefilter | VWR | 28143-295 | |
| Sterilizing syringe filter | Corning | 431219 | |
| pH Standards | Sigma-Aldrich | 33643, 33646, 33648 | |
| MEM | Sigma-Aldrich | M1018 or M4642 | |
| Leibovitz L-15 | Sigma-Aldrich | L4386 | |
| Sodium bicarbonate, 7.5% | Sigma-Aldrich | S8761 | |
| Fetal bovine serum | Invitrogen | 10082-139 | |
| Antibiotic-Antimycotic | Life Technologies | 15240-062 | |
| Trypsin, EDTA | Invitrogen | 25200072 |
Ссылки
- Bradbury, K. R., et al. Source and transport of human enteric viruses in deep municipal water supply wells. Environ. Sci. Technol. 47 (9), 4096-4103 (2013).
- Aslan, A., Xagoraraki, I., Simmons, F. J., Rose, J. B., Dorevitch, S. Occurrence of adenovirus and other enteric viruses in limited-contact freshwater recreational areas and bathing waters. J. Appl. Microbiol. 111 (5), 1250-1261 (2011).
- Begier, E. M., et al. An outbreak of concurrent echovirus 30 and coxsackievirus A1 infections associated with sea swimming among a group of travelers to Mexico. Clin. Infect. Dis. 47 (5), 616-623 (2008).
- Anderson, A. D., et al. A waterborne outbreak of Norwalk-like virus among snowmobilers-Wyoming, 2001. J. Infect. Dis. 187 (2), 303-306 (2003).
- Glass, R. I., Parashar, U. D., Estes, M. K. Norovirus gastroenteritis. N.Engl.J. Med. 361 (18), 1776-1785 (2009).
- Khetsuriani, N., Lamonte-Fowlkes, A., Oberst, S., Pallansch, M. A. Enterovirus surveillance--United States. MMWR Surveill. Summ. 55 (8), 1-20 (2006).
- Sawyer, M. H. Enterovirus infections: diagnosis and treatment. Semin. Pediatr. Infect. Dis. 13 (1), 40-47 (2002).
- Abzug, M. J., Finn, A., Pollard, A. J. The enteroviruses: an emerging infectious disease? The real, the speculative and the really speculative. Hot Topics in Infection and Immunity in Children. , (2008).
- Harris, J. P., Edmunds, W. J., Pebody, R., Brown, D. W., Lopman, B. A. Deaths from norovirus among the elderly, England and Wales. Emerg. Infect. Dis. 14 (10), 1546-1552 (2008).
- Ho, M., et al. An Epidemic of Enterovirus 71 Infection in Taiwan. New England J. Med. 341 (13), 929-935 (1999).
- Bae, J., Schwab, K. J. Evaluation of murine norovirus, feline calicivirus, poliovirus, and MS2 as surrogates for human norovirus in a model of viral persistence in surface water and groundwater. Appl. Environ. Microbiol. 74 (2), 477-484 (2008).
- Ward, R. L., Knowlton, D. R., Winston, P. E. Mechanism of inactivation of enteric viruses in fresh water. Appl. Environ. Microbiol. 52 (3), 450-459 (1986).
- Kahler, A. M., Cromeans, T. L., Roberts, J. M., Hill, V. R. Effects of Source Water Quality on Chlorine Inactivation of Adenovirus, Coxsackievirus, Echovirus, and Murine Norovirus. Appl. Environ. Microbiol. 76 (15), 5159-5164 (2010).
- Dahling, D. R., Wright, B. A. Optimization of the BGM cell line culture and viral assay procedures for monitoring viruses in the environment. Appl. Environ. Microbiol. 51 (4), 790-812 (1986).
- Fout, G. S., Schaefer, F. W., Messer, J. W., Dahling, D. R., Stetler, R. E. EPA/600/R-95/178. ICR Microbial Laboratory Manual. , (1996).
- Cashdollar, J. L., et al. Development and Evaluation of EPA Method 1615 for Detection of Enterovirus and Norovirus in Water. Appl. Environ. Microbiol. 79 (1), 215-223 (2013).
- USEPA. 40 CFR Parts 141 and 142 Revisions to the Unregulated Contaminant Monitoring Regulation (UCMR3) for Public Water Systems Final Rule. Federal Register. 77 (85), 26072-26101 (2012).
- USEPA. 40 CFR Part 141 National Primary Drinking Water Regulations: Monitoring Requirements for Public Drinking Water Supplies; Final Rule. Federal Register. 61 (94), 24353-24388 (1996).
- Shaw, S., Regli, S., Chen, J., McGuire, M. J., McLain, J. L., Obolensky, A. Virus occurrence and health risks in drinking water . Information Collection Rule Data Analysis. , 437-462 (2002).
- Lieberman, R. J., et al. . Microbial monitoring of vulnerable public groundwater supplies. , (2002).
- Lukasik, J., Scott, T. M., Andryshak, D., Farrah, S. R. Influence of salts on virus adsorption to microporous filters. Appl. Environ. Microbiol. 66 (7), 2914-2920 (2000).
- Sedmak, G., Bina, D., MacDonald, J. Assessment of an enterovirus sewage surveillance system by comparison of clinical isolates with sewage isolates from milwaukee, wisconsin, collected august 1994. Appl. Environ. Microbiol. 69 (12), 7181-7187 (2003).
- Ikner, L. A., Soto-Beltran, M., Bright, K. R. New method using a positively charged microporous filter and ultrafiltration for concentration of viruses from tap water. Appl. Environ. Microbiol. 77 (10), 3500-3506 (2011).
- Karim, M. R., Rhodes, E. R., Brinkman, N., Wymer, L., Fout, G. S. New electropositive filter for concentrating enteroviruses and noroviruses from large volumes of water. Appl. Environ. Microbiol. 75 (8), 2393-2399 (2009).
- Cashdollar, J. L., Wymer, L. Methods for primary concentration of viruses from water samples: a review and meta-analysis of recent studies. J Appl Microbiol. 115 (1), 1-11 (2013).
Erratum
Formal Correction: Erratum: EPA Method 1615. Measurement of Enterovirus and Norovirus Occurrence in Water by Culture and RT-qPCR. II. Total Culturable Virus Assay
Posted by JoVE Editors on 1/01/1970. Citeable Link.
A correction was made to: EPA Method 1615. Measurement of Enterovirus and Norovirus Occurrence in Water by Culture and RT-qPCR. II. Total Culturable Virus Assay. The values for Reagent Grade Water shown in Figure 2 were changed from a mean value of 111% with a standard error of 8% to a mean value of 82% with a standard error of 26%.
The penultimate sentence of the last paragraph of the Representative Results section was changed from:
These controls performed similarly with a mean recovery of 111% and a coefficient of variation of 100% (Figure 2),
to:
These controls had a mean recovery of 82% and a coefficient of variation of 110% (Figure 2).
The third sentence of the fourth paragraph of the Discussion section was changed from:
The mean recovery from the LFB samples of 111% with a coefficient of variation (CV) of 100% also met the method performance acceptance criteria even though they are higher than that observed for PE samples during the ICR,
to:
The mean recovery from the LFB samples of 82% with a coefficient of variation (CV) of 110% also met the method performance acceptance criteria even though they are higher than that observed for PE samples during the ICR.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены