Method Article
В пробирке и в естественных моделью для изучения бактериальной адгезии к стенке сосуда в проточных условиях
В этой статье
Резюме
To study the interaction of bacteria with the blood vessels under shear stress, a flow chamber and an in vivo mesenteric intravital microscopy model are described that allow to dissect the bacterial and host factors contributing to vascular adhesion.
Аннотация
Для того, чтобы вызвать эндоваскулярных инфекций и инфекционный эндокардит, бактерии должны быть способны прилипать к стенке сосуда, будучи подвержены напряжении сдвига течет кровь.
Для выявления бактериальных и хост факторов, которые способствуют сосудистой адгезии микроорганизмов, соответствующие модели, которые изучают эти взаимодействия в физиологических условиях сдвига необходимы. Здесь мы описываем в пробирке камеры модели потока, который позволяет исследовать бактериальную адгезию к различным компонентам внеклеточного матрикса или эндотелиальными клетками, и прижизненной микроскопии модель, которая была разработана непосредственно визуализировать начальную адгезию бактерий к висцеральной циркуляции в естественных условиях , Эти методы могут быть использованы для идентификации бактериальных и хост факторов, необходимых для адгезии бактерий в потоке. Проиллюстрируем актуальность напряжения сдвига и роль фактора фон Виллебранда для адгезии Staphylococcus стафилококк с использованием как в пробирке и в естественных условиях модели.
Введение
To establish endovascular infections, pathogens require a mechanism to adhere to the endothelium, which lines the vessel wall and the inner surface of the heart, and to persist and establish an infection despite being exposed to the shear stress of rapidly flowing blood. The most frequent pathogen causing life-threatening endovascular infections and infective endocarditis is Staphylococcus aureus (S. aureus)1.
Various bacterial surface-bound adhesive molecules mediate adhesion to host tissue by interacting with extracellular matrix components. These MSCRAMMs (microbial surface components recognizing adhesive matrix molecules) recognize molecules such as fibronectin, fibrinogen, collagen and von Willebrand factor (VWF). MSCRAMMs are important virulence factors of S. aureus and are implicated in the colonization and invasion of the host2. Most studies on these virulence factors have been performed in static conditions, and thus may not be representative for human infections where initial adhesion of the bacteria occurs in flowing blood.
In the case of bloodstream infections, bacteria need to overcome the shearing forces of flowing blood in order to attach to the vessel wall. Models that investigate the interaction between bacteria and endothelium or subendothelium under flow conditions are therefore of particular interest.
A recent study showed that the adhesion of S. aureus to blood vessels under shear stress is mediated by VWF3. VWF, a shear stress-operational protein, is released from endothelial cells upon activation. Circulating VWF binds to collagen fibers of the exposed subendothelial matrix. Our group reported that the von Willebrand factor-binding protein (vWbp) of S. aureus is crucial for shear-mediated adhesion to VWF4.
In this article, we present an in vitro flow chamber model where bacterial adhesion to different components of the extracellular matrix or to endothelial cells can be evaluated. To validate the findings from in vitro data, we have developed an in vivo model that visualizes and quantifies the direct interaction of bacteria with the vessel wall and the formation of bacteria-platelet thrombi in the mesenteric circulation of mice, using real-time intravital vascular microscopy.
протокол
Эксперименты на животных были одобрены комитетом по этике KU Leuven по.
1. Подготовка Бактерии для In Vitro перфузии и в естественных экспериментов
- Мы использовали S. стафилококк штамм Ньюман для всех экспериментов, описанных в этой рукописи. С. стафилококк Newman хранили в Brain Heart Infusion (BHI) с 10% глицерине при -80 ° С.
- Использование стерильной петлей, чтобы очистить замороженных бактерий от прививки и в 5 мл трипсиновый соевый бульон (ТСБ) O / N при 37 ° С (OD 600> 3).
- Вымойте бактерий путем центрифугирования (2600 г, РТ, 5 мин) и ресуспендирования бактериальных гранул в 5 мл PBS (фосфатный буферный солевой раствор).
- Подготовка 1 мг / мл раствора 5 (6) карбокси-флуоресцеин N-гидроксисукцинимидным эфиром (карбокси-флуоресцеин) в этаноле. Развести 1 мг / мл карбокси-флуоресцеина решение 150 мкг / мл в воду, содержащую лаборатории (например, MilliQ воды). Защитите трубки из светас алюминиевой фольгой и хранят при -20 ° С.
- Центрифуга бактерии (2600 XG, RT, 5 мин). Ресуспендируют бактериальных гранул в 800 мкл PBS и добавляют 200 мкл (конечная концентрация 30 мкг / мл для перфузии экспериментов) или 400 мкл (конечная концентрация 50 мкг / мл для экспериментов в естественных условиях) от 150 мкг / мл карбокси-флуоресцеина раствора. Защита труб от света с алюминиевой фольгой и инкубируют в течение 30 мин при комнатной температуре на шейкере.
- После маркировки, блок с 6% бычьего сывороточного альбумина (БСА) в растворе PBS.
- Развести бактерии, используя оптический денситометрии (OD), внешний диаметр 600 0,65 для экспериментов в пробирке (что соответствует приблизительно 3 х 10 8 колониеобразующих единиц (КОЕ) / мл для золотистого стафилококка) и OD 600 1,8 для экспериментов в естественных условиях ( соответствует приблизительно 1 · 10 9 КОЕ / мл для золотистого стафилококка) в PBS. Защитите трубки от света с алюминиевой фольгой и оставить на льду.
2. Экстракорпоральное перфузии Эксперименты
- Покрытие покровные стекла
- Развести фактора Виллебранда (VWF) (Haemate Р, концентрации акций 2400 мкг / мл) в лабораторном воду, содержащую (деионизированной дистиллированной) до конечной концентрации 50 мкг / мл.
- Развести коллаген в изотоническом растворе глюкозы (решения SKF, рН 2,7-2,9, а от изготовителя) до конечной концентрации 160 мкг / мл.
- Шерсть покровные стекла (24 × 50 мм) с VWF или коллагена путем отказа 200 мкл покрытия на парафином и поместить покровное в верхней части капли. Капли будет распространяться вдоль поверхности покровного стекла.
- Инкубируйте покровное в увлажненной контейнере в течение 4 ч при комнатной температуре. Осторожно поднимите покровные из парафильмом с тупой иглой. Установите покровное в нижней части камеры подачи.
- Покрытие пластической скользит с эндотелиальных клеток
- Пальто пластиковые скользит(1-а РСА культуры клеток камеру, Sarstedt, Германия) с 1 мл 1% раствора желатина в PBS и инкубируют в течение 30 мин при 37 ° С. Семенной пупочной вены человека эндотелиальных клеток (HUVECs) на покрытые желатином пластиковых листах и выращивать их до 70-80% слияния. Установите пластического скольжения в нижней части камеры подачи.
- Перфузии эксперимент
Примечание: схематический общий вид в пробирке на модели перфузии представлена на Рисунке 1.- Выполните в пробирке бактериальных исследований адгезии в проточной камере пластины микро-параллельно при напряжении сдвига ламинарного от 2,5 дин / см 2 и 20 дин / см 2, чтобы имитировать различные условия физиологические потока.
- (Дизайн в доме) камера поток состоит из металлической рамы и перфузии камеры сделаны из оргстекла (поли (метил) метакрилат (PMMA)). При подключении его к высокой точности инфузионный насос (PHD 2000 Infusion, Гарвардский Аппарат, США), мы можем генерировать поток раTES от 0,0001 мкл / мин и 220,82 мл / мин.
- Подключение трубки к верхней части камеры потока и придать среды в трубопроводе. Аккуратно верхнюю часть камеры потока в верхней части нижней части и собрать проточную камеру. Будьте осторожны, чтобы избежать воздушных пузырей. Вводите 1 мл среды через камеру, чтобы убедиться, что камера не протекает и для удаления избытка раствора покрытия. Избегайте воздушных пузырьков.
- Наведите на термо-контролем грелку при 37 ° С на предметное лотка. Так как это терминал процедура, нет необходимости в строгих процедур asceptic. Сделайте надрез около яремной вены, аккуратно снимите правую сторону шейки мышцы и изолировать яремную вену от окружающей ткани.
- Настройте инфузионный насос и флуоресцентного микроскопа. Параметры инфузионный насос зависит от диаметра шприца и желаемой скорости потока (раздел 2.4). Отныне, работать в темной комнате.
- ФВ Покрытие:
- Заполните шприц с флуоресцентно меченных бактерий и подключить его к впускной трубе. Избегайте воздушных пузырьков. Начните инфузионный насос в течение 10 мин. Время инфузии зависит от скорости сдвига и покрытием, бактерий и среды, используемой и должна представлять устойчивого состояния сцепления.
- Через 10 мин смыть несвязанных бактерий путем подключения шприц с PBS, чтобы впускной трубы и началом инфузионного насоса.
- Возьмите по крайней мере 15 изображения или фильмы в разных местах после процесса стирки. Бактерии малы и, возможно, трудно сосредоточиться. До эксперимента в пробирке потока, соответствующая фокальной плоскости могут быть получены путем размещения каплю флуоресцентно меченных бактерий на покровное и покровное размещения в проточную камеру. Затем, поиск нужного фокальной плоскости и сохранить настройки.
Примечание: В ходе эксперимента в пробирке потока, захвата изображения во время стадии промывки (± 5 мин после начала) гарантирует, что толькосигнал для прикрепленных бактерий в плен.
- Коллаген Покрытие:
- Добавить 60 мкг / мл VWF с флуоресцентно меченных бактерий непосредственно перед началом перфузии. Заполните шприц с флуоресцентно меченых бактерий или флуоресцентно меченных бактерий с добавлением 60 мкг / мл ФВ и подключить его к впускной трубе. Избегайте воздушных пузырьков. Повторите шаги 2.3.5.2 2.3.5.3 для
- Эндотелиальных клеток:
- Активация эндотелиальных клеток путем перфузии с 0,1 мМ раствора Ca 2+ -ionophore А23187 (маточного раствора 10 мМ растворяли в диметилсульфоксиде (ДМСО)) в среде DMEM с той же скоростью сдвига в бактериальной перфузии в течение 10 мин с помощью перфузии 0,1 мм. Повторите шаги 2.3.5.2 2.3.5.3 для.
- Рассчитать скорости сдвига и напряжения сдвига следующим образом.
Скорость сдвига = 6Q / WH 2
Где: Q: скорость потока в мл / мин, W: ширина в см, H: Высота в см
Напряжение сдвига (τ) = крыса сдвигаэкс вязкость (μ)
Где μ: среда: 0.01 дин х сек / см 2, вся в крови: 0,04 дин х сек / см 2 - Анализ изображений
- Получить живые изображения с помощью инвертированного флуоресцентного микроскопа с черным и белым камеры и развивать с помощью программного обеспечения визуализации. Используйте время экспозиции 1,5 сек. Возьмите несколько снимков (по крайней мере, 15) случайным образом распределенных по поверхности с покрытием из проточной камеры и сохранять их в соответствующем формате файла.
- Выполнить анализ изображения с ImageJ. Вычтите фон для удаления гладкие непрерывные фоны с картинки (Process - Вычтите фона) и определить порог для установки нижних и верхних пороговых значений, сегментация полутоновых изображений в особенностях интересов. Измерение площади ограничены к порогу.
- Сравните бактериальной адгезии, выраженная в люминесцентной области, например, с помощью программного обеспечения статистического анализа. Сравните группы, используя односторонний ANOVA или ТWO-белохвост t-тест Стьюдента. Обо всех ценностей, как средней ± стандартная ошибка среднего (SEM). Рассмотрим p- значение <0,05 значительной (* р <0,05; ** р <0,01; *** р <0,001).
3. В Vivo брыжеечной модели перфузии
- Подготовка / хирургия мыши
- Быстрое мышь ночь перед экспериментом для того, чтобы ограничить движение кишечника.
- Дайте 6-8 недели их мыши (C57BL / 6), предварительно оперативное обезболивание с помощью подкожной инъекции бупренорфина (0,1 мг / кг массы тела (МТ)) 20-30 мин до операции.
- Обезболить мыши внутрибрюшинным инъекции кетамина (125 мг / кг BW) и ксилазина (12,5 мг / кг BW). Проверьте по педали рефлекс. Применить ветеринар мазь для предотвращения сухости.
- Наведите на термо-контролем грелку при 37 ° С на предметное лотка. Так как это терминал процедура, нет необходимости в строгом asceptiC процедур. Сделайте надрез около яремной вены, аккуратно снимите правую сторону шейки мышцы и изолировать яремную вену от окружающей ткани.
- Вставьте 2 французский внутривенный катетер в правую яремную вену для инфузий флуоресцентно меченых бактерий или других решений. Откройте брюшную полость через разрез брюшной стенки по средней линии и использовать ватные тампоны, чтобы распространить брыжейки и визуализировать брыжеечной артериол и венул кровообращение.
- Наведите на правой стороне на прозрачную пластину и закрепите канюлю с лентой. Используйте горячую пакет, чтобы предотвратить переохлаждение. Чтобы предотвратить обезвоживание ткани, падение 500 мкл 0,9% NaCl на кишечнике.
- Флуоресцентная микроскопия бактериальной адгезии к брыжеечной обращения
- Работа в темной комнате. Используйте ватные тампоны, чтобы обездвижить сосуды и визуализировать их под инвертированным микроскопом.
- Тематически применить 5 мкл 10 мМ раствора Oе Са 2+ -ionophore А23187 растворяли в ДМСО. После 10 сек, вводят 100 мкл меченых бактерий (см пункт 1) через яремную катетер. Возьмите покадровой изображения. После эксперимента закончил, усыпить мышь в соответствии с утвержденными руководящими принципами институциональных.
- Анализ изображений
- Получить живые изображения с помощью инвертированного флуоресцентного микроскопа, захваченных с помощью черно-белая камера и разработана с использованием любого программного обеспечения изображения. Применить Автоматизированная экспозиции и контрастности оптимизации, специфичную для используемого оборудования.
- Приобретать покадровой изображения с помощью '' Приобретение инструмента на панели инструментов (многомерных Приобретение - время), используя 40 циклов 1000 изображений / сек. Сохранение изображений в соответствующем формате файла изображения.
- Изображения процесса с использованием программного обеспечения ImageJ анализа для измерения площади флуоресцентного сигнала на изображении. Определить порог, чтобы установить верхние и нижние пороговые значения, сегментации полутоновых изображений в Рeatures интересов. Определить области интереса (кровеносного сосуда) и измерить площадь, ограниченную порогом и области интересов. Сравните бактериальной адгезии, выраженная в люминесцентной области с помощью какой-либо статистической или графическое программное обеспечение.
Результаты
Золотистого стафилококка адгезия к ФВ, субэндотелиальных матрица и эндотелиальные клетки является напряжение сдвига зависит явление
Чтобы подчеркнуть роль напряжения сдвига во взаимодействии между S. стафилококк и ФВ, мы провели перфузии более VWF покрытием покровные при различных скоростях сдвига (схематический общий вид в пробирке на модели перфузии приведен на рис 1. Адгезия золотистого стафилококка к Виллебранда увеличивается с увеличением скорости сдвига от 250 сек -1 до 2000 с -1 (рисунок 2), что свидетельствует о высокой силы сдвига не ингибируют но усиливают адгезию бактерий к VWF.
Для того чтобы исследовать вклад VWF к бактериальной адгезии к коллагену, основным компонентом субэндотелиальном матрицы, мы перфузировались флуоресцентно меченных С. стафилококк над коллагена в присутствии или в отсутствие VWF. При отсутствии ФВ, адгезии S.ureus коллагена уменьшается с увеличением скорости сдвига. Однако, когда ФВ присутствовал в среде, адгезия S. стафилококк растет с увеличением скорости сдвига (рисунок 3).
В пробирке модель потока также позволяет исследовать адгезию бактерий к эндотелиальных клеток в потоке. Мы перфузии HUVECs с флуоресцентно меченных S. стафилококк при скоростях сдвига от 500 до 2000 сек -1. Там, где указано, HUVECs были активированы с Ca 2+ -ionophore, чтобы вызвать освобождение ФВ. Активации эндотелиальных клеток и последующее освобождение ФВ, увеличение адгезии S. стафилококк (4А), который формируется типичные "строка, как" паттерны флуоресцентно меченных бактериальных кластеров, выровненные в направлении силы сдвига (рис 4В), указывая связывания бактерий вдоль растягивается линейно-ФВ молекулы.
Начальное в естественных условияхбактериальной адгезии в висцеральной вен опосредуется ФВ
С S. стафилококк способен придерживаться VWF, мы использовали мышей дикого типа (VWF + / +) и ФВ-дефицитных мышей (Виллебранда - / -), чтобы исследовать бактериальную адгезию к стенке сосуда активированного в естественных условиях. В режиме реального времени видеомикроскопии из чревных вен позволило визуализации в естественных условиях циркулирующих флуоресцентно меченных С. стафилококк (Схематический обзор в естественных условиях модели перфузии представлена на рисунке 5).
После фармакологической активации эндотелия по Са 2+ -ionophore, мы наблюдали быстрое локальное накопление отдельных бактерий и агрегатов бактерий к стенке сосуда WT мышей (дополнительного видео 1 и 2). Почти нет адгезии бактерий не наблюдалось на активированном стенки сосуда ФВ -deficieнт мышей (дополнительное видео 3) по сравнению с адгезией у мышей дикого типа (фиг.6). Отсутствие ФВ уменьшается способность S. стафилококк придерживаться активированного стенки сосуда.
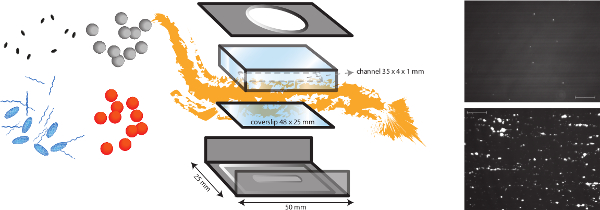
Рисунок 1. Схематическое изображение в пробирке модель потока в. В пробирке модель потока представляет собой многофункциональный модель, которая позволяет исследовать различные сдвига зависимых механизмов, таких как бактериальной адгезии к субэндотелиальном матрицы, но и формирование тромб. Проточная камера микро-параллельный помещают на покровное (пластик или стекло) с различными покрытиями белков и эндотелиальных клеток. Адгезия различных бактерий (оранжевый и серый точек) могут быть проанализированы, и влияние присутствия белков плазмы, тромбоцитов и цельной крови может быть оценена. Флуоресцентные маркеры для тромбоцитов (синие овалы) или fibrinogен (синие строки) может быть использован в сочетании с различными ингибиторами (черный овалов), чтобы отличить бактериальные и факторов хозяина. Типичные изображения бактериальной адгезии S. стафилококк в коллагена покрытием в наличии (внизу) или отсутствие (вверху) ФВ показаны (масштаб бар 100 мкм). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
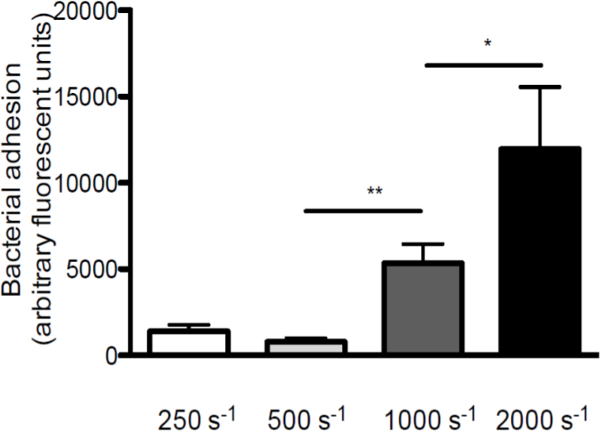
Рисунок 2. Адгезия S. стафилококк, чтобы ФВ возрастает с увеличением скорости сдвига. Микро-параллельный поток перфузионной камеры над покрытием VWF (50 мкг / мл) с флуоресцентно меченных С. стафилококк Ньюман при скоростях сдвига от 250 до 2000 с -1 (с -1) в среде (п> 5). Все результаты представлены в виде среднего ± SEM. * Р <0,05, ** р <0,01,
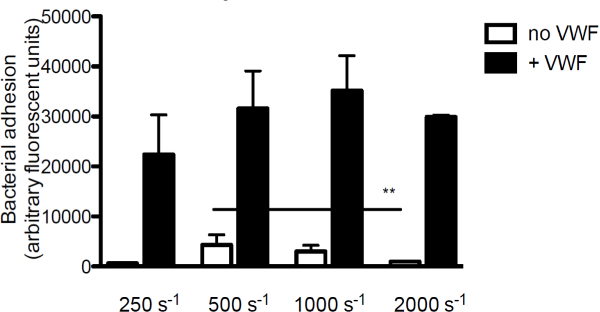
Рисунок 3. Адгезия S. стафилококк, чтобы это субэндотелия сдвига и фактора Виллебранда зависит. Микро-параллельный поток перфузионной камеры над покрытием коллагеном (160 мкг / мл) с флуоресцентно меченных С. стафилококк Ньюман при скоростях сдвига от 250 до 2000 с -1 в среде (п> 5). ФВ (60 мкг / мл) присутствует в среде, где указано. Все результаты представлены в виде среднего ± SEM. ** Р <0,01.
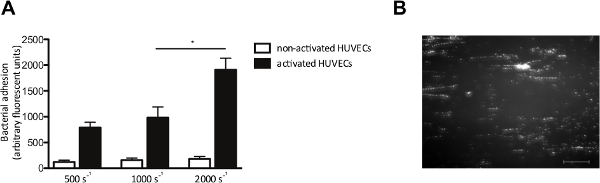
Рисунок 4. Адгезия S. стафилококк с активированными эндотелиальными клетками сдвига зависит. Микро-параллельный поток перфузионной камеры над эндотелиальных клеток. (A) пупочной вены человека эндотелиальных клеток были активированы с Ca 2+ -ionophore А23187 (0,1 мМ), а затем 10 мин перфузии флуоресцентно-меченного С. стафилококк Ньюман при скоростях сдвига от 500 до 2000 с -1 в среде (п> 5). Все результаты представлены в виде среднего ± SEM. * Р <0,05. (Б) Изображение микро-параллельной камеры поток перфузии над активированными HUVECs с S. стафилококк при скорости сдвига 1000 сек-2. С. стафилококк образует ниточки ± 200 мкм длины, предполагая, адгезию к ФВ мультимеры (масштаб бар 100 мкм). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 5. схематическое представление брыжеечной модели перфузии в естественных условиях. Право яремной вены катетер (желтая линия) вставляется в администрации фтораescently меченые бактерии (оранжевые точки), дополнительные анестетики или другие компоненты, такие как фармацевтические ингибиторы и антитела. Брюшную полость открывается и брыжейки распространяется визуализировать кровеносные сосуды (венозных и артериальных) под флуоресцентным микроскопом. После фармакологической активации эндотелия с помощью Ca 2+ -ionophore, который индуцирует высвобождение VWF, бактерии могут быть введены через яремную вену катетера. В режиме реального времени внутрисосудистого видео микроскопия позволяет в естественных условиях Визуализация оборотных флуоресцентно меченных бактерий и в результате образование бактерий тромбоцитов тромбов. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
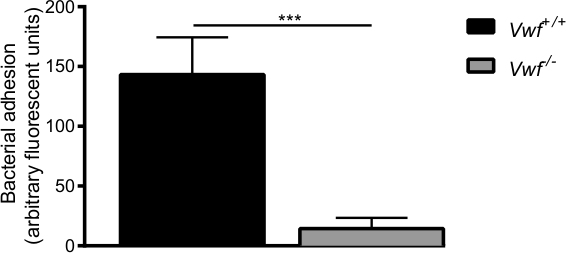
Рисунок 6. Первоначальная адгезия S. стафилококкс активированным эндотелия в естественных условиях при посредничестве ФВ в естественных условиях венозной перфузии брыжеечной модели с C57Bl / 6- ФВ + / + и C57Bl / 6- Виллебранда. - / - мышей. Адгезия флуоресцентно меченных С. стафилококк в локально активированного стенки сосуда значительно ниже ФВ - / - мышей. Все результаты представлены в виде среднего ± SEM. *** Р <0,001, п> 7.
Видео 1: реальном времени адгезия S. стафилококк с активированным стенки сосуда в + / + мышей Виллебранда. Пожалуйста, нажмите здесь, чтобы смотреть это видео.

Видео 2: в режиме реального времени образование агрегатов и эмболизация S. стафилококк в ФВ + / + мышей. Пожалуйста, нажмите здесь, чтобы смотреть это видео.

Видео 3: в реальном времени адгезия S. стафилококк с активированным стенки сосуда в ФВ - / - мышей. В естественных условиях брыжеечной модели перфузии с ФВ + / + и фактора Виллебранда - / - мышей. Пять мкл Ca 2+ -ionophore (10 мм) примеред в области визуализируется сосудистого русла. Суспензию карбокси-меченных флуоресцеином S. стафилококк вводили через яремную катетер. Брыжеечная циркуляция визуализировали под инвертированным микроскопом. Пожалуйста, нажмите здесь, чтобы смотреть это видео.
Обсуждение
Напряжение сдвига является решающим фактором для раннего бактериальной адгезии к стенке сосуда и последующего поколения эндоваскулярной или эндокардиальных растительности и метастатических инфекций 4,5. Мы описали дополняют друг друга в пробирке и в естественных условиях модели для изучения патогенеза эндоваскулярных инфекций при физиологической напряжения сдвига. Эти модели позволили определить фактор фон Виллебранда-связывающего белка (vWbp) в качестве основного S. стафилококк белка взаимодействуют в потоке с поврежденной сосудистой стенки подвергая ФВ 4.
Эндоваскулярные инфекции, и инфекционный эндокардит в частности, представляют интерес не только из-за сепсиса индуцированных органной недостаточности и смерти, но также из-за местных и дальних («») метастатических осложнений. Чтобы заставить инфекционный эндокардит и метастатических инфекций, бактерии должны придерживаться к стенке сосуда и, таким образом, противостоять напряжения сдвига в протекающей крови. Наиболееисследования факторов вирулентности бактерий были выполнены в статических условиях. Тем не менее, эти установленные взаимодействия не может выдержать силы сдвига и исследования в условиях потока может выявить новые, ранее неизвестные факторы бактерии-хозяина взаимодействия.
Использование камеры микро-параллельного течения, и мы, и другие показали важность ФВ для сосудов адгезии. Под напряжением сдвига, ФВ постепенно разворачивается от своего отдыха глобулярной структурой, и выставляет домен A1, который взаимодействует с тромбоцитами через его рецептором GPIb 6. Flow камеры были широко используются для изучения функции тромбоцитов 7.
Примечательно также С. стафилококк адгезии в потоке требуется VWF, и, в частности домен А1, что подвергается на сдвиг. Мы определили vWbp посредником связывание ФВ. vWbp является коагулазо, что способствует S. стафилококк патофизиологии путем активации протромбина хозяина. Staphylothrombin, что разрешенияulting комплекс бактериальной коагулазо и протромбина, превращает фибриноген в нерастворимый фибрин 8,9. Наши исследования показали, что vWbp не только активировать протромбин, но вызывает образование фибрина бактерии тромбоцитов агрегатов, которые увеличивают адгезию к кровеносных сосудов в потоке 4,10,11.
В пробирке камера модель потока позволяет изучать различные игроки в бактериальной адгезии к сотовым или матричных компонентов. Бактериальные факторы вирулентности могут быть изучены с помощью мутантов или безвредные бактерии, экспрессирующие специфические поверхностные белки. Кроме того, фармакологические ингибиторы или блокирующие антитела могут быть добавлены к среде в проточную камеру. Роль принимающих факторов, таких как различных компонентов внеклеточного матрикса могут быть изучены с помощью покровные с различными покрытиями. Покровные стекла могут быть также покрыты эндотелиальных клеток, из которых статус активации можно модулировать путем добавления конкретные стимуляторы. АпаRT из сосудистой стенки, вклад принимающих клеток крови и белков плазмы могут быть изучены путем добавления этих факторов в текучей среде. Таким образом, различные условия возрастающей сложности могут быть изучены в стандартных условиях ламинарного потока, чтобы разгадать взаимодействия, которые позволяют бактериям прилипать к стенке сосуда в естественных условиях.
Взаимодействия выявленные в модели в пробирке впоследствии учился в животной модели, чтобы проверить их актуальность в сложном организме. Другое в моделях естественных условиях для изучения динамического взаимодействия в потоке были описаны, например, в хомячка спинной кожной складки камеры 12 и кремастер модели 13. Для сравнения, брыжеечных модель перфузии описано здесь предлагает несколько преимуществ из-за своей простоты использования, возможность варьировать провести генетический фон мышей и оценить фармакологические вмешательства.
В заключение, описаны моделипредлагаем возможность для изучения поверхностных белков не только S. стафилококк, но и многих других микроорганизмов в разных слоев хозяев, чтобы лучше понять патогенез сосудистых инфекций.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Эта работа была поддержана Fonds пакета Wetenschappelijk Onderzoek (FWO) Vlaanderen G0466.10, 11I0113N; "Эдди Меркс Исследование Грант" и "Спорта исследования Грант" детской кардиологии, UZ Левен, Бельгия (x); Центр молекулярной биологии и сосудистой поддерживается Programmafinanciering KU Leuven (PF / 10/014), в "Geconcentreerde Onderzoeksacties" (ГОА) 2009/13 от университета Левена и исследовательский грант от компании Boehringer-Ingelheim.
Материалы
| Name | Company | Catalog Number | Comments |
| Brain Heart Infusion (BHI) | BD Plastipak | 237500 | |
| Tryptic Soy Broth (TSB) | Oxoid | CM0129 | |
| Phosphate Buffered Saline (PBS) | Invitrogen | 14190-169 | D-PBS |
| 5(6)-carboxy-fluorescein N-hydroxysuccinimidyl ester | Sigma-Aldrich | 21878-25MG-F | fluorescent labeling |
| Bovine Serum Albumin Fraction V (BSA) | Roch | 10 735 086 001 | |
| Haemate-P | CSL Behring | PL 15036/0010 | VWF |
| Horm collagen | Takeda | 10500 | collagen |
| 1-well PCA cell culture chambers | Sarstedt | 94.6140.102 | plastic slips |
| Temgesic | Reckitt Benckiser | 283716 | bruprenorphine |
| Anesketin (Ketamin hydrochloride 115 mg/ml (100 mg/ml ketaminum)) | Eurovet | BE-V136516 | ketamin |
| XYL-M 2% (xylazine hydrochloride 23.32 mg/ml (20 mg/ml xylazine)) | VMD Arendonk | BE-V170581 | xylazine |
| 2 french intravenous catheter green | Portex | 200/300/010 | |
| 0,9% Sodium chloride (NaCl) | Baxter Healthcare | W7124 | |
| cotton swabs | International Medical Product | 300230 | |
| Ca2+-ionophore solution A23187 | Sigma-Aldrich | C7522-10 MG | |
| 26 gauge 1 ml syringe | BD Plastipak | 300013 | |
| 26 gauge 1 ml syringe with needle | BD Plastipak | 300015 | intra-peritoneal injection |
| Centrifuge 5810-R | Eppendorf | 5811 000.320 | |
| Glass cover slips (24x50) | VWR | BB02405A11 | Thickness No, 1 |
| PHD 2000 Infusion | Harvard Apparatus | 702100 | High-accuracy Harvard infusion pump |
| Axio-observer DI | Carl-Zeiss | Inverted fluorescence microscope | |
| ImageJ | National Institute of Health | Analysis software | |
| Graphpad Prism 5,0 | Graphpad Software | Analysis software | |
| AxioCam MRm | Carl-Zeiss | Black and white camera |
Ссылки
- Vanassche, T., Peetermans, W. E., Herregods, M. C., Herijgers, P., Verhamme, P. Anti-thrombotic therapy in infective endocarditis. Expert Rev Cardiovasc Ther. 9 (9), 1203-1219 (2011).
- Heying, R., van de Gevel, J., Que, Y. A., Moreillon, P., Beekhuizen, H. Fibronectin-binding proteins and clumping factor A in Staphylococcus aureus experimental endocarditis: FnBPA is sufficient to activate human endothelial cells. Thromb Haemost. 97 (4), 617-626 (2007).
- Pappelbaum, K. I., et al. Ultralarge von Willebrand factor fibers mediate luminal Staphylococcus aureus adhesion to an intact endothelial cell layer under shear stress. Circulation. 128 (1), 50-59 (2013).
- Claes, J., et al. Adhesion of Staphylococcus aureus to the vessel wall under flow is mediated by von Willebrand factor–binding protein. Blood. 124 (10), 1669-1976 (2014).
- Thiene, G., Basso, C. Pathology and pathogenesis of infective endocarditis in native heart valves. Cardiovasc Pathol. 15 (5), 256-263 (2006).
- Sixma, J. J., Schiphorst, M. E., Verweij, C. L., Pannekoek, H. Effect of deletion of the A1 domain of von Willebrand factor on its binding to heparin, collagen and platelets in the presence of ristocetin. Eur J Biochem/FEBS. 196 (2), 369-375 (1991).
- Theilmeier, G., Lenaerts, T., Remacle, C., Collen, D., Vermylen, J., Hoylaerts, M. F. Circulating activated platelets assist THP-1 monocytoid/endothelial cell interaction under shear stress. Blood. 94 (8), 2725-2734 (1999).
- Bjerketorp, J., Jacobsson, K., Frykberg, L. The von Willebrand factor-binding protein (vWbp) of Staphylococcus aureus is a coagulase. FEMS Microbiol Lett. 234 (2), 309-314 (2004).
- Friedrich, R., et al. Staphylocoagulase is a prototype for the mechanism of cofactor-induced zymogen activation. Nature. 425 (6957), 535-539 (2003).
- Vanassche, T., et al. Fibrin formation by staphylothrombin facilitates Staphylococcus aureus-induced platelet aggregation. Thromb Haemost. 107 (6), 1107-1121 (2012).
- Vanassche, T., et al. The role of staphylothrombin-mediated fibrin deposition in catheter-related Staphylococcus aureus infections. J Infect Dis. 208 (1), 92-100 (2013).
- Buerkle, M. A., Lehrer, S., Sohn, H. Y., Conzen, P., Pohl, U., Krötz, F. Selective inhibition of cyclooxygenase-2 enhances platelet adhesion in hamster arterioles in vivo. Circulation. 110 (14), 2053-2059 (2004).
- Kim, K. H., Barazia, A., Cho, J. Real-time imaging of heterotypic platelet-neutrophil interactions on the activated endothelium during vascular inflammation and thrombus formation in live mice. J Vis Exp. 2 (74), (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены