Method Article
Пространственный и временной анализ активного ERK в
В этой статье
Резюме
Мы представляем метод обработки изображений на основе иммунофлюоресценции для пространственной и временной локализации активного ERK в рассеченной C. Элеганс гонад. Протокол , описанный здесь , может быть адаптирована для визуализации любой сигнализации или структурного белка в C. Элеганс гонад, при условии , подходящим реагентом антитело доступно.
Аннотация
Эволюционно консервативными внеклеточный сигнал трансдукции РТК-RAS-ERK путь является важной киназа-сигнальный каскад , который контролирует множество клеточных и развития процессов , главным образом посредством активации ERK, терминальной киназы пути. Tight регулирование ЭРК деятельности имеет важное значение для нормального развития и гомеостаза; чрезмерно активные ERK приводит к чрезмерной пролиферации клеток, в то время как пониженная ЭРК вызывает гибель клеток. C. Элеганс является мощной моделью системы , которая помогла охарактеризовать функции и регулирование РТК-RAS-ERK сигнального пути в процессе разработки. В частности, путь РТК-RAS-ERK , имеет важное значение для C. Элеганс развитие зародышевой линии, которая находится в центре внимания этого метода. С помощью антител , специфичных к активному, diphosphorylated форме ЭРК (dpERK), стереотипные модели локализации могут быть визуализированы в зародышевой. Поскольку эта модель является одновременно во времени и пространстве Controllе изд, способность к воспроизводимым пробирного dpERK полезен для идентификации регуляторов пути, которые влияют на длительность сигнала dpERK и амплитуду и, таким образом, зародышевую развитие. Здесь показано , как успешно рассекать, пятно и dpERK изображения в C. Элеганс гонад. Этот метод может быть адаптирован для пространственной локализации любой сигнализации или структурного белка в C. Элеганс гонад, при условии , антитело совместим с иммунофлуоресценции доступен.
Введение
Рецепторных тирозинкиназ (РТК) -RAt саркомы (РАН) -Extracellular сигнал регулируемой киназы (ERK) путь реле внеклеточные сигналы через консервативному киназы каскада , что приводит к фосфорилированию и активации ERK 1-3. ERK белки являются членами законсервированного пролина направленной серин / треонин MAP (митоген активированный протеин) киназ, и непосредственно активируются МЕК с помощью двойного фосфорилирования на треонин (Т) и тирозина (Y) сохраняющегося TEY мотива. Активный ЭРК (называемый diphosphorylated ERK или dpERK) , а затем регулирует многие клеточные и процессы , сопровождающие развитие через фосфорилирование батареи ниже по течению субстратов 1-3. Таким образом , ненормальное ERK активность приводит к большому количеству клеток и дефектов развития 4-7.
Строгое регулирование ЭРК деятельности имеет решающее значение для нормального развития: в системах млекопитающих слишком много ERK активность приводит к избыточному ведущих клеточной пролиферациидля онкогенного роста; слишком мало активности приводит к гибели клеток 4,6. Кроме того, изменения в продолжительности ЭРК активности также может привести к различным результатам: в клетках PC12, активацию ERK в течение 30 мин или меньше индуцирует пролиферацию клеток, но активацию ERK в течение 60 мин или более индуцирует дифференцировку нейронов 8,9. Tight регуляция активности ERK, таким образом, очевидно, необходимы для нормального развития и гомеостаза.
C. Элеганс является мощным, и генетически податливым модель системы рассекать функции и регулирование РТК-RAS-ERK сигнального пути 3,10-15. По отношению к системам млекопитающих, которые содержат несколько генов РАН и ERK, C. Элеганс содержит один ген RAS (пусть-60) и один ген ERK (MPK - 1), что делает его генетически более легкое систему , в которой рассекать функцию этого пути 3,10-14. C. Элеганс зародышевой по существу трубка , которая состоит из митотическихстволовые клетки на своем дистальном конце и зрелых ооцитах на своем ближнем конце (рис 1) 16. Половые клетки инициируют мейоз только проксимального к дистальному зоне митоза, и прогресс с помощью расширенного мейоза профазе (пахитены), после чего они начинают формироваться ооциты в области петли, наконец , проходит созревание ооцитов в проксимальной области 16.
Генетические исследования из нескольких лабораторий, в том числе наши собственные, показали , что путь РТК-RAS-ERK имеет важное значение для развития зародышевой в C. Элеганс 12,13,15,17-19. В частности, мы обнаружили , что элементы управления ERK и координирует , по меньшей мере девять различных биологических процессов во время развития зародышевой, начиная от коммутаторов развития , таких как апоптоз зародышевой клетки к клетке биологические процессы , такие как 11,18 роста ооцитов. Так же, как в системах млекопитающих, слишком много ЭРК активности в C. Элеганс результаты зародышевых в производстве нескольких небольших ооцитов, тогда как слишком LiРезультаты ttle активности в одном большом ооцит 11. Таким образом плотно регулирование dpERK имеет важное значение для нормального развития зародышевой. Активная форма ЭРК, как и визуализировали антителом , специфичным к dpERK, отображает стереотипное, динамичный, бимодальный образец локализации: dpERK высока в течение середины пахитене (зона 1, рисунок 1), низко в области петли и высокий снова в зрелые ооциты (зона 2, рисунок 1). В последнее время , мы обнаружили , что питание действует через инсулин-подобный фактор роста рецептора-1 (ДАФ-2) , чтобы активировать ERK в зоне 1 , 12; Предшествующая работа показала , что сигнал спермы (через рецептор тирозинкиназы эфрин) активирует ERK в Зоне 2 13.
Учитывая, что активные ERK функционирует как реостат в зародышевой для регулирования роста ооцитов, пространственной и временной локализации, а также амплитуду dpERK, является ключом к пониманию его нормального результата сигнализации. Используя метод, описанный здесь, изменения встереотипное локализация dpERK можно легко контролировать и прогнозы, полученные на воздействие окружающей среды или генетических возмущений на ЭРК активности и, следовательно, функции. Таким образом, для опробования dpERK дает полное представление о его роли в процессе зародышевого развития.
протокол
Протокол , описанный здесь, в первую очередь для беспозвоночное модельной системы C. Элеганс, и соблюдает все этические принципы , изложенные в учреждении.
1. Техническое обслуживание животных
- Поддерживать C. Элеганс работает маточных культур на нематоде роста среды 20,21 (NGM см Материалы таблицу) агар засевали Е. OP50 палочка.
- Поддержание запасов червя при температуре от 16 ° C до 25 ° C.
Примечание: Культивирование червей при более высоких температурах приводит к более высокими темпами роста, зачастую, развитие отклоняющегося зародышевой и нижних размеров выводка. Кроме того, чувствительные к температуре генотипы будут отображать различные фенотипы при различных температурах. - Передача червей на новые планшеты NGM каждые 2 - 3 дня, в зависимости от скорости их роста так, чтобы поддерживать постоянную подачу сытых червей.
ПРИМЕЧАНИЕ: Для любого данного эксперимента с участием уровней dpERK, черви НЕ должны быть получены от голода или толпыред пластины. Вытеснение или голодание воздействие инсулина сигнализации в глистов 22 и передачу сигналов инсулина регулирует ЭРК 12 деятельности. Таким образом, черви изголодавшимися или перенаселенных пластин приведет к переменным и труднодоступных воспроизведите моделей окрашивания.
2. Препарирование взрослых червей для получения гонад
- Pick 100 - 150 WT (N2) или желаемый генотип червей на желательные и определенной стадии развития (L1, L2, L3, L4, взрослых и т.д..) В 100 мкл буфера M9 в 1,5 мл микроцентрифужных трубки.
- Заполните микроцентрифужных пробирку с 900 мкл буфера M9 (см Материалы таблицу). Центрифуга пробирки при 1000 х г в микроцентрифуге в течение 1 мин при температуре окружающей среды.
- Аккуратно удалите 900 мкл буфера M9 и выбросить. Удалите буфер под рассекает микроскопом, чтобы гарантировать, что черви не случайно удалены.
- Повторите шаги 2.2 - 2.3 еще два раза со свежим M9 буфера каждый раз.Это гарантирует, что любые бактерии, которые были перенесены с червями эффективно смыты.
- После окончательной промывки удалить 900 мкл буфера M9 из трубки и отбрасывать.
- Передача оставшихся 100 мкл M9 буфера, содержащего 100 - 150 червей с наконечником 200 мкл-микропипетки с плоским дном стекла часов блюдо. Убедитесь в том, что кончик микропипетки разрезают на отметке 10 мкл перед использованием. Не резки наконечник приведет к стрижке червей.
- Добавьте 1 - 3 мкл 0,1 М левамизола к стеклу часов чашку, содержащую червей в буфер М9. Аккуратно вихревой левамизол и М9, чтобы позволить даже смешиваться, пока черви не перестанут двигаться.
Примечание: Левамизол запасы можно хранить при температуре -20 ° С в течение длительного хранения. При этом используют более высокую концентрацию 1 - 3 мм , чем то , что было описано в литературе 23 0,2 - 0,25 мМ левамизола, чтобы получить быструю потерю подвижности у животных. Если животные содрать вокруг слишком лОнг в жидкой суспензии, полученные образцы dpERK в гонадах может быть переменной (из-за стресса или недостатка питания или обоих). Более воспроизводимые модели окрашивания были достигнуты с 1 - 3 мМ левамизол для рассечения. - Прикрепите две иглы 25 G к двум шприцами 1 мл (размер шприца не имеет значения, датчик иглы имеет решающее значение). Позиция один шприц в каждой руке (рисунок 2).
- Под микроскопом рассекает, поместите каждую иглу под и над каждым червем , как показано на рисунке 2 и поместить точную резку на червя вблизи второй глоточной лампочкой в ножницам , как движение. После одного разреза в червя перейти к следующему животному, пока все животные в блюдо не были сокращены, по крайней мере один раз.
Примечание: Помните, что шаги 2.8 - 2.9 являются чувствительным ко времени. Проанализируйте все червей в блюдо в возрасте до пяти минут для воспроизводимой шаблона dpERK. Более длительное время рассечение приведет к выключив сигнала dpERK, особенно в Zодин 1. Отрегулируйте количество червей на раунд рассечения (то есть 50 червей против 150) , если это необходимо , чтобы остаться в отведенный срок.- В случае экструдированный гонад не виден во время вскрытия, не пытайтесь другой разрез в том же животном. Как правило, это будет только сдвигать животное и не приводят к экструзии гонады. Вместо этого перейдем к следующему животному. Черви, где гонады не экструзию будут появляться в качестве таковых на слайдах, которые будут сделаны в разделе 6 и могут быть проигнорированы во время съемки
Примечание: Через все рассечение и обработки шагов, важно иметь в виду, что гонады будет оставаться прикрепленной к корпусу / каркаса. Не заставляйте гонады и тело на части с иглой. Часто аберрантный разрыв в гонадной ткани в попытке разорвать гонады из организма может привести к ложному сигналу антитела. Тело / туши можно пренебречь во время стадий обработки изображений (раздел 6), и только гонад образ. Кроме того, сомаetimes кишечные клетки могут также служить в качестве внутреннего контроля / управления соматические для антитела, подвергаемые исследованию.
- В случае экструдированный гонад не виден во время вскрытия, не пытайтесь другой разрез в том же животном. Как правило, это будет только сдвигать животное и не приводят к экструзии гонады. Вместо этого перейдем к следующему животному. Черви, где гонады не экструзию будут появляться в качестве таковых на слайдах, которые будут сделаны в разделе 6 и могут быть проигнорированы во время съемки
3. гонад Фиксирование
- После того, как рассечение завершено, добавьте 2 мл 3% параформальдегида (PFA) непосредственно на стекло часов блюдо, содержащую 100 мкл M9 и рассеченных животных и накрыть парафильмом. Поместите покрытую часы стеклянную посуду в химическом вытяжном шкафу.
Внимание: PFA является опасным химическим веществом. Таким образом, фиксация должна быть выполнена в химическом вытяжном шкафу. - Инкубируют при комнатной температуре в течение 10 мин.
- Использование одноразового использования 9 "стекло пипетки Пастера добавить 3 мл 1x PBS-T (см Материалы таблицы) в часы стеклянную посуду , содержащую расчлененный животных. Смешать рисуя раствора PFA и 1x PBS-T с рассеченными животными в Пастера пипетку и выпуская аккуратно обратно в часы стеклянную посуду. не вихре трубки во время мытья.
- С помощью Freш стекло пипетки Пастера привлечь 5 мл жидкости (содержащей расчлененный червей, PFA и 1x PBS-T) из стеклянной посуде часов в пипетку Пастера и передать содержимое в 5 мл свежей стеклянной конической трубе.
- Центрифуга конические пробирки в течение 30 секунд в клинической центрифуге при 1000 х г. Используйте стеклянные пипетки Пастера и конические пробирки, как расчлененный яичники придерживаться пластика.
- Удаляют супернатант заботиться, чтобы не мешать расчлененный животных. Удалите жидкость после каждой промывки от конической трубе при рассекает микроскопом, чтобы не влиять на расчлененный гонады, и минимизировать их потери.
- С помощью свежей пипетки Пастера, добавляют 5 мл 1x PBS-T в конические пробирки. Центрифуга конические пробирки в клинической центрифуге в течение 30 с при 1000 об х г. Удаляют супернатант заботиться, чтобы не мешать расчлененный животных.
- Повторите шаг 3.7 в общей сложности три раза.
- Использование свежей пипетки Пастера, добавьте 2 мл 100%метанол в пробирки, и осторожно перемешать гонад с метанолом, разработав в пипетку Пастера. Инкубируйте пробирку при -20 ° С в течение как минимум 1 ч.
Примечание: расчлененный гонады могут храниться в метаноле в течение до 2-х дней для dpERK окрашивания. Хранение в течение более 2-х дней и до 2-х недель, совместим с другими приложениями с использованием меченых антител, таких как анти-Lamin антителом, но не с антителом dpERK. - По истечении заданного времени инкубации, повторите шаг 3.7 в общей сложности три раза для того, чтобы вымыть гонады. Не вихре трубки во время мытья. После окончательной промывки оставить 500 мкл 1X PBS-T в конической трубе 5 мл.
- Использование свежей пипетки Пастера переноса содержимого конической стеклянной трубки в свежий 1 мл стеклянной трубки (6 мм х 50 мм). Дайте рассеченные животных осесть под действием силы тяжести в течение 5 - 10 мин.
- Использование свежей пипетки Пастера и под микроскопом рассекает, удалить как можно больше стирке, насколько это возможно от 1 мл стеклянных трубок остроумияХаут тревожа расчлененный гонады.
4. Блокирование и первичное антитело Лечение
- Добавьте 100 мкл 30% нормальной козьей сыворотки (NGS) , разведенного в 1x PBS-T (см таблицу) Материалы к вскрытых животных в 1 мл стеклянные пробирки. 30% NGS служит в качестве блокирующего буфера. Накройте трубку парапленкой, чтобы избежать испарения жидкости. Инкубируют при комнатной температуре в течение 1 ч или при 4 ° С в течение ночи.
- По истечении заданного времени инкубации, удалите блокирующий буфер, используя свежий пипетку Пастера, удаляя столько жидкости, сколько это возможно. Используйте рассекает микроскоп, чтобы убедиться, что яичники не составлены в пипетку Пастера.
- Развести антитело MAPKYT (см Материалы таблицу, о которой говорится в этом методе в качестве dpERK) в соотношении 1: 400 в 30% NGS. Подготовьте достаточное количество разведения антител использовать 100 мкл на пробирку. Неиспользованный, разбавленный антитело можно хранить при температуре 4 ° С в течение недели.
- Добавьте 100 мкл разведенного антитела против dpERK таклюция к 1 мл стеклянные пробирки, содержащие расчлененный животных. Уплотнение трубок с парафильмом. Инкубировать пробирки при температуре 4 ° С в течение ночи.
- После инкубации в течение ночи, добавляют 800 мкл 1x PBST в пробирки при комнатной температуре.
- Draw образец в свежей стеклянной пипетки Пастера и отпустить осторожно, чтобы гарантировать, что гонады равномерно взвешенном состоянии в 1х PBS-T. Пусть гонады оседают на дно с гравитацией. Удалить супернатант. Это гарантирует, что расчлененный гонады моют, но не были повреждены во время процесса.
- Повторите шаги 4.5 - 4.6 в общей сложности трех стирок. Не вихре трубки во время мытья. После третьей промывки не забудьте удалить и выбросить как можно больше супернатант насколько это возможно, не нарушая расчлененный животных. Убедитесь в том, что свежие пипетки Пастера используется каждый раз.
5. Антитело Лечение Вторичный
- Во время первичного антитела смывки готовят разбавлением на второе антитело. Развести анти-мышиного С.Е.condary антитела в соотношении 1: 500 в 30% NGS. Как и в случае с первичным антителом, используют в количестве 100 мкл на пробирку. Неиспользованный антитела можно хранить при температуре 4 ° С в течение недели.
- Добавьте 100 раствор вторичного антитела мкл к 1 мл стеклянные пробирки, содержащие расчлененный животных. Накройте каждую пробирку парафильмом, а затем обернуть трубы в алюминиевую фольгу, чтобы сохранить содержимое трубки в темноте. Инкубировать пробирки при комнатной температуре в течение 2 ч, или в качестве альтернативы при 4 ° С в течение ночи.
- По истечении заданного времени инкубации, добавьте 800 мкл 1X PBS-T в пробирки и повторите шаги 4.5 - 4.6 в общей сложности три раза. После последней промывки, удалить и выбросить, как большая часть надосадочной жидкости, как это возможно под микроскопом рассекает с использованием свежей пипетки Пастера.
- Приготовьте раствор DAPI во время промывки для вторичного антитела. Развести 1 мкл DAPI (из 1,000x запаса 1 мг / мл хранили при -20 & deg; C) ин- 1 мл 1x PBST.
- Добавьте 800 мкл разведенного раствора DAPI в пробирки, содержащиерассеченные животных. Накройте рот трубки с Parafilm, и обернуть каждую пробирку алюминиевой фольгой. Инкубируют при комнатной температуре в течение 20 мин.
- После инкубации с DAPI, удалить как можно больше раствора DAPI, насколько это возможно со свежим пипеткой Пастера, под микроскопом рассекает так, чтобы не мешать рассеченных животных.
- Добавьте 1 каплю решение для монтажа к трубам. Оберните каждую пробирку алюминиевой фольгой.
ПРИМЕЧАНИЕ: Для визуализации dpERK окрашивания, окрашивали гонады должен быть установлен для микроскопии немедленно. Для других антител приложений, таких как фосфорилируется серина 10 гистона H3, гонады могут быть сохранены в СМИ для монтажа до 2-х недель при температуре 4 ° С в темноте.
6. Сборка и обработка изображений Слайды
- Поместите слой лаборатории ленты в продольном направлении , сверху, из двух предметные стекла микроскопа (25 мм х 75 мм х 1 мм) , как показано на рисунке 3. Поместите свежий чистый предметное стекло микроскопа между двумя заклеенными горками.
Примечание: Толщиналенты помогает генерировать агарозы накладку на среднем слайде. Толщина агарозном площадки практически равна ленты, так как лента служит в качестве распорки для создания агарозном площадку. - Падение ~ 200 мкл растопленным 2% агарозы (сделано в дистиллированной воде), на предметном стекле микроскопа в середине. Быстро поместить свежий чистый слайд, перпендикулярно и на вершине, из агарозы.
- Пусть агарозном затвердевает (1 - 2 мин).
- Удалить верхний стекло микроскопа очень осторожно, так, что агароза подушка не разрушается. Агарозы накладка может оставаться прикрепленной либо к верхней или нижней слайда. Не имеет значения, которые скользят агарозном подушка остается прикрепленной к, до тех пор, как она является гладкой поверхностью агарозы.
- С помощью пипетки Пастера перенести расчлененный животных на агарозном площадку. Удалите лишнюю жидкость из слайда с помощью пипетки Пастера под рассекает микроскопом.
- Использование волос ресниц или тонко нарисованный капилляр, толкать гонад и кишечникпуть друг от друга для того, чтобы распространить гонады на слайде.
- Покройте стекло микроскопа с покровным размером х 50 мм на 24 мм. Позаботьтесь, чтобы убедиться, что покровное осторожно опускают на слайде с минимальным воздушные пузырьки образуются между покровным и горкой.
- Хранить при температуре 4 ° С в течение ночи в коробке слайдов (непрозрачной слайд коробки с горок лежа, покровное вверх), чтобы избыток жидкости испаряться и гонады, чтобы стать несколько уплощена (из-за веса покровного на гонады). Небольшое уплощение гонад позволяет лучше визуализации в противном случае круглой трубы гонад.
- После того, как покровное монтируется, не оказывать давление на верхней части покровного с пальцами. Часто это приводит к искажению гонад и потери сигнала dpERK.
- Свести гонады на ночь только для более эффективной визуализации. Слайды готов к просмотру, как только они будут собраны. Для того, чтобы немедленно принять образы, мягко поглощаютизбыток жидкости между покровным и ползуна из углов с помощью чистой ткани лаборатории.
- После ночной период, печать слайдов и покровное с прозрачным верхним слоем лака для ногтей по четырем углам покровного и границы слайда. Лак для ногтей / покровное уплотнение гарантирует, что покровное не двигается во время визуализации и защищает от разрушения образцов.
- Изображение гонады с соединением микроскопа при 63x. Однако линза объектива и микроскопа можно варьировать в зависимости от наличия в микроскопах и пользовательского приложения. Поскольку размер всего гонад от пролиферативного области к ооцитов больше , чем может быть захвачено в одном изображении, изображения принимаются как монтаж с перекрывающимися границами , как показано на рисунке 4. 11-14, 18.
- Во многих случаях, редактировать тушу после окончательной обработки изображений и сборки, пока никаких серьезных изменений не выполнены в зародышевой изображения. магазин тон сырые изображения вдоль собранного изображения для обеспечения возможности сравнения «до» сборки / монтажа и 'после' сборки / редактирования изображений.
Примечание: микроскопия изображения не должны быть изменены для силы сигнала или насыщения во время сборки монтажа.
- Во многих случаях, редактировать тушу после окончательной обработки изображений и сборки, пока никаких серьезных изменений не выполнены в зародышевой изображения. магазин тон сырые изображения вдоль собранного изображения для обеспечения возможности сравнения «до» сборки / монтажа и 'после' сборки / редактирования изображений.
Результаты
В WT взрослых гермафродитных животных, dpERK обычно визуализируется в середине пахитены области, зоны 1, а в наиболее зрелых ооцитов от -1 до -4 или -5 (зона 2). Возмущения в этой модели активации отражают изменения сигнального пути. Женский germlines не уточняют спермы, и , таким образом , не проявляют активацию ERK в зоне 2, только слабой активации в зоне 1. Они представлены на рисунке 5.
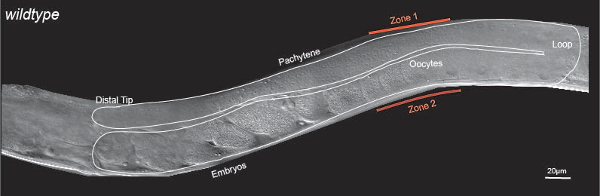
Рисунок 1: C. Элеганс зародышевой Морфология. Дифференциальная интерференционного контраста (ДИК) изображение взрослого гермафродита с одной U-образной гонад руки обведены белой линией. Взрослый гермафродитами гонад содержит митотических клеток на дистальном кончике. Митотические клетки вступают в мейоз и прогресс через мейоза профазе (пахитены) развивается в Матуре ооциты в проксимальном гонад. Зона 1 и Зона 2 знака стереотипное локализации dpERK во взрослом гермафродитической гонады. Масштаб:. 20 мкм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
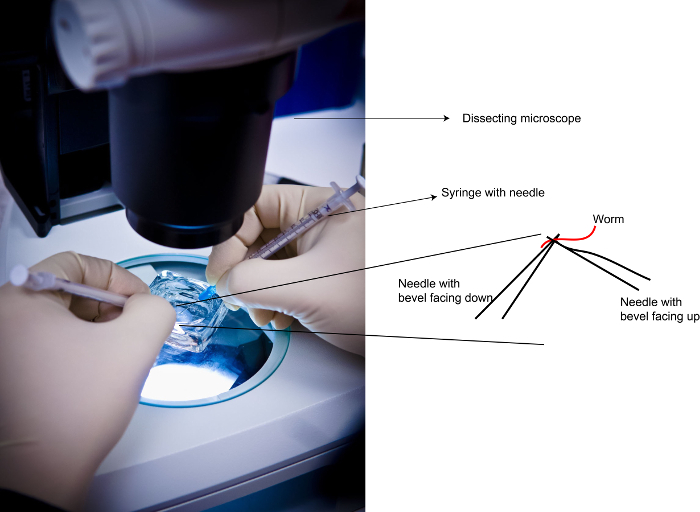
Рисунок 2: Демонстрация игольчатые позиций во время вскрытий . Слева: Фотография рассечения в процессе. Справа:. Игольчатые позиции со ссылкой на червя Пожалуйста , нажмите здесь , чтобы увидеть большую версию этой фигуры.

Рисунок 3: Демонстрация слайдов Агарозном Подготовка. (A) Поместите ленту lengthwisе через 2 чистые предметные стекла микроскопа. Поместите свежий чистый стекло микроскопа между двумя предметными стеклами с лентой, как показано на рисунке. Три горки рядом друг с другом в продольном направлении . (В) Add расплавленную агарозу к слайду в центре. (C) Поместите свежий стекло микроскопа перпендикулярно, и на вершине, средний слайд, несущий каплю агарозы. ( D) Разрешить агарозы , чтобы затвердеть. (Е) Снимите верхний слайд , оставляя за затвердевшего агарозном площадку. Используйте нижний слайд с агарозном площадку для монтажа расчлененных и окрашивали germlines. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
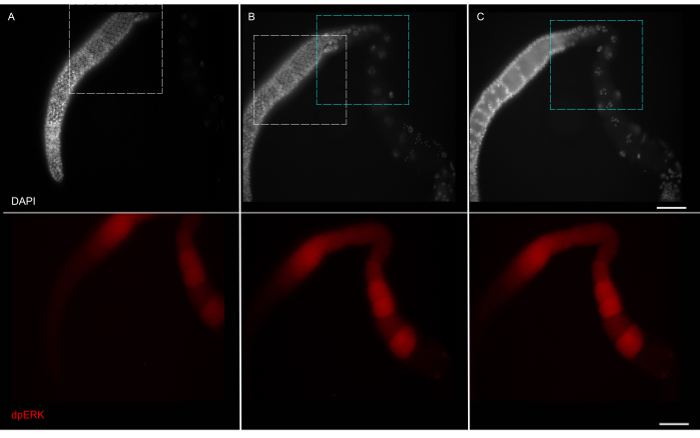
Рисунок 4: Визуализация слайдах как Montage Montage дикого типа зародышевой с DAPI (т.ор) и канал dpERK (внизу). Изображения, полученные при 63x с перекрытием границы, были взяты белые коробки для панели А и В и зеленые коробки для панели B и C. DAPI и dpERK изображений для каждой панели одновременно в двух разных каналах. Собранное изображение показано на рисунке 5А. Шкала бар:. 20 мкм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
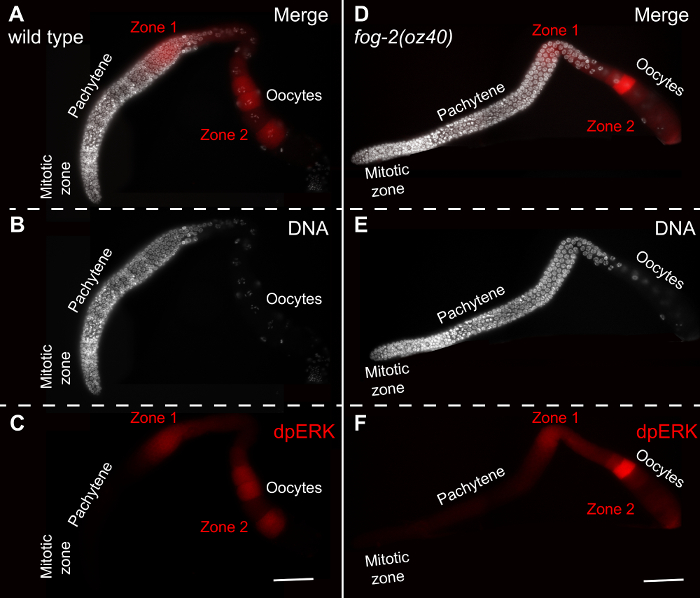
Рисунок 5: Динамическая временная / пространственная активация ERK. (AC) WT (N2) для взрослых (24 часа мимо середины L4 стадии развития) гермафродитные germlines окрашивали ДНК (B, DAPI, белый) и dpERK (C, красный). Сигнал dpERK в зоне 1, область пахитены и Zone 2, зрелых ооцитов подсвечивается. (DF)Туман-2 (oz40) женские germlines (через 8 ч мимо середины L4 стадии развития) окрашиваются по ДНК (Е, DAPI) и dpERK (F). Молодые женщины-germlines дисплей слабый dpERK в зоне 1, и в одном ооцита в спермы независимым образом. Зона 2 зависит спермы, и, таким образом, отсутствует в женском зародышевой. Шкала бар:. 20 мкм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Активный ЭРК (dpERK) следует стереотипную пространственную и динамическую картину локализации в C. Элеганс зародышевой. Это стереотипное dpERK пространственная структура (рисунок 5), а амплитуда у взрослого C. Элеганс гонад, может быть эффективно коррелируют со многими биологическими процессами , которые регулируют ЭРК. Например, неспособность активировать ERK в Зоне 2 приводит арест в ооциты в профазе мейоза, фенотип наблюдается у самок germlines , которые не указывают спермы, и , таким образом , не активируют ERK в зрелых ооцитов (рисунок 5). Спаривание с результатами самцов в процессе эффективного накопления dpERK в Зоне 2 в женских germlines 11,13, в сочетании с началом созревания ооцитов и овуляции. Таким образом, анализ пространственных структур и временной активации dpERK при определенных генетических возмущений (таких как РНК-интерференции, опосредованной инактивации генов) или химической обработки позволяет идентифицировать факторы, которые Reguв конце передачи сигналов ERK и, таким образом, ERK-зависимые биологические процессы. Такие анализы позволяют также открытие новых генетических взаимодействий между сигнальными путями.
Критическим узким местом для любого на основе анализа изображений является наличие функциональных реагентов, таких как антитела, которые являются специфическими для приложения. Если такой реагент существует, то методы, такие, как описанный выше, может быть легко адаптирована для анализа локализации шаблона для любого белка, представляющего интерес. Приложение, таким образом, ограничивается наличием функционирующего антитела. Кроме того, так как метод описывает рассечение и окрашивания в определенный момент времени развития, он позволяет только захват информации в один период времени, и не пролить свет на динамику или регуляции белка в режиме реального времени или скорости оборота белка.
Описанный выше метод заимствован из Francis и др. 23, которая отличается от Сейду и Dunn меню 24 для гонад экструзии и с использованием меченых антител. Метод , основанный на Francis и др. Будет называться "метод подвески" и метод Сейду и Dunn называется «замораживать растрескиванию метод" для сравнения. Метод подвески была очень эффективна в наших руках для получения воспроизводимых моделей локализации сигнальных молекул, таких как dpERK, которые по своей природе более чувствительны к суровым условиям обработки. В случае локализации dpERK, в нашем опыте, сигнал в зоне 1 практически невозможно обнаружить с помощью метода сублимационной растрескиванию. Кроме того, образец для сушки, которые часто могут возникать с методом сублимационной растрескиванию, приводит к паразитных сигналов антител. Способ подвески сводит к минимуму образец сушки, так как гонады подвешены в жидкости в течение всего процесса. Мы также считаем, что метод подвески полезно для получения изображений нескольких различных генотипов на одном слайде. Например, если два генотипы, такие как гермафродитов противСамки должны быть непосредственно по сравнению локализации dpERK, два генотипы могут быть смешаны вместе и обработаны. Это возможно потому , что фенотипы различны и могут быть выделены с помощью DAPI морфологией. Окрашивание в той же трубе с последующей обработки изображений на одном предметном стекле позволяет для прямого сравнения между половыми железами разных генотипов. В качестве альтернативы, если DAPI морфологию не различимы, а затем с использованием меченых антител двухступенчатый может быть принят. Во-первых каждый отдельный генотип обрабатывают двумя различными антителами, Антитело А при WT и антителу B для мутанта (оба антитела должны быть подняты в хозяине, отличной от антитела dpERK). После того, как два генотипы были окрашены с первичным антителом, и промывают, они могут быть смешаны друг с другом в одной трубке, и теперь окрашивали антителом dpERK, с последующей обработкой вторичным антителом для визуализации всех антител в трубке. Возможность сравнения различных генотипов на одном слайде, особенно когда deductions паттернов активации делаются обеспечивает высокую точность интерпретации не затронутых различных условий окрашивания.
В то время как выгодно, есть несколько шагов, на протяжении метода подвески, которые требуют тщательного манипуляций. Очень важно, что диссекция происходит в то время, эффективным образом; важно то, что диссекция не следует принимать в течение 5 мин. Более длительное время рассечение в результате переменного сигнала dpERK, которые часто могут быть неверно истолкованы как регулируемые изменения в активации ERK, а не в качестве технических сбоев. Крайне важно, чтобы начать с более чем 100 - 150 животных для каждого рассечение, потому что на протяжении различных мытья шаги гонады могут быть легко потеряны из труб из-за ошибок при использовании пипеток. Потеря гонад может быть уменьшена либо путем рассечения в нескольких небольших партий (например, три порции по 50 животных в каждой), которые могут быть объединены, или рассечением одну крупную партию 150. Еще одной проблемой становится все гонады лежать в хорошо разнесены формированиена слайде таким образом, что весь дистальный гонад может быть отображена. Для включения этого использовать ресничку на спичкой или запряженных пипеткой в космос из гонад. Тем не менее, следует соблюдать осторожность, чтобы не повредить гонады во время этого процесса. Часто с этими методами она занимает несколько попыток овладеть вскрытий, а также аранжировки гонад на слайдах.
После того, как эта техника была освоена, она служит мощным методом для различных биологических анализов, и может быть использовано для изучения более чем просто уровней dpERK. Например, этот метод может быть использован для визуализации активных уровней р38 или активных уровней CDK или любой белок, для которых реагент антитела существует. Кроме того, способ может быть соединен с экраном химическое ингибирование в целых животных для анализа на новых ингибиторов или активаторов пути, с помощью анализа на уровне dpERK. Это позволит для считывания в естественных условиях обоих реакции и чувствительности к любым ингибиторам , которые могут ИНТeract с сигнального пути РТК-RAS-ERK. Более того, этот метод может быть использован в комбинации с антителом несколькими выходами сигнализации, которые могут быть использованы и визуализированных в одно время. Использование нескольких антител позволяет корреляцию между несколькими путями, их статус активации, и результаты все в пределах той же ткани, что позволяет более глубокое понимание этих взаимодействий. Это всего лишь несколько примеров дальнейшего применения этого метода, но эта система может быть изменена для изучения нескольких научных интересов.
Раскрытие информации
The authors declared that no competing interests exist.
Благодарности
Work in the Arur Lab is supported by grants from the National Institutes of Health, NIHGM98200; Cancer Prevention Research Institute of Texas, CPRIT RP160023; the American Cancer Society Research Scholar Award (ACS RSG014-044-DDC); and by the Anna Fuller Funds.
Материалы
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma Inc. | A9539 | Dissolve 2 g in 100 mL to make the 2% solution |
| Flat bottom glass watch dish | Agar Scientific | AGL4161 | We use glass because dissected gonads often stick to plastic |
| 25 G needles | BD PrecisionGlide | 305122 | |
| Syringes (could be 1 or 5 mL) | BD Syringes | 1 mL: BD 309659 | |
| Microscope slides (25 x 75 x 1.0 mm) | Fisherbrand | 12-550-343 | |
| Coverslips (24 x 50 mm) | Corning | 2935-245 | |
| 5 mL glass conical tube | Corning | 8060-5 | |
| 9" disposable Pasteur pipette | Fisherbrand | 13-678-20D | |
| Clinical bench top centrifuge | |||
| Glass tubes (6 x 50 mm) | Fisherbrand | 14-958-A | |
| *M9 solution | |||
| Levamisole | Sigma | L9756 | |
| 3% Paraformaldehyde (PFA) | Electron microscopy services | 17500 | Obtained as 16% solution in ampoules, and diluted to 3% in Potassium Phosphate Buffer |
| 1x PBS-T | 1x PBS with 0.1% Tween 20 | ||
| Methanol | Electron microscopy services | 18510 | |
| Normal goat serum (NGS) | Cell Signaling | 5425 | Diluted to 30% in 1x PBS-T |
| MAPKYT (dpERK) antibody | Sigma Inc. | M9692 | Dilution 1:400 in 30% NGS |
| Secondary antibody | Invitrogen | A-11005 | Dilution 1:500 in 30% NGS |
| DAPI | Sigma | D9542 | |
| Vectashield | Vector Labs | H-1000 | |
| *M9 Buffer Recipe | 3 g KH2PO4, 6 g Na2HPO4, 5 g NaCl, 1 mL 1 M MgSO4, H2O to 1 L. | ||
| **PBS (1x) | 8 g NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4, 0.133 g CaCl2, 0.10 g MgCl2, H2O to 1 L | ||
| Nematode Growth Medium (NGM) | 3 g NaCl, 17 g Agar, 2.5 g Peptone, 975 mL of water in 2 L Erlenmayer Flask. Autoclave for 50 min. Cool, and add 1 mL of 1 M CaCl2, 1 mL of 5 mg/mL cholesterol, 1 mL of 1 M MgSO4 and 25 mL of 1 M KPO4. |
Ссылки
- Chang, L., Karin, M. Mammalian MAP kinase signalling cascades. Nature. 410, 37-40 (2001).
- McKay, M. M., Morrison, D. K. Integrating signals from RTKs to ERK/MAPK. Oncogene. 26, 3113-3121 (2007).
- Sundaram, M. V. Canonical RTK-Ras-ERK signaling and related alternative pathways. WormBook. , 1-38 (2013).
- Fabregat, I., Roncero, C., Fernandez, M. Survival and apoptosis: a dysregulated balance in liver cancer. Liver Int. 27, 155-162 (2007).
- Hackett, A., Rowe, L. FGFR1 Pfeiffer syndrome without craniosynostosis: an additional case report. Clin Dysmorphol. 15, 207-210 (2006).
- Murphy, L. O., Blenis, J. MAPK signal specificity: the right place at the right time. Trends Biochem Sci. 31, 268-275 (2006).
- Vogels, A., Fryns, J. P. Pfeiffer syndrome. Orphanet J Rare Dis. 1, 19 (2006).
- Klesse, L. J., Meyers, K. A., Marshall, C. J., Parada, L. F. Nerve growth factor induces survival and differentiation through two distinct signaling cascades in PC12 cells. Oncogene. 18, 2055-2068 (1999).
- Marshall, C. J. Specificity of receptor tyrosine kinase signaling: transient versus sustained extracellular signal-regulated kinase activation. Cell. 80, 179-185 (1995).
- Chang, C., Sternberg, P. W. C. elegans vulval development as a model system to study the cancer biology of EGFR signaling. Cancer Metastasis Rev. 18, 203-213 (1999).
- Lee, M. H., et al. Multiple functions and dynamic activation of MPK-1 extracellular signal-regulated kinase signaling in Caenorhabditis elegans germline development. Genetics. 177, 2039-2062 (2007).
- Lopez, A. L., et al. DAF-2 and ERK couple nutrient availability to meiotic progression during Caenorhabditis elegans oogenesis. Dev Cell. 27, 227-240 (2013).
- Miller, M. A., et al. A sperm cytoskeletal protein that signals oocyte meiotic maturation and ovulation. Science. 291, 2144-2147 (2001).
- Ohmachi, M., et al. C. elegans ksr-1 and ksr-2 have both unique and redundant functions and are required for MPK-1 ERK phosphorylation. Curr Biol. 12, 427-433 (2002).
- Church, D. L., Guan, K. L., Lambie, E. J. Three genes of the MAP kinase cascade, mek-2, mpk-1/sur-1 and let-60 ras, are required for meiotic cell cycle progression in Caenorhabditis elegans. Development. 121, 2525-2535 (1995).
- Hubbard, E. J., Greenstein, D. The Caenorhabditis elegans gonad: a test tube for cell and developmental biology. Dev Dyn. 218, 2-22 (2000).
- Arur, S., et al. MPK-1 ERK controls membrane organization in C. elegans oogenesis via a sex-determination module. Dev Cell. 20, 677-688 (2011).
- Arur, S., et al. Multiple ERK substrates execute single biological processes in Caenorhabditis elegans germ-line development. Proc Natl Acad Sci U S A. 106, 4776-4781 (2009).
- Mattingly, H. H., Chen, J. J., Arur, S., Shvartsman, S. Y. A Transport Model for Estimating the Time Course of ERK Activation in the C. elegans Germline. Biophys J. 109, 2436-2445 (2015).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77, 71-94 (1974).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Dorman, J. B., Albinder, B., Shroyer, T., Kenyon, C. The age-1 and daf-2 genes function in a common pathway to control the lifespan of Caenorhabditis elegans. Genetics. 141, 1399-1406 (1995).
- Francis, R., Barton, M. K., Kimble, J., Schedl, T. gld-1, a tumor suppressor gene required for oocyte development in Caenorhabditis elegans. Genetics. 139, 579-606 (1995).
- Seydoux, G., Dunn, M. A. Transcriptionally repressed germ cells lack a subpopulation of phosphorylated RNA polymerase II in early embryos of Caenorhabditis elegans and Drosophila melanogaster. Development. 124, 2191-2201 (1997).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены