Method Article
Рассечение Слуховые Буллы в постнатальном мышей: Выделение среднего уха Кости и гистологический анализ
В этой статье
Резюме
We present a protocol to isolate the auditory bulla, capsule, and ossicles from postnatal mice for whole mount and histological analysis.
Аннотация
У большинства млекопитающих, слуховые косточки в среднем ухе, в том числе молоточка, наковальни и стремени, являются самыми маленькими кости. У мышей, костная структура, называемая слуховая булла дома Косточки, в то время как слуховой капсулы окружает внутреннее ухо, а именно улитку и полукружные каналы. Мышиные косточками имеют важное значение для слуха и, таким образом, представляет большой интерес для исследователей в области отоларингологии, но их метаболизм, развитие и эволюция являются весьма актуальными и в других областях. Измененный костный метаболизм может повлиять на функцию слуха у взрослых мышей, а также различных генов-дефицитных мышей показывают изменения в морфогенезе слуховых косточек в утробе матери. Хотя мышиные слуховые косточки крошечные, их манипуляции осуществимо, если человек понимает их анатомической ориентации и 3D-структуру. Здесь мы опишем, как рассекают слуховую буллу и капсулу послеродовых мышей, а затем изолировать отдельные косточки путем удаления части буллы. Мы также обсудим, как EMкровать булла и капсулы в различных направлениях для создания парафином или замороженные срезы, пригодные для получения продольных, горизонтальных или фронтальных разделов молоточка. Наконец, мы перечисляем анатомических различий между мышью и слуховыми косточками человека. Эти методы были бы полезны при анализе патологических, развития и эволюционные аспекты слуховых косточек и среднего уха у мышей.
Введение
Три слуховые косточки среднего уха, а именно молоточек, наковальня и стремя, образуют млекопитающим специфические слуховую цепь , которая осуществляет передачу звука от барабанной перепонки во внутреннее ухо, или улиткой 1,2. Слух функция может быть оценена на мышах путем измерения слуховую стволомозговые Response (ABR) порогов 3-6, и вибрация молоточка позади барабанной перепонки можно контролировать с помощью лазерной доплеровской виброметрии (LDV) 7. Объединив ABR, LDV и измерения продукта искажения отоакустической эмиссии (DPOAE), проводящая потеря слуха может быть различен с нейросенсорной обесценения 8.
Модели на животных условий уха необходимы, учитывая важность слуха и здоровья уха к благополучию пациентов всех возрастов. Например, средний отит является чрезвычайно распространенной инфекцией уха видел в человеческих младенцев и детей, и тяжелые, острый средний отит и его осложнения могут возникнуть, если кондиционция не лечится с помощью соответствующих антимикробных 9. Мышиные модели отита могут оказаться полезными в понимании патогенеза и в разработке методов лечения 10,11.
Мышиные косточками, которые (для goniale части молоточка исключением) образованы эндохондральной окостенения 12,13, имеют непосредственное отношение к изучению костного метаболизма и морфогенеза. Во- первых, их небольшой размер позволяет производить анализ с высоким разрешением костей с интактным надкостницы с использованием рентгеновской флуоресцентной микроскопии или 14. Во- вторых, аберрантное костного метаболизма, таких как избыток или недостаток костной резорбции или обесцененных взаимодействий между клетками костной ткани 15, могут быть проанализированы в качестве потенциального вкладчика к потере слуха 3,4,7. В- третьих, ненормальное косточка морфогенез сообщается в нескольких генов мышей с дефицитом, таких как животных , не имеющих Hoxa2 16-19 MSX1 20-22, Prrx1 23, Goosecoid(РКГ) 24,25, Bapx1 13, Tshz1 26, Dusp6 (Mkp3) 27, Noggin (Ног) 28, Fgfr1 29, гормонов щитовидной железы рецепторов (тра, Thrb) 5, BCL2 30 и другие 1,31, или у мышей с гиперэкспрессией Hoxa2 32. И, наконец, несмотря на их небольшие размеры, структуры , связанные с косточками , таких как мышцы и суставы 33 34,35 доступны.
Косточки Mouse меньше человеческих косточками, но следует отметить, что мышь среднего уха не является уменьшенной версией своего человеческого аналога. Например, у мышей, то стремянный артерия, которая проходит через кольцо стремени, сохраняется на протяжении всей жизни 36, в то время как у человека, эмбриональная стремянный артерии исчезает во время беременности. Кроме того, морфология молоточка мыши отличается от гое кости человека (рисунок 6). У мышей, слуховая (барабанная) булла окружает заполненные воздухом полости среднего уха, в то время как у людей, мастоидные клетки воздуха , состоящие из губчатой кости в височной кости находится Косточки , а не гутрашса 37. У обоих видов, слуховая капсула (ушные капсулы, костный лабиринт) замыкает улитку и полукружные каналы внутреннего уха. Сравнительная и эволюционная биология среднего уха широко рассмотрено 38-40.
Протокол Ниже приводится первый описывает, как рассекать из слуховую буллу и капсулы, которые состоят в основном из среднего уха и внутреннего уха, соответственно. Этот протокол также демонстрирует, как изолировать молоточек, наковальня и стремя из слуховом буллы. И, наконец, он показывает, как ориентировать слуховую буллу и капсулы для встраивания в рамках подготовки к ткани секционирования слуховых косточек.
протокол
Все процедуры на животных, проведенные в этом исследовании одобрены Университета Кейо Institutional Уход за животными и использование комитета (IACUC - номер официального утверждения: 09221) и следуйте институциональные рекомендации по экспериментированию животных при Университете Кейо для использования животных в научных исследованиях. Человеческие особи были изолированы от трупа, подаренной кафедры анатомии, Кейо школы медицины университета, и были использованы в соответствии с институциональными нормами.
1. Выделение Слуховые Буллы и Capsule
- Эвтаназии мышей в банку, содержащую платформу над бумажными полотенцами, смоченными в изофлуран или севофлурана до респираторная вентиляция не прекращается в течение более чем мин, а затем выполнять цервикальной дислокации. Будьте осторожны, чтобы избежать прямого контакта мышей с пропитанных бумажных полотенец.
- Сделайте небольшой поперечный разрез на спинной стороне шеи и потянуть кожу в разные стороны по направлению к голове и хвост, используя обе руки, чтобы выставить основной мю шеиSCLE ткани.
- Обезглавьте мышей в шейной области, используя 14 см острые хирургические ножницы.
- Пил кожи полностью к носу. Срезать всю кожу вместе с мордой и резцами.
- Вставьте ножницы в рот и разрезают жевательные мышцы с обеих сторон.
- Осторожно откройте челюсть и удалить язык и нижнюю челюсть вместе.
- Используя острые ножницы, колотый черепа и основания черепа на две половины вдоль среднесагиттальных плоскости (рис 1A, B).
- Использование щипцов, удалить церебральных и мозжечка полушарий и ствола мозга. Слуховой булла и капсулы расположены сбоку от мозжечка и ствола мозга. Обратите внимание , что слуховое Булла дополнительно латеральнее слуховой капсулы (рис 1C, D).
- Рассеките из буллу и капсулу с окружающей кости черепа (рис 1E).
- Передача образца в чашку, содержащую фосфатно-солевом буфере (PBS), рН 7,4 при комнатной температуре.
- UNDER бинокулярный микроскоп рассекает, используйте пинцет , чтобы растащить окружающие кости и ножницы , чтобы вырезать ослабленную границу вокруг Булла и капсулы (рис 1F). Окружающие кости удалены являются затылочной кости (вентральной границы), exoccipital (вентро-задняя граница), верхнезатылочной (задняя граница), interparietal, теменной (спинные граница), чешуйчатой (спинно-передняя граница), alisphenoid (передняя граница), и нижняя часть клиновидной кости (передне-вентральной границы) кости. Следует отметить , что процесс в форме столбика (СП), который поддерживает барабанной отверстие евстахиевой трубы 41, отличается от процесса шиловидный отросток височной кости.
2. Выделение слуховых косточек: Malleus, наковальни и стремени
- Молоточек
- Используя оба маленькие ножницы и пинцет, удалите часть наружного слухового бокового канала к борозде tympanicus так что барабанной перепонки видна (фиг.2А, В).
- Удалите часть барабанной перепонки и барабанной кости недалеко от malleal отросток Brevis (орбикулярной апофиза см Обсуждение), как на вентральной (пунктир) и задний (#) стенки (рис 2С). Молоточек и тензор барабанной мышцы должны теперь быть выставлены (рис 2D, Е).
- Поднимите молоточек (рис 2F) и перерезал тензор барабанной мышцы с скошенным краем 27 G иглы (рис 2G). Обратите внимание, что malleal прочно прикрепляется рукоятка к барабанной перепонке, как это видно и у других млекопитающих.
- Отделить барабанную перепонку тщательно от рукоятки, которая является хрупкой. Удалить гутрашсит выявить три слуховые косточки.
- Вывихнуть молоточек из наковальни в слуховых косточек сустава (рис 2H).
- Изолировать молоточек гидроразрывом передний процесс на goniale.
- Наковальня и Stapes
- Изолировать тон Наковальня отрезав задней связки наковальни на короткой ножкой (рис 3А).
- Изолировать стремени, отрезав стремянный артерии возле стремени с скошенным краем 27 G иглы (рис 3B, C). При необходимости вырезать сухожилия стремянный мышцы в мышечном процессе стремени с иглой.
- Вставьте швейной иглы (или маркировочный штифт) в запирательного отверстия стремени и поднимите стремени. После удаления стремени, отверстие овальное окно должно быть отчетливо видно (рис 3D).
3. Вложение Слуховые Буллы и Capsule
- Подготовка для встраивания в парафиновых блоков
- Изолировать буллу и капсулу, как описано в разделе 1.
- Разрежьте передний конец буллы (процесс) в форме столбика прочь с ножницами, погружать буллу и капсулы в 4% параформальдегида (PFA) в PBS при 4 °C, и позволяют закрепляющий войти в буллы. Если воздух попадает в ловушку в буллы, удалите его с помощью иглы и шприца. Оставьте буллу и капсулы в фиксаторе при 4 ° CO / N на ротатор трубки.
Внимание: PFA является токсичным и следует обращаться осторожно. - Промывают один раз PBS.
- Удаление накипи в Булла и капсула в течение недели при температуре 4 ° С в 10% дигидрата соли этилендиаминтетрауксусной динатриевой кислоты (ЭДТА-2Na), 100 мМ Трис-основание, рН 7,0, в 2 мл пробирку. Изменение буфера каждый день.
- Промывают один раз PBS. Образцы можно хранить в 70% этанола в воде при температуре 4 ° С. При желании, перевод на 70% этанола с помощью ряда градуированной спирта (30%, 50%, 70% в воде).
- На процессоре ткани, обезвоживают образцов в серии градуированных растворов этанола (70%, 2 раза 95%, 3x 100%, каждый 1 час), ясно в ксилоле (4x, каждый 1 час при 40 & deg; C), и пропитать образцы с расплавленный парафин 42. Необязательно, может заменить ксилол с clearin коммерческой тканиг раствора (например, Histo-Clear).
- Выгрузка образцы от процессора, и удалить их из кассет.
- На ткани внедрения системы консоли, место образцы в формы, наполненные расплавленным парафином. Перейдите к встраивание (раздел 4).
- Подготовка для встраивания в замороженных блоков (метод пленки Кавамото в) 43
- Изолировать буллу и капсулу, как описано в разделе 1.
- Разрежьте передний конец буллы (процесс) в форме столбика прочь с ножницами, погружать буллу и капсулы в фиксаторе (2% или 1% PFA, а не 4% в PBS, чтобы сохранить антигенность) при 4 ° С. Если воздух в ловушке буллы, удалите ее с помощью иглы и шприца. Оставьте буллу и капсулы в фиксаторе при 4 ° CO / N на ротатор трубки.
- Вымойте буллу и капсулу быстро в PBS и сразу же погружают в жидкий крио-вложение соединения при 4 ° С.
- Важно: Удалить пузырьки воздуха если в серединеи наружное ухо через устремление иглой, а также путем добавления соединения с вложением щипцов. Перейдите к встраивание (раздел 4).
4. Образец Ориентация и встраивание
Примечание: Вся Булла и капсула должна быть организована в определенной ориентации в процессе встраивания вырезать желательные секций. Процедуры, описанные ниже, используются в разделе молоточек в различных направлениях.
- Продольный (Парасагиттальное) секционирования молоточка
- Поместите боковую сторону буллы или наружного слухового прохода вниз в теплый парафин (или крио-вложение соединения). Отрегулируйте ориентацию таким образом , чтобы горлышко и поперечная пластина молоточка параллельны горизонтальной нижней части вложения тарелки (рис 4A - C). Обратите внимание , что в барабанной перепонке наклонен под углом примерно 30 ° к вертикали в голове мыши (фиг.4А; фигура 59 в Кампену 44).
- Горизонтальное секционирование молоточка
- Поместите спинной гребень горизонтально в теплой парафином (или крио-вложение соединения). Отрегулировать ориентацию гутрашса и капсулы таким образом , чтобы горлышко и поперечная пластина молоточка перпендикулярны к нижней части вложению тарелки (рис 4D - F).
- Лобовой секционирования (сечения) из рукоятки и барабанной перепонки 5
- Поместите malleal в теплой рукоятки парафина (или крио-вложение соединения) таким образом, чтобы она была перпендикулярна к нижней части вложения блюдо.
- Охладить блок до температур, соответствующих затвердеть парафина на ткани внедрения системы консоли (в качестве альтернативы, использовать крио-вложение соединения в сухой лед / гексан бане).
- блок ткани Процесс и секции резки с использованием обычных процедур. Например, секции Пятно парафин с гематоксилином и эозином (H & #38; Е), Safranin O (для хряща), или для тартрат-резистентная кислая фосфатаза (TRAP) активность (для остеокластов) 3, или с помощью иммуногистохимии. Undecalcified криосрезы подходят для маркировки костей с использованием флуорохромии 14, ализарин красным окрашиванием для кальция и иммунофлуоресценции 42.
Результаты
Этот протокол представляет собой метод, чтобы изолировать от косточки мыши слуховой буллы. Во- первых, буллы и капсула отсекают как единое целое из черепа (рисунок 1). Рассеченные булла затем используется для приготовления молоточек (рисунок 2) и наковальни и стремени (рисунок 3). Ориентиры слуховом гутрашса и капсулы являются процесс в форме столбика на переднем конце гутрашса, спинной гребень, переднего полукруглого канала, и subarcuate ямки (рис 1F). Microcomputed томография (КТ) томография выявляет в косточки слуховой буллы, а также оптимальные ориентиры для продольной и горизонтальной секционирования этих косточками (рисунок 4).
Для продольного парафина секционирования молоточка, буллы и капсулы были декальцинированной в ЭДТА при 4 ° С в течение одной недели, встроенный в раRaffin блок в ориентации , показанной на рисунке 4 , А - С, срезы толщиной 4 мкм, а затем окрашивали H & E. Молоточек прикреплен к барабанной перепонке в слуховом гутрашса показал продолжающийся Эндохондральный окостенение на P14 (рис 5А). Для того, чтобы визуализировать образование новой кости, кальцеин (30 мкг / г веса тела) был внутрибрюшинно вводили в P20 мыши, и булла и капсулы выделяли через 24 ч на P21. Образец без декальцинации заливали замораживают и затем cryosectioned на 6 мкм с использованием адгезивной пленки , основанный на методе Кавамото 43. После ядерного окрашивания DAPI (4 ', 6-диамидино-2-фенилиндол), секция наблюдали под флуоресцентным микроскопом. Кальцеин сигналы (зеленый) показал образование новой кости в молоточка (м), буллу и капсулы (рис 5б). Для горизонтального секционирования молоточка, слуховое Булла изолированы от 5-недельных мышей был встроен замороженный без декальцинации (дляориентация рис 4D - F), cryosectioned на 6 мкм с использованием метода Кавамото и окрашивали H & E. Горизонтальное секционирование malleal отростка Brevis (MPB) также показывает улитку (рис 5в).
Медиальная вид правильных слуховых косточек , выделенных из P31 мыши показывает типичные черты молоточка мыши, а именно, "скользя-чайка-крыловидная" (или персидский меч , как 45) рукоятка, видный отросток Brevis (округло отросток см Обсуждение) и поперечная пластина (рисунок 6). Обратите внимание, что передний процесс (отросток передняя) была сломана в процедуре рассечения вокруг goniale и был отделен от барабанной кольца (ectotympanic). Этот представительный образец демонстрирует нетронутую incudomalleolar соединение между молоточка и наковальни, в то время как наковальне-стременной сустав вывихнул. Сухожильных вставок в malleal истремянный мышечные процессы могут быть обнаружены (рис 6A, отмеченные звездочкой).
Рисунок 6B сравнивает мышь и слуховые косточки человека при том же увеличении. Межвидовые различия, кроме размера, включают в себя следующее. Malleal крыльев рукоятка, как у мышей, но клуб, как у людей. Угол между анатомической осью (или оси вращения, линии, проходящей через переднюю процессе молоточка и непродолжительного процесса наковальни) и рукояткой значительно меньше у мышей и два почти параллельны, в отличие от почти перпендикулярна у людей 6,46-48. В человеческих косточками, vibrometric исследования показывают , что incudo-лодыжковая сустав подвижен , а не функционально фиксированной 49. Молоточек мыши проявляет широкий, тонкий и плоский поперечный пластинки не видимую в организме человека 47. У мышей отросток передняя предохранители мембранными костей, а именно goniale и барабаннойкольцо С, в то время как у людей отросток передняя сводится к небольшому спикулы кости 41. Стремя мышей и человека также отличается: у мышей, передняя голень искривлена и задняя части CRU более прямой, тогда как у человека, передней голени является более прямой, чем задняя ножкой. Стоит отметить , что молоточек голова по отношению к размеру тела массово расширен в таких видов, как золотой моль, демонстрируя значительную изменчивость в аллометрических отношений "самых маленьких" кости 48.
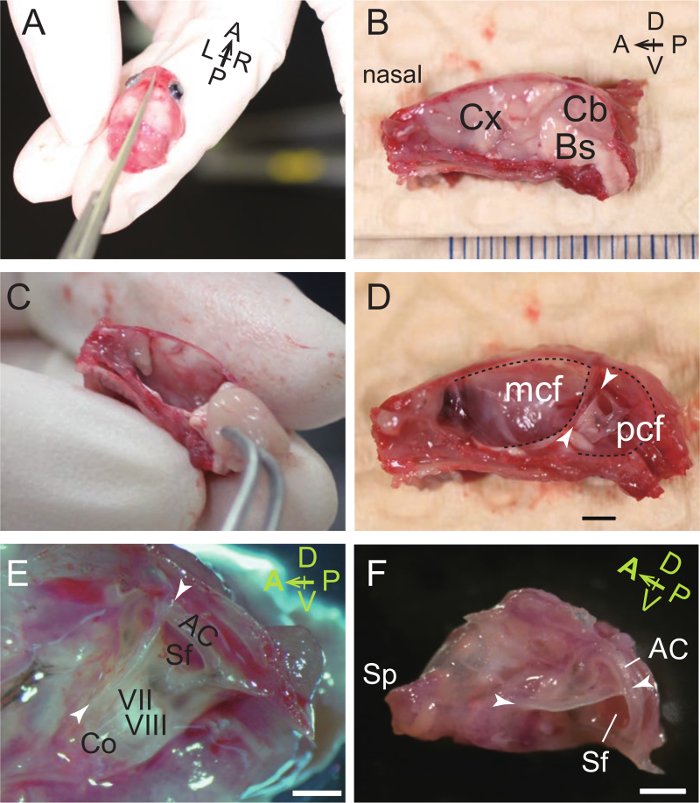
Рисунок 1. Вскрытие слуховом Буллы и Capsule. (А) Череп P31 мыши разделяется на правую и левую половины. А впереди; P, задний; L, слева; R, верно. (Б) Медиальная поверхность правой половины надвое, покрытого кожей головы. Cx, кора головного мозга; Cb, мозжечок; Bs, Brainstem. D, спинной; V, вентральный. (C) Удаление мозга с пинцетом. (D) Медиальный вид слуховой капсулы в правом черепа. Спинной гребень (наконечники стрел) лежит между средней черепной ямки (ККМ) и задней черепной ямки (ПФУ) и отделяет спинно-передней и вентро-задней поверхности слуховой капсулы. Шкала бар, 2 мм. (Е) более высокое увеличение слуховой буллы и капсулы (медиальной зрения). Co, улитка; VII, лицевого нерва; VIII, преддверно-улитковый нерв; AC, передняя (верхняя) полукружного канала; Sf, subarcuate ямка, в котором находится мозжечковая paraflocculus. Масштаб бар, 1 мм. (F) Микрофотография изолированной слуховой буллы и капсулы (медиальная вид). Sp, процесс в форме столбика. Масштаб бар, 1 мм. (А - Е), P31 мыши. (F), P33 мыши. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
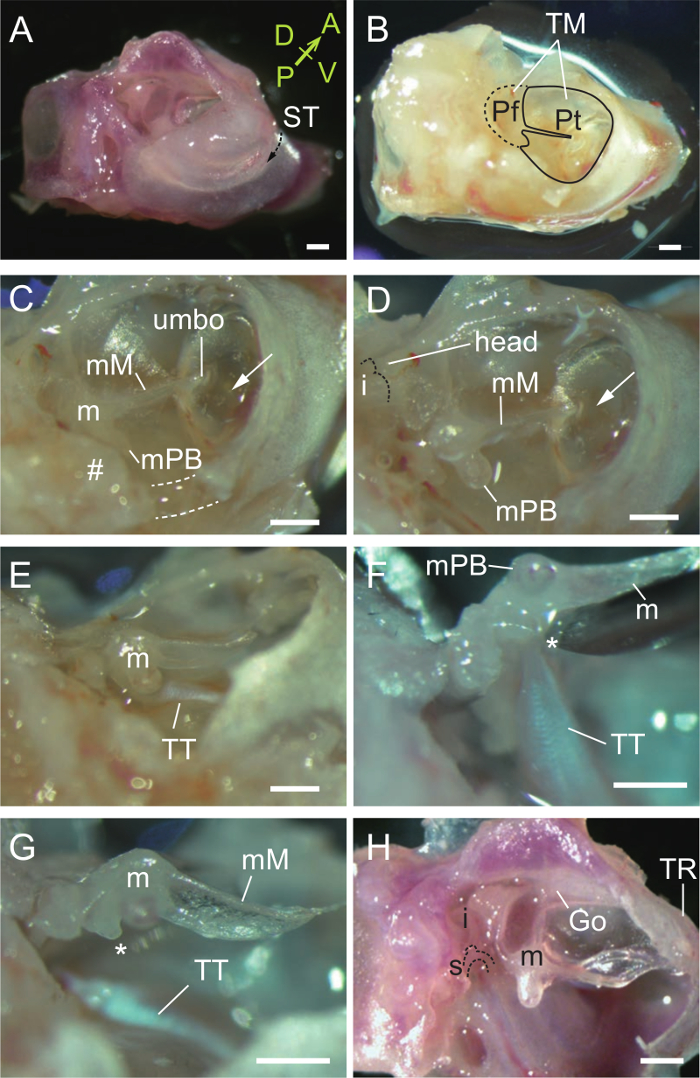
Рисунок 2. Препарирование молоточка. (А) Вентролатеральные вид правого слухового гутрашса и капсулы. Борозда tympanicus (ST, пунктирная стрелка) является местом прикрепления барабанной перепонки. Костный латеральнее ST является частью наружного уха, а кость Медиальная к ЗБ образует пол в полости среднего уха. А впереди; P, задний; D, спинной; V, вентральный. (B) Вид после удаления наружного слухового прохода , чтобы выявить барабанной перепонки (TM) , включая Рагз flaccida (ТОФ) и Парс TENSA (Pt). (C) Удаление частей гутрашсит (пунктирные линии и #) вблизи malleal отросток Brevis (МПБ). м, молоточек; мМ, malleal рукояткой. Стрелка, воздушный пузырь в полости среднего уха виден через барабанную перепонку. (D) Выставленный молоточек. Маллеус голова указывается. Пунктирныйлиния указывает на суставные поверхности наковальни. (Е) сухожилие тензора барабанной мышцы (ТТ) , прикрепленных к молоточка. (F) Тензор барабанная вытягивается , когда молоточек поднимается. *, Мускулистая процесс. (G) Тензор барабанная разрезают с помощью иглы. (Н) Три слуховые косточки после удаления барабанной перепонки. Incudo-лодыжковая сустав вывихнул. м, молоточек; я, наковальня; s, стремечко; Go, goniale (слит с молоточком и барабанной кольца, TR). Все масштабные линейки, 0,5 мм. (A, H), P33 мыши. (B - G), P31 мыши. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
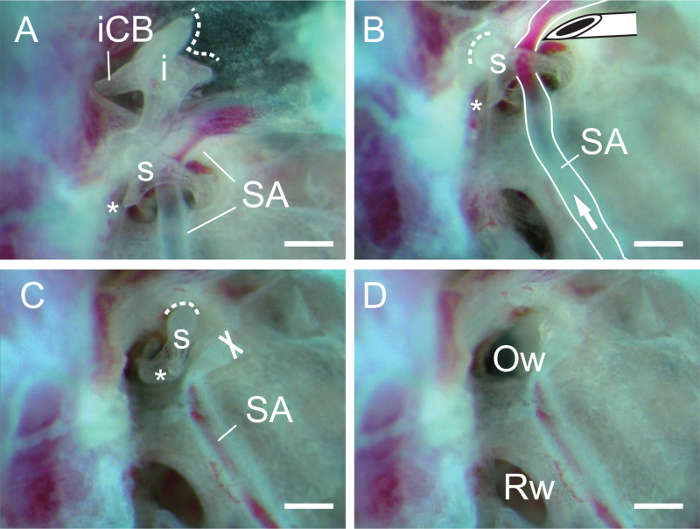
Рисунок 3. Вскрытие наковальни и стремени. (A) Наковальня иСтремени после удаления молоточка. Стремянный артерии (СА) проходит через стремени (ы). Пунктирная линия указывает на суставные поверхности наковальни. Обратите внимание, что короткий CRU (ICB, голень бревис) наковальни (I) фиксируется задней связкой (не показан). Звездочка, мускулистая процесс стремени. (Б) Стремени после удаления наковальни. Игла используется наконечник, чтобы сократить стремянный артерии (SA). Стрелка, направление кровотока. Пунктирная линия указывает на суставные поверхности стремени. (C) стремянный артерии удаляется из стремени. Х обозначает обрезанный конец стремянный артерии (СА). (D) овальное окно (Оу, Fenestra ovalis или Фенестра преддверия) видна после удаления стремени. Rw, круглое окно (Фенестра ротонда или Фенестра cochleae). Шкала баров, 0,5 мм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этогоцифра.
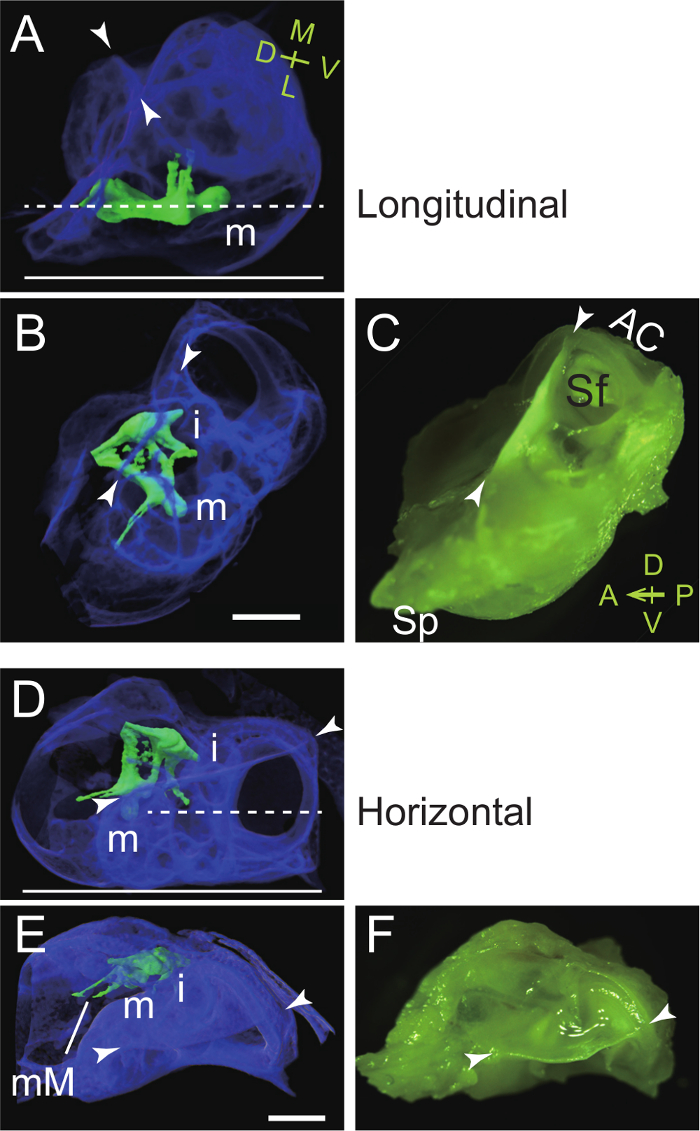
Рисунок 4. Ориентирование слуховом Bulla и Capsule во вложении для Продольные (Парасагиттальное, A - C) и горизонтального (D - E) Секционирование молоточка. (А - С) Горловина и поперечная пластина молоточка расположены параллельно нижней части встраивания блюдо. (A) Вид сбоку: микро-КТ изображение , чтобы показать вложение правой молоточка в буллы (псевдоцветной синий). Молоточек и наковальня псевдоцветной зеленый. Пунктирная линия, требуемая плоскости резания. Сплошная линия, дно вложения блюдо. м, молоточек; наконечники стрел, спинной гребень. M, медиальная; L, боковые; D, спинной; V, вентральный. (B) Вид сверху: Micro-CT изображение. Обратите внимание, что передний конец (BULLA процесса в форме столбика) был удален. я, наковальня. (C) Вид сверху: микрофотография (взято сцветной фильтр). AC, передняя (верхняя) полукружного канала; Sf, subarcuate ямка; Sp, процесс в форме столбика. А впереди; P, задний; D, спинной; V, вентральный. (D - F) отросток Brevis молоточка , расположенные перпендикулярно к нижней части встраивания блюдо. (D) Вид сбоку: Micro-CT изображение , чтобы показать вложение правой молоточка. Пунктирная линия, требуемая плоскости резания. Сплошная линия, дно вложения блюдо. (E) Вид сверху: Micro-CT изображение. мМ, malleal рукояткой. (F) Вид сверху: микрофотография (взято с цветным фильтром). Шкала баров, 1 мм. Микро-КТ изображения были получены при разрешении воксельном 5 мкм, как было описано выше 7. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
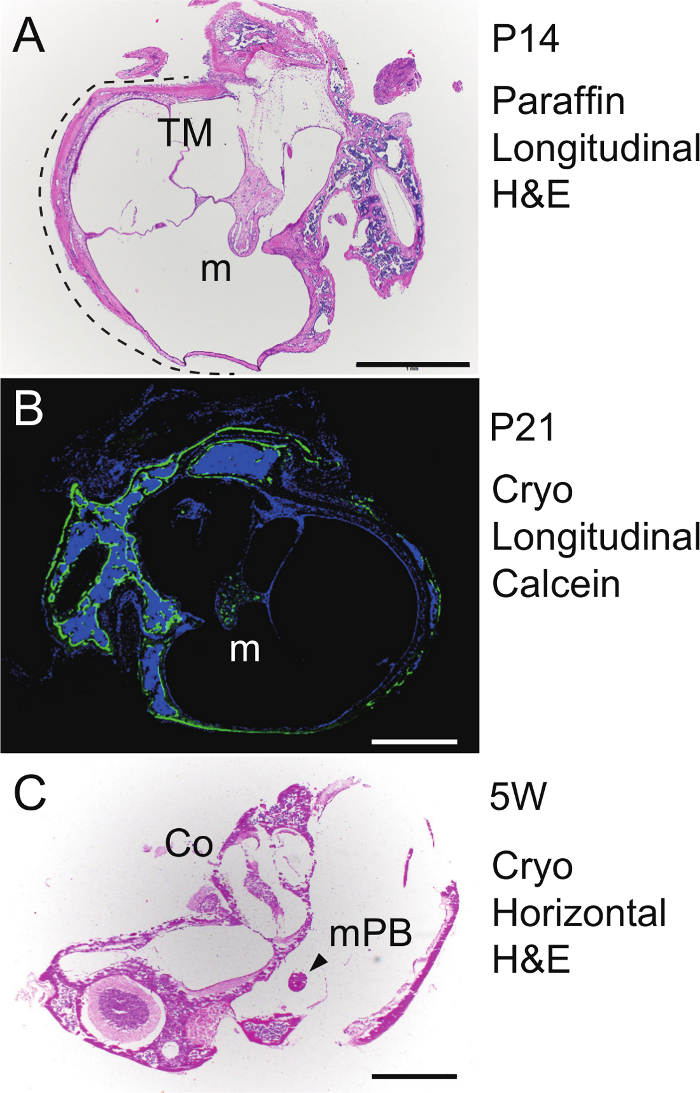
Figure 5. гистологии. (A) H & E окрашивание. Продольный разрез (Парасагиттальное) в парафин правой молоточка (м) в слуховом Булла (пунктирная линия) на P14. ТМ, барабанная перепонка. (B) Кальцеин кости маркировки. Продольный разрез замороженного, undecalcified левого молоточка (м) в слуховой буллы на P21. Контрастное, DAPI. (C) , Н & Е окрашивание. Горизонтальная секция мороженые, undecalcified левого malleal отростка Brevis (МПБ) в слуховой буллы и капсулы (5-недельных мышей). Co, улитка. Шкала баров, 1 мм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 6. медиальной Вид слуховых косточек. (A) правый слуховые косточки Р31 мыши. А впереди; P, задний; D, спинной; V, вентральный. Масштаб бар, 1 мм. молоточек головы (Caput mallei, Капитула mallei); шеи (Collum mallei); листовая пластинка (поперечная пластинка); мМ (mallei рукоятка); черная звездочка (мышечная процесс молоточка); Мпа (Processus передняя, Processus гасШз); MPB (отросток Brevis); Наковальня тело (корпус incudis); ICB (Крю бревисом, короткая голень, короткий процесс); ICL (Крю лонгум, долго голень, длительный процесс); Ipl (Processus двояковыпуклый, линзовидные процесс, Sylvian отросток); голова стремени (Caput stapedis); белая звездочка (мышечная процесс стремени); Sca (Крю anterius, передняя голень); ПКПП (Крю posterius, задняя голень); база (основы stapedis, подножку); SOF (запирательного отверстия, intercrural отверстие). (B) Правый слуховыми косточками из 76-летнего человека женского пола (Предоставлено кафедры анатомии, Кейо школы медицины университета). Косточки от P31 мыши (справа внизу) изображаются при том же увеличении, которое используется для человека косточками. CurvЕ.Д. стрелки указывают угол между анатомической осью и рукояткой (пунктирные линии). Шкала бар, 2 мм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Здесь мы представляем метод полезной для выделения слуховую буллу и капсулы в послеродовых мышей. До P12, ткани хрупки и могут быть повреждены во время изоляции. После того, как P12, слуховая булла и капсула может быть легко выделен из окружающих тканей. Препарирование буллу от головы до того секционирования имеет ряд преимуществ. Во- первых, послеродовые кавитация и рост слуховой буллы происходят наиболее активно из P6 года и являются полными , P14 50. Мезенхимальной ткани между барабанной перепонкой и кохлеарного стенки заменяется воздухом через кавитационного процесса. Полученный в результате воздух в полости среднего уха может препятствовать контакту между тканями и жидкостями при фиксации, декальцинации и встраивание. Легче удалить воздух из изолированной слуховой буллы, отрезав переднего конца (процесс в форме столбика), а не пытаться сделать это в Неизолированный буллы. Во-вторых, ориентация молоточка (и барабанной перепонки) не вертикальнав голове. Поэтому проще раздел молоточек в требуемых плоскостях путем встраивания выделенной слуховую буллу и капсулы в данной ориентации.
После выделения, слуховое Булла и капсулы могут быть использованы для многочисленных анализов. Например, высокое разрешение рентгеновских лучей микро-КТ может выявить костную микроструктура морфологии , такие как остеогенных капилляров в молоточка 14. Stereofluorescence рассечения микроскоп представляет собой мощный инструмент для визуализации структур в оценке репортер мышей , экспрессирующие флуоресцентные белки в середине или внутреннее ухо 33. Кроме того, различные в естественных условиях или бывших естественных условиях флуоресцентных методов маркировки и обнаружения всего иммунофлюоресценции монтирования может быть проведена. Свет листа флуоресцентной микроскопии также полезен для трехмерного анализа 51. Хотя это и не описано здесь, различные анатомические структуры, связанные с слуховым гутрашса и капсулы, такие как периферических нервов, кровеносных сосудов, ибарабанная перепонка в среднем ухе также может быть оценена с помощью этого протокола.
Обратите внимание, что парафин секционирования требует декальцинации костной тканей, прежде чем встраивание и, следовательно, не допускает анализ минерализации. В противоположность этому , метод пленки Кавамото 43 используется для подготовки замороженных срезов могут быть выполнены без декальцинации и подходит для исследований с использованием минерализация в естественных условиях методов костной маркировки или специального окрашивания , такие как ализарин окрашивания. условия крио-секционирования должны быть оптимизированы в зависимости в зависимости от возраста мыши. Например, менее круто температура внутри криостата камеры рекомендуется для более старых образцов мыши, чтобы свести к минимуму повреждение секций.
У мышей, правильный термин для известного полусферической протрузии молоточка "округло отросток". Тем не менее, термин "отросток Brevis" широко используется для обозначения округло апофиза для более-йАн два десятилетия, особенно среди мышей онтогенетики 16,20,22-25. "Processus Brevis" изначально относился к боковому процесса (отростки латеральной), которая отличается от округлой апофиза. У людей, боковой процесс , похожий на небольшую коническую проекцию образует общую линию прикрепления к барабанной перепонке, простирающейся от рукоятки (не показано на рисунке 6B, медиальная вид). У мышей, боковой процесс также проекция рукоятки на противоположном конце к макушкой 48. Рагз flaccida барабанной перепонки находится выше бокового процесса молоточка. Округло отросток не проявляется в человеческом молоточка.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
The authors thank Masaki Yoda and Elise Lamar for critical reading of the manuscript, Kazumasa Takenouchi for help with histology, Mari Fujiwara for help with microscopy and Makoto Morikawa for help in photographing human and mouse auditory ossicles.
Материалы
| Name | Company | Catalog Number | Comments |
| Tools/Equipment | |||
| Paper towel | Daio Paper Corporation | 703347 | can be purchased from other vendors |
| Glass Jar | Various | can be purchased from other vendors | |
| 14 cm surgical scissors | Fine Science Tools (F.S.T.) | 91400-14 | can be purchased from other vendors |
| Extra fine scissors-straight | Fine Science Tools (F.S.T.) | 14084-08 | can be purchased from other vendors |
| Fine Forceps Angled 45° | Fine Science Tools (F.S.T.) | 11063-07 | can be purchased from other vendors |
| Dissecting microscope | Nikon | SMZ800N | for routine dissection |
| Dissecting microscope | Nikon | SMZ18 | for movies |
| Injection needle 27 G | TERUMO | NN-2719S | |
| Syringe (1 mL) | TERUMO | SS-01T | |
| Marking Pin | Various | ||
| Tube rotator RT-50 | TAITEC | 0000165-000 | can be purchased from other vendors |
| Cryostat | Leica | CM3050S | http://www.leicabiosystems.com/histology-equipment/cryostats/details/product/leica-cm3050-s/ |
| TC-65 Tungsten blade | Leica | 14021626379 | for Kawamoto's firm method |
| Stainless containers | Leica | for Kawamoto's firm method | |
| Cryofilm type IIC | Leica | for Kawamoto's firm method | |
| Silane coated slide (New Silane II) | Muto Pure Chemicals | 511617 | can be purchased from other vendors |
| Cover glass | Matsunami | can be purchased from other vendors | |
| Tissue processor | Sakura Finetek | VIP-5 | can be purchased from other vendors |
| Tissue Embedding Console System | Sakura Finetek | Tissue-Tek TEC 5 | can be purchased from other vendors |
| Sliding microtome for paraffin | Yamato Kohki Industrial | REM-710 | can be purchased from other vendors |
| Path Blade+pro for hard tissue | Matsunami | PB3503C | for paraffin section |
| Micro-CT | RIGAKU | R_mCT2 | http://www.rigaku.com/en |
| Fluorescence microscope | KEYENCE | BZ-9000 | |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Isoflurane | Maruishi pharmaceutical Co. Ltd | ||
| NaCl | wako | 191-01665 | for PBS |
| KCl | wako | 285-14 | for PBS |
| Na2HPO4 12H2O | wako | 196-02835 | for PBS |
| KH2PO4 | wako | 287-21 | for PBS |
| Paraformaldehyde (PFA, EM Grade) | TAAB | P001 | |
| EDTA-2Na | wako | 15111-45 | |
| Trizma base | Sigma | T1503-1KG | |
| Super Cryoembedding Medium | Leica | for Kawamoto's firm method | |
| Dry Ice | Various | for Kawamoto's firm method | |
| Hexane | wako | 080-03423 | for Kawamoto's firm method |
| Super Cryomouting Medium type R2 | Leica | for Kawamoto's firm method | |
| Paraffin | Sakura Finetek | 781001A0107 | |
| Histo-Clear | NDS | HS-200 | |
| Calcein | DOJINDO | 340-00433 | |
| Hematoxylin | wako | 131-09665 | |
| Eosin | wako | 051-06515 |
Ссылки
- Mallo, M. Formation of the middle ear: recent progress on the developmental and molecular mechanisms. Dev Biol. 231, 410-419 (2001).
- Manley, G. A. An evolutionary perspective on middle ears. Hear Res. 263, 3-8 (2010).
- Kanzaki, S., Ito, M., Takada, Y., Ogawa, K., Matsuo, K. Resorption of auditory ossicles and hearing loss in mice lacking osteoprotegerin. Bone. 39, 414-419 (2006).
- Kanzaki, S., Takada, Y., Ogawa, K., Matsuo, K. Bisphosphonate therapy ameliorates hearing loss in mice lacking osteoprotegerin. J Bone Miner Res. 24, 43-49 (2009).
- Cordas, E. A., et al. Thyroid hormone receptors control developmental maturation of the middle ear and the size of the ossicular bones. Endocrinology. 153, 1548-1560 (2012).
- Dong, W., Varavva, P., Olson, E. S. Sound transmission along the ossicular chain in common wild-type laboratory mice. Hear Res. 301, 27-34 (2013).
- Kanzaki, S., et al. Impaired vibration of auditory ossicles in osteopetrotic mice. Am J Pathol. 178, 1270-1278 (2011).
- Qin, Z., Wood, M., Rosowski, J. J. Measurement of conductive hearing loss in mice. Hear Res. , (2009).
- Klein, J. O. Is acute otitis media a treatable disease?. N Engl J Med. 364, 168-169 (2011).
- Rosch, J. W., et al. A live-attenuated pneumococcal vaccine elicits CD4+ T-cell dependent class switching and provides serotype independent protection against acute otitis media. EMBO Mol Med. 6, 141-154 (2014).
- Li, X., et al. Otitis media in sperm-associated antigen 6 (Spag6)-deficient mice. PLoS One. 9, e112879 (2014).
- Rodríguez Vázquez, J. F., Mérida Velasco, J. R., Jiménez Collado, J. A study of the os goniale in man. Acta Anat (Basel). 142, 188-192 (1991).
- Tucker, A. S., Watson, R. P., Lettice, L. A., Yamada, G., Hill, R. E. Bapx1 regulates patterning in the middle ear: altered regulatory role in the transition from the proximal jaw during vertebrate evolution. Development. 131, 1235-1245 (2004).
- Matsuo, K., et al. Osteogenic capillaries orchestrate growth plate-independent ossification of the malleus. Development. 142, 3912-3920 (2015).
- Matsuo, K. Cross-talk among bone cells. Curr Opin Nephrol Hypertens. 18, 292-297 (2009).
- Rijli, F. M., et al. A homeotic transformation is generated in the rostral branchial region of the head by disruption of Hoxa-2, which acts as a selector gene. Cell. 75, 1333-1349 (1993).
- Mallo, M., Gridley, T. Development of the mammalian ear: coordinate regulation of formation of the tympanic ring and the external acoustic meatus. Development. 122, 173-179 (1996).
- O'Gorman, S. Second branchial arch lineages of the middle ear of wild-type and Hoxa2 mutant mice. Dev Dyn. 234, 124-131 (2005).
- Santagati, F., Minoux, M., Ren, S. Y., Rijli, F. M. Temporal requirement of Hoxa2 in cranial neural crest skeletal morphogenesis. Development. 132, 4927-4936 (2005).
- Satokata, I., Maas, R. Msx1 deficient mice exhibit cleft palate and abnormalities of craniofacial and tooth development. Nat Genet. 6, 348-356 (1994).
- Zhang, Z., et al. Malleal processus brevis is dispensable for normal hearing in mice. Dev Dyn. 227, 69-77 (2003).
- Houzelstein, D., Cohen, A., Buckingham, M. E., Robert, B. Insertional mutation of the mouse Msx1 homeobox gene by an nlacZ reporter gene. Mech Dev. 65, 123-133 (1997).
- Martin, J. F., Bradley, A., Olson, E. N. The paired-like homeo box gene MHox is required for early events of skeletogenesis in multiple lineages. Genes Dev. 9, 1237-1249 (1995).
- Yamada, G., et al. Targeted mutation of the murine goosecoid gene results in craniofacial defects and neonatal death. Development. 121, 3005-3012 (1995).
- Rivera-Pérez, J. A., Mallo, M., Gendron-Maguire, M., Gridley, T., Behringer, R. R. Goosecoid is not an essential component of the mouse gastrula organizer but is required for craniofacial and rib development. Development. 121, 3005-3012 (1995).
- Coré, N., et al. Tshz1 is required for axial skeleton, soft palate and middle ear development in mice. Dev Biol. 308, 407-420 (2007).
- Li, C., Scott, D. A., Hatch, E., Tian, X., Mansour, S. L. Dusp6 (Mkp3) is a negative feedback regulator of FGF-stimulated ERK signaling during mouse development. Development. 134, 167-176 (2007).
- Hwang, C. H., Wu, D. K. Noggin heterozygous mice: an animal model for congenital conductive hearing loss in humans. Hum Mol Genet. 17, 844-853 (2008).
- Calvert, J. A., et al. A missense mutation in Fgfr1 causes ear and skull defects in hush puppy mice. Mamm Genome. 22, 290-305 (2011).
- Carpinelli, M. R., et al. Anti-apoptotic gene Bcl2 is required for stapes development and hearing. Cell death dis. 3, e362 (2012).
- Chapman, S. C. Can you hear me now? Understanding vertebrate middle ear development. Front Biosci (Landmark Ed). 16, 1675-1692 (2011).
- Kitazawa, T., et al. Distinct effects of Hoxa2 overexpression in cranial neural crest populations reveal that the mammalian hyomandibular-ceratohyal boundary maps within the styloid process. Dev Biol. 402, 162-174 (2015).
- Wang, L., et al. Scleraxis is required for differentiation of the stapedius and tensor tympani tendons of the middle ear. J Assoc Res Otolaryngol. 12, 407-421 (2011).
- Amin, S., Tucker, A. S. Joint formation in the middle ear: lessons from the mouse and guinea pig. Dev Dyn. 235, 1326-1333 (2006).
- Amin, S., Matalova, E., Simpson, C., Yoshida, H., Tucker, A. S. Incudomalleal joint formation: the roles of apoptosis, migration and downregulation. BMC Dev Biol. 7, 134 (2007).
- Hiruma, T., Nakajima, Y., Nakamura, H. Development of pharyngeal arch arteries in early mouse embryo. Journal of anatomy. 201, 15-29 (2002).
- Treuting, P. M., Dintzis, S. M., Treuting, P. M., Dintzis, S. M. Ch. 22, Special senses: ear. Comparative Anatomy and Histology: A Mouse and Human Atlas. 22, 419-432 (2012).
- Mallo, M., Schrewe, H., Martin, J. F., Olson, E. N., Ohnemus, S. Assembling a functional tympanic membrane: signals from the external acoustic meatus coordinate development of the malleal manubrium. Development. 127, 4127-4136 (2000).
- Anthwal, N., Joshi, L., Tucker, A. S. Evolution of the mammalian middle ear and jaw: adaptations and novel structures. Journal of anatomy. 222, 147-160 (2013).
- Takechi, M., Kuratani, S. History of studies on mammalian middle ear evolution: a comparative morphological and developmental biology perspective. J Exp Zool B Mol Dev Evol. 314, 417-433 (2010).
- Henson, O. W., Keidel, W. D., Neff, W. D. Ch. 3, Comparative Anatomy of the Middle Ear. Handbook of Sensory Physiology. Vol. 1, Auditory System. Anatomy, Physiology (Ear), 39-110 (1974).
- . . Handbook of Histology Methods for Bone and Cartilage. , (2003).
- Kawamoto, T. Use of a new adhesive film for the preparation of multi-purpose fresh-frozen sections from hard tissues, whole-animals, insects and plants. Arch Histol Cytol. 66, 123-143 (2003).
- Kampen, P. N. V. . Gegenbaurs Morphologiesches Jahrbuch. 34, 321-722 (1905).
- Lee, J. H., Park, K., Kang, T. C., Choung, Y. H. Three-dimensional anatomy of the temporal bone in normal mice. Anat Histol Embryol. 38, 311-315 (2009).
- Fleischer, G. Evolutionary principles of the mammalian middle ear. Adv Anat Embryol Cell Biol. 55, 3-70 (1978).
- Lavender, D., Taraskin, S. N., Mason, M. J. Mass distribution and rotational inertia of "microtype" and "freely mobile" middle ear ossicles in rodents. Hear Res. 282, 97-107 (2011).
- Mason, M. J. Of mice, moles and guinea pigs: functional morphology of the middle ear in living mammals. Hear Res. 301, 4-18 (2013).
- Willi, U. B., Ferrazzini, M. A., Huber, A. M. The incudo-malleolar joint and sound transmission losses. Hear Res. 174, 32-44 (2002).
- Richter, C. A., et al. Defects in middle ear cavitation cause conductive hearing loss in the Tcof1 mutant mouse. Hum Mol Genet. 19, 1551-1560 (2010).
- Buytaert, J. A., Johnson, S. B., Dierick, M., Salih, W. H., Santi, P. A. MicroCT versus sTSLIM 3D imaging of the mouse cochlea. J Histochem Cytochem. 61, 382-395 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены