Method Article
Загрузка кальциевой красителя в нервные окончания лягушек через нервный культи: регистрация переходного процесса кальция в нервно-мышечном соединении лягушки
В этой статье
Резюме
Здесь мы описываем метод загрузки чувствительного к кальция красителя через пень нерва лягушки в нервные окончания. Мы также представляем протокол для регистрации и анализа быстрых переходных процессов кальция в периферических нервных окончаниях.
Аннотация
Одним из наиболее эффективных методов измерения уровня пресинаптического кальция в пресинаптических нервных терминалах является оптическая запись. Он основан на использовании чувствительных к кальции флуоресцентных красителей, которые изменяют их интенсивность излучения или длину волны в зависимости от концентрации свободного кальция в клетке. Существует несколько методов, используемых для окрашивания клеток кальциевыми красителями. Наиболее распространенными являются процессы загрузки красителей через микропипетку или предварительная инкубация с формами ацетоксиметилового эфира красителей. Однако эти методы не совсем применимы к нервно-мышечным переходам (NMJ) из-за возникающих методологических проблем. В этой статье мы представляем метод загрузки чувствительного к кальция красителя через нервный культ лягушки нерва лягушки в нервные окончания. Поскольку ввод внешнего кальция в нервные окончания и последующее связывание с кальциевым красителем происходят в миллисекундном масштабе времени, необходимо использовать быструю систему визуализации для записи этих взаимодействийнс. Здесь мы описываем протокол регистрации переходного процесса кальция с быстрой камерой CCD.
Введение
Ионы кальция (Ca 2+ ) участвуют во многих процессах нейронной сигнализации, включая инициирование, поддержание и пластичность релиза 1 , 2 , 3 , 4 , 5 медиатора. По прибытии потенциала действия внеклеточный Ca 2+ входит в нервный конец и инициирует высвобождение нейротрансмиттера. В некоторых синапсах ток кальция может быть измерен непосредственно электрофизиологическими методами 6 , 7 , 8 . В случае нервно-мышечного перехода (NMJ) нельзя использовать прямой патч-зажим и двухэлектродные зажимные методы за счет минимального размера нервных окончаний.
Записи внутренних токов Ca 2+ от нервных окончаний в NMJ могут выполняться косвенными электронамиИологические методы 9 , 10 . Однако эти методы требуют предварительной обработки синапса блокаторами ионов натрия и калия. Оптические методы не требуют фармакологического разделения ионных токов в нервном терминале и позволяют регистрировать приток Ca 2+ , вызванный потенциалами действия, и последующее повышение ионов Ca 2+ в аксоплазме 11 , 12 , 13 , 14 . Эти методы основаны на регистрации изменений флуоресценции конкретных Ca 2+ -чувствительных красителей при связывании свободных ионов Ca 2+ 15 , 16 , 17 , 18 , 19 .
Индикаторы Ca 2+ могут быть загружены в cEll с помощью различных методов, в зависимости от цели эксперимента. Исследователи используют ванновое применение мембранно-проницаемых форм красителей 20 , 21 , погрузка через патч-пипетку 22 или микроинъекцию 23 , 24 , 25 . Однако все эти методы имеют некоторые ограничения в случае NMJ из-за его особенностей в синаптической архитектонике. Для NMJ наиболее удобным и успешным методом является загрузка красителя через нервный культ, метод форвардного заполнения 26 , 27 , 28 , 29 . Этот метод можно использовать для загрузки различных флуоресцентных красителей в периферические нервные окончания. Этот метод был успешно использован для нервных терминалов Drosophila 28 , моторного нерва ящерицы28 , и клеммы 17 , 26 , 27 , 30 моторного нерва лягушки. В зависимости от исследуемого объекта, методические данные могут варьироваться. Стеклянную микропипетку можно использовать для небольших нервов у личинок 28 . Несколько исследователей описали способ 27 , 28, в котором свежесрезанный конец нерва, иннервирующий мышцу, погружен в колодец, предварительно заполненный красителем. Затем препарат оставляют на несколько часов для впитывания красителя. Краска впитывается аксонами и транспортируется к нервным окончаниям. В этой статье мы описываем метод загрузки индикатора флуоресценции в моторные нервные терминалы лягушки через нервный культи. В нашем протоколе используется наконечник пластиковой пипетки для инкубации ткани с красителем. Мы также описываем, как получить и проанализировать флуоресцентный тракт Са 2+nsients.
протокол
Эксперименты проводились на изолированных нервно-мышечных препаратах кожной грудной мышцы у лягушки рана-дзимибунды . Размер животных обоих полов составлял около 5-9 см. Экспериментальные процедуры проводились в соответствии с руководящими принципами использования лабораторных животных Казанского федерального университета и Казанского медицинского университета в соответствии с Руководством NIH по уходу и использованию лабораторных животных. Экспериментальный протокол соответствовал требованиям Директивы Совета Европейского сообщества 86/609 / EEC и был одобрен Этическим комитетом Казанского медицинского университета.
1. Подготовка решений
- Подготовка раствора Рингера.
- Подготовьте раствор Рингера: 113,0 мМ NaCl, 2,5 мМ KCl, 3,0 мМ NaHCO 3 и 1,8 мМ CaCl 2 . Отрегулируйте pH до 7,2-7,4.
- Подготовьте раствор Рингера с низким содержанием Ca 2+ и высокое содержание Mg 2+ : 113,0 мМ NaCl, 2,5 мМ KCl, 3,0 мМ NaHCO 3 , 6,0 мМ MgCl 2 , 0,9 мМ CaCl 2 . Отрегулируйте pH до 7,2-7,4.
- Приготовление раствора для загрузки красителя.
- Подготовьте раствор на водной основе, содержащий HEPES-Na, при 10 мМ (рН 7,2-7,4).
- Добавить 14 мкл раствора HEPES во флакон с красителем 30 .
ПРИМЕЧАНИЕ. Индикаторная краска Ca 2+ поставляется в 500-миллилитровом флаконе с 500 мкг порошка. - Вихрь и спин вниз, чтобы тщательно перемешать.
- Разбавьте раствор до достижения конечной концентрации индикатора Ca 2+ до 30 мМ. Избегайте воздействия света и храните его при температуре -20 ° C.
2. Порядок нанесения красителя
- Рассекайте кожную грудную мышцу кусочком грудного прорезивного нерва.
ПРИМЕЧАНИЕ. Процедура вскрытия доступнаВ бесплатной загрузке статьи от Blioch et al. , 1968 31 .- Для процедуры вскрытия используйте два тонких щипца и ножницы для роговицы (см. Таблицу материалов ). Перенесите расчлененную ткань в чашку Петри, покрытую силиконовым эластомером, предварительно заполненную раствором Рингера, и закрепите ткань тонкими штифтами из нержавеющей стали так, чтобы она слегка растянулась в тарелке.
- Повторно заполните чашку Петри свежей аликвотой раствора Рингера. Удалите соединительные ткани. Не повредите нерв.
- Подготовьте заполняющую пипетку: используя лезвие бритвы, вырежьте кусок конической части стандартного пластикового наконечника пипетки размером 10 мкл длиной ~ 2 мм.
- Подготовьте кусок моделирующей глины, чтобы установить заполняющую пипетку на чашку Петри.
- Подключите заднюю часть заполняющей пипетки к пластиковому шприцу через силиконовые трубки и пластиковые соединительные адаптеры, изготовленные из наконечников пипеток.
- До dВы загружаете процедуру, удалите раствор Рингера из чашки Петри с помощью пластиковой пипетки. Высушите мышечный нерв, используя тонкий шприц; Это предотвратит разбавление красителя Ca 2+ при последующей загрузке заполняющей пипетки.
- Удалите индикаторную емкость Ca 2+ из морозильника и дайте ему оттаивать при комнатной температуре в темном месте.
- Под контролем стереомикроскопа с малым увеличением (10 ×) обнаруживают соединение между мышцей и нервом. С тонким пинцетом и ножницами отрежьте грудной протрузивный нерв близко к поверхности мышц (см. Шаг 2.1). Оставьте нервный культи длиной около 2 мм.
- Закрепите наполнительную пипетку, прикрепленную к трубке, и шприц на чашке Петри, используя модельную глину.
- Переместите кончик пипетки близко к нервному культи.
- Не зажимая его, аккуратно аспирируйте нервный культ в кончик заполняющей пипетки.
- Снимите всасывающий шлангT конец заполняющей пипетки.
- Осторожно удалите избыточный раствор из наполнительной пипетки с помощью шприца с длинной иглой (см. Таблицу материалов ). Не зажимайте нервный культи.
- Вертикально поднимите наконечник пипетки, удерживая наконечник нерва в отсасывании.
- Изолируйте аспирационную часть нервного пена снаружи наконечника пипетки, используя вазелин.
- Высушите нервную культуру, изолированную в наполнительной пипетке, если необходимо: аккуратно аспирируйте избыток раствора из наполняющей пипетки с помощью шприца с длинной иглой.
- Нанесите 0,5 мкл раствора для загрузки красителя (см. Шаг 1), используя пипетку с длинным наконечником пипетки.
- Аккуратно вставьте наконечник пипетки с загрузочным раствором в наполнительную пипетку. Извлеките смесь непосредственно на культи нерва.
- Запечатайте открытый конец заполняющей пипетки вазелином.
- Добавьте небольшую аликвоту Ringer's sОливковое масло для чашки Петри, чтобы держать препарат мокрым.
- Инкубируйте препарат при комнатной температуре в темных и влажных условиях в течение 5 часов.
- Удалите заполняющую пипетку загрузочным раствором, промойте препарат раствором Рингера и храните его в течение ночи в холодильнике при 8 ° C.
3. Подготовка ткани для микроскопии
- Подготовьте препарат в камеру, покрытую силиконовым эластомером, и закрепите его стальными микроигонами так, чтобы он слегка растягивался.
- Промойте ткань аликвотой свежего раствора Рингера.
- Используйте всасывающий электрод для стимуляции нерва; Построение электрода можно получить из бесплатной загрузки статьи Kazakov et al. , 2015 год 32 . Расположите наконечник электрода близко к разрезающему концу нерва и влейте в него нервную культуру в отверстие электрода.
- Установите подготовительную камеру на ступень микроскопа. ПлацE температурный зонд и входные и выходные обмотки в камере.
- Подключите шнур питания к элементу Пельтье.
- Чтобы переработать препарат, используйте простую систему с гравитационным управлением. Чтобы удалить избыточный раствор, включите перфузионный всасывающий насос.
- Включите термоконтроллер.
- Установите регулятор температуры на 20 ° C.
- Установите защитный экран ультрафиолета.
- Подключите стимулирующий проволочный электрод к электрическому стимулятору и наблюдайте за мышечными сокращениями под микроскопом с 4-кратным объективом.
- Заполните перфузионную систему раствором Рингера с низким содержанием Ca 2+ и высоким содержанием Mg 2+ .
ПРИМЕЧАНИЕ. Это решение используется для предотвращения мышечных сокращений. Снижение концентрации внешнего кальция и повышение внешнего магния приводит к уменьшению амплитуды переходных процессов Ca 2+. Однако , исходя из предыдущего опыта, 0,9 мМ CaCl 2 и 6 мМ MgCl 2 все еще достаточно, чтобы надежно разрешить амплитуду переходных процессов Ca 2+ . Стоит отметить, что существуют и другие способы уменьшения мышечных сокращений без снижения концентрации Ca 2+. Например, использование d-тубокурарина или альфа-бунгаротоксина, специфических блокаторов никотиновых рецепторов ацетилхолина, полностью или частично блокирует мышечные судороги 17 , 27 , 28 , 30. Однако добавление этих токсинов также может влиять на введение пресинаптического кальция 33 . Чтобы этого избежать, можно использовать μ-конотоксин GIIIA 27 . - Включите насос и начните суперфузию препарата раствором Рингера с низким содержанием Ca 2+ и высоким Mg 2+ .
- Переключитесь на объектив 40 × на микроскоп.
- Включить t Он монохроматор (см. Таблицу материалов ).
- Выберите длину волны излучения 488 нм и непрерывный режим освещения в программном обеспечении управления монохроматором.
- При большом увеличении в режиме флуоресценции убедитесь, что нервные окончания загружены красителем.
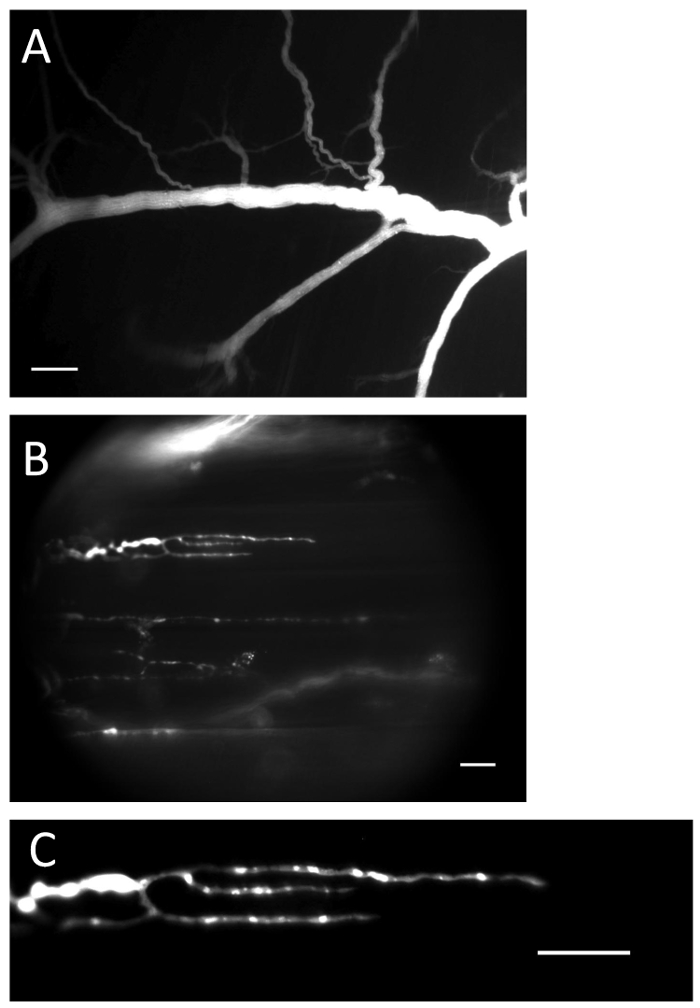
Рисунок 1 : Нерв и клеммы с нагруженным индикатором Ca 2+ . ( A ) Нерв, заполненный индикатором Ca 2+ после процедуры загрузки. Шкала шкалы = 200 мкм. ( B ) Нервные окончания, заполненные индикатором Ca 2+ . Шкала шкалы = 20 мкм. ( C ) Ca 2+ -индикаторная флуоресценция хорошо видна в нервном окончании. Шкала шкалы = 20 мкм._blank "> Нажмите здесь, чтобы посмотреть увеличенную версию этого рисунка.
- Позвольте препарату уравновешиваться в течение минимум 30 минут в растворе с низким содержанием Ca 2+ и высоким содержанием Mg 2+ .
4. Захват видео с помощью цифровой ПЗС-камеры
Примечание. Детали захвата сигналов флуоресценции специфичны для каждого микроскопа и типа камеры, но ключевым соображением является скорость захвата изображения.
- Используйте 1 кГц в качестве минимальной частоты захвата для регистрации одиночных переходных процессов Ca 2+ в NMJ.
ПРИМЕЧАНИЕ. Для флуоресцентной визуализации необходимы быстрые цифровые ПЗС-камеры (см. Таблицу материалов ). Система сбора данных и программное обеспечение (см. Таблицу материалов ) использовались здесь для синхронизации камеры, монохроматора и стимулятора. Короче говоря, этот протокол позволяет генерировать импульсы синхронизации на цифровых выходах данныхЧтобы открыть затвор, захватить видеосигнал и инициировать стимуляцию. Все временные параметры могут быть установлены в протоколах и / или на устройствах. Типичным протоколом является серия из 500 кадров, полученных с частотой 1 кГц (80 х 80 пикселей). Освещение светом возбуждения может отбеливать индикатор Ca 2+ и фотопамять клеточной ткани. Таким образом, избегайте длительного воздействия света возбуждения. В этом протоколе затвор открыт только на время, необходимое для захвата видео. Приобретите двадцать серий на конкретный нервный терминал. Цель здесь - следить за тем же сайтом в контрольной группе и после доставки лекарств. - Под объективом 4X объектива микроскопа используйте режим яркого поля, чтобы визуализировать мышцы и нервные ветви.
- Переключитесь на объектив 40X и, используя режим эпифлуоресценции и длину волны возбуждения 488 нм, выполните поиск нагруженных красителем нервных окончаний. Определите интересующий вас нервный регион.
- На тринокулярной трубке oF микроскоп, выберите уровни обмена световым путём: 100% свет для камеры.
- Запустите программное обеспечение для сбора данных для ПЗС-камеры.
- В режиме «Live» найдите ROI и настройте фокус.
- Выберите меню «Изменить».
- Используйте «Базовая конфигурация» со скоростью 1000 кадров в секунду (fps) с разрешением 80 x 80.
- Установите количество входных кадров на 500.
- Введите название эксперимента.
- Выберите «Внешний триггер».
- Установите время до триггера до 10 мс.
- Установите количество повторов до 20.
- В программном обеспечении управления монохроматором выберите длину волны излучения 488 нм и режим «внешнего триггерного освещения».
- Запустите программное обеспечение для сбора данных.
- Загрузите протокол стимуляции.
- Прежде чем записывать видео, снимите темную рамку с помощью программного обеспечения для сбора видео.
- Запустите протокол стимуляции.
- Выберите ROI и checK записанный сигнал.
5. Анализ данных
NoOTE: для анализа данных используйте программное обеспечение камеры CCD и ImageJ; Данные представлены в виде кривой в программе электронных таблиц. В программном обеспечении камеры CCD среднее значение 20 повторяется и экспортирует результаты в файл поддержки ImageJ. В ImageJ выберите ROI и фон. Вычтите фон из ROI. Представляют данные как отношение: (ΔF / F 0 -1) x 100%, где ΔF - интенсивность флуоресценции во время стимуляции, а F 0 - интенсивность флуоресценции в состоянии покоя.
- В программном обеспечении для получения CCD-камеры нажмите «Файл»> «Средние файлы». Выберите файлы и усредните их.
- Сохраните усредненный файл как .fit-файл, нажав «Сохранить как подходящий файл».
- Запустите программное обеспечение ImageJ. Выполните следующие действия:
- Нажмите «Изображение»> «Настройка»> «Яркость / контрастность».
- Нажмите «Изображение»> «Стеки»> «Инструменты»>; Стековый сортировщик.
- Нажмите «Анализ»> «Инструменты»> «Менеджер ROI».
- Перетащите усредненный файл .fit в окно ImageJ.
- Увеличьте масштаб окна, чтобы получить лучшее представление.
- Перемещая курсор, выберите последний кадр и удалите его (это темный кадр)
- Выберите прямоугольный ROI над областью, которая считается фоном. Добавьте его в менеджер ROI
- Измерьте фон, нажав «Дополнительно»> «Мультимедиа». Обратите внимание на MEAN. Скопируйте данные, экспортируйте их в программу электронных таблиц и вычислите среднее значение порога для коэффициента.
- Вычтите порог из стеков, нажав «Процесс»> «Главная»> «Вычесть». Введите усредненное значение порогового значения.
- Выберите прямоугольный ROI вокруг нервного терминала. Добавьте его в менеджер ROI.
- Измените значение, нажав «Дополнительно»> «Мера». Обратите внимание на MEAN. Скопируйте и экспортируйте его в программу для работы с электронными таблицами.
- Среднее смещение сигналов.
ПРИМЕЧАНИЕ. ИспользуйтеПервые несколько десятков точек, демонстрирующих флуоресценцию базового красителя без стимуляции; Это флуоресценция в состоянии покоя. - Разделите сигналы флуоресценцией в покое.
- Вычтите «1» и умножьте на 100%.
- Постройте сигнал и вычислите амплитуду переходного процесса Ca 2+ .
Результаты
После загрузки красителя и стимуляции двигательного нерва в нервных окончаниях может быть обнаружено увеличение амплитуды флуоресцентного сигнала (переход Ca 2+ ) (см. Рис. 2 ). Параметры переходных процессов Ca 2+ представлены в таблице 1 . Количественно параметры переходных процессов Ca 2+, измеренные в нашем исследовании, близки к данным, полученным другими учеными в синапсах хладнокровных животных 15 , 34 . Параметры переходных процессов Ca 2+ зависят от скорости связывания Ca 2+ с красителем и последующей диссоциации. Скорость поступления Ca 2+ в нервное окончание, взаимодействие с красителем и диффузия в цитоплазме влияют на время нарастания переходного процесса Ca 2+ . Время затухания флуоресцентного сигнала зависит от сродства красителя,Скорость взаимодействия Ca 2+ с внутриклеточными буферами и удаление ионными насосами 35 . Амплитудный анализ переходных процессов Ca 2+ можно использовать для изучения влияния различных веществ на вход кальция, который участвует в высвобождении нейротрансмиттера 33 .

Рисунок 2 : Среднее значение Ca 2+ Переходный, измеренный в лягуше NMJ. Переходный переход Ca 2+ рассчитывали на основе среднего значения сигналов от 13 NMGs лягушек. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Вершина горыΔF / F (%) | Время нарастания 20% -80% (мс) | Τ (ms) |
| 12,6 ± 1,1 (n = 13) | 4,6 ± 0,5 (n = 13) | 115,3 ± 8,3 (n = 13) |
Таблица 1: Усредненные параметры переходного процесса Ca 2+ . Данные представлены как среднее ± SE; N - количество измерений в отдельных NMJ. Пик ΔF / F представляет собой усредненную амплитуду ΔF / F.
Обсуждение
В этой статье мы представили метод проведения насыщения Ca 2+ -чувствительным красителем в нервных окончаниях лягушки через нервный культи. К концу процедуры загрузки все терминалы в проксимальной части нерва имеют значительные уровни флуоресценции. Было подсчитано, что внутритерминальная концентрация зонда колеблется между 40 и 150 мкМ 17 .
Процедура инкубации проводится в два этапа: при комнатной температуре и затем при более низкой температуре в холодильнике. Важно контролировать время инкубации ткани с красителем при комнатной температуре. В зависимости от фактической длины культи нерва, специфического красителя и температуры время инкубации может изменяться. Если переэкспонировано, клеммы в проксимальных частях, близких к пням нерва, могут быть перегружены. Однако в средней части нерва все еще можно найти терминалы, которые удовлетворительно загружены. Во времяДлительная инкубация в холодильнике, краситель равномерно распределяется по нервным окончаниям.
Наши собственные наблюдения 33 , 35 , а также данные других исследователей 30 доказывают отсутствие какого-либо заметного влияния процедуры нагружения на амплитуду постсинаптического отклика или на частоту миниатюрных потенциалов концевых пластин. Хорошее долголетие было зафиксировано в загруженных препаратах. Есть несколько важных моментов, на которые мы хотели бы обратить внимание. Очень важно поместить нервный культ в раствор для загрузки красителя в течение нескольких минут после удаления, чтобы краска могла войти в аксоны срезанного нерва; Задержки могут привести к неэффективной нагрузке, по-видимому, из-за повторного запечатывания нервных аксонов 27 , 36 . Некоторые исследователи погружают нервную культуру в 100 мМ ЭДТА (Ca 2+ - и Mg 2+ -литератор) Сразу после удаления нерва, чтобы предотвратить резание разрезанных аксонов. Буфер удаляют через 1-2 мин и заменяют раствором для загрузки красителя 37 . Использование бутылки с нефтяным железом вместо пластиковых труб для процедуры загрузки позволяет использовать более короткий нервный культи. При использовании этого подхода нерв разрезается после того, как он погружен в раствор HEPES с красителем, и аксоны не запечатываются из-за отсутствия двухвалентных ионов в растворе красителя 27 , 28 .
В нашем исследовании мы использовали водорастворимую соль с индикатором Ca 2+ вместо декстрана. Конъюгаты декстрана диффундируют в аксоне медленнее, чем соли. Однако использование декстранового конъюгата уменьшает компартментализацию красителей и обработку нервами и NMJ. Кальций зеленый Конъюгат декстрана с энергией 1-3 000 МВт имеет хорошую скорость диффузии и демонстрирует снижение компартментализации Up class = "xref"> 38.
Очень важно избегать длительного периода флуоресцентного освещения ткани, поскольку это влияет на его здоровье и выживание. Мы используем оптику Nomarski в канале видимого света для поиска нервных терминалов. Во время записи мы ограничиваем освещенное поле с помощью диафрагмы.
Следует отметить, что этот метод загрузки подходит только для препаратов, которые могут выдерживать длительные инкубации. Чтобы уменьшить время загрузки красителя, когда исследования проводятся на более хрупких тканях ( например, синапсы теплокровных животных), необходимо уменьшить масштаб нервной культи и использовать микропипетки для загрузки 29 , 39 .
Эта методика загрузки хорошо подходит для визуализации изменений в цитозольном Ca 2+ , с флуоресцентными показателями как при стимуляции одной нервной системой, так и в ритмической синаптической активностиEf "> 17 , 27 , 35. Анализ амплитуды перехода Ca 2+ может быть использован для изучения влияния различных веществ на вход кальция, который участвует в высвобождении нейротрансмиттера 33 .
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование проводилось в рамках Программы конкурентоспособности России при Казанском федеральном университете и гранта Российского фонда фундаментальных исследований (16-04-01051, 16-34-00817, 15-04-02983). Мы благодарим четырех анонимных рецензентов за предоставление полезных комментариев по более ранним черновикам рукописи. Выражаем благодарность Юлии Арацской за запись голоса. Мы благодарны д-ру Виктору Ильину за многочисленные полезные комментарии и помощь в финальном редактировании рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| Ca2+ indicator | Molecular Probes, USA | Oregon Green 488 BAPTA-1 hexapotassium salt, O6806 | 500 μg |
| Silicone Elastomer | Dow Corning, USA | Sylgard 184 elastomer | |
| Pipette | Biohit, Russia | 720210 | 0.5-10µL |
| Pipette tip | Fisher Scientific, USA | 02-707-175 | 10µL |
| Pipette tip | Biohit, Russia | 781349 | 10µL |
| Razor Blade | Fisher Scientific, USA | 12-640 | |
| Minutien Pins | Fine scince tools, Canada | 26002-20 | |
| Corneal Mini-Scissors | MT MEDI CORP, Canada | S-1111 | |
| Jeweler Forceps | MT MEDI CORP, Canada | F-9610 | |
| Jeweler Forceps | MT MEDI CORP, Canada | F-9611 | |
| Modelling clay | local producer | can be replaced by any local producer | |
| Petroleum jelly | local producer | can be replaced by any local producer | |
| Microspin FV 2400 | Biosan, Latva | BS-010201-AAA | |
| Multi-spin MSC 3000 | Biosan, Latva | BS-010205-AAN | |
| Single-use hypodermic needles | Bbraun | 100 Sterican | 0.4×40mm |
| Syrynge | local producer | 0.5 ml | |
| HEPES | Sigma-Aldrich, USA | H0887 | 100ml |
| Microscope, BX51 | Olympus, Japan | ||
| Data acquisition system | Molecular Devices, USA | Digitdata 1550 | |
| software | Molecular Devices, USA | pClamp software, Version 10 | protocol can be download from : http://kpfu.ru/portal/docs/F_230007060/Video.capture.with. RedShirt.Neuro.CCD.camera.pro |
| Bath and bath temperature controler | Experimental Builder | can be replaced by any chamber with temperature control. For example from https://www.warneronline.com/ | |
| Monochromator | Till Photonics, Germany | Polychrome V | no longer available, can be replaced by other sutable stable light source 488 nm |
| monochromator control software | Till Photonics, Germany | Polycon | |
| Digital CCD camera | Redshirt imaging, USA | Neuro CCD SMQ | |
| Model 2100 Isolated Pulse Stimulator | A-M Systems, USA | ||
| Acquisition software for CCD camera | Redshirt imaging, USA | Turbo SM software | |
| ImageJ | National Institutes of Health, USA | http://rsb.info.nih.gov/ij/download.html | |
| Spreadsheet program | Microsoft, USA | Microsoft Office Excel |
Ссылки
- Llinás, R., Sugimori, M., Silver, R. B. Microdomains of high calcium concentration in a presynaptic terminal. Science. 256, 677-679 (1992).
- Augustine, G. J. How does calcium trigger neurotransmitter release? Curr Opin Neurobiol. 11, 320-326 (2001).
- Burnashev, N., Rozov, A. Presynaptic Ca2+ dynamics, Ca2+ buffers and synaptic efficacy. Cell Calcium. 37, 489-495 (2005).
- Schneggenburger, R., Neher, E. Presynaptic calcium and control of vesicle fusion. Curr Opin Neurobiol. 15, 266-274 (2005).
- Pang, Z. P., Südhof, T. C. Cell biology of Ca2+-triggered exocytosis. Curr Opin Cell Biol. 22, 496-505 (2010).
- Borst, J. G., Sakmann, B. Calcium influx and transmitter release in a fast CNS synapse. Nature. 383, 431-434 (1996).
- Borst, J. G., Sakmann, B. Calcium current during a single action potential in a large presynaptic terminal of the rat brainstem. J Physiol. 506, 143-157 (1998).
- Yazejian, B., DiGregorio, D. A., Vergara, J. L., Poage, R. E., Meriney, S. D., Grinnell, A. D. Direct measurements of presynaptic calcium and calcium-activated potassium currents regulating neurotransmitter release at cultured Xenopus nerve-muscle synapses. J Neurosci. 17, 2990-3001 (1997).
- Molgó, J., Mallart, A. Effects of Anemonia sulcatatoxin II on presynaptic currents and evoked transmitter release at neuromuscular junctions of the mouse. Pflugers Arch. 405 (4), 349-353 (1985).
- Slutsky, I., Rashkovan, G., Parnas, H., Parnas, I. Ca2+-independent feedback inhibition of acetylcholine release in frog neuromuscular junction. J Neurosci. 22 (9), 3426-3433 (2002).
- Haugland, R. P. Indicators for Ca2+, Mg2+, Zn2+ and other metal ions. Handbook of fluorescent probes and research products. Gregory, J. , MolecularProbes. Eugene,Oregon. 771-826 (2002).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Tsien, R. Y. Fluorescent indicators of ion concentrations. Methods Cell Biol. 30, 127-156 (1989).
- Adams, S. R. How calcium indicators work. Cold Spring Harb Protoc. 2010 (3), (2010).
- DiGregorio, D. A., Vergara, J. L. Localized detection of action potential-induced presynaptic calcium transients at a Xenopus neuromuscular junction. J Physiol. 505, 585-592 (1997).
- Sabatini, B. L., Regehr, W. G. Optical measurement of presynaptic calcium currents. Biophys J. 74, 1549-1563 (1998).
- Suzuki, S. Ca2+ dynamics at the frog motor nerve terminal. Pflug Arch Eur J Phisiol. 440, 351-365 (2000).
- Sabatini, B. L., Oertner, T. G., Svoboda, K. The life cycle of Ca2+ ions in dendritic spines. Neuron. 33, 439-452 (2002).
- Luo, F., Dittrich, M., Stiles, J. R., Meriney, S. D. Single-pixel optical fluctuation analysis of calcium channel function in active zones of motor nerve terminals. J Neurosci. 31, 11268-11281 (2011).
- Regehr, W. G. Monitoring presynaptic calcium dynamics with membrane-permeant indicators. Imaging in neuroscience and development: a laboratory manual. Yuste, R., Konnerth, A. , Cold Spring Harbor Laboratory Press. New York. 307-314 (2005).
- Macleod, G. T. Topical Application of Indicators for Calcium Imaging at the Drosophila Larval Neuromuscular Junction. Cold Spring Harb Protoc. 2012 (7), 786-790 (2012).
- Eilers, J., Konnerth, A. Dye loading with Patch Pipettes. Cold Spring Harb Protoc. 2009 (4), 277-281 (2009).
- Coleman, W. L., Bill, C. A., Simsek-Duran, F., Lonart, G., Samigullin, D., Bykhovskaia, M. Synapsin II and calcium regulate vesicle docking and the cross-talk between vesicle pools at the mouse motor terminals. J Physiol. 586 (19), 4649-4673 (2008).
- Macleod, G. T. Direct Injection of Indicators for Calcium Imaging at the Drosophila Larval Neuromuscular Junction. Cold Spring Harb Protoc. 2012 (7), 797-801 (2012).
- Talbot, J. D., David, G., Barrett, E. F., Barrett, J. N. Calcium dependence of damage to mouse motor nerve terminals following oxygen/glucose deprivation. Exp Neurol. 234 (1), 95-104 (2012).
- Peng, Y. Y., Zucker, R. S. Release of LHRH is linearly related to the time integral of presynaptic Ca2+ elevation above a threshold level in bullfrog sympathetic ganglia. Neuron. 10, 465-473 (1993).
- Tsang, C. W., Elrick, D. B., Charlton, M. P. alpha-Latrotoxin releases calcium in frog motor nerve terminals. J Neurosci. 20 (23), 8685-8692 (2000).
- Newman, Z., Malik, P., Wu, T. Y., Ochoa, C., Watsa, N., Lindgren, C. Endocannabinoids mediate muscarine-induced synaptic depression at the vertebrate neuromuscular junction. Eur J Neurosci. 25 (6), 1619-1630 (2007).
- Macleod, G. T. Forward-filling of dextran-conjugated indicators for calcium imaging at the drosophila larval neuromuscular junction. Cold Spring Harb Protoc. 2012 (7), 3440-3450 (2012).
- Wu, L. G., Betz, W. J. Nerve activity but not intracellular calcium determines the time course of endocytosis at the frog neuromuscular junction. Neuron. 17 (4), 769-779 (1996).
- Blioch, Z. L., Glagoleva, I. M., Liberman, E. A., Nenashev, V. A. A study of the mechanism of quantal transmitter release at a chemical synapse. J Physiol. (1), 11-35 (1968).
- Kazakov, A., Aleksandrov, M., Zhilyakov, N. V., Khaziev, E. F., Samigullin, D. V. A simple suction electrode for electrical stimulation of biological objects. Mezhdunarodnyj nauchno-issledovatel'skij zhurnal. 40 (9), In Russian 13-16 (2015).
- Khaziev, E. Acetylcholine-induced inhibition of presynaptic calcium signals and transmitter release in the frog neuromuscular junction. Front Physiol. 7 (621), 1-10 (2016).
- Bélair, E. L., Vallée, J., Robitaille, R. Long-term in vivo modulation of synaptic efficacy at the neuromuscular junction of Rana pipiens frogs. J Physiol. 569 (1), 163-178 (2005).
- Samigullin, D., Fatikhov, N., Khaziev, E., Skorinkin, A., Nikolsky, E., Bukharaeva, E. Estimation of presynaptic calcium currents and endogenous calcium buffers at the frog neuromuscular junction with two different calcium fluorescent dyes. Front Synaptic Neurosci. 6 (29), 1-10 (2015).
- Angleson, J. K., Betz, W. J. Intraterminal Ca2+ and spontaneous transmitter release at the frog neuromuscular junction. J Neurophysiol. 85 (1), 287-294 (2001).
- Shahrezaei, V., Cao, A., Delaney, K. R. Ca2+ from one or two channels controls fusion of a single vesicle at the frog neuromuscular junction. J Neurosci. 26 (51), 13240-132499 (2006).
- Troncone, L. R., et al. Promiscuous and reversible blocker of presynaptic calcium channels in frog and crayfish neuromuscular junctions from Phoneutria nigriventer spider venom. J Neurophysiol. 90 (5), 3529-3537 (2003).
- Samigullin, D. V., Khaziev, E. F., Zhilyakov, N. V., Sudakov, I. A., Bukharaeva, E. A., Nikolsky, E. E. Calcium transient registration in response to single stimulation and during train of pulses in mouse neuromuscular junction. BioNanoSci. 7 (1), 162-166 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены