Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измерение поглощения глюкозы и ответ на стимуляцию инсулина в
В этой статье
Резюме
В этом методе человеческие первичные мышечные клетки культивируют in vitro для получения дифференцированных миотубов и измеряют скорости поглощения глюкозы. Мы предоставляем подробный протокол для количественной оценки показателей в базальных и стимулированных инсулином состояниях с использованием радиоактивно меченого [ 3 H] 2-дезокси-D-глюкозы.
Аннотация
Скелетные мышцы являются самым большим содержанием глюкозы у млекопитающих и в значительной степени способствуют гомеостазу глюкозы. Оценка чувствительности к инсулину мышечных клеток имеет большое значение для всех исследований, посвященных изучению метаболизма глюкозы в мышцах и характеризующих метаболические изменения. В мышечных клетках белки транспортера белка глюкозы типа 4 (GLUT4) транслоцируются в плазматическую мембрану в ответ на инсулин, что позволяет массово вводить глюкозу в клетку. Способность мышечных клеток реагировать на инсулин путем увеличения скорости поглощения глюкозы является одним из стандартных показателей для количественной оценки чувствительности мышечных клеток к инсулину. Первичные миотубы человека являются подходящей моделью in vitro , так как клетки поддерживают многие особенности фенотипа донора, включая чувствительность к инсулину. Эта модель in vitro также подходит для тестирования любых соединений, которые могут влиять на чувствительность к инсулину. Измерения скорости поглощения глюкозы в дифференцированных миотубах отражаютЧувствительность к инсулину.
В этом методе человеческие первичные мышечные клетки культивируют in vitro для получения дифференцированных миотубов и измеряют уровни поглощения глюкозы с стимуляцией инсулина и без нее. Мы предоставляем подробный протокол для количественной оценки пассивных и активных скоростей переноса глюкозы с использованием радиоактивно меченой [ 3 H] 2-дезокси-D-глюкозы ([ 3 H] 2dG). Методы расчета предоставляются для количественного определения активных базальных и стимулированных инсулином скоростей, а также сгибания стимуляции.
Введение
Скелетные мышцы являются самым большим содержанием глюкозы у млекопитающих и в значительной степени способствуют гомеостазу глюкозы. Эта чувствительная к инсулину ткань является основным участком поглощения глюкозы, вызванным стимуляцией инсулина 1 .
При диабете 2 типа резистентность к инсулину наблюдается в нескольких тканях, включая скелетную мышцу, и приводит к превышению нормальной концентрации глюкозы в крови. Таким образом, очень важно определить уровень чувствительности к инсулину этой ткани и ее клеток, независимо от того, является ли цель характеризовать дефект у субъекта или оценить эффективность лечения, направленного на его улучшение. У людей или животных, метод золотого стандарта для оценки чувствительности к инсулину - это гиперинсулинемико-эвгликемический зажим. Введенный DeFronzo в 1979 году 2 и измененный с 3 , 4, тогда метод позволяет количественно измерить все тело aЙ сыворотке крови, измеряемой как скорость глюкозы, которую нужно перфузировать при стимуляции инсулина для поддержания нормальной концентрации глюкозы в крови.
Исследование чувствительности к инсулину также может быть выполнено на уровне клеток с использованием моделей мышц in vitro , а измерение уровня поглощения глюкозы остается эффективным и надежным инструментом для количественной оценки биологической реакции клетки на стимуляцию инсулина 5 , 6 , 7 . Действительно, измерение поглощения глюкозы количественно оценивает биологическую реакцию клеток на стимуляцию инсулина, от связывания инсулина с его рецептором с транслокацией обогащенных GLUT4 везикул и включая внутриклеточные сигнальные и фосфорилирующие каскады 8 .
Это представляет большой интерес для образцов человека, поскольку дифференцированные миотубы поддерживают многие особенности донорского фенотипа, включая метаболическое свойствоИ нарушениями, наблюдаемыми у пациента 9 , 10 , 11 , 12 . Миотубы демонстрируют структурное, метаболическое и фенотипическое сходство с скелетной мышцей 13 , 14 , включая экспрессию транспортеров 15 для глюкозы и аппаратуру сигнализации клеточного инсулина 16 . Таким образом, измерение поглощения глюкозы в первичных миопутах имеет значение для характеристики фенотипа мышц донора или исследования влияния вмешательства (лекарственного средства, питания или физической активности) на чувствительность к инсулину в мышечной клетке.
Измерение поглощения глюкозы на культивируемых миопутах также является надежным инструментом при проведении экспериментов, которые изменяют чувствительность к инсулину 17 , 18 . В пробирке подходит для испытаний любых соединений, которые могут улучшить чувствительность к инсулину, или могут предотвратить или обратить вспять приобретенную или индуцированную резистентность к инсулину 19 , 20 , 21 , 22 , 23 .
Здесь мы описываем подробный протокол к культуре и дифференцируем человеческие миотубы и измеряем уровни поглощения глюкозы клеток. Этот метод применим к любому источнику клеток-предшественников мышечных клеток человека, независимо от того, поступают ли они из лабораторных препаратов, совместной работы или коммерчески доступных поставщиков. Иммертизированные линии мышечных клеток, такие как C2C12 и L6, соответственно, из происхождения мыши и крысы, также могут использоваться для измерения поглощения глюкозы с помощью этого протокола 7 .
Мы предоставляем подробный протокол для количественной оценки показателей в базальных и стимулированных инсулином состояниях с использованием радиоактивно меченого [ 3 H] 2dG. TОн использует маркированный глюкозный аналог, позволяющий точно определять введение глюкозы с уменьшенным исходным материалом, обычное условие при работе с первичными клетками. Модифицированная молекула глюкозы неспособна проникать в метаболические пути и, таким образом, накапливается внутри клетки, обеспечивая надежную количественную оценку с помощью полной радиоактивности клеток. Экспериментальные условия включают использование ингибитора транспорта глюкозы (цитохалазин В), а измерения проводятся с инсулином и без него. Эта комбинация позволяет определить уровни активности активного глюкозы, а также расчет изменения смены индекса инсулина. Метод представлен одной дозой инсулина в течение одного времени инкубации, но протокол может быть легко модифицирован для дозозависимых или временных экспериментов 12 .
протокол
1. Подготовка среды и растворов клеточной культуры
- Получение культуральной среды
- Подготовьте среду для пролиферации (ПМ), добавив среду Х-Х-F с глутамином (2 мМ), пенициллином / стрептомицином (5 мкг / мл конечной), 2% сывороткой плодного теленка (FCS) и 2% -ной заменой сыворотки.
- Подготовьте среду дифференцировки (DM), добавив модифицированную Дульбекко среду Игла (DMEM) глутамином (2 мМ), пенициллином / стрептомицином (5 мкг / мл конечной) и 2% FCS.
- Подготовка растворов для поглощения глюкозы
Осторожно: обращение с радиоактивным материалом разрешается только в ограниченном и контролируемом районе уполномоченным персоналом. Материал и отходы должны обрабатываться в соответствии с надлежащими процедурами, руководящими принципами и местным законодательством.- Для получения забуференного фосфатом соляного раствора X-Dulbecco (X-DPBS), получают раствор DPBS, содержащий 0,2% (мас. / Об.) (Конечная концентрация) бычьей сыворотки albUmin (BSA). Фильтруйте раствор через фильтр 0,2 мкм. Хранить при температуре 4 ° C.
- Для приготовления холодного раствора 2-дезокси-D-глюкозы (2 г) взвесьте 16,4 мг 2 дГ и солюбилизируют в 10 мл дистиллированной воды с получением 10 мМ раствора. Хранить при температуре 4 ° C.
- Добавьте 600 мкл холодного 2dG и 6 мкл радиоактивно меченого [ 3 H] 2dG до 5400 мкл X-DPBS для получения радиоактивно меченного раствора 2dG (2dG *).
ПРИМЕЧАНИЕ. Конечная концентрация составляет 1 мМ 2 дГ, а маркировка составляет 1 мкКи / мл.- Отложите 20 мкл аликвоты (TC20) радиоактивно меченного раствора 2dG *.
- Получение инкубационных смесей
- Для смеси цитохалазина В добавить 2 мкл 20 мМ цитохалазина В в 2 мл радиоактивно меченного 2dG * раствора.
ПРИМЕЧАНИЕ. Сыпучий раствор цитохалазина В составляет 10 мг / мл в диметилсульфоксиде (ДМСО). - Для смеси ДМСО добавить 4 мкл ДМСО в оставшиеся 4 мл радиоактивно меченного 2dG * раствора.
2. Культура первичных мышечных клеток человека
- Посев 6-луночных планшетов с человеческими мышечными спутниковыми ячейками
ПРИМЕЧАНИЕ. Используйте внутреннюю (см. Ссылку 24 для деталей) или коммерчески доступные человеческие мышиные спутниковые клетки из замороженного флакона (содержащего 250 000 клеток). Для 250 000 клеток дается следующая процедура для получения одной 6-луночной планшеты, необходимой для измерения поглощения глюкозы в одном состоянии.- Быстро оттаивайте замороженные пузырьки внутренних или коммерческих препаратов человеческих мышечных сателлитных клеток в предварительно нагретой воде (37 ° C), пока в флаконе не останется только небольшой ледяной блок.
- Налейте непосредственно в пластиковую трубку объемом 50 мл, содержащую 10 мл предварительно нагретого (37 ° С) ТЧ.
- Центрифугируют в течение 5 мин при 500 мкг и отбрасывают супернатант.
- Аккуратно ресуспендируйте клеточный осадок с 18 мл предварительно нагретого ТЧ (чтобы получить 42 000 клеток в3 мл среды). Распределите 3 мл в каждую лунку 6-луночного планшета (9,6 см 2 ).
ПРИМЕЧАНИЕ. Для выполнения двойного измерения поглощения глюкозы требуются шесть отдельных лунок планшета для следующих условий: пассивное ингибирование транспорта (лунки 1 и 2), базальная скорость (лунки 3 и 4) и скорость стимуляции инсулина (лунки 5 и 6). Повторите как можно больше шести-луночных планшетов, так как необходимы различные процедуры. - Инкубируйте в стандартных условиях культивирования (37 ° C, 5% CO 2 ) до тех пор, пока клетки не достигнут 90% слияния.
ПРИМЕЧАНИЕ. Этот шаг занимает от 48 до 72 часов в зависимости от партии ячейки. Не изменяйте среду во время этого шага.
- Дифференциация мышечных клеток
- Удалите PM (через 48-72 ч) и замените предварительно нагретым DM (3 мл на лунку). Инкубируйте при 37 ° C, 5% CO 2 .
ПРИМЕЧАНИЕ. Дифференциация занимает пять дней, чтобы достичь стабильного состояния, когда клетки выравниваются и полинуклеируются. Как правило, первичныйМиотубы культивируют в 1 г / л глюкозной среде. Поэтому, чтобы избежать истощения глюкозы во время культивирования, наполните планшет 3 мл среды, чтобы обеспечить достаточное содержание глюкозного субстрата для клеток в любое время. - Заменяйте DM-среду каждые два дня.
ПРИМЕЧАНИЕ. С этого момента миотубы стабильны в течение 7 дней без каких-либо значительных изменений, и измерение поглощения глюкозы может быть выполнено в любое время.
- Удалите PM (через 48-72 ч) и замените предварительно нагретым DM (3 мл на лунку). Инкубируйте при 37 ° C, 5% CO 2 .
- Обработка мышечных клеток (по желанию)
ПРИМЕЧАНИЕ. Первичные миотубы можно лечить в течение нескольких дней, чтобы вызвать модификацию (тест на наркотики, ингибиторы / активаторы сигнального пути и т. Д. ) До проведения инсулиновой стимуляции и измерения поглощения глюкозы. Мышечные клетки могут быть подвергнуты любой обработке, которая может повлиять на чувствительность к инсулину, и измерение поглощения глюкозы будет определять это влияние. Например, инкубация мышечных клеток с пальмитатом насыщенных жирных кислот способствует резистентности к инсулину, а клетки показывают снижение iНсулин стимулировал поглощение глюкозы.- Подготовьте 12 мл DM, дополненного 10% BSA (без жирной кислоты) и 0,5 мл пальмитата (PALM). Подготовьте 12 мл DM, дополненного только 10% BSA (без жирной кислоты).
- Подготовьте две 6-луночные планшеты с первичными миотубами человека и культивируйте их, как описано в разделах 2.1 и 2.2 (с 5-дневным дифференцированием).
- На 5-й день промыть каждую лунку 2 мл PBS. На одну пластину добавить 2 мл DM, содержащего PALM. К другой пластине добавляют 2 мл BSA, содержащих только DM.
- Инкубируйте в течение 48 ч при 37 ° С, 5% CO 2 .
3. Стимулирование инсулина
- Промыть дифференцированные мышечные клетки дважды с помощью 2 мл PBS.
- Немедленно удалите PBS и инкубируйте с 3 мл DM без FCS в течение 3 часов (37 ° C, 5% CO 2 ) для истощения сыворотки.
- Замените носитель во всех лунках 3 мл DM без FCS. Добавить 100 нМ инсулин в лунки 5 и 6.
- Инкубируйте культуру человеческих миотубов для1 ч (37 ° С, 5% CO 2 ).
4. Поглощение глюкозы
- Через 1 ч стимуляции инсулина дважды промывайте лунки X-DPBS (1 мл на промывку).
- Добавьте 1 мл смеси цитохалазина В в лунки 1 и 2 и 1 мл смеси ДМСО в лунки 3-6. Инкубируйте в течение 15 мин (37 ° С, 5% СО 2 ). В конце инкубации немедленно поместите пластину на лед.
5. Лизис клеток
- Промойте клетки дважды 1 мл ледяного PBS.
- Lyse клетки в каждой лунке с 600 мкл 50 мМ NaOH. Инкубируйте на льду в течение 5 минут и осторожно перемешайте с медленным вращением орбиты.
ПРИМЕЧАНИЕ. Если лизат слишком вязкий, разбавьте до 1,5 мл NaOH. - Используя пипетку, повторно суспендируйте и собирайте лизат клеток.
6. Определение радиоактивно меченой глюкозы
- Поместите 400 мкл каждого клеточного лизата в жидкостный сцинтилляционный счетный флакон. Подготовьте отрицательный контрольный флакон с 400Мкл 50 мМ NaOH и положительный контрольный флакон с 20 мкл TC20 (из шага 1.2.3.1).
- Добавьте 4 мл жидкого сцинтилляционного раствора в каждый флакон. Закройте колпачок и тщательно перемешайте каждый флакон (1-2 с).
- Вставьте каждый флакон в жидкий сцинтилляционный счетчик и измерьте радиоактивность в соответствии с инструкцией производителя. Количество записей в минуту (CPM) для каждого сцинтилляционного флакона в течение 10 мин.
ПРИМЕЧАНИЕ: CPM = «дезинтеграция в минуту» x «эффективность подсчета».
7. Скорость поглощения глюкозы
- Используйте оставшийся лизат (200 мкл, шаг 5,2) для измерения концентрации белка. Определите концентрацию белка в каждом клеточном лизате с использованием Bradford 25 или эквивалентного метода. Вычислите общее количество белка (Q) в мг для каждой лунки.
- Чтобы получить TC1 (значение для 1 мкл радиоактивно меченого 2dG *), разделите значение CPM TC20 на 20.
- Для каждого флакона вычислите tОн оценивает потребление глюкозы следующим образом:
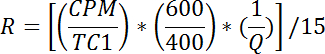
ПРИМЕЧАНИЕ: R измеряется в пмоль / мг / мин. Среднее значение R для скважин 1 - 2 дает пассивную скорость переноса, R p . Среднее значение R для скважин 3-4 дает базовую общую скорость переноса, R bt . Среднее значение R для скважин 5-6 дает стимулированную инсулином общую транспортную скорость, R it .- Рассчитайте базовую активную скорость переноса (R ba ) следующим образом:
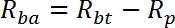
- Рассчитайте скорость активного транспорта, стимулированную инсулином (R ia ) следующим образом:
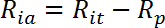
ПРИМЕЧАНИЕ. В клетках, чувствительных к инсулину, таких как миотубы, показатели поглощения глюкозы обычно представлены тремя значениями: R ba , R ia и стимулированием складки инсулина в виде R ia / R ba .
- Рассчитайте базовую активную скорость переноса (R ba ) следующим образом:
- Для смеси цитохалазина В добавить 2 мкл 20 мМ цитохалазина В в 2 мл радиоактивно меченного 2dG * раствора.
Результаты
На третий день миобласты достигают слияния ( рис. 1А ). Миобласты на этом этапе обычно мононуклеированы. Средство было изменено, и на 8-й день была завершена дифференциация ( рисунок 1B ) (раздел протокола 2). Через 5 дней дифференцировки миот?...
Обсуждение
Поглощение глюкозы является ключевым биологическим измерением для тестирования активаторов или ингибиторов клеточной культуры и того, как они влияют на использование глюкозы, и способность клетки реагировать на инсулин. Описанный здесь метод оказался быстрым и надежным и широко исп...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы признают Энн Шарри в службе радиобиологии (больница Лион-Сюд) и Фонд «Национальный суис» (FNS) за финансовую поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| Human primary muscle cell | In house preparation from human skeletal muscle biopsies | In house preparation from human skeletal muscle biopsies | If not available, use commercial source |
| Human primary muscle cell | Promocell | C-12530 | Should be cultured with associated media C23060 and C23061 |
| 6-well plate | Corning | 356400 | BioCoat Collagen I Multiwell Plates |
| Ham's F10 | Dutscher | L0145-500 | 1 g/L glucose |
| Glutamine | Dutscher | X0551-100 | |
| penicilin/streptomycin 100x | Thermo fisher scientific | 15140122 | |
| Serum substitute UltroserG | Pall France | 15950.017 | serum substitute in text |
| DMEM low glucose | Dutscher | L0064-500 | 1 g/L glucose |
| Fetal Calf Serum | Eurobio | CVFSVF00-01 | |
| Dulbecco's Phosphate-Buffered Saline | Dutscher | L0625-500 | Contains Mg2+ (0.5 mM) and Ca2+ (0.9 mM) |
| Insulin solution human | Sigma-Aldrich | I9278 | |
| 2-deoxy-D-glucose | Sigma-Aldrich | D6134 | |
| Albumin bovine | euromedex | 04-100-812-E | |
| fatty acid-free BSA | Roche | 10,775,835,001 | |
| palmitate | Sigma-Aldrich | P0500 | |
| Deoxy-D-glucose, 2-[1,2-3H (N)] | PerkinElmer | NET328A001MC | Specific Activity: 5 - 10 Ci (185-370GBq)/mmol, 1 mCi (37MBq |
| Cytochalasin B | Sigma-Aldrich | c2743 | |
| PICO PRIAS VIAL 6 mL | PerkinElmer | 6000192 | |
| ultima gold MW CA | PerkinElmer | 6013159 | scintillation liquid |
| bêta counter | PerkinElmer | 2900TR |
Ссылки
- Stump, C. S., Henriksen, E. J., Wei, Y., Sowers, J. R. The metabolic syndrome: role of skeletal muscle metabolism. Ann Med. 38 (6), 389-402 (2006).
- DeFronzo, R. A., Tobin, J. D., Andres, R. Glucose clamp technique: a method for quantifying insulin secretion and resistance. Am J Physiol. 237 (3), E214-E223 (1979).
- Fossum, E., Hoieggen, A., Moan, A., Nordby, G., Kjeldsen, S. E. Insulin sensitivity relates to other cardiovascular risk factors in young men: validation of some modifications of the hyperinsulinaemic, isoglycaemic glucose clamp technique. Blood Press Suppl. 2, 113-119 (1997).
- Heise, T., et al. Euglycaemic glucose clamp: what it can and cannot do, and how to do it. Diabetes Obes Metab. 18 (10), 962-972 (2016).
- Sell, H., Jensen, J., Eckel, J. Measurement of insulin sensitivity in skeletal muscle in vitro. Methods Mol Biol. 933, 255-263 (2012).
- Sarabia, V., Lam, L., Burdett, E., Leiter, L. A., Klip, A. Glucose transport in human skeletal muscle cells in culture. Stimulation by insulin and metformin. J Clin Invest. 90 (4), 1386-1395 (1992).
- Sarabia, V., Ramlal, T., Klip, A. Glucose uptake in human and animal muscle cells in culture. Biochem Cell Biol. 68 (2), 536-542 (1990).
- Richter, E. A., Hargreaves, M. Exercise, GLUT4, and skeletal muscle glucose uptake. Physiol Rev. 93 (3), 993-1017 (2013).
- Gaster, M., Kristensen, S. R., Beck-Nielsen, H., Schroder, H. D. A cellular model system of differentiated human myotubes. Apmis. 109 (11), 735-744 (2001).
- Bouzakri, K., et al. Reduced activation of phosphatidylinositol-3 kinase and increased serine 636 phosphorylation of insulin receptor substrate-1 in primary culture of skeletal muscle cells from patients with type 2 diabetes. Diabetes. 52 (6), 1319-1325 (2003).
- Scheele, C., et al. Satellite cells derived from obese humans with type 2 diabetes and differentiated into myocytes in vitro exhibit abnormal response to IL-6. PLoS One. 7 (6), e39657 (2012).
- Jackson, S., et al. Decreased insulin responsiveness of glucose uptake in cultured human skeletal muscle cells from insulin-resistant nondiabetic relatives of type 2 diabetic families. Diabetes. 49 (7), 1169-1177 (2000).
- Aas, V., et al. Are cultured human myotubes far from home?. Cell Tissue Res. 354 (3), 671-682 (2013).
- Bakke, S. S., et al. Myotubes from severely obese type 2 diabetic subjects accumulate less lipids and show higher lipolytic rate than myotubes from severely obese non-diabetic subjects. PLoS One. 10 (3), e0119556 (2015).
- Stuart, C. A., et al. Hexose transporter mRNAs for GLUT4, GLUT5, and GLUT12 predominate in human muscle. Am J Physiol Endocrinol Metab. 291 (5), E1067-E1073 (2006).
- Al-Khalili, L., et al. Insulin action in cultured human skeletal muscle cells during differentiation: assessment of cell surface GLUT4 and GLUT1 content. Cell Mol Life Sci. 60 (5), 991-998 (2003).
- Tsuka, S., et al. Promotion of insulin-induced glucose uptake in C2C12 myotubes by osteocalcin. Biochem Biophys Res Commun. 459 (3), 437-442 (2015).
- Gorbunov, E. A., Nicoll, J., Myslivets, A. A., Kachaeva, E. V., Tarasov, S. A. Subetta Enhances Sensitivity of Human Muscle Cells to Insulin. Bull Exp Biol Med. 159 (4), 463-465 (2015).
- Breen, D. M., Sanli, T., Giacca, A., Tsiani, E. Stimulation of muscle cell glucose uptake by resveratrol through sirtuins and AMPK. Biochem Biophys Res Commun. 374 (1), 117-122 (2008).
- Pinnamaneni, S. K., Southgate, R. J., Febbraio, M. A., Watt, M. J. Stearoyl CoA desaturase 1 is elevated in obesity but protects against fatty acid-induced skeletal muscle insulin resistance in vitro. Diabetologia. 49 (12), 3027-3037 (2006).
- Gastebois, C., et al. Transition from physical activity to inactivity increases skeletal muscle miR-148b content and triggers insulin resistance. Physiol Rep. 4 (17), (2016).
- Naimi, M., Tsakiridis, T., Stamatatos, T. C., Alexandropoulos, D. I., Tsiani, E. Increased skeletal muscle glucose uptake by rosemary extract through AMPK activation. Appl Physiol Nutr Metab. 40 (4), 407-413 (2015).
- Feng, Y. Z., et al. PPARdelta activation in human myotubes increases mitochondrial fatty acid oxidative capacity and reduces glucose utilization by a switch in substrate preference. Arch Physiol Biochem. 120 (1), 12-21 (2014).
- Perrin, L., et al. Human skeletal myotubes display a cell-autonomous circadian clock implicated in basal myokine secretion. Mol Metab. 4 (11), 834-845 (2015).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Bouzakri, K., et al. Malonyl CoenzymeA decarboxylase regulates lipid and glucose metabolism in human skeletal muscle. Diabetes. 57 (6), 1508-1516 (2008).
- Shemyakin, A., et al. Endothelin-1 reduces glucose uptake in human skeletal muscle in vivo and in vitro. Diabetes. 60 (8), 2061-2067 (2011).
- Alkhateeb, H., Chabowski, A., Glatz, J. F., Luiken, J. F., Bonen, A. Two phases of palmitate-induced insulin resistance in skeletal muscle: impaired GLUT4 translocation is followed by a reduced GLUT4 intrinsic activity. Am J Physiol Endocrinol Metab. 293 (3), E783-E793 (2007).
- Coll, T., et al. Oleate reverses palmitate-induced insulin resistance and inflammation in skeletal muscle cells. J Biol Chem. 283 (17), 11107-11116 (2008).
- Gaster, M., Rustan, A. C., Beck-Nielsen, H. Differential utilization of saturated palmitate and unsaturated oleate: evidence from cultured myotubes. Diabetes. 54 (3), 648-656 (2005).
- Hage Hassan, R., et al. Endoplasmic reticulum stress does not mediate palmitate-induced insulin resistance in mouse and human muscle cells. Diabetologia. 55 (1), 204-214 (2012).
- Haghani, K., Pashaei, S., Vakili, S., Taheripak, G., Bakhtiyari, S. TNF-alpha knockdown alleviates palmitate-induced insulin resistance in C2C12 skeletal muscle cells. Biochem Biophys Res Commun. 460 (4), 977-982 (2015).
- Hommelberg, P. P., et al. Palmitate-induced skeletal muscle insulin resistance does not require NF-kappaB activation. Cell Mol Life Sci. 68 (7), 1215-1225 (2011).
- Yang, M., et al. Saturated fatty acid palmitate-induced insulin resistance is accompanied with myotube loss and the impaired expression of health benefit myokine genes in C2C12 myotubes. Lipids Health Dis. 12, 104 (2013).
- Peng, G., et al. Oleate blocks palmitate-induced abnormal lipid distribution, endoplasmic reticulum expansion and stress, and insulin resistance in skeletal muscle. Endocrinology. 152 (6), 2206-2218 (2011).
- Lambernd, S., et al. Contractile activity of human skeletal muscle cells prevents insulin resistance by inhibiting pro-inflammatory signalling pathways. Diabetologia. 55 (4), 1128-1139 (2012).
- Nikolic, N., et al. Electrical pulse stimulation of cultured human skeletal muscle cells as an in vitro model of exercise. PLoS One. 7 (3), e33203 (2012).
- Hsu, F. L., et al. Antidiabetic effects of pterosin A, a small-molecular-weight natural product, on diabetic mouse models. Diabetes. 62 (2), 628-638 (2013).
- Zou, C., Wang, Y., Shen, Z. 2-NBDG as a fluorescent indicator for direct glucose uptake measurement. J Biochem Biophys Methods. 64 (3), 207-215 (2005).
- Catalano, K. J., et al. Insulin resistance induced by hyperinsulinemia coincides with a persistent alteration at the insulin receptor tyrosine kinase domain. PLoS One. 9 (9), e108693 (2014).
- Liu, H. Y., et al. Insulin is a stronger inducer of insulin resistance than hyperglycemia in mice with type 1 diabetes mellitus (T1DM). J Biol Chem. 284 (40), 27090-27100 (2009).
- Renstrom, F., Buren, J., Svensson, M., Eriksson, J. W. Insulin resistance induced by high glucose and high insulin precedes insulin receptor substrate 1 protein depletion in human adipocytes. Metabolism. 56 (2), 190-198 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены