Method Article
3D митохондриальной Ультраструктура дрозофилы косвенные полет мышцы показали серийный Секция электрон томография
В этой статье
Резюме
В этом протоколе мы продемонстрировать применение серийный Секция электрон томографии для выяснения митохондриальной структуры в дрозофилы косвенные полет мышцы.
Аннотация
Митохондрии являются сотовой тяжеловесы, которые производят АТФ, липиды и метаболитов, а также регулировать кальция гомеостаза и клеток смерть. Ультраструктура уникальное макул богатые двойной мембраной этой органелле элегантно организовал для выполнения нескольких функций путем разбиения биомолекул. Митохондриальной Ультраструктура тесно связана с различными функциями; Однако мелкие детали этих отношений структура функции являются только начинают быть описаны. Здесь мы демонстрируем применение серийный Секция электрон томографии для выяснения митохондриальной структуры в дрозофилы косвенные полет мышцы. Томография серийный Секция электрон может быть адаптирована для изучения любой сотовой структуры в трех измерениях.
Введение
Электронная микроскопия является ценным инструментом для изучения структурного контекста субцеллюлярные сборок и органеллы, которые выполняют клеточные процессы. Были разработаны методы для сохранения Ультраструктура ткани или клетки, либо путем химической фиксации с альдегидов или под высоким давлением замораживания (HPF), а затем заморозить замещения (FS)1,2. Встроенный образец блоки затем секционного, витражи и наблюдается с просвечивающий электронный микроскоп (ТЕА). HPF образец также может быть обработан при крио условии, таких как, крио резании или целенаправленного ионного пучка (FIB) фрезерные и под наблюдением крио ет3,4.
Хотя тонкие секции EM предоставляет информативный морфологического исследования, результате 2D изображения можно только раскрыть Ультраструктура определенного сечения. Как Ультраструктура организуется в 3D-объем по-прежнему неясными. Для того, чтобы визуализировать сотовой Ультраструктура в трех измерениях, был разработан метод томография электрона, где серии наклона изображения были приобретены и обратно, согласно прогнозам, генерировать томографических реконструкции5 (рис. 1). Двойной наклон серии могут быть собраны путем вращения образца 90° и приобретения второй серии наклона. Это сведет к минимуму пропавших без вести клин артефактов, которые в результате ограниченной выборки углов и улучшить разрешение томограмм.
Здесь мы описывают применение серийный Секция электрон томографии для изучения митохондриальной Ультраструктура дрозофилы косвенные полет мышцы (IFM)6,7,8,9 . Для того, чтобы получить 3D реконструкций, охватывающих весь митохондрии (примерно 2,5 мкм толстый), последовательный разделы были получены от дрозофилы IFM блоков ткани. Томограмм каждой секции были собраны индивидуально с помощью программного обеспечения для сбора данных. Томографические реконструкций были созданы и серийный томограмм были соединены с IMOD пакет для получения восстановленных объем всего митохондрий. Соединяемые томограмм были проанализированы 3D программного обеспечения. Плотности митохондриальной макул были сегментирована сформировать модель сегментации, которые показали Организации в трех измерениях.
протокол
1. раздел дрозофилы тканей с помощью вибрационного лезвие микротом
- Анестезировать дрозофилы на льду и погрузить каждый один летать в 1 мл 4% низких плавления агарозы в фосфатного буфера. Разрешить агарозы для закрепления на льду. Как правило 4-6 мух были обработаны.
- Используйте вибрирующие микротом лезвие раздел геля агарозы встраиваемых дрозофила в ломтиками толщиной 100 мкм и погрузиться в фиксирующие раствор, содержащий глютаральдегид 2,5% в 0,1 М фосфатного буфера.
Примечание: Вырезание Vibratome является предпочтительным, поскольку архитектура ткани остается более неизменным по сравнению с другими методами. Кроме того пройдя пинцет может использоваться для рассекать IFM в фиксирующие раствор, содержащий глютаральдегид 2,5% в 0,1 М фосфатного буфера.
2. Подготовка EM образцы высокого давления замораживание и замораживание метод подстановки (HPF/FS)
- Мыть разделов ткани в 3 капли (~ 150 мкл) фосфатного буфера, следуют 2 капли (~ 100 мкл) фосфатного буфера с 20% BSA. Затем место разделы в золото перевозчиков для HPF заполнены буфера и 20% BSA.
- Загрузите образец, содержащий перевозчиков в морозильной камерой высокого давления согласно руководству пользователя.
- После замораживания, перевозчиков от держателя под жидкого азота и переноса замораживания замена устройство, охлаждается до-140 ° C.
- Выполните замораживания замена протокол, как показано в таблице 1, с FS коктейль, содержащий 2% глютаральдегид, 2% осмия тетраоксид и уранила ацетата 0,1% в ацетоне.
- Тщательно удалить образцы из перевозчиков с иглой и внедрить образцы смолы при комнатной температуре. Полимеризации смолы при 65 ° C для 16 h.
Примечание: FS протоколов должна быть изменена для подготовки других видов проб. HPF/FS предпочли сохранить Ультраструктура и свести к минимуму потери клеточного содержания.- Можно также применить протокол химической фиксации. Исправить образцов с 2,5% глютаральдегид на ночь, мыть с буферами и затем исправить с 1% осмия тетраоксид для 2 h. мыть и обезвоживает с возрастания концентрации этанола и затем проникнуть и внедрить образцы в Spurr в смоле до полимеризации при 65 ° C для 16 h.
3. подготовьте серийный разделы образцов для электрона томография
- Трим образца блоков подвергать лицо нужный блок, содержащий ткани.
- Предварительной обработки частиц золота (10 Нм в диаметре) с BSA 1% для 30 min. мыть и приостановить золотые частицы в буфере PBS. Наложение золотые частицы меди слот сетки покрытые углеродной пленки для создания фидуциальный маркеров.
- Проверить под ТЕА иметь достаточных фидуциальный маркеров (по крайней мере 5-10 маркеров) в поле зрения томография приобретения.
- Вырежьте последовательных секций, 200-250 Нм в толщину, используя ultramicrotome.
- Соберите последовательные секции на слот сеток с использованием идеальный цикл для тонких секций.
- Пятно секции с Рейнольдса в свинец цитрат за 10 мин.
- Наложить второй слой фидуциальный частиц золота на верхней секции.
4. сбор двойной наклона электронов томография
- Загрузить сетку на двухосевой томография держатель и вставьте просвечивающий электронный микроскоп, работающих в 200 кв.
- Совместите Микроскоп на eucentric фокус.
- Настройка программного обеспечения сбора данных. Настроить и выравнивание электронного пучка на параметр многомасштабной изображений. Обратитесь к руководству пользователя для операции подробно10 (рис. 2).
- Приобрести камеры темные и светлые ссылки на пустой области без углеродной пленки под настройку коллекции томография.
- Соберите сетку Атлас при низком увеличении. Выберите митохондрии на последовательных участках как цели для томографии коллекции.
- Приобрести серию наклона от-60 ° до + 60 ° с шагом 2 ° на оси A для каждого целевого компьютера.
Примечание: Углы наклона будет быть механически ограничен дизайн держатель образца. Владелец будет блокировать луча на высокой наклона углов. - Чтобы собрать второй серии наклона, поверните держатель образца 90°. Приобрести новый Атлас. Выберите соответствующие позиции и приобрести наклона серии на оси B для каждой цели.
Примечание: Другие пакеты программного обеспечения, таких как SerialEM и Xplore3D, доступны для автоматический сбор данных.
5. восстановить 3D томограмм и сегмент суб томов с помощью программного обеспечения
- Реконструировать томограмм двойной оси наклона изображения с помощью программного обеспечения IMOD11.
- Обратитесь к руководству пользователя для детализации операции.
- Совместите серии отдельных наклона позиции золотой фидуциальный маркеров. Реконструировать томограмм обратно проекции методом или методом одновременное итеративный реконструкции техника (СИРТ) для обеих осей A и оси B, соответственно (рис. 3).
- Объединить томограмм оси-a и оси B для создания двойной наклон томограммы с сокращение пропавших клин артефакт.
- Объединить двойной наклон томограмм последовательных секций для получения реконструкций, охватывающих весь митохондрий тома. Модели разрыва между последовательным разделы программой IMOD.
- Трим присоединились томограмм и Бен до нужного размера для тома сегментации.
- Анализируйте присоединился к последовательному томограмм, с использованием 3D программного обеспечения.
- Обратитесь к руководству пользователя для детализации операции.
- Фильтр томограмм с фильтр Гаусса (или другой нужный метод) для улучшения контраста функций и уменьшения плотности фона.
- Сегмент Ультраструктура митохондрий, вручную или автоматически.
- Отображение модели сегментации разрешить инспектирование в 3D.
- Создайте фильмы с помощью инструментов, имеющихся в 3D.
Результаты
Мы применили серийный Секция электрон томография анализировать структурные особенности митохондриальной макул, которая отражает его энергетического состояния и старения. Мы показали, что митохондрии дрозофилы IFM образуют интегрированную макул и матрица сети в 3D (рис. 4)7. Кроме того мутант мух с митохондриальной ДНК репликации дефекта и ускоренное старение фенотип накопленных митохондрий, которые содержатся подразделы лук как закрученного ядро (рис. 5)7.
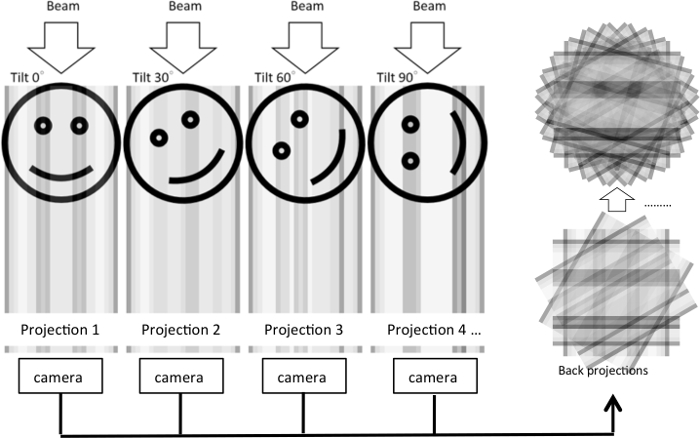
Рисунок 1: Иллюстрация реконструкции томография электрона из серии tilt. В эксперименте электронный луч проходит через трехмерный объект наклоне объекта в различной степени. Для каждого условия наклона 2D проекцию генерируется и захватили с камерой. 2D прогнозы затем обратно предполагается реконструировать 3D объект, основанный на теореме центрального фрагмента. На рисунке для исходного 2D изображения, которое проецируется в одном измерении под различными углами наклона отображается тот же процесс. Затем 1D прогнозы используются для восстановления 2D изображения. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
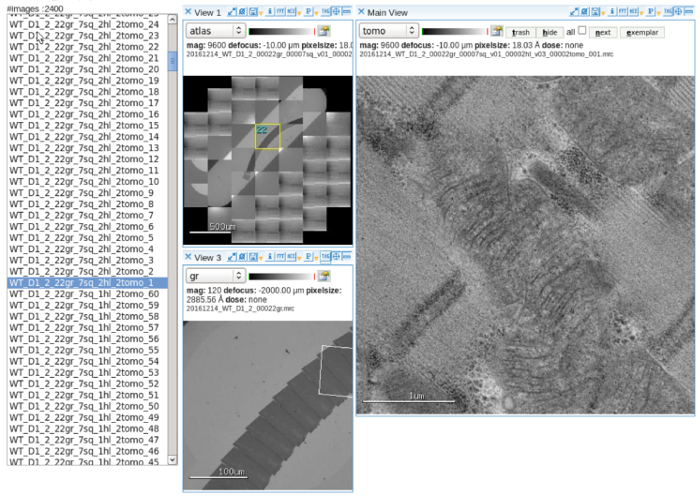
Рисунок 2: автоматический сбор данных. Просмотра изображения показаны Атлас слот сетку, содержащую серийный разделы программного обеспечения, многомасштабный ориентации митохондрий и приобрела наклона изображения. Шкалы бар = 500 мкм (левой верхней панели), 100 мкм (слева внизу панели), 1 мкм (правая панель). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3: Серийный Секция электрон томография одного митохондрий в дрозофилы косвенные полет мышцы. 2D микроскопии (A) и (B) 3D томограмм из последовательных секций, охватывающих весь объем митохондрий. (C) присоединился к серийный Секция томограмм, согласно прогнозам, для создания продольной секции, с оси z, показано вертикально. В частности разрезания ткани привели к потере материала, оставляя пробелы между присоединились томограмм. Шкалы бар = 500 Нм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
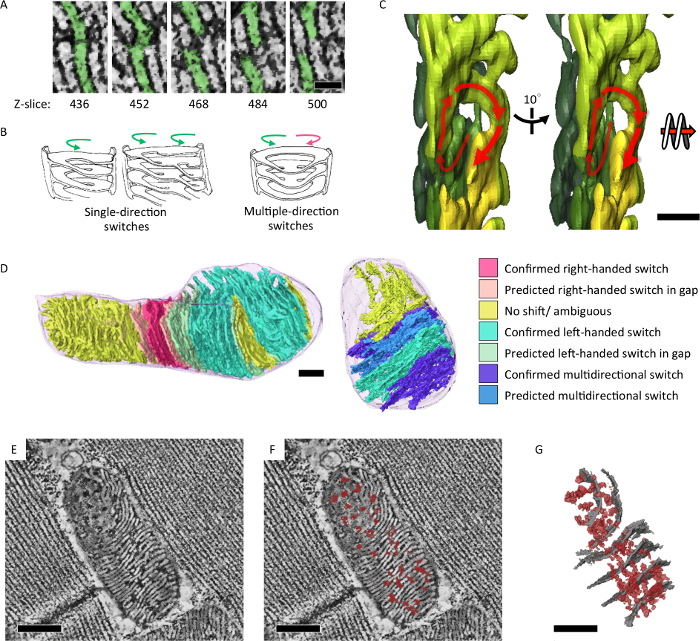
Рисунок 4: комплексное интра митохондрии макул и матрица сети показали в 3D. (A) ломтики митохондриальной электрон томографических реконструкций показаны переключает пластинчатые мембраны по оси z. (B) иллюстрации наблюдаемых макул переключения модели правой рукой или левша спирали. (C) томографических сегментации, иллюстрирующие левостороннюю спираль в 3D (D) макул переключение шаблонов были проанализированы и цвет вынес на модель сегментации (E, F). Томографические срез показаны боковые матрица confluency (темный плотности, отмеченные красным) через макул мембраны (белая плотностью). (G) сегментации модель томограммы в (E) показаны боковой матрица confluency (в красном) и представитель макул (в серый). Шкалы бар = 50 Нм (A), 200 Нм (C) и 300 Нм (D, E, F, G). Этот показатель был Перепечатка от Цзян и др. 7 пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
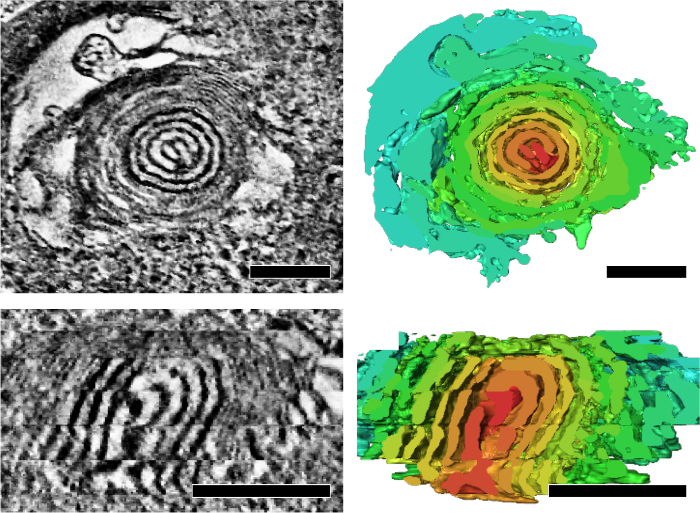
Рисунок 5: митохондрии с луком как закрученного ядер накопленных в мух с митохондриальной ДНК репликации дефектов во время старения. Представитель томографических ломтиками и соответствующей сегментации (правой панели) показаны представление поперечного сечения (вверху) и продольной-разрез (внизу) закрученного ядра. Объем сегментации обозначается произвольным цветопередача для выделения закрученного ядро. Линейки: 200 Нм. Этот показатель был Перепечатка от Цзян и др. 7 пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Шаг | Темп | Время | Решение | |||
| 1 | -140 ° C до 0-9 ° C | 30 мин. | Жидкий азот | |||
| 2 | -90 ° C | 96 ч | FS коктейль | |||
| 3 | -90 ° C до-60 ° C | 6 ч (5 ° C/ч) | FS коктейль | |||
| 4 | -60 ° C | 12 hr | FS коктейль | |||
| 5 | -60 ° C до-25 ° C | 7 ч (5 ° C/ч) | FS коктейль | |||
| 6 | -25 ° C | 12 hr | FS коктейль | |||
| 7 | 25 ° C до 0 ° C | 5 ч (5 ° C/ч) | FS коктейль | |||
| 8 | 0 ° C | 1 hr x 3 раза | Ацетон | |||
| 9 | Комнатной температуре | Проникновение смолы | ||||
Таблица 1: Замораживание замена протокол.
Обсуждение
В этом протоколе мы описываем Оптимизированный рабочий процесс для применения серийный Секция электрон томографии для изучения 3D митохондриальной Ультраструктура дрозофилы косвенные полет мышцы. Сохранение Ультраструктура в образце является основной технической проблемой для этого типа анализа. Для того, чтобы лучше сохранить Ультраструктура два методологических шаги были включены. Во-первых был пробы ткани при резании с вибрационным ножа микротома для поддержания тканей архитектуры как можно больше. Во-вторых HPF/FS протокола был оптимизирован для сохранения Ультраструктура органелл в ходе подготовки блоков встроенного образца. Образцы были заморожены под высоким давлением, который понижает точку замерзания воды и уменьшает образование кристаллов льда, которые повреждают Ультраструктура1. Образцы толщиной 0,1 мм может быть мгновенно керамические, а затем подвергается заморозить замещения для создания образца блоки для анализа EM. Было отмечено улучшение сохранения Ультраструктура, HPF/FS, когда по сравнению с методами химической фиксации. С помощью этой серии шагов для пробоподготовки, сохранение митохондриальной двойной мембраны и мембраны макул был значительно улучшен.
Получение последовательных секций образца является наиболее сложным шагом метода. Как электронного луча, имеет ограниченную проникающей способностью, толщина секции ограничивается либо 250 Нм или 500 Нм, используя ТЭМ на 200 кв или 300 кв, соответственно. Потому что толщина митохондрий могут быть более чем 2 мкм, для получения полном объеме реконструкций необходимы последовательные секции. Однако восстановление достаточное количество последовательных разделы охватывают весь органеллы — техническая задача. Отделка блок лицо, чтобы быть как плоский как можно между основания трапеции может позволить слот grid для размещения более секций и таким образом охватывать большие объемы. Кроме того использование идеальный цикл для тонких слоев увеличивает успех скорость передачи последовательных секций в сетке.
Томография серийный Секция электрон может осуществляться со стандартным оборудованием основных EM. Однако этот метод имеет некоторые неизбежные ограничения, которые вытекают из технических ограничений. То, что материал неизбежно теряется между последовательным разделами, оставляя пробелы в присоединился к реконструкции. Во-вторых, отсутствует клин артефакт, который возникает из-за ограниченной наклона углов, которые достижимы. Это ограничение возникает потому, что держатель образца не может быть включен в полное вращение без блокирования электронного луча. Несмотря на эти ограничения серийный Секция электрон томографии обеспечивает достаточное разрешение раскрыть клеточного и органелл Ультраструктура в 3D.
Для меньшего масштаба изображений, крио электронная томография является новой технологией, которая может использоваться для получения структура макромолекулярных комплексов и сборки на месте в резолюции Нм или суб ангстрем в сочетании с суб томографических Реконструкция3. В этом приложении клетки разбавленной путем разрезания или целенаправленного ионный луч, фрезерование под жидкого азота. Томограмм собираются в крио условиях где молекулярные структуры сохранились недалеко от родного государства без химической фиксации, обезвоживание или встраивание. На другом конце шкалы для анализа больших ткани тома за счет резолюции, последовательный блок лицо растровая электронная микроскопия является привлекательным механизм, даже несмотря на то, что он требует определенного инструмента4.
Раскрытие информации
Авторы заявляют, что они не имеют никаких финансовых интересов.
Благодарности
Исследования проведены в ядре EM в Институт сотовой и организмический биологии и крио EM ядро Синика, Тайбэй, Тайвань. Работа была поддержана Синика и большинство.
Материалы
| Name | Company | Catalog Number | Comments |
| vibrating blade microtome | Leica | VT1200S | Tissue sectioning |
| high-pressure freezer | Leica | EM HPM100 | Specimen preparation |
| freeze-substitution device | Leica | EM AFS2 | Specimen preparation |
| ultramicrotome | Leica | EM UC7 | Ultra-thin sectioning |
| dual-axis tomography holder | Fischione | Model 2040 | tomography collection |
| transmission electron microscope | FEI | Tecnai F20 | tomography collection |
| CCD | Gatan | UltraScan 1000 | tomography collection |
| Leginon | NRAMM/AMI | tomography collection | |
| IMOD | Boulder Laboratory for 3-D Electron Microscopy of Cells | Tomography reconstruction | |
| Avizo 3D | FEI | Tomography analysis |
Ссылки
- Dahl, R., Staehelin, L. A. High-pressure freezing for the preservation of biological structure: theory and practice. J Electron Microsc Tech. 13 (3), 165-174 (1989).
- Sabatini, D. D., Bensch, K., Barrnett, R. J. Cytochemistry and electron microscopy. The preservation of cellular ultrastructure and enzymatic activity by aldehyde fixation. J Cell Biol. 17, 19-58 (1963).
- Rigort, A., et al. Micromachining tools and correlative approaches for cellular cryo-electron tomography. J Struct Biol. 172 (2), 169-179 (2010).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLoS Biol. 2 (11), e329 (2004).
- Lucic, V., Forster, F., Baumeister, W. Structural studies by electron tomography: from cells to molecules. Annu Rev Biochem. 74, 833-865 (2005).
- Soto, G. E., et al. Serial section electron tomography: a method for three-dimensional reconstruction of large structures. Neuroimage. 1 (3), 230-243 (1994).
- Jiang, Y. F., et al. Electron tomographic analysis reveals ultrastructural features of mitochondrial cristae architecture which reflect energetic state and aging. SciRep. 7, 45474 (2017).
- Cogliati, S., Enriquez, J. A., Scorrano, L. Mitochondrial Cristae: Where Beauty Meets Functionality. TrendsBiochemSci. 41 (3), 261-273 (2016).
- Friedman, J. R., Nunnari, J. Mitochondrial form and function. Nature. 505 (7483), 335-343 (2014).
- Suloway, C., et al. Fully automated, sequential tilt-series acquisition with Leginon. J Struct Biol. 167 (1), 11-18 (2009).
- Mastronarde, D. N., Held, S. R. Automated tilt series alignment and tomographic reconstruction in IMOD. J Struct Biol. 197 (2), 102-113 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены