Method Article
Расширение редактирования с Cas9 рибонуклеопротеида в различных клеток и организмов геном
* Эти авторы внесли равный вклад
В этой статье
Резюме
Используя креплению Cas9 рибонуклеопротеида комплекс (RNP) является мощный метод для изменения генома точный и эффективный. Здесь мы подчеркиваем свою полезность в широком диапазоне клеток и организмов, включая первичных клеток человека и оба классических и новых модельных организмов.
Аннотация
Участкам генома эукариот редактирования с ТРИФОСФАТЫ (кластерный регулярно interspaced короткие палиндром повторяет)-Cas (связанные ТРИФОСФАТЫ) систем быстро стал обычным явлением среди исследователей, проводит широкий спектр биологических вопросов. Пользователи наиболее часто используют Cas9 белок, производный от Streptococcus pyogenes в комплексе с легко перепрограммировать руководство РНК (gRNA). Эти компоненты будут введены в клетки, и через спаривание с взаимодополняющих региона двуцепочечной ДНК (dsDNA) генома, фермент отщепляет обе нити для генерации двухручьевой перерыв (DSB). Последующий ремонт приводит к случайные вставки или удаления события (indels) или включение экспериментатора условии ДНК на сайте перерыва.
Использование очищенной сингл руководство РНК и Cas9 белок, предварительно смонтированный сформировать RNP и непосредственно на клетки, является мощным подход для достижения высокоэффективных гена редактирования. RNP редактирования особенно повышает скорость вставки гена, результат, который часто является сложной задачей для достижения. По сравнению с доставкой через плазмиды, короче сохранение RNP Cas9 в пределах ячейки приводит к меньше пробить событий.
Несмотря на свои преимущества много случайных пользователей ТРИФОСФАТЫ гена редактирования менее знакомы с этой техникой. Чтобы понизить барьер для вступления, мы наметим подробные протоколы для реализации стратегии RNP в различных контекстах, подчеркнув его различных пособий и различных приложений. Мы покрываем, редактирования в двух типов первичных человеческих клеток, Т-клеток и гемопоэтических стволовых/прогениторных клеток (HSPCs). Мы также покажем, как Cas9 RNP редактирования позволяет снисходительный генетические манипуляции целых организмов, включая классическую модель аскариды Caenorhabditis elegans и более недавно представила модель ракообразное, Parhyale hawaiensis.
Введение
Внешний ТРИФОСФАТЫ-Cas9 система позволяет ученым для изменения целевых регионах любой генома1. Это быстрый и недорогой технологии изменил фундаментальные исследования и обещает сделать глубокое влияние на развитие персонализированные болезни терапии, прецизионное сельское хозяйство и за его пределами2. ТРИФОСФАТЫ редактирования является инструментом демократизации и внедрения системы в новой лаборатории требует не конкретного опыта в геном инженерных, просто основные навыки молекулярной биологии. Исследователи могут теперь изучать ранее неразрешимыми организмов с несколько альтернативных средств для генетических манипуляций3,4. За последние пять лет ТРИФОСФАТЫ генома редактирования использовалась для инженер-более 200 различных позвоночных, беспозвоночных, растений и видов микроорганизмов.
Адаптировано из путь прокариот обороны ТРИФОСФАТЫ, основные элементы, необходимые для конкретных участков генома редактирования являются Cas9 белок, обычно S. pyogenes и кодон оптимизированный сигнал добавлен ядерной локализации (NLS), и ее специализированных Руководство РНК5,6. Хотя здесь не обсуждаются, могут также использоваться другие Cas9 orthologues или ТРИФОСФАТЫ эндонуклеазами. Естественно-происходя gRNA состоит из двух отдельно транскрибируется штук, ТРИФОСФАТЫ РНК (crRNA) и транс активация crRNA (tracrRNA)7. Эти РНК можно слились в одну запись, известный как сингл руководство РНК (sgRNA)8. Большинство редакторов генома выбрать обтекаемый sgRNA9, хотя двойной руководство также регулярно используется в10,11. Экспериментаторы выбрать 20-нуклеотидов (nt) геномная ДНК целевой, обеспечение того, что он находится рядом с короткой лицензирования подписи, необходимые для признания Cas9, называется protospacer прилегающие мотив (PAM) и дизайна gRNA, содержащий дополнительные последовательности12 .
Как только внутри клетки, RNP комплекс находит genomic цели, gRNA низкопробных пар с комплементарной ДНК прядь, и затем фермента расщепляет обе нити ДНК для генерации двухручьевой перерыв2. Клеток ремонт техники исправляет ОУС одним из по крайней мере два пути: через ошибкам non гомологичных прихода в конце пути (NHEJ) или ориентированные на гомологии ремонт (HDR), которая плавно включает ДНК, содержащие «оружия» гомологии с обеих сторон перерыва. Бывший ремонт пути обычно приводит к indel формирование и последующее гена потрясений, в то время как последний позволяет экспериментаторов вставить или изменить ДНК последовательности1.
Редактирования эффективность и точность зависит от средств, по которому Cas9 и gRNA ввести в ячейку. Эти компоненты могут быть доставлены на культивируемых клеток, эмбрионы или организмов в виде нуклеиновых кислот или как в собранном виде RNP комплекс13,14,15. Общие методы доставки на основе нуклеиновых кислот включают вирусные трансдукции, transfection или электропорации mRNA или плазмидной ДНК. Затем производятся Cas9 белка и руководство РНК в ячейке и они ассоциируют сформировать комплекс.
Прямая доставка RNP требует отдельной очистки в Cas9 белка и РНК. Это может быть сделано в доме, или белков и sgRNA можно приобрести у одного из нескольких коммерческих поставщиков. После приобретения, Cas9 и gRNA смешиваются ферментативно компетентных комплекс RNP и представлен прямого впрыска в оплодотворенных яиц/эмбрионы, липидных трансфекции16или electroporation клетки. Первый доклад RNP редактирования участие инъекции в C. elegans гонад17. Микроинъекции по-прежнему предпочтительным средством введения RNP в эмбрионов и весь организмов, хотя эффективное электропорации была продемонстрирована в мыши18,19 и крыса20 эмбрионов. Мы опишем протоколы для непосредственно впрыскивать RNP в C. elegans гонад и P. hawaiensis эмбрионов и порекомендовать специализированный тип электропорации доставить RNP при редактировании первичных клеток человека. Этот метод, nucleofection, включает в себя оптимизированный электропорации программы и решения определенного типа клеток и позволяет RNP ввести цитоплазмы и ядра21.
Изменения генома с RNP предлагает несколько различных преимуществ. Потому что белка и РНК компоненты уже предварительно смонтированы, и качество может быть обеспечено до доставки, RNP редактирования позволяет избежать многих ошибок, связанных с доставкой на основе нуклеиновых кислот. А именно нет никакого риска интеграции Cas9-кодирования ДНК в хост геномов, мРНК не подвергаются деградации, и он обходит проблемы с в vivo gRNA или белка выражение, складные и ассоциации22,23. Кроме того с помощью RNP приводит к снижению токсичности и гораздо меньше пробить событий, чем на основе плазмида выражение, результат RNP короче half-life внутри клетки24,25,,2627.
Наконец RNP редактирования явно приводит к высокой частоте редактирования в различных линий клеток человека, первичные элементы, такие как фибробластов, эмбриональных стволовых клеток (ЭСК), индуцированных плюрипотентных стволовых клеток (iSPCs), HSPCs, и Т-клеток16,24, 25,26,27,,2829; беспозвоночных, включая C. elegans, P. hawaiensisи дрозофил3,17,30; в позвоночных видов как данио рерио, мышей и крыс31,32; в растительных видов, включая Arabidopsis, табак, салат, рис, виноградной лозы, яблоко, кукурузы и пшеницы33,34,,3536; и в Хламидомонада, Penicilliumи Candida видов37,,3839. Частота indel образование может быть выше при использовании RNP, по сравнению с плазмида доставки, и HDR-опосредованной ДНК вставки может быть легче добиться25,27,29.
Описанные здесь протокол использует Cas9 RNP и является эффективной, легко адаптируемый техника, которая является простой для применения к широкий спектр биологических систем40,41, особенно в клетках, которые иначе трудно работать с и в организмах без хорошо отлаженные системы для точного генетические манипуляции. Начнем с описанием того, как дизайн, получать и собирать Cas9 RNP до ее использования, охватывая различные модели типы клеток и организмов. Гемопоэтических стволовых/прогениторных клеток (HSPCs) и Т-клетки редактируются, используя тот же метод, nucleofection, поэтому они рассматриваются вместе в шагах 2 и 3 настоящего Протокола. Изменение процедуры на C. elegans описаны в шагах 4 и 5 и P. в шаги 6 и 7 рассматривается hawaiensis редактирования. Наконец поскольку успех эксперимента, ген редактирование в любом организме может оцениваться путем sequencing генотип, подэтапы, описывая методы возможного анализа для всех клеток и организмов, указанных в протоколе изложены в шаге 8.
протокол
1. RNP Ассамблея
-
Дизайн эксперимент заблаговременно, приобретения всех РНК, ДНК и белковых компонентов досрочно. В первом проходе попробуйте один из позитивных элементов, перечисленных в таблице 1 и использование коммерческих реагентов, описанные в таблица материалов для обеспечения надежной экспериментальный дизайн и целостность материалы. Дополнительные советы по планированию нового эксперимента изменения генома увидеть документы по этой теме по12,42,43.
Примечание: После сборки, как описано в последующих шагах, RNPs, заранее подготовленные может храниться при температуре-80 ° C.- После выбора какой ген целевому объекту, используйте один из бесплатных онлайн инструментов для разработки оптимального gRNA44,45,46,47,48. Убедитесь, что целевой экзона если надеясь создать нокаут.
Примечание: Эти инструменты помогут определить целевой сайт с рядом S. pyogenes PAM последовательность, показатель высокого качества и низкой пробить оценка. - Очищение протеина Cas9 S. pyogenes через опубликованные методы8, или приобрести его у коммерческих поставщиков.
- Готовить типичные Cas9 буфер для разбавления РНК, RNP подготовки и хранения белок, который содержит 20 мм HEPES pH 7.5, 150 мм KCl, 10% глицерина и 1 мм TCEP. Всегда используйте нуклеиназы свободной воды в буферы, которые будут использоваться для Ресуспензируйте или разбавлять РНК для предотвращения деградации.
- Производят руководство РНК (tracrRNA и crRNA или sgRNA) через в vitro транскрипция с использованием опубликованных методов, или купить его от нуклеиновой кислоты синтеза компании17,21,49, 50 , 51.
- Если вставка гена, синтезировать или приобрести доноров ДНК шаблон.
- Храните белка и РНК аликвоты-80 ° C и оттепели на льду непосредственно перед использованием.
Примечание: Каждый замораживания оттаивания слегка снижает эффективность. Подробные, открытого доступа протоколы для Cas9 очистки52 и в vitro транскрипция sgRNAs53 доступны в других местах.
- После выбора какой ген целевому объекту, используйте один из бесплатных онлайн инструментов для разработки оптимального gRNA44,45,46,47,48. Убедитесь, что целевой экзона если надеясь создать нокаут.
- При работе с C. elegans, перейдите к шагу 1.5. Для протокола P. hawaiensis перейдите к шагу 1.6. При использовании sgRNA, перейдите к шагу 1.4. Перейдите к пункт 1.3 собрать gRNA для главной ячейки редактирования.
-
Соберите gRNA путем смешивания эквимолярных количествах tracrRNA и crRNA. Сделайте 100 мкл 80 мкм gRNA акций, для около 50 генома редактирования экспериментов.
- Инкубировать gRNA при 37 ° C за 30 минут, а затем позволить ему медленно остыть до комнатной температуры.
-
RNP prep для редактирования HSPC и Т: собрать RNP комплекс, очень медленно, смешивая 1-2 x молярный объем gRNA до 200 пмоль Cas9 белка в общем объеме 10 мкл. Добавить концентрированные Cas9 gRNA (предварительно разводят в буфере Cas9) около 30 s , делая быстрые круги с пипеткой, чего конечная концентрация Cas9 до 20 мкм.
- Подготовьте электропорации кюветы.
Примечание: Этот протокол для коммерческой системы, о чем говорится в Таблице материалы, но RNP редактирования также может быть достигнуто с другими устройствами электропорации. - Добавьте 5 мкл (100 pmols, Т-клетки) или 10 мкл (200 пмоль, HSPCs) RNP каждый кювет.
- Если вставка новых ДНК, вместо того, чтобы сделать нокаут, добавить 1 мкл, 100 мкм (100 пмоль) одноцепочечной олигонуклеотида доноров ДНК (ssODN)25,,5455 кюветы или скважин пластины.
- Перейдите к шагу 2 для следующей инструкции в редактировании главной ячейки протокол.
- Подготовьте электропорации кюветы.
-
RNP prep для редактирования C. elegans : собрать RNP комплекса путем добавления следующих реагентов для того, чтобы создать окончательный объем 20 мкл, (в скобках указаны окончательные концентрации): Cas9 (2 мкм), HEPES рН 7,5 (10 мкм), KCl (115 мкм), crRNA (12 мкм) , tracrRNA (40 мкм) и ремонт шаблоны при необходимости (0,5 мкм ssDNA или до 350 нг/мкл dsDNA).
Примечание: Эффективность Cas9-опосредованной DSB-шаблонного ремонта пропорциональна концентрации dsDNA ремонта конструкции; Таким образом чем выше концентрация ремонт шаблона, более эффективным шаблонного ремонт. Однако инъекции смесей, содержащих более чем 350 нг/мкл dsDNA было показано, уменьшить жизнеспособность вводят червей. Таким образом это лучше всего использовать до, но не более чем 350 нг/мкл dsDNA в смесь, чтобы максимизировать эффективность ремонта при сведении к минимуму его поражающее действие.- Добавьте несколько crRNAs для целевых нескольких локусов одновременно, как это необходимо для co ТРИФОСФАТЫ/co conversion скрининг подход, описанный в шаге 5.4. При добавлении более одного crRNA, добавьте каждый последовательно на основной микс.
Примечание: Количество каждого crRNA не нужно быть таким же, и даже удвоение общая концентрация crRNAs в мастер смеси без изменения концентрации Cas9, представляется, не вмешиваться с частотой мутагенеза в конкретных локусе. Примеры описаны подробно в Paix и др. 56. - Смешать, закупорить и спина RNP решение на 16000 x g 5 s для обеспечения что решение собирается в нижней части трубки.
- Инкубируйте решение при 37 ° C для 15 m.
- Центрифуга для образца на 16000 x g за 1 мин до Пелле любые частицы, которые могут засорить тонкие скучно микроинъекции иглы. Используйте супернатант в последующих шагах.
- Перейдите к шагу 4 на оставшуюся C. elegans протокола.
- Добавьте несколько crRNAs для целевых нескольких локусов одновременно, как это необходимо для co ТРИФОСФАТЫ/co conversion скрининг подход, описанный в шаге 5.4. При добавлении более одного crRNA, добавьте каждый последовательно на основной микс.
-
RNP prep для редактирования P. hawaiensis : подготовить одноразовые Cas9 аликвоты путем разбавления их свободной от нуклеиназы водой и фенола красного (для визуализации инъекции) до окончательного концентрации 6,25 мкм Cas9 и 0,15% фенола красного.
- Соберите RNP комплекс, смешивая 2-5 x Молярная избыток gRNA Cas9 белка в общем объеме 6 мкл. Добавить 12 пмоль по Cas9 к gRNA, в результате чего конечная концентрация Cas9 до 2 мкм, gRNA концентрация для мкм 4-8 и концентрации фенола красного до 0,05%.
- Инкубируйте смесь при комнатной температуре за 10 мин до сложных RNP.
- Перейдите к шагу 6 для следующей инструкции в редактировании P. hawaiensis протокол.
2. клетки культуры и подготовка
Примечание: Выполните 2.1.1 для 3.3.3 в биологической безопасности кабинета.
-
Покупка криоконсервированных человека мобилизованы периферической крови CD34+ HSPCs от производителя.
- Оттепель ~ 1 x106 HSPCs в воды 37 ° C ванна на 3 мин и передавать их на 15 мл Конические трубки. Добавить 10 мл сыворотки бесплатный расширения среды из коммерческих источников и спина смеси на 100 x g 10 минут удалить супернатант и Ресуспензируйте клетки в 2 мл дополнено SFEM. Пластина клетки в 6-ну пластины и культуры их в инкубаторе 37 ° C за 24-48 ч до электропорации RNP.
- Подсчет количества ячеек с Горяева и передачи общее количество HSPCs необходимо пластиковых пробирок (150000-200000 HSPCs в кювет быть electroporated).
- Вращайте трубу на 100 g x 10 мин для пеллет клетки.
-
Приобретение человека первичной CD4+ T-клеток от поставщика или изолировать их от человека цельной крови, плотность градиентного центрифугирования29.
- До активации клеток T, предварительно покрыть 48-ну культуры пластин с αCD3 (UCHT1) и αCD28 (CD28.2). Слой пластины с 500 мкл 10 мкг/мл αCD3 и 10 мкг/мл αCD28 в PBS для по крайней мере 2 ч при 37 ° C.
Примечание: Для некоторых локусов, NHEJ может достигаться без предварительной стимуляции, но включая этот шаг повышает его эффективность. - Культура T клетки для 48 ч при 37 ° C на αCD3/αCD28 антитела прыгните пластины в полной среду RPMI [RPMI 1640 дополнена 5 мм HEPES, 2 мм коммерческой альтернативы L-глютамином, 50 мкг/мл пенициллина/стрептомицина, 50 мкм 2-меркаптоэтанол, 5 мм несущественные аминокислот, 5 мм пируват натрия, и 10% (vol/vol) FBS]. Культура T клетки на плотности 2,000,000 Т-клеток в 500 мкл СМИ за хорошо 48-ну плиты.
- Количество T клетки с помощью Горяева и передачи общее количество Т-клеток, необходимых для электропорации эксперимент (100 000-1 000 000 Т-клеток в кювет быть electroporated) для пластиковых пробирок.
- Спин трубы на 90 x g 8 мин для пеллет клетки. Если клетки были плотности, разделенных градиент в течение 2 дней, вращать их в 200 x g 8 мин.
- До активации клеток T, предварительно покрыть 48-ну культуры пластин с αCD3 (UCHT1) и αCD28 (CD28.2). Слой пластины с 500 мкл 10 мкг/мл αCD3 и 10 мкг/мл αCD28 в PBS для по крайней мере 2 ч при 37 ° C.
-
Для обоих типов клеток аспирационная супернатант с пипеткой/вакуум, удаляя любые пузыри.
- Нежно ресуспензируйте клетки с 20 мкл буфера электропорации в кювет.
- 20 мкл клеток (HSPCs 150 000-200 000 или 100 000-1 000 000 Т-клетки), для каждого кювета, который уже содержит 10 мкл RNP и перемешать хорошо закупорить вверх и вниз без создания пузырьков.
3. RNP Electroporation
- Electroporate кюветы после размещения их в nucleofector. Для HSPCs используйте код Импульсный ER100. Для Т-клеток используйте импульсный код EH-115.
-
Только HSPCs: Добавить 100 мкл дополнениями среды SFEM (разогрет до 37 ° C) для каждого кювет сразу после электропорация и пусть клетки восстановить на 10-15 мин
- Клетки перехода к культуре их в 96-луночных раунд нижней пластины и дополнительные 100 мкл дополнено SFEM среды за 24 ч.
- Измените их на свежий дополнено средней SFEM и проинкубируйте дополнительных 24-72 ч.
- Удалить ячейки для генотипирования их 48-96 h пост электропорация. Спиновые клетки на 300 g x 5 минут и удалить супернатант перед началом экстракции ДНК (шаг 8.2).
-
T-клеток только: добавить 80 мкл RPMI завершить культуры средств массовой информации, предварительно нагретой до 37 ° C от водохранилища каждому кювета или хорошо, с помощью многоканальных дозаторов (при необходимости).
- Инкубируйте их при 37 ° C 15 мин.
- Добавьте соответствующие средства массовой информации, антитела, цитокинов и т.д. для назначения знаке и предварительно согреть их в инкубаторе 37 ° C.
- Трансфер 107 мкл electroporated клеток из скважин в раунд-96-луночных днище с помощью многоканальных дозаторов (при необходимости).
- Для получения информации об оценке редактирования результатов перейдите к шагу 8.
4. Подготовка C. elegans
-
за 1 день до микроинъекции: подготовиться микроинъекции агарозы колодки.
- Сделайте раствор агарозы 3% (w/v) в воде, добавив агарозы воды и чего раствор до кипения на горячей плите или в микроволновой печи.
- Организовать 24 мм x 50 мм x 1,5 мм Стекло покровное слайды на стол и использовать стеклянные пипетки Пастера поставить небольшой (~ 15 мкл) капля раствора агарозы на слайд. Быстро сгладить падение агарозы, поставив еще coverslip на вершине. Разрешить агарозы затвердеть и затем удалите одну из coverslips.
- Оставьте агарозы покрытием coverslip лицом вверх на столешницу на ночь, чтобы высушить. После 24 часов магазин агарозы колодки в чистом, сухом контейнере.
Примечание: Они могут использоваться на неопределенный срок.
- Потяните микроинъекции иглы: с использованием боросиликатного стекла капилляров с ворсом (наружный диаметр 1,0 мм, внутренний диаметр 0,58 мм), вытащить иголки, основанные на57 Мелло и огонь и другие ресурсы58. Иглы могут быть использованы сразу или могут быть сохранены в контейнер чистой, сухой, рамно глины поддерживает.
- Для поддержания червей, подготовить нематода роста СМИ (НГМ) агар выливают в Петри пластины и пятнистый с ОР50 бактериями (для протоколов на стандартных C. elegans обслуживания и рецепты для роста СМИ, см Stiernagle59).
- Черви для микроинъекции этап: 12-24 ч до микроинъекции, выбрать L4-поставил гермафродитки к новой пластинкой нг агар с ОР50 бактериями и инкубировать их на ночь в 20 ° C. Для каждой целевой/инъекции микс Cas9 выберите ~ 30 червей к пластине.
-
День микроинъекции: Загрузить вытащил микроинъекции иглы раствором RNP супернатанта подготовлен на шаге 1.5.
- Пипетка супернатант из шага 1.5.4 в вытащил капиллярные пипетки и засыпки решение от капиллярные Пипетка в подготовленные микроинъекции иглу (обычно загрузки меньше, чем 0.1 мкл).
- Смонтируйте загруженного иглы на аппарате микроинъекции придает микроманипулятор. Установите аппарат давление впрыска 250 кПа и баланс давления до 25 кПа.
-
Разбейте обратно кончик иглы загруженного сформировать края острые иглы. Место 15 x 15 мм x 1,5 мм квадратный coverslip на вершине 24 мм x 50 мм x 1,5 мм coverslip.
- Наложение одного края квадратный coverslip с маслом галоидоуглеводородов 700.
- Положение иглы в масле, на краю площади coverslip 15 мм.
- С помощью руки руководство микроскопа и coverslip, кисть слайд вверх и вдоль края иглы при удручает инъекции педаль/кнопку. Разбейте кончик иглы обратно, увеличение потока жидкости из иглы. Достичь оптимального расхода путем инъекции перепутать потока вдоль края иглы, образуя ~ 1 пузырь/сек.
- Убедитесь, что черви L4, выбрал 12-24 ч до микроинъекции развивающих постановке молодых людей в день инъекции. Выберите молодых взрослых червей к нг агар пластины, что не хватает ОР50 бактерий и позволяют им ползать за 5 мин. Это уменьшает количество бактерий, переданы инъекции pad, минимизации иглы Сабо.
- Поместите агарозы инъекции колодки/coverslip на область рассечение. С помощью забрать червя, заложить небольшой трек галоидоуглеводородов нефти вдоль одного края сенсорной панели.
-
С помощью забрать червя, с покрытием в масле, поднимите несколько червей пластину нг агар и в трек нефти. С тонких волос, придает пипетки, например ресниц или кошка нитевидные поместите червей в параллельно, аккуратно вставив червей в агарозы pad. Пока не комфортно с процедурой микроинъекции, только смонтировать и придать одного червя в то время.
Примечание: Сухой агарозы будет фитиль влагу от червей, заставляя их придерживаться pad. Следовательно один должен работать быстро, как черви могут пересыхают.- Однажды в позиции и прилагается к подушке, наложение червей с другой выбрать несколько капель масла (~ 20 мкл) галоидоуглеводородов от кончика червь.
5. C. elegans Гонада микроинъекции с RNPs и впрыск Уход
Примечание: Протокол микроинъекции заимствован из57Мелло и огонь и подробно описаны в других,6061.
-
Место coverslip с подключенного червей на инъекции микроскопа. Под низким увеличением (5 X цель, 10 X окуляр) поместите червей перпендикулярно инъекционной иглы.
- Переход к высоким увеличением (40 X цель, 10 X окуляр), изменить положение иглы, прилегающих к руку гонад, соответствующего региона вблизи ядра в середине - до конца pachytene.
- С помощью микроманипулятор, перемещения иглы против червь, немного удручает кутикулы. Затем с одной стороны, нажмите на стороне микроскопа для толчка иглы через кутикулу. Отпустите педаль/кнопку инъекций и медленно заполнить Гонада руку с впрыском смесь и удалите иглу.
- Повторите этот шаг с другой рукой гонад.
-
Как только вводили червей, удалите панель coverslip/агарозы и поместите его под микроскопом рассечения.
- С помощью вытащил капиллярные пипетки, вытеснения нефти от червей, закупорить буфером M9 над ними. Выполните это лечение выпустить червей из агар.
- После 10 минут когда черви обмолота вокруг в буфере, переместите их в нг агар пластины с ОР50 бактериями, используя вытащил капиллярные Пипетка. Место пластину при 20 ° C на 2-3 ч до черви выздоровели и передвигаться.
- После восстановления, индивидуально передать нг агар пластины с ОР50 червей и передачи пластины 25 ° C инкубатора.
-
Разрешить P0-вводят червей расти и заложить потомства на 3 дня. Экран F1 потомство.
- При использовании совместного преобразование или co ТРИФОСФАТЫ62,63,64,65, затем выберите кандидата червей для скрининга на основании того, имеют ли они мутант фенотип ссылка гена. Индивидуально передавать новые нг агар пластины с ОР50 эти отмеченные червей и позволяют им заложить F2 потомства при 20 ° C.
Примечание: Фенотип, используемых для co ТРИФОСФАТЫ скрининг или выбор должен предусматривать ранней оценки успеха Cas9 редактирования. - Если не присутствует co ТРИФОСФАТЫ фенотип, microinject плазмиды позитивного управления для оказания помощи в повышении эффективности микроинъекции.
Примечание: К примеру, включая плазмида в инъекции микс, который кодирует mCherry тегами MYO-2 поможет оценить эффективность инъекции. Черви, успешно вводится с pCFJ90 будет иметь некоторые потомство с флуоресцентной pharynxes.
- При использовании совместного преобразование или co ТРИФОСФАТЫ62,63,64,65, затем выберите кандидата червей для скрининга на основании того, имеют ли они мутант фенотип ссылка гена. Индивидуально передавать новые нг агар пластины с ОР50 эти отмеченные червей и позволяют им заложить F2 потомства при 20 ° C.
- Изучите червей1 F наличие желаемых изменений. Выбрать F1 мать индивидуальных хорошо 96-луночных плиты, лизируют ее и изучить ее ДНК амплификации PCR Вставка конкретных, анализа последовательностей ДНК или топографа нуклеиназы пробирного (CEL-1)66.
Примечание: Эти анализы могут выполняться при использовании co ТРИФОСФАТЫ/co conversion или другие проверки или выбора режимов65,,6667,68. - Для получения информации об оценке редактирования результатов перейдите к шагу 8.
6. Подготовка P. hawaiensis
- за 1 день до микроинъекции, обогатить для ранних эмбрионов, создав баком пара в ночь перед; Недавно разлученных женщин будет содержать свежую оплодотворенных эмбрионов. Увидеть Рем и др. 69 на детали.
- В день микроинъекции, собирать одноклеточных зародышей Parhyale (0-4 h после оплодотворения), обезболивающим беременных самок с 0,02% гвоздичное масло в морской воде и мягко очищая эмбрионов из ее брюшной выводок мешочек с использованием пламени вытащил и Закругленный стеклянный пипетки и тупой пара #3 пинцет.
7. P. hawaiensis микроинъекции эмбриона с RNPs и впрыск Уход
- Засыпки вытащил капилляр с примерно 1 мкл структуре впрыска RNP описано выше.
-
Использовать сжатый азот для microinject каждого эмбриона, как описано в Рем и др. 69.
- Придать Parhyale эмбрионы под микроскопом рассечения, с использованием microinjector и микроманипулятор. Загрузить 1.5 мкл структуре впрыска в задней части вытащил капиллярной трубки (4 дюймов - 1,0 мм с нитями, потянул с помощью микропипеткой, вытягивать аппарат) с помощью кончика пипетки microloader.
- Установите иглу на аппарат инъекций и разорвать кончик иглы (очень небольшое количество) с помощью пары щипцы рассечения сферу. Калибровка объем оказываемых впрыскивать в галоидоуглеводородов нефти 700 и измерения диаметра пузырька.
- Вырежьте «корыта» из отвердителя, с помощью лезвия бритвы. Заполнить его на полпути фильтр стерилизации морской водой и линия Parhyale эмбрионов в кормушке для стабилизации.
- Придать эмбрионов, с помощью установки микроинъекции, стабилизации каждого эмбриона с парой щипцы во время инъекции. После инъекции используйте передачи Пипетки стеклянные для передачи эмбрионов за свежий 60 мм культуры блюдо заполнен наполовину с фильтр стерилизации морской водой.
-
Если первый дивизион уже произошло в форме 2-клеток эмбриона (4-6 ч после оплодотворения), создайте полностью мутанта животных путем инъекций оба бластомеров. Для обеспечения общего расщепления этапа 2-клеток, совместно внедрить бластомеров с FITC или TRITC декстран и наблюдать, что сигнал ограничивается одной бластомера под люминесцентные, пройдя через область после инъекции.
- Кроме того генерировать «половина мутант» животных путем инъекций только один из двух бластомеров на этапе 2-клеток (примерно разделены слева направо в зависимости от ткани и положение вдоль оси A-P).
- Внедрить одну ячейку в эмбрион 8-секционная (7,5-9 h после оплодотворения) для ограничения редактирования в один слой семенозачатка. Увидеть Гербердинг и др. 70 на карте ранних бластомера линий.
-
Инкубируйте эмбрионов в 60 мм культуры блюда (не более чем 25 за блюдо), заполнен наполовину, с морской водой, фильтр стерилизации, «предварительно кислородом» с помощью барботер аквариум или путем встряхивания энергично.
- Место блюда эмбрионов в слабо запечатанный пластик, выстроились с мокрого бумажные полотенца для поддержания влажности и поместите их в инкубаторе 26 ° C с циклом свето тени 12 h.
- Передача выживших эмбрионов для очистки морской кухни каждые несколько дней.
Примечание: Эмбрионы могут культивировали при комнатной температуре, хотя они будут развиваться гораздо более медленно.
-
Вскрыть и исправить эмбрионы на различных этапах для анализа выражения в situ гибридизация или антитело пятная (см. Браун и др. « 71 для промежуточной руководство и дополнительные ссылки для фиксации и dissection72, в situ гибридизация73и антитело пятная74).
- Сделать вскрытие иглы, резьбы изогнутый кусок Вольфрамные проволоки приблизительно 0,5 дюйма в длину в конце инсулин иглы. Заточите иглу в гидроксида натрия под ток. Используйте 1 мл шприц как ручку рассечение иглы.
- Заполняют раствором, свежеприготовленные, 9 частей PEM буфера (0,1 М трубы рН 6.95, 2 мм по EGTA, 1 MgSO4), 1-часть 10 x PBS и 1 часть 32% одной скважиной 3-ну стеклянную посуду на полпути PFA. Место 3-5 эмбрионов в блюдо и совать небольшое отверстие в каждом эмбриона, используя острый вольфрама иглы тыкать и один немного притупилась для стабилизации, позволяя желток стеканию и фиксатором для выполнения в.
- Используя пару заостренный вольфрамовые иглы, нежно дразнить от внешних два мембран, окружающих Parhyale эмбриона. Вскрыть их в фиксатор, чтобы сделать более надежным, эмбрионов, но работа быстро, чтобы сохранить мембраны от становится фиксированной эмбриона, что затрудняет снятие мембраны. Позвольте эмбрионов исправить для в общей сложности 15-20 минут для пятнать антитела или 40-50 мин в situ гибридизация.
- Изображение живых детеныши и анализировать их для морфологических и поведенческих фенотипы или исправить и выведение их для более подробного анализа. Поднимите молодь до половой зрелости в 2-3 месяца для установления Выбивное и трансгенных линий (см. Kontarakis и Павлопулос75 детеныш ухода и другие полезные данные).
8. Оценка результатов редактирования
- Если применимо, ищите визуального или функциональных фенотип в отредактированных ячейках или организмов.
Примечание: Этот процесс поменяет широко приложением, и приводятся некоторые примеры в конце их соответствующие протоколу описанные выше действия. После исправления Серповидноклеточная мутации в HSPCs, проанализируйте производства гемоглобина дифференцированных erythroblasts с помощью ВЭЖХ (рис. 1А). Нокаут гена рецептора Ил-2 в Т-клетки могут быть подтверждены поверхности окраски и проточная цитометрия (рис. 1Б). Чтобы оценить C. elegans и P. hawaiensis фенотипов, наблюдать животных морфологии и поведении под микроскопом света или флуоресцентные (цифры 1 c и 1 D). - Чтобы определить эффективность и тип геномных изменений генерируется, лизируют бассейны отредактированных ячеек и извлечь их геномной ДНК, используя коммерческая добыча комплект21.
-
Для быстрой оценки формирования indel, ПЦР увеличить по меньшей мере 200 пар вокруг разреза сайт и выполнить T7 endonuclease1 (T7E1)76 или топографа (CEL-1 нуклеиназы) анализа77.
- Если indel формирования на уровне сайта Cas9-вырезать или успешных HDR будет создавать или удалять места известные ограничения, рассмотрите возможность использования Пищеварение энзима ограничения для оценки эффективности редактирования6. Assay полиморфизма (фрагментов ПДРФ) длина фрагмента ограничение может быть удобным способом для проверки эффективности, если это случается быть доступны.
- Для точной количественной оценки эффективности редактирования и определение преобладающего редактирования результатов, отправить Ампликон ПЦР для стандартной Сэнгер виртуализации с вперед и назад грунтовки.
Примечание: Если анализ один клон или организм, анализ результатов Сэнгер прост, как показано в рисунке 2A. Если проанализировать совокупность клеток, затем проанализируйте хроматограммы с онлайн инструмент78, как показано на рисунке 2B. - Для полной количественной и последовательности редактирования результатов выполните глубокое последовательности27,54, как показано на рис. 2C.
- Для оценки определенный набор изменений пробить, ПЦР усилить предсказал-цели сайты и отправлять их для NGS. Чтобы включить обнаружение хромосомные транслокации, выполняют GUIDE-seq79 или высокой пропускной способностью, транслокации генома общесистемной последовательности (HTGTS)80. Для полноты картины пробить правок в клоновых населения выполните всего генома (РГ)81,,8283.
Примечание: Существует целый ряд методов для количественной оценки изменения генома на - и пробить, пояснил далее в обзоре различных статей84,,8586.
Результаты
Эти эксперименты, показать, как заранее собрал Cas9 RNP может использоваться для манипулировать геномов первичные элементы и весь организмов. Исследователи очистить или приобрести Cas9 белка и sgRNA, объединить два компонента заранее сформировать комплекс и ввести RNP в их клетки или организма интерес. После позволяет достаточно времени для редактирования происходят и потомство следующего поколения родиться (если применимо), проверьте фенотипы и/или собрать клетки для генотипирования. Фенотипов может наблюдаться через функциональные анализы, выражение анализов, Визуализация (на глаз или с помощью микроскопии) или других методов, в зависимости от эксперимента.
Например HSPCs, которые были отредактированы для исправления β-глобина мутация, вызывающая серповидно-клеточной анемии могут быть дифференцированы в эритроцитах и assayed для производства здоровой или серп гемоглобина27,87 (Рисунок 1 A). T-клетки отредактирован в нокаут гена рецептора Ил-2 высокоспецифичные, CD25 (IL2RA), может быть анализируемой поверхности окраски и потока цитометрии88и функционально проанализированы для обнаружения сигналов ответ на стимуляцию ИЛ-2 (рис. 1B ). Т-клетки могут быть перепрограммированы также во многом клинически важные, которые требуют оценки разных фенотипов, включая эффективность ВИЧ инфекции89 и в естественных условиях противоопухолевая эффективность автомобиля-T клетки11.
Используя подход co ТРИФОСФАТЫ/co conversion скрининга, черви нематоды Caenorhabditis elegans редактируются одновременно на двух локусов62. HDR в гене dpy-10 ссылки, с помощью ssODN ремонт шаблона приводит к мутации усиления функции легко забил доминирующую dpy-10 . У гетерозиготных мышей F1dpy-10(gof) животных являются роликовые (Rol) и гомозиготных dpy-10(gof) животных унылый (Dpy). Присутствие фенотипа указывает, что Cas9 редактирования произошла в этих животных и повышает вероятность выявления редактирования событий на второй локус в рол или Dpy F1 животных. Успешный эксперимент редактирования должна привести к 33-50% вводят P0 червей приносит 20 или более потомство1 F, которые90леев или Dpy. Затем можно выбрать не рол животных, чтобы вернуться dpy-10 wildtype и выбрать для гомозиготных редактирования интерес. Как правило концентрация crRNA ориентации генов co ТРИФОСФАТЫ ссылка должна быть половина что из crRNA ориентации гена интереса. Если редактирование в ген интереса не восстанавливается, соотношения двух ТРИФОСФАТЫ РНК может регулироваться увеличить вероятность восстановления желаемого мутации. Например увеличение количества crRNA гена интереса по отношению к crRNA гена ссылка будет увеличить долю червей, обладающие изменения гена интереса населения червей, которые также обладают изменения на ссылку Локус гена. Совместное преобразование частоты варьируются, но цены, как правило, 20-60%, часто приносит гомозиготных правки в поколении1 F (рис. 1C).
Р. hawaiensis молодь, которые были отредактированы в нокаут гена Брюшной стенки-B (Абд-B) отображение ясно морфологические аномалии3 (рис. 1D). Этот ген необходим для правильного брюшной патронирования, и его нарушение приводит к грудной тип прыжки и ходьба ноги, заменив плавание и якорь ноги, которые, как правило, на животе.
Определение генома, редактирование результатов на уровне генотипической требует последовательности или в пробирке assay который обнаруживает изменения последовательности. Здесь мы показываем представитель последовательности данных от нашей модели типы клеток и организмов, отметив различные подходы к редактированию количественной оценки. Обратите внимание, что фигура метки обобщены, потому что все методы, показанные здесь может применяться к любой биологической системе.
Подходы на основе последовательности различаются в технической сложности и глубине результатов. Для клоновых отредактированный населения или легко отделяющейся отдельных организмов отредактированный лиц можно упорядочивать после экстракции геномной ДНК. Стандартные результаты секвенирования Сэнгер покажет последовательность изменения на сайте Cas9-cut в данного индивида, с гипотетической frameshifts, что бы сорвать его функцию (рисA). Онлайн инструмент, используемый для виртуализации является другой Сэнгер на основе последовательности подход, который может применяться к смешанным населением, а не отдельных мутантов78. Последовательности анализируются с онлайн инструмент, который может приближаться эффективность редактирования, а также преобладает последовательность результатов. Репрезентативных данных показаны на рисунке 2B.
Наиболее тщательно последовательности метод, описанный здесь является глубокой последовательности (иногда упоминается как высок объём или следующего поколения последовательности). Этот метод обеспечивает последовательностей ДНК из отдельных геномов в смешанного населения. Такие данные можно проиллюстрировать в различных способами. Здесь мы классифицировали отдельные последовательности считывает из отредактированных ячеек на основе редактирования результатов (рис. 2C). Большинство клеток редактируются через путь NHEJ, что обычно приводит к нарушению гена. В других странах целевого гена был выгружен на альтернативную версию через HDR27.
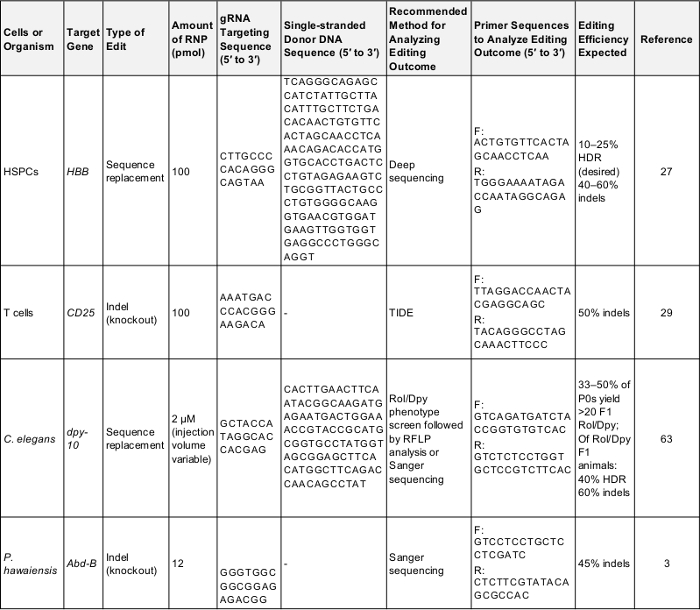
Таблица 1: положительный контроль для предварительного редактирования экспериментов генома. Эта таблица показывает ключевую информацию, необходимую для выполнения впервые генома, редактирования эксперимент в каждом из клеток и организмов, указанных в настоящем Протоколе. После этих параметров может принести успешный результат, который может использоваться для проверки протокола или в качестве базовых для сравнения раз экспериментатор ориентирована на ген их собственных интересов. F: передних, R:, HDR: Гомология направленных ремонт. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
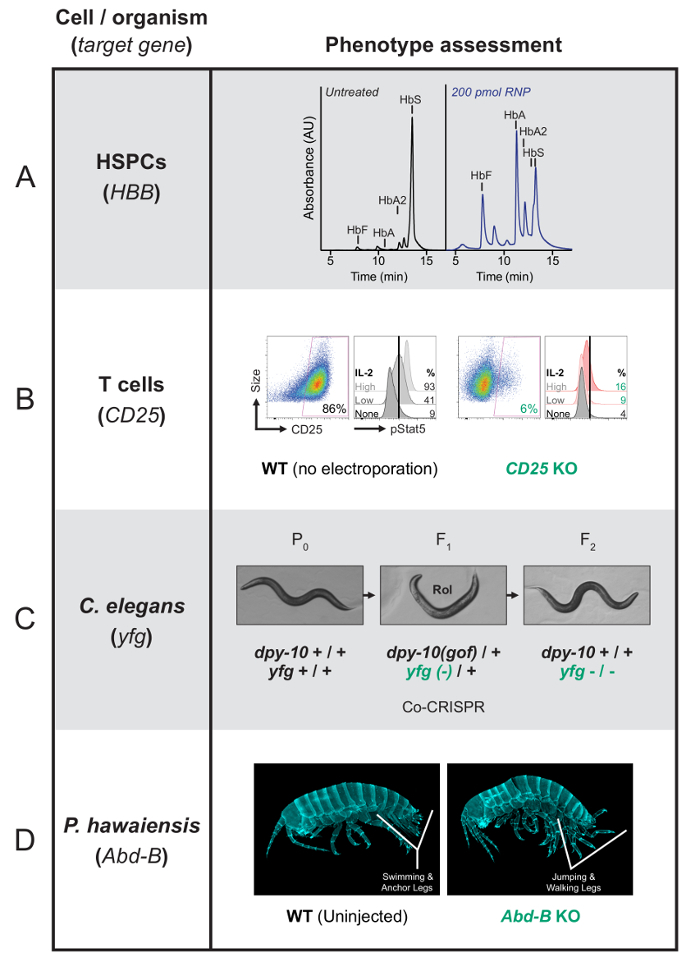
Рисунок 1 : Представитель фенотипические результаты от Cas9 RNP редактирования первичных человеческих клеток и организмов. (A) это след ВЭЖХ, показывая, что после успешного генома редактирования, HSPCs, которые дифференцируются в поздней стадии erythroblasts будет производить более функциональный гемоглобина, чем серп гемоглобина. Мутант эритроцитов производят серп гемоглобина (ОБД), в то время как успешно редактировать клетки будут производить здоровые гемоглобина (HbA и HbA2) а также фетального гемоглобина (HbF). Поглощение графике в произвольных единицах (АС). Эта группа была впервые опубликована в DeWitt et др 27. Она перепечатана с разрешения от Американской ассоциации за научный прогресс. (B) на левой стороне, для каждого условия, эта панель показывает поток цитометрии данные, показывающие, что окрашенные поверхности Т-клетки не выражают CD25 после CD25 ген был выбит с RNP. Изобилие CD25 строится на оси x с размером ячейки на оси y. Справа, для каждого условия на этой панели отображается количественная оценка фосфо-Stat5 (pStat5) после индукции с Ил-2. Сигнализации уменьшается, когда рецепторов ИЛ-2 отсутствует (CD25 KO). Обилие pStat5 строится на оси x и данные, получаемые из трех различных уровней IL-2 ввода сравниваются по вертикали. (C) эта группа показывает Caenorhabditis elegans co ТРИФОСФАТЫ/co conversion экран ориентации dpy-10 как сопредседатель преобразования маркера. Два руководства RNAs целевой двух локусов, dpy-10 и ваши любимые гена (yfg), в том же P0-вводили животным. HDR в dpy-10 результатов Rol или Dpy фенотип. Выбор Rol - или Dpy-F1 животных увеличивает шансы выявления изменений на второй Локус. (D) этой группы показывает, что wildtype Parhyale hawaiensis молодь нормальной животы с плаванием и якорь ноги. Молодь нокаут Абд-B (F0 человек) разработать живота преобразован к грудной клетки. Таким образом плавание и якорей ноги исчезли и заменены прыгать и ходить ногами, связанные с нормальной грудной клетки. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
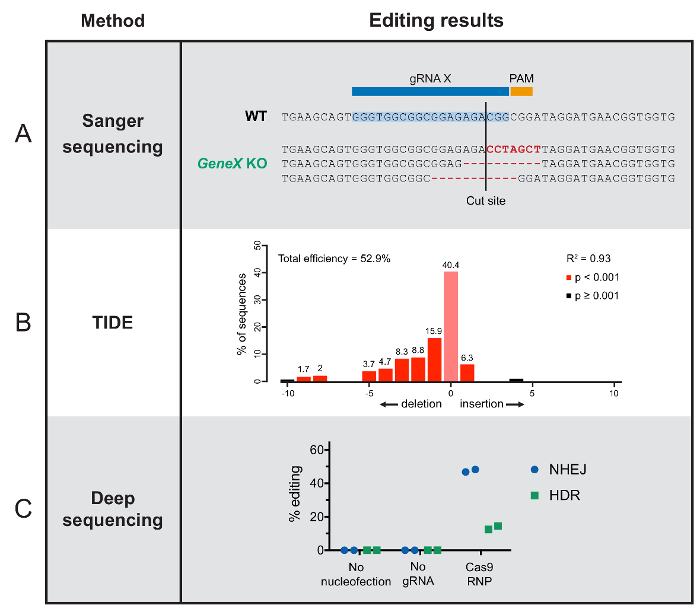
Рисунок 2 : Типичные результаты от редактирования методы анализа результатов. (A) эта группа показывает примеры Сэнгер последовательности результаты от отдельных F1 P. hawaiensis организмов, включая последовательность wildtype и три различных indels, которые нарушают функцию гена, сдвигая кадр открытом чтения. (B) эти TIDE результаты показывают диапазон вставки и удаления событий, которые произошли в Cas9-целевого сайта в бассейне виртуализированного Т-клеток. Ось x указывает длину заданного вставки или удаления в нуклеотиды. (C) эти глубокие последовательности результаты показывают, без изменения генома без nucleofection или gRNA, и успешное редактирование с нетронутыми Cas9 RNP, сгруппированных по результату ремонт ДНК в HSPCs. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Создание надежной генома, редактирования протокола в ячейке строки или организм интерес требует оптимизации и эмпирическое тестирование нескольких ключевых параметров, описанных в этом разделе. Настоятельно рекомендуется попробовать несколько вариантов общих подходов, представленные здесь. Основным ограничением этого протокола является то, что применяя эти методы в другие ячейки или организмов может привести к другой результат в зависимости от изученных видов, и экспериментальный дизайн, что приводит к высокой эффективности гена нокаут не могут поощрять ДНК вставки. Таким образом мы рекомендуем, начиная с методов, представлены здесь и устранения неполадок, как описано ниже.
Устранение неполадок генома редактирования реагент качества:
Создание или приобретение высококачественных реактивов является важнейшим шагом в любых генома, редактирования протокола. Cas9 белка могут быть очищены в лаборатории или приобрели коммерчески. Многие протоколы внимание конечная концентрация в RNP рецепты для Cas9, но оптимальный гена, редактирование деятельность будет зависеть от конкретной деятельности любых индивидуальных подготовки белка Cas9, которая варьируется в зависимости от источника. После того, как работает протокол, представленные здесь, рассмотреть вопрос об оптимизации количество RNP используются титрования Cas9 уровнях для установления оптимальной концентрации: один, который обеспечивает весьма конкретных целевых расщепления ДНК без ненужных пробить расщепления, вызванные чрезмерное Cas940.
Детерминанты генома редактирования успех22можно также руководство РНК чистоты и однородности. Приобретенные sgRNAs или отдельные компоненты crRNA и tracrRNA обычно высококачественные реагенты и целый ряд химических изменений доступны для борьбы с проблемами с РНК деградации или наполнить дополнительные функции для RNP91. В то время как химически модифицированные оформления не может быть необходимой для стандартных генома, редактирования эксперименты, некоторые группы наблюдали гораздо выше, приверженец с таких реагентов, поэтому они могут быть стоит попробовать после освоения процесса, или когда gRNA деградации как представляется, вопрос22,91. В vitro транскрипция и последующие гель очистки является недорогой альтернативой, которая может быть достаточно для рутинной генома, редактирования эксперименты17,21,,4950. Кроме того несколько подходов, которые обычно применяются для получения однородной gRNA населения в естественных условиях, в том числе на основе рибозима и тРНК иссечение индивидуальных гидов, может быть продлен в vitro РНК подготовки для создания чистых Продукция-92.
Советы Дизайн руководство РНК и ДНК доноров:
Руководство РНК выбор является решающим фактором в достижении высокоэффективных редактирования на цель при сведении к минимуму шансы пробить расщепления. Для помощи в руководстве выбор, несколько исследований использовали экраны высокой пропускной способности в сочетании с секвенирование нового поколения для компиляции последовательности черты успешного руководства47,,7993,94, , 9596. Эти возможности были использованы для разработки прогнозных алгоритмов и онлайн-инструментов для оказания помощи в руководстве выбор44,45,46,47,48. Такие алгоритмы основаны на экранах с помощью ДНК-систем для руководства РНК выражение. Направляющие выражаются с помощью Pol III промоутер, и их выражение подвержен таким образом ограничения, связанные с Pol III транскрипции, как преждевременное прекращение при обнаружении следов урацила97,98, 99. Однако, использование RNPs сделал с in vitro-синтезированных руководство РНК обходит эти проблемы и упрощает ограничений на дизайн руководство. Общей чертой, которая возникла из этих алгоритмов и было подтверждено в многочисленных исследованиях с высокоэффективным генома редактирования, является наличие пуриновых, особенно гуанином, в конце 3′ руководство целевого объекта последовательности. Эта функция руководство весьма успешно среди организмов, начиная от млекопитающих C. elegans, плодовых мух и данио рерио65,100,101. Кроме того для C. elegans, проектирование гиды с GG динуклеотид в конце 3′ руководство ориентации региона является эффективной стратегией для прогнозирования весьма эффективное руководство РНК65. В идеале Проверьте несколько направляющих параллельно, чтобы определить, что является наиболее успешным для данного приложения.
При попытке ввести последовательность ДНК в геноме, важно также дизайн доноров или шаблон ДНК. Более надежно, чем другие типичные ремонт шаблоны, линейные двунитевая и плазмида ДНК54,55,102вставляются одноцепочечной олигонуклеотида доноров (ssODNs). В некоторых локусов HDR эффективность может быть повышена с ssODNs, которые дополняют непромысловых или перемещенных ДНК и обладают оружием гомологии, которые асимметричной длины27,55. Поскольку шаблон ремонт вставляется в месте разреза и включает в себя целевые последовательности, необходимо принять меры для предотвращения Cas9 от раскалывание доноров ДНК до или после геномной вставки. Это достигается путем мутации молчаливый PAM последовательности или семян региона, избегая признание Cas9 при сохранении функции вставленной гена21,103. Хотя даже единичных нуклеотидных изменений в PAM, вероятно, для отмены привязки104, попробуйте изменить по крайней мере четырех нуклеотидов, чтобы быть безопасным.
Значение и будущих приложений:
Геном редактирования с ТРИФОСФАТЫ-Cas9 возник как мощный метод, позволяя снисходительный генетические манипуляции любого организма. Редактирование с Cas9 RNP требует немного больше усилий на первый, но прост в использовании, как только реагентов и протоколы устанавливаются в лаборатории. Редактирование ячеек с собранном RNP вместо плазмида ДНК приводит к повышению общего редактирования эффективности, включая трудно достичь гена вставки через HDR, с меньшим количеством пробить эффекты24,25,26 , 27 , 29. Кроме того, экспериментаторов избежать проблем с экспрессии генов, РНК деградации, сворачивание белков и связь между gRNA и Cas9 молекулы синтезируется отдельно внутри клетки22,23. RNP редактирования также обходит безопасности обеспокоенность инсерционному мутагенезу и устойчивое выражение, которое может возникнуть, когда методы вирусный доставки используется клинически14. Учитывая все эти преимущества многие ученые, проведение доклинических, доказательства в концепция эксперименты пользу RNP редактирования для человека терапевтического применения. Как в естественных условиях , так и ex vivo RNP-основанные геном редактирования подходы находятся в стадии разработки для лечения или даже вылечить целый ряд условий, от генетических заболеваний, как Duchenne мускульная дистрофия105 и серповидно-клеточной анемии27 ВИЧ29 и рака11. Интересно, что Cas9 RNP все чаще используется как метод доставки для сельскохозяйственных инженерных, потому что это позволяет «ДНК свободный» редактирование растений33,34,36.
Раскрытие информации
Авторы Александр Марсон и Якоб э. Кукуруза являются соучредителями Spotlight терапии. Якоб э. Кукуруза является советником миссии терапии и его лаборатория получила поддержку авторами исследования от компании АстраЗенека и Pfizer. Александр Марсон является советником Juno терапии и терапии Пакт, и его лаборатория получила поддержку авторами исследований от Juno терапии, Epinomics и Санофи. Его Лаборатория также применяется для патентов, связанных с технологией Cas9 RNP.
Благодарности
Мы благодарим многих предыдущих членов нашей лаборатории и Bay Area генома редактирования сообщества за их вклад в развитие этих методов. Мы благодарим Россом Уилсоном критически чтения этой рукописи.
Александра Марсон исследований поддерживается в подарок от Jake Аронов и национальное общество рассеянного склероза Грант (CA 1074-A-21). Александр Марсон имеет награду карьеры для ученых-медиков из Фонда Добро пожаловать Берроуз и следователь Biohub Цукерберг Чан. Якоб э. Кукуруза исследований поддерживается ли Ка Шинг фонд, медицинский институт медицинских исследований наследия и Калифорнийском институте восстановительной медицины. Behnom Farboud и Барбара J. Мейер исследования частично финансируется NIGMS Грант R01 GM030702 Барбара Дж. Мейер, который является следователь Говард Хьюз медицинский институт. Эрин Джарвис и Nipam H. Patel исследования частично финансируется NSF Грант IOS-1257379 и Джарвис Эрин признает поддержку от NSF GRFP и стипендиатом Philomathia.
Материалы
| Name | Company | Catalog Number | Comments |
| Reagents/Materials | |||
| DNA oligonucleotides | Integrated DNA Technologies | - | IDT will provide custom DNA sequences, including those in Table 1 |
| Guide RNAs | Synthego | - | Synthego will provide high-quality sgRNAs for S. pyogenes Cas9, including custom sgRNAs containing the targeting sequences included in Table 1 |
| Purified Cas9 protein (EnGen Cas9 NLS, S. pyogenes) | New England Biosciences | M0646T | If possible, purifying Cas9 in-house or purchasing from local core facilities is a less expensive option |
| Normal peripheral blood CD34+ stem/progenitor cells | AllCells | PB032-2 | |
| StemSpan SFEM | StemCell Technologies | 09650 | |
| StemSpan CC110 | StemCell Technologies | 02697 | |
| P3 Primary Cell 4D-Nucleofector X Kit | Lonza | V4XP-3032 | |
| RPMI-1640 Medium, With sodium bicarbonate, without L-glutamine, liquid | Sigma | R0883-6X500ML | |
| EasySep™ Human T Cell Isolation Kit | Stemcell | 17951 | |
| cell culture plate, 96 wells, round | Fisher Scientific | 3799 | |
| CTS (Cell Therapy Systems) Dynabeads CD3/CD28 | Life Tech | 40203D | |
| Reombinant Human IL-2 | UCSF Pharmacy | NA | |
| SepMate-50 500-pack IVD | Stemcell Technologies | 85460 | |
| OP50 Escherichia coli | Caenorhabditis Genetics Center | OP-50 | https://cgc.umn.edu/ |
| Nematode Growth Media agar in petri dishes | - | - | See Stiernagle, T (ref. 59) |
| Standard borosilicate glass capillaries with filament: 4 in (100 mm), 1/0.58 OD/ID | World Precision Instruments | 1B100F-4 | |
| Single-barrel standard borosilicate glass capillaries: 6 in (152 mm), 2/1.12 OD/ID | World Precision Instruments | 1B200-6 | |
| Cover glass; 24 × 50 mm | Thermo Fisher Scientific | 12-544E | |
| Cover glass; 22 × 22 mm | Thermo Fisher Scientific | 12-518-105K | |
| Apex LE agarose | Genesee Scientific | 20-102 | |
| Halocarbon oil 700 | Sigma-Aldrich | H8898-100ML | |
| pCFJ90 plasmid | Addgene | 19327 | |
| Compressed nitrogen | - | ||
| 60 mM culture dishes | BD | ||
| Capillary tubes with filament: 4 in (1.0 mm) | World Precision Instruments | T2100F-4 | |
| Sylgard 184 | Dow Corning | ||
| Petri dishes (100 × 15 mm) | - | ||
| Tungsten wire (0.005 in. diameter) | Ted Pella | ||
| Perfluoroalkoxy alkane (PFA) | - | ||
| Marine salt | - | ||
| 9" pasteur pipettes | - | ||
| Phenol red | - | ||
| Nuclease-free water | - | ||
| Equipment | |||
| 4D Nucleofector | Lonza | AAF-1002X | |
| MZ75 Stereomicroscope | Leica | Out-of-production. Current model is the M80 Stereomicroscope | |
| Axio Vert35 inverted phase contrast fluorescent microscope | Zeiss | Out-of-production. Current model is the Axio VertA.1 | |
| Laser-based micropipette puller (for C. elegans protocol) | Sutter Instrument | FG-P2000 | |
| Picoliter Microinjector (for C. elegans protocol) | Warner Instruments | PLI-100A | |
| Three-axis Joystick oil hydraulic micromanipulator | Narishige International | MO-202U | |
| Coarse manipulator | Narishige International | MMN-1 | |
| Micropipette puller (for P. hawaiensis protocol) | Sutter Instrument | P-80/PC | |
| Microinjector (for P. hawaiensis protocol) | Narishige | IM300 | |
| Microloader pipette tips | Eppendorf | 5242956003 | |
| NG-agar |
Ссылки
- Komor, A. C., Badran, A. H., Liu, D. R. CRISPR-based technologies for the manipulation of eukaryotic genomes. Cell. , 1-17 (2016).
- Barrangou, R., Horvath, P. A decade of discovery: CRISPR functions and applications. Nature Microbiology. 2, 1-9 (2017).
- Martin, A., Serano, J. M., et al. CRISPR/Cas9 mutagenesis reveals versatile roles of Hox genes in crustacean limb specification and evolution. Current Biology. 26 (1), 14-26 (2016).
- Goldstein, B., King, N. The future of cell biology: emerging model organisms. Trends in Cell Biology. 26 (11), 818-824 (2016).
- Mali, P., Yang, L., et al. RNA-guided human genome engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Cong, L., Ran, F. A., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Deltcheva, E., Chylinski, K., et al. CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III. Nature. 471 (7340), 602-607 (2011).
- Jinek, M., Chylinski, K., Fonfara, I., Hauer, M., Doudna, J. A., Charpentier, E. A Programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Nowak, C. M., Lawson, S., Zerez, M., Bleris, L. Guide RNA engineering for versatile Cas9 functionality. Nucleic Acids Research. 44 (20), 9555-9564 (2016).
- Jiang, W., Cox, D., Zhang, F., Bikard, D., Marraffini, L. A. RNA-guided editing of bacterial genomes using CRISPR-Cas systems. Nature Biotechnology. , 1-9 (2013).
- Rupp, L. J., Schumann, K., et al. CRISPR/Cas9-mediated PD-1 disruption enhances anti-tumor efficacy of human chimeric antigen receptor T cells. Scientific Reports. 7 (1), 737 (2017).
- Graham, D. B., Root, D. E. Resources for the design of CRISPR gene editing experiments. Genome Biology. 16, 260 (2015).
- Wang, H., La Russa, M., Qi, L. S. CRISPR/Cas9 in genome editing and beyond. Annual Review of Biochemistry. 85, 2270 (2016).
- Nelson, C. E., Gersbach, C. A. Engineering delivery vehicles for genome editing. Annual Review of Chemical and Biomolecular Engineering. 7, 637-662 (2016).
- Yin, H., Kauffman, K. J., Anderson, D. G. Delivery technologies for genome editing. Nature Reviews Drug Discovery. 16 (6), 387-399 (2017).
- Zuris, J. A., Thompson, D. B., et al. Cationic lipid-mediated delivery of proteins enables efficient protein-based genome editing in vitro and in vivo. Nature Biotechnology. 33 (1), 73-80 (2015).
- Cho, S. W., Lee, J., Carroll, D., Kim, J. -. S., Lee, J. Heritable gene knockout in Caenorhabditis elegans by direct injection of Cas9-sgRNA ribonucleoproteins. Genetics. 195 (3), 1177-1180 (2013).
- Wang, W., Kutny, P. M., et al. Delivery of Cas9 protein into mouse zygotes through a series of electroporation dramatically increases the efficiency of model creation. Journal of Genetics and Genomics. 43 (5), 319-327 (2016).
- Chen, S., Lee, B., Lee, A. Y. -. F., Modzelewski, A. J., He, L. Highly efficient mouse genome editing by CRISPR ribonucleoprotein electroporation of zygotes. Journal of Biological Chemistry. 291 (28), 14457-14467 (2016).
- Remy, S., Chenouard, V., et al. Generation of gene-edited rats by delivery of CRISPR/Cas9 protein and donor DNA into intact zygotes using electroporation. Scientific Reports. 7 (1), 16554 (2017).
- DeWitt, M. A., Corn, J. E., Carroll, D. Genome editing via delivery of Cas9 ribonucleoprotein. Methods. , 1-7 (2017).
- Hendel, A., Bak, R. O., et al. Chemically modified guide RNAs enhance CRISPR-Cas genome editing in human primary cells. Nature Biotechnology. 33 (9), 985-989 (2015).
- Thyme, S. B., Akhmetova, L., Montague, T. G., Valen, E., Schier, A. F. Internal guide RNA interactions interfere with Cas9-mediated cleavage. Nature Communications. 7, 11750 (2016).
- Kim, S., Kim, D., Cho, S. W., Kim, J., Kim, J. -. S. Highly efficient RNA-guided genome editing in human cells via delivery of purified Cas9 ribonucleoproteins. Genome Research. 24 (6), 1012-1019 (2014).
- Lin, S., Staahl, B. T., Alla, R. K., Doudna, J. A. Enhanced homology-directed human genome engineering by controlled timing of CRISPR/Cas9 delivery. eLife. 3, 04766 (2014).
- Liang, X., Potter, J., et al. Rapid and highly efficient mammalian cell engineering via Cas9 protein transfection. Journal of Biotechnology. 208, 44-53 (2015).
- DeWitt, M. A., Magis, W., Bray, N. L., Wang, T. Selection-free genome editing of the sickle mutation in human adult hematopoietic stem/progenitor cells. Science Translational Medicine. 8 (360), (2016).
- Ramakrishna, S., Kwaku Dad, A. -. B., Beloor, J., Gopalappa, R., Lee, S. -. K., Kim, H. Gene disruption by cell-penetrating peptide-mediated delivery of Cas9 protein and guide RNA. Genome Research. 24 (6), 1020-1027 (2014).
- Schumann, K., Lin, S., et al. Generation of knock-in primary human T cells using Cas9 ribonucleoproteins. Proceedings of the National Academy of Sciences of the United States of America. 112 (33), 10437-10442 (2015).
- Lee, J. -. S., Kwak, S. -. J., et al. RNA-guided genome editing in Drosophila with the purified Cas9 protein. G3: Genes, Genomes, Genetics (Bethesda, MD). 4 (7), 1291-1295 (2014).
- Sung, Y. H., Kim, J. M., et al. Highly efficient gene knockout in mice and zebrafish with RNA-guided endonucleases. Genome Research. 24 (1), 125-131 (2014).
- Menoret, S., De Cian, A., et al. Homology-directed repair in rodent zygotes using Cas9 and TALEN engineered proteins. Scientific Reports. 5, 14410 (2015).
- Woo, J. W., Kim, J., et al. DNA-free genome editing in plants with preassembled CRISPR-Cas9 ribonucleoproteins. Nature Biotechnology. 33 (11), 1162-1164 (2015).
- Malnoy, M., Viola, R., et al. DNA-free genetically edited grapevine and apple protoplast using CRISPR/Cas9 ribonucleoproteins. Frontiers in Plant Science. 7, 1904 (2016).
- Svitashev, S., Schwartz, C., Lenderts, B., Young, J. K., Mark Cigan, A. Genome editing in maize directed by CRISPR-Cas9 ribonucleoprotein complexes. Nature Communications. 7, 13274 (2016).
- Liang, Z., Chen, K., et al. Efficient DNA-free genome editing of bread wheat using CRISPR/Cas9 ribonucleoprotein complexes. Nature Communications. 8, 14261 (2017).
- Shin, S. -. E., Lim, J. -. M., et al. CRISPR/Cas9-induced knockout and knock-in mutations in Chlamydomonas reinhardtii. Scientific Reports. 6, 27810 (2016).
- Pohl, C., Kiel, J. A. K. W., Driessen, A. J. M., Bovenberg, R. A. L., Nygård, Y. CRISPR/Cas9 based genome editing of Penicillium chrysogenum. ACS Synthetic Biology. 5 (7), 754-764 (2016).
- Grahl, N., Demers, E. G., Crocker, A. W., Hogan, D. A. Use of RNA-protein complexes for genome editing in non-albicans Candida species. mSphere. 2 (3), (2017).
- Rivera-Torres, N., Kmiec, E. B. A standard methodology to examine on-site mutagenicity as a function of point mutation repair catalyzed by CRISPR/Cas9 and ssODN in human cells. Journal of Visualized Experiments. (126), (2017).
- Nandal, A., Mallon, B., Telugu, B. P. Efficient generation and editing of feeder-free IPSCs from human pancreatic cells using the CRISPR-Cas9 system. Journal of Visualized Experiments. (129), (2017).
- Mohr, S. E., Hu, Y., Ewen-Campen, B., Housden, B. E., Viswanatha, R., Perrimon, N. CRISPR guide RNA design for research applications. The FEBS Journal. 283 (17), 3232-3238 (2016).
- Bauer, D. E., Canver, M. C., Orkin, S. H. Generation of genomic deletions in mammalian cell lines via CRISPR/Cas9. Journal of Visualized Experiments. (95), e52118 (2015).
- Hsu, P. D., Scott, D. A., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nature Biotechnology. 31 (9), 827-832 (2013).
- Heigwer, F., Kerr, G., Boutros, M. E-CRISP: fast CRISPR target site identification. Nature Methods. 11 (2), 122-123 (2014).
- Moreno-Mateos, M. A., Vejnar, C. E., et al. CRISPRscan: designing highly efficient sgRNAs for CRISPR-Cas9 targeting in vivo. Nature Methods. 12 (10), 982-988 (2015).
- Labun, K., Montague, T. G., Gagnon, J. A., Thyme, S. B., Valen, E. CHOPCHOP v2: a web tool for the next generation of CRISPR genome engineering. Nucleic Acids Research. 44, 272-276 (2016).
- Haeussler, M., Schönig, K., et al. Evaluation of off-target and on-target scoring algorithms and integration into the guide RNA selection tool CRISPOR. Genome Biology. 17 (1), 148 (2016).
- Lo, T. -. W., Pickle, C. S., et al. Precise and heritable genome editing in evolutionarily diverse nematodes using TALENs and CRISPR/Cas9 to engineer insertions and deletions. Genetics. 195 (2), 331-348 (2013).
- Bassett, A., Liu, J. -. L. CRISPR/Cas9 mediated genome engineering in Drosophila. Methods. 69 (2), 128-136 (2014).
- Prior, H., Jawad, A. K., MacConnachie, L., Beg, A. A. Highly efficient, rapid and co-CRISPR independent genome editing in Caenorhabditis elegans. G3: Genes, Genomes, Genetics. , (2017).
- Hirsh, A. Cas9 expression and purification protocol. protocols.io. , (2017).
- DeWitt, M. A., Wong, J. In vitro transcription of guide RNAs. protocols.io. , (2017).
- Yang, L., Guell, M., et al. Optimization of scarless human stem cell genome editing. Nucleic Acids Research. 41 (19), 9049-9061 (2013).
- Richardson, C. D., Ray, G. J., DeWitt, M. A., Curie, G. L., Corn, J. E. Enhancing homology-directed genome editing by catalytically active and inactive CRISPR-Cas9 using asymmetric donor DNA. Nature Biotechnology. 34 (3), 339-344 (2016).
- Paix, A., Folkmann, A., Seydoux, G. Precision genome editing using CRISPR-Cas9 and linear repair templates in C. elegans. Methods. 121-122, 86-93 (2017).
- Mello, C., Fire, A. DNA transformation. Methods in Cell Biology. 48, 451-482 (1995).
- . Sutter Pipette Cookbook Available from: https://www.sutter.com/PDFs/pipette_cookbook.pdf (2017)
- Stiernagle, T. Maintenance of C. elegans. WormBook: the online review of C. elegans biology. , (2006).
- Evans, T. C. Transformation and microinjection. WormBook: the online review of C. elegans biology. , (2006).
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of stable transgenic C. elegans using microinjection. Journal of Visualized Experiments. (18), (2008).
- Kim, H., Ishidate, T., et al. A co-CRISPR strategy for efficient genome editing in Caenorhabditis elegans. Genetics. 197 (4), 1069-1080 (2014).
- Arribere, J. A., Bell, R. T., Fu, B. X. H., Artiles, K. L., Hartman, P. S., Fire, A. Z. Efficient marker-free recovery of custom genetic modifications with CRISPR/Cas9 in Caenorhabditis elegans. Genetics. 198 (3), 837-846 (2014).
- Ward, J. D. Rapid and precise engineering of the Caenorhabditis elegans genome with lethal mutation co-conversion and inactivation of NHEJ repair. Genetics. 199 (2), 363-377 (2015).
- Farboud, B., Meyer, B. J. Dramatic enhancement of genome editing by CRISPR/Cas9 through improved guide RNA design. Genetics. 199 (4), 959-971 (2015).
- Wood, A. J., Lo, T. -. W., et al. Targeted genome editing across species using ZFNs and TALENs. Science. 333 (6040), 307 (2011).
- Friedland, A. E., Tzur, Y. B., Esvelt, K. M., Colaiácovo, M. P., Church, G. M., Calarco, J. A. Heritable genome editing in C. elegans via a CRISPR-Cas9 system. Nature Methods. 10 (8), 741-743 (2013).
- Dickinson, D. J., Ward, J. D., Reiner, D. J., Goldstein, B. Engineering the Caenorhabditis elegans genome using Cas9-triggered homologous recombination. Nature Methods. 10 (10), 1028-1034 (2013).
- Rehm, E. J., Hannibal, R. L., Chaw, R. C., Vargas-Vila, M. A., Patel, N. H. Injection of Parhyale hawaiensis blastomeres with fluorescently labeled tracers. Cold Spring Harbor Protocols. 2009 (1), (2009).
- Gerberding, M., Browne, W. E., Patel, N. H. Cell lineage analysis of the amphipod crustacean Parhyale hawaiensis reveals an early restriction of cell fates. Development (Cambridge, England). 129 (24), 5789-5801 (2002).
- Browne, W. E., Price, A. L., Gerberding, M., Patel, N. H. Stages of embryonic development in the amphipod crustacean, Parhyale hawaiensis. Genesis. 42 (3), 124-149 (2005).
- Rehm, E. J., Hannibal, R. L., Chaw, R. C., Vargas-Vila, M. A., Patel, N. H. Fixation and dissection of Parhyale hawaiensis embryos. Cold Spring Harbor Protocols. 2009 (1), (2009).
- Rehm, E. J., Hannibal, R. L., Chaw, R. C., Vargas-Vila, M. A., Patel, N. H. In situ hybridization of labeled RNA probes to fixed Parhyale hawaiensis embryos. Cold Spring Harbor Protocols. 2009 (1), (2009).
- Rehm, E. J., Hannibal, R. L., Chaw, R. C., Vargas-Vila, M. A., Patel, N. H. Antibody staining of Parhyale hawaiensis embryos. Cold Spring Harbor Protocols. 2009 (1), (2009).
- Kontarakis, Z., Pavlopoulos, A. Transgenesis in non-model organisms: the case of Parhyale. Methods in Molecular Biology. 1196, 145-181 (2014).
- Kim, H. J., Lee, H. J., Kim, H., Cho, S. W., Kim, J. -. S. Targeted genome editing in human cells with zinc finger nucleases constructed via modular assembly. Genome Research. 19 (7), 1279-1288 (2009).
- Qiu, P., Shandilya, H., D'Alessio, J. M., O'Connor, K., Durocher, J., Gerard, G. F. Mutation detection using Surveyor nuclease. BioTechniques. 36 (4), 702-707 (2004).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42 (22), 168 (2014).
- Tsai, S. Q., Zheng, Z., et al. GUIDE-seq enables genome-wide profiling of off-target cleavage by CRISPR-Cas nucleases. Nature Biotechnology. 33 (2), 187-197 (2015).
- Frock, R. L., Hu, J., Meyers, R. M., Ho, Y. -. J., Kii, E., Alt, F. W. Genome-wide detection of DNA double-stranded breaks induced by engineered nucleases. Nature Biotechnology. 33 (2), 179-186 (2015).
- Smith, C., Gore, A., et al. Whole-genome sequencing analysis reveals high specificity of CRISPR/Cas9 and TALEN-based genome editing in human iPSCs. Cell Stem Cell. 15 (1), 12-13 (2014).
- Veres, A., Gosis, B. S., et al. Low incidence of off-target mutations in individual CRISPR-Cas9 and TALEN targeted human stem cell clones detected by whole-genome sequencing. Cell Stem Cell. 15 (1), 27-30 (2014).
- Kim, D., Bae, S., et al. Digenome-seq: genome-wide profiling of CRISPR-Cas9 off-target effects in human cells. Nature Methods. 12 (3), 237-243 (2015).
- Hendel, A., Fine, E. J., Bao, G., Porteus, M. H. Quantifying on- and off-target genome editing. Trends in Biotechnology. 33 (2), 132-140 (2015).
- O'Geen, H., Yu, A. S., Segal, D. J. How specific is CRISPR/Cas9 really. Current Opinion in Chemical Biology. 29, 72-78 (2015).
- Tsai, S. Q., Joung, J. K. Defining and improving the genome-wide specificities of CRISPR-Cas9 nucleases. Nature Reviews Genetics. 17 (5), 300-312 (2016).
- Hoban, M. D., Cost, G. J., et al. Correction of the sickle cell disease mutation in human hematopoietic stem/progenitor cells. Blood. 125 (17), 2597-2604 (2015).
- Simeonov, D. R., Gowen, B. G., et al. Discovery of stimulation-responsive immune enhancers with CRISPR activation. Nature. , (2017).
- Hultquist, J. F., Schumann, K., et al. A Cas9 ribonucleoprotein platform for functional genetic studies of HIV-host interactions in primary human T cells. Cell Reports. 17 (5), 1438-1452 (2016).
- Paix, A., Wang, Y., et al. Scalable and versatile genome editing using linear DNAs with microhomology to Cas9 sites in Caenorhabditis elegans. Genetics. 198 (4), 1347-1356 (2014).
- Lee, K., Mackley, V. A., et al. Synthetically modified guide RNA and donor DNA are a versatile platform for CRISPR-Cas9 engineering. eLife. 6, (2017).
- Minkenberg, B., Wheatley, M., Yang, Y. CRISPR/Cas9-enabled multiplex genome editing and its application. Progress in Molecular Biology and Translational Science. 149, 111-132 (2017).
- Doench, J. G., Fusi, N., et al. Optimized sgRNA design to maximize activity and minimize off-target effects of CRISPR-Cas9. Nature Biotechnology. 34 (2), 184-191 (2016).
- Doench, J. G., Hartenian, E., et al. Rational design of highly active sgRNAs for CRISPR-Cas9-mediated gene inactivation. Nature Biotechnology. , 1-8 (2014).
- Liu, H., Wei, Z., Dominguez, A., Li, Y., Wang, X., Qi, L. S. CRISPR-ERA: a comprehensive design tool for CRISPR-mediated gene editing, repression and activation. Bioinformatics (Oxford, England). 31 (22), 3676-3678 (2015).
- Wu, X., Scott, D. A., et al. Genome-wide binding of the CRISPR endonuclease Cas9 in mammalian cells. Nature Biotechnology. 32 (7), 670-676 (2014).
- Bogenhagen, D. F., Brown, D. D. Nucleotide sequences in Xenopus 5S DNA required for transcription termination. Cell. 24 (1), 261-270 (1981).
- Cozzarelli, N. R., Gerrard, S. P., Schlissel, M., Brown, D. D., Bogenhagen, D. F. Purified RNA polymerase III accurately and efficiently terminates transcription of 5S RNA genes. Cell. 34 (3), 829-835 (1983).
- Chen, B., Gilbert, L. A., et al. Dynamic imaging of genomic loci in living human cells by an optimized CRISPR/Cas system. Cell. 155 (7), 1479-1491 (2013).
- Gagnon, J. A., Valen, E., et al. Efficient mutagenesis by Cas9 protein-mediated oligonucleotide insertion and large-scale assessment of single-guide RNAs. PLoS ONE. 9 (5), 98186 (2014).
- Ren, X., Yang, Z., et al. Enhanced specificity and efficiency of the CRISPR/Cas9 system with optimized sgRNA parameters in Drosophila. Cell Reports. 9 (3), 1151-1162 (2014).
- Ran, F. A., Hsu, P. D., Wright, J., Agarwala, V., Scott, D. A., Zhang, F. Genome engineering using the CRISPR-Cas9 system. Nature Protocols. 8 (11), 2281-2308 (2013).
- Serano, J. M., Martin, A., et al. Comprehensive analysis of Hox gene expression in the amphipod crustacean Parhyale hawaiensis. Developmental Biology. 409 (1), 297-309 (2016).
- Sternberg, S. H., Redding, S., Jinek, M., Greene, E. C., Doudna, J. A. DNA interrogation by the CRISPR RNA-guided endonuclease Cas9. Nature. , 1-17 (2014).
- Lee, K., Conboy, M., et al. Nanoparticle delivery of Cas9 ribonucleoprotein and donor DNA in vivo induces homology-directed DNA repair. Nature Biomedical Engineering. 1 (11), 889-901 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены