Method Article
Долгосрочный в Vivo отслеживания динамики воспалительных клеток внутри куколки дрозофилы
В этой статье
Резюме
Здесь мы представляем протокол для ремонта раны жить изображений и связанных воспалительной реакции при высокой пространственно временных резолюции в естественных условиях. Этот метод использует куколки стадии развития дрозофилы , чтобы долгосрочное изображений и отслеживание конкретных клеточных популяций со временем и совместим с эффективным гена, опосредованного системой РНК-интерференции инактивации.
Аннотация
Во время быстрого воспалительной реакции на повреждение ткани клетки иммунной системы быстро набираются на сайт травмы. Однажды на рану, врожденные иммунные клетки выполнить ряд основных функций, таких, как борьба с инфекцией, некротические очищаемых и стимулирования матрицы осаждения. Для того чтобы полностью понять различные сигнализации событий, которые регулируют этот иммунный ответ, важно соблюдать комплекс поведения (и взаимодействия, которые происходят между) несколько клеток линий в естественных условиях и в режиме реального времени, с высокой пространственно временным разрешением. Оптическая прозрачность и генетические уступчивость дрозофилы эмбрионов установили дрозофилы как бесценный модель live-образ и вскрыть основные аспекты поведения воспалительных клеток, включая механизмы развития разгон, Распродажа apoptotic трупов и/или патогенных микроорганизмов и вербовки в раны. Однако, более поздние работы теперь продемонстрировали, что используя намного позже в жизненном дрозофилы – дрозофилы pupa – предлагает целый ряд различных преимуществ, включая повышение эффективности интерференции, больше изображений периодов, и значительно большее число иммунных клеток. Здесь мы описываем протокол для визуализации ремонта раны и связанные воспалительной реакции в высоком разрешении пространственно временных в живых куколок дрозофилы . Следить за динамикой эпителизация и воспаления, мы используем целый ряд конкретных в vivo флуоресцентные маркеры эпителия и врожденные иммунные клетки. Мы также продемонстрировать эффективность фото кабриолет флуорофоров, например Каэдэ, для следующих подмножества определенных иммунных клеток, отслеживать их поведение, как они мигрируют и решимость от места повреждения.
Введение
Эффективное и действенное воспалительной реакции имеет решающее значение для любого организма для борьбы с инфекцией, сброс мусора и организовать ремонт поврежденных тканей1. Хотя этот ответ является неизбежным результатом большинства повреждения тканей, воспаление требует строгого регулирования, потому что неуместные воспалительной реакции был связан с целый ряд различных заболеваний человека (включая хронического незаживающие раны, чрезмерная рубцов и предрасположенность к раку)1,2,3. Учитывая это клиническое значение, важно получить более подробное понимание молекулярных и клеточных механизмов, вождение воспалительной реакции для того, чтобы разрабатывать новые прогнозные показатели и стратегии для лечения ряда хронических воспалительных условия, которые могут защитить ремонт тканей от длительного и ненужных воспаления.
В последние годы дрозофила стала устоявшейся и ценную модель системы вскрыть основные черты воспалительной реакции, сохраняется от насекомых до человека4,5. В настоящее время, дрозофила предлагает гораздо больше генетических уступчивость, чем это возможно в настоящее время в других экспериментальных моделей (например, мыши или данио рерио), обеспечивая точное пространственно временных генетических манипуляций в естественных условиях (для инактивации или чрезмерно Экспресс любой ген интереса в пределах конкретных клеток в определенной области развития время точке) и простота генома общесистемной экраны6,7. Традиционно большинство живут изображений исследования заживления раны и воспаления у дрозофилы были проведены на эмбриональных стадиях, как эмбрионы неподвижным (в отличие от дрозофилы личинки или взрослых) и оптически прозрачных который позволяет беспрецедентную высокого разрешения в vivo imaging8. Это позволило исследователям для визуализации быстрый и надежный набор дрозофилы innate иммунных клеток (hemocytes) к месту раны в ответ на механическое или лазерно индуцированным травмы на эмбриональных эпителия9, 10 , 11 , 12 , 13 , 14. объединив эти исследования жить изображений с генетической манипуляции, исследования эмбрионов дрозофилы обнаружили много важных иммунных клеток белки, которые контролируют воспалительных клеток поведения в естественных условиях. К примеру, КНИ-1 гомолога Дрейпер (ИТПМ домена содержащих белков) были определены как важные «ущерб рецептор» которая опосредует набора дрозофилы иммунные клетки в H2O2-зависимым образом сайты повреждение15. Дрейпер уровней внутри иммунные клетки в свою очередь регулируется кальция индуцированной JNK сигнализации и повышенном вниз по течению apoptotic труп поглощение12. Кровяные моторики далее требует сложные изменения цитоскелета координировать режиссер миграции к ране и это зависит от активности цитоскелета регуляторы как актин планшеты белка Башчаршия16 и небольшой семьи Ро 9GTPases РКК и Ро.
Дрозофилы является holometabolous насекомое, которое проходит через дополнительные этапы личинки и куколки, после эмбриогенеза, до достижения совершеннолетия17. Куколки дрозофилы был разработан как дополнительные модели для неинвазивной жить изображений различных динамических сотовой событий, включая развития клеток миграции18, деление клеток19, рост клеток20и мышц сокращение21. Совсем недавно она была создана как Роман модель, в которой для изучения динамики заживления ремонт и воспаления в vivo22,23.
Как и эмбриональных стадий дрозофила куколок немобильные и оптически прозрачным, после тщательного вскрытия от их непрозрачной куколки случаях18. Воспользовавшись этой оптической прозрачности, один может следовать поведения в естественных условиях innate иммунных клеток (hemocytes) в ответ на повреждение тканей внутри куколки ткани дрозофилы , такие куколки крыло22. Куколки крыло существует как простой bilayered структура, состоящая из двух больших плоских эпителиальных листов, которые связаны по периметру крыла; внеклеточного пространства между этими двумя слоями эпителия заполняется с гемолимфа (насекомых крови) и большое количество подвижных hemocytes24. Просто как эмбрионы механические или лазерно индуцированным травм в эпителии крыло вызывает быстрый набор hemocytes на сайт травмы23. Однако эта стадия куколки предлагает некоторые явные преимущества для воображения над ранее эмбриональных стадий. Раненых куколки могут быть imaged над гораздо более длительных периодов времени (для по крайней мере 5 h), больше площади ткани доступен для экспериментальной возмущения (например, создание нескольких РАН) и существует значительно большее число присутствующих на этой стадии (hemocytes предоставление более клеток траектории от дальнейшего расстояния для совершенствования статистической мощности во время математического анализа.) Кроме того в стадии куколки, позволяя многих генов быть «постучал вниз» в ткани или время конкретным образом, по сравнению с более традиционными целом мутант подходом эмбрионов значительно повышается эффективность инактивации гена, опосредованного системой РНК-интерференции.
Для того, чтобы следить за динамикой эпителизация раневой и сопровождающих воспалительной реакции в рамках этой новой модели, куколки, должны быть помечены два различных клеточных популяций: куколки эпителия и врожденные иммунные клетки (дрозофила hemocytes). Количество различных маркеров (Таблица материалов) доступны для обозначения этих двух различных клеточных популяций - Выбор маркера зависит от конкретного процесса необходимо изучить. Марк куколки эпителия, дрозофила строки, содержащие либо повсеместно выраженной GFP-меткой E-Кадгерины (помечаемого adherens развязок) обычно используются для указания позиции поля ячеек, или альтернативно, GFP-тегами Актин связывающий домен Moesin (помечаемого Цитоскелет актина) для визуализации раны край сократительной актина кольцо и передовые выступы. Для обозначения Drosophila hemocytes, кровяные конкретных srp-Gal425 диск выражение ядерной ППП (для ядерной отслеживания), цитоплазматических GFP или GFP-меткой Moesin (ярлык в цитоплазме или актин цитоскелета, соответственно) или photoconvertible Флюорофор (например Каэдэ) используются. В самом деле часто бывает выгодно использовать несколько маркеров иммунных клеток в сочетании, чтобы одновременного анализа движения ядерных и морфологию клеток (см. Представитель результаты). Однако поскольку этот протокол включает в себя использование дрозофилы куколок, только сочетания генетических маркеров, являются жизнеспособными до середины куколки этапы могут быть использованы. Кроме того эмбриональных смертоносных запасов не будет подходящим. Это вряд ли может быть проблемой при визуализации элемента управления (или одичал тип) куколок, но важно учитывать при гены должны быть сбит или оверэкспрессировали, чтобы оценить их влияние на закрытие раны и воспаления. В случае раннего летальность, вызванные нокдаун гена (или гиперэкспрессия), Gal80ts конструкции может использоваться побудить Gal4-driven нокдаун позже в процессе развития (см. обсуждение).
В наших последних исследований движущихся в стадии куколки позволило нам собрать достаточных данных иммунных клеток траектории для анализа воспалительных поведения с использованием сложного математического моделирования, который в свою очередь позволило нам заключить новые детали раны воспалительные аттрактанта сигналы23. Например этот подход показал, что раны хемотаксического распространяется медленно через воспаленные ткани на 200 мкм2мин., стоимость намного медленнее, чем ранее предложил кандидата в малых молекул, таких как АТФ или сообщается, H2O2 Диффузный26,27,,2829; Эти небольшие «ущерб» молекулы вместо склонны действовать как разрешающий сигнал. Кроме того следуя долгосрочное поведение innate иммунных клеток, как они решить от первоначальной раны и подвергаются воздействию второй (сделанные на различных timepoints после первого), мы обнаружили временной «десенсибилизации» период во время которого иммунные клетки слепы к последующим травм23. Эксплуатируя долгосрочное изображений потенциал куколки модели, вместе с дрозофилы генетических уступчивость, один можно следить за поведение населения конкретных иммунных клеток (например, только те иммунные клетки, набранных к месту раны) в ответ на последующих оскорбления, используя photoconvertible Флюорофор30 , который может быть выражен исключительно в пределах иммунных клеток линии23.
Здесь мы описываем протокол для визуализации динамики ремонта раны и связанные воспалительной реакции высоким пространственно временных разрешением с помощью живых куколок дрозофилы . Мы предоставляем подробные методологии для покрытия шаги, необходимые для подготовки первоначального куколки (рассечение и монтажа) и последующего ранив лазер опосредованной и покадровой съемки. Мы также описывают использование фото кабриолет флуорофоров разрешить маркировки конкретных иммунных клеток подмножества в естественных условиях. В долгосрочной перспективе мы предполагаем, что эта новая модель куколки дрозофилы открывает интересные возможности для рассечения сложных сигналов динамика, лежащие в основе воспалительной реакции на повреждение тканей. Путем применения более совершенных статистических анализов может раскрыть особенности ответ, который в противном случае останется экспериментально недоступными, в то время как повышение эффективности RNAi может поддаваться применение скрининг генома общесистемной в течение иммунные клетки в естественных условиях для выявления новых игроков, регулирующие поведение иммунных клеток.
протокол
Этот протокол состоит из четырех основных последовательных этапов: (1) подготовка дрозофилы запасов и постановка дрозофилы куколок, (2) куколки диссекции и монтаж, (3) куколки ранения, (4) в естественных условиях покадровой конфокальная томография.
1. подготовка запасов дрозофилы и постановка куколок
- Получите соответствующие дрозофилы запасов (см. Введение и Таблица материалов).
- Сбор молодых здоровых взрослых мух соответствующие генотипа.
- Выберите взрослых мух с помощью углекислого газа колодки для кратко анестезировать мух и тонкой кисточки для передачи летит соответствующие генотип или пола в коллекции флакон.
- Добавить 20 девственной женщин и 20 мужчин каждый флакон, содержащий стандартные летать пищевых сред (смесью кукурузной муки меласса агар, смотрите Таблицу материалы) с дрожжей.
- Для оптимального куколки поколения наконечник взрослых мух каждый день на новые продукты в свежих флаконов, сохраняя все флаконы при 25 ° C.
Примечание: Если система Gal4-Уан31 используется для привода экспрессии генов линии конкретных, все шаги должны выполняться при 25 ° C или выше, как Gal4-Уан система не чувствительна к температуре. - 18 h перед запланированной сессии изображений, выберите по крайней мере 10 новообразованной белый предварительно куколки (рис. 1A) из флаконов (то есть 0 h после формирования puparium, АТФ) с помощью щипцов или тонкой кистью выбить куколки от поверхности внутренних флакона и Передача куколок тщательно в сторону чистой пустой пластиковый флакон.
Примечание: Блуждающих 3rd instar личинки выползать вверх питания среднего пройти Окукливание; вновь образованных белых prepupae легко идентифицируются как они обладают вывернута передней дыхальца и стационарные (в отличие от 3rd instar личинок). Кутикула превращается в «puparium» (куколки случай), который первоначально мягкий и белый17. Будьте внимательны, чтобы избежать повреждения куколок, как это может привести не только нежелательные травмы индуцированной воспалительной реакции, но и значительные задержки развития. - Возраст отдельных куколок на соответствующей стадии развития (18 h, APF даст оптимальные результаты) во флаконе при 25 ° C.
Примечание: Как развивать куколок, куколки дела станут постепенно темнее и более хрупкими. - Подготовка других реагентов для следующего шага впереди времени. Чтобы сделать Гептан клей, объединить 20 см длиной засучив двухсторонний скотч с 20 мл гептана в 50 мл пластиковых пробирок, печать с парафин фильм и рок при комнатной температуре на ночь на скамейке.
2. Подготовка и рассечение дрозофилы куколок
- Передать поставил куколок дрозофилы кусок двухсторонняя клейкая лента монтируется на стеклянное скольжение. Расположите куколки вентральной стороне прочно застрял на ленту и спинной стороне вверх (рис. 1B).
Примечание: Передней из куколки будет отличимыми от двух дыхальца, выступающие от переднего конца куколки дела. - Осторожно удалите куколок из их защитные puparium корпус под микроскопом рассечение brightfield, с помощью щипцов и микро ножницы (рис. 1B-D).
- Первоначально надрезать в регионе передней большинстве puparium, с помощью щипцов (рис. 1B). Убедитесь, что куколки в этой области является полой и лишенный куколки ткани потому что куколок будет сократились в случае во время раннего развития куколки.
- После этого первоначального разреза тщательно слезу или разрезать куколки дела в передней к задней направление с помощью щипцов или microscissors (рис. 1 c) до тех пор, пока куколки является полностью свободным от коричневый непрозрачный хрупкий корпус (рис. 1 d).
Примечание: Куколок на данном этапе очень хрупкие и необходимо позаботиться о том, чтобы избежать проколов куколки поверхности; проколов очевидна гемолимфа быстро выливается из прокола сайта. Куколки с проколов, однако малые, должны быть отброшены.
- Смонтируйте куколки в прозрачным дном блюдо с помощью клея Гептан.
- Используйте наконечник пипетки 20 мл для размещения 10 мл капли клея заранее подготовленные гептана (см. раздел 1.6 выше) в линии на блюдо прозрачным дном.
- Разрешить клей для просушки на 5 s перед передачей расчлененных куколок осторожно прижмите гептана клей с помощью щипцов (Рисунок 1E).
- Для удобства ранения и изображений выстраиваются куколки подряд; предлагается около 5 куколок, но больше будет управляемым с опытом работы.
Примечание: Использование гептана клей рекомендуется при использовании вертикально тепловизионных систем, но не является необходимым при использовании Перевернутый системы. Если клей создает оптические аберрации во время визуализации, куколки могут быть размещены непосредственно на coverglass вместо – естественный адгезии между куколки ткани и стекла будет достаточно в большинстве случаев для стабильной изображений, до тех пор, как осторожность при перемещении изображения блюдо между микроскопы.
- Для достижения наилучших результатов смонтируйте куколок, так что крыла является плоской на coverglass с большинством поверхности крыла в непосредственном контакте с coverglass (Рисунок 1F). Ролл куколок, используя пинцет изменить свою позицию, чтобы убедиться, что крыло установлен правильно.
- Чтобы предотвратить обезвоживание образец в течение периода обработки изображений, добавьте часть абсорбирующего фильтр-бумаги, пропитанной в дистиллированной воде в сторону, стеклянным дном посуды в конце установки, стараясь не нарушить куколки (Рисунок 1E). Обложка блюдо с крышкой.
Примечание: Куколки теперь готовы для ранения и изображений.
3. лазерно индуцированным ранив дрозофилы куколки крыльев
- Передача прозрачным дном блюдо, содержащий подключенные куколки с микроскопом поля, оборудованных системой перестраиваемая лазерная абляция.
- Использование air-cooled закачивается азот абляции импульсно УФ лазерной настройкой до 435 Нм – смотрите Таблицу материалы для детали11; точные длины волны света, используемые для освещения выбирается пользователем с помощью соответствующей окрашивания клеток.
- С помощью brightfield Оптика, отрегулируйте микроскоп этапа найти куколки крыло первого куколки быть ранены (Рисунок 1F).
- Для получения оптимальных результатов используйте масло погружения 40 X или 63 X объектив для обоих изображений и лазерной абляции; гарантировать согласованность между абляции и системы визуализации погружения используемой жидкости (масла или глицерина). Отрегулируйте Микроскоп, чтобы сосредоточиться на плоскости эпителия куколки крыло ближайшее стекло coverslip (т.е. фокус на регионе эпителия пораниться) используя ручку управления тонкой фокус.
- С помощью микроскопа этап корректировок, позиция куколки крыла, так что область пораниться непосредственно выравнивается с известным целевой области лазерной абляции.
- Использование плотность энергии аттенюатора слайд установлены Микроскоп вручную настроить уровень мощности света абляции.
Примечание: Аттенюатор ползунок имеет остановки нажмите и постановлений для определения относительного уровня затухания и разрешить использование воспроизводимых параметров. - С помощью элемента управления внешней ручной триггера , активируйте лазерной абляции, используя одним щелчком краткий триггера, чтобы раны. Проверите для внешнего вида переходных воздушный пузырь на сайте абляции с ранив обычно сопровождал его. Проверьте, если лазерно индуцированным ранив была успешной, используя соответствующие флуоресцентных фильтров для визуализации куколки эпителия.
Примечание: позаботьтесь, чтобы избежать случайного воздействия лазерных лучей, как отражения луча может вызвать тяжелые глаза или повреждения кожи. - Если ранив неудачн, различаются фокальной плоскости (перемещение фокуса Микроскоп немного выше или ниже текущего уровня фокуса) и повторить щелчком абляция триггера. Кроме того постепенно увеличивайте мощность лазера с помощью аттенюатора слайд, пока не будет достигнут размер желаемого рану.
- Варьировать лазерной абляции частота следования импульсов, используйте ручку Частота повторения на задней панели (которая изменяет скорость от менее чем 1 импульсный/s до 60 Гц). Для оптимального ранения, равным 40 Гц частота следования импульсов.
- Для создания различных размеров раны, используйте плотность энергии аттенюатора слайд вручную настроить уровень мощности света абляции.
- Воздерживаться от ранив все подключенные куколок и использовать эти номера удаленной куколки как разматывать элементы управления.
- Для согласованных результатов регулярно перестроить абляции системы (с помощью соответствующих руководство по эксплуатации). Кроме того чистые и пополнить ячейку резонатор краситель, управляет выходную длину волны лазера.
4. в естественных условиях покадровой конфокальная томография
- Быстро передавать соответствующие микроскоп для покадровой изображения прозрачным дном блюдо.
Примечание: Для получения оптимальных результатов используйте высокой спецификации конфокальный или вращающийся диск микроскоп оснащен чувствительных детекторов, которые могут обнаружить GFP и mCherry флуорофоров. - Для изображения всего куколки крыла, используйте объектив малое увеличение (например 20 X) (рис. 2A). Чтобы изображение раны ремонт и сопровождающих воспалительной реакции с высоким пространственным разрешением, используйте масло погружения 40 X (NA 1.3) или 63 X (NA 1.4) объективов (см. Представитель изображения в Рисунок 2B-D).
- Откройте соответствующий образ захвата программного обеспечения, связанные с микроскопом.
- С помощью программного обеспечения захвата изображения, включите соответствующие лазеры например 488 нм и 561 Нм лазеры для визуализации GFP и mCherry флуорофоров, соответственно (нажав в соответствующих полях) и отрегулировать мощность лазера и усиления/смещение настройки, чтобы дать достаточно флуоресцентного сигнала избегая пиксель насыщения; Используйте низкие возможности лазерного луча (в диапазоне 5-20%) для сведения к минимуму Фотообесцвечивание и Фототоксичность.
- Чтобы захватить оба ремонта эпителия и воспалительных клеток вербовки, установите микроскоп для записи z стека с помощью ручки регулировки тонкой фокус на панели управления; для получения оптимальных результатов установите программное обеспечение (с помощью ручного щелчков) записи z-ломтики через куколки крыло (минимум каждые 3 мм), от верхней части раненых эпителия через внеклеточного пространства под (содержащие перенос hemocytes) для достижения большой z стек (в диапазоне от 50-100 мм).
- Для покадровой изображений, записывать z стеки через регулярные интервалы времени (минимум каждые 30 s) для по крайней мере 1 час после ранения.
Примечание: Точный временной интервал между z стеки выбрали представляет собой компромисс между захвата быстро меняющейся динамики клеток и избегая фото Отбеливание образцов. - Чтобы одновременно изображения несколько куколок (включая номера удаленной разматывать контроль), используйте моторизованного столика (прилагается к Микроскоп) и функцию многопозиционных приобретения имеющихся изображений программное обеспечение. Вручную задать положение каждого индивидуального куколки в программное обеспечение с помощью ручки управления позиция этап, а затем вручную установить пределы соответствующие z стека (сверху и снизу) для каждого индивидуального куколки.
- Визуализируйте покадровой фотографии во время захвата изображения или позднее с программное обеспечение для анализа изображений специалист (например ImageJ32) с помощью z стек прогнозы или 3-D визуализации. Например, чтобы следить за движениями отдельных hemocytes (как показано на рисунке 2 c' и D'), трек кровяные ядер с помощью открытого доступа плагинов ImageJ «TrackMate» или «Руководство отслеживания» (методы, опубликованных в 33, 34.)
- Использование photoconvertible зонды (например Каэдэ30) чтобы выборочно photoconvert и этикетки подмножество эпителия или иммунных клеток во время визуализации.
- Откройте соответствующие модули в пределах изображений программное обеспечение для выполнения photoconversion (например, FRAP, флуоресценции восстановления после отбеливания фото модуль) и активировать 405nm лазерный (щелкнув в поле соответствующего программного обеспечения)35.
- Выберите клетки, чтобы быть photoconverted в рамках программного обеспечения FRAP, используя инструмент выделения квадратные, круглые или руки. В рамках программного обеспечения FRAP установите время курс для photoconversion (отбеливание) для однорамные итерации и установите 405 нм лазер на мощность лазера 20%. Вручную выберите начать эксперимент для выполнения photoconversion.
- Выход из FRAP модуль (нажмите Close) и вернуться к экрану оригинальных изображений в программном обеспечении; Использование 488 нм и 561 Нм лазеры для изображения поведение photoconverted и не photoconverted клеток, создав z стек и покадровой записи как указано выше.
Примечание: Photoconverted зонды остаются стабильными для многих часов после первоначального photoconversion, позволяя поведение клеток photoconverted следует со временем (для по крайней мере 5 h). Например воспалительных клеток в рану может быть выборочно photoconverted (Рисунок 2F), и их поведение после, как они решить от места повреждения (Рисунок 2 g и H).
Результаты
Этот протокол описывает подготовку дрозофилы куколок живой покадровой изображений рану ремонта и воспаления в естественных условиях. С помощью этого метода, можно сформировать несколько фильмов с высоким разрешением закрытия куколки ран и воспалительных клеток вербовки с легкостью и изображения куколок для длительного времени (по крайней мере 5 h) после ранения без значительных Фотообесцвечивание.
Общая схема для приготовления куколки дрозофилы
Рисунок 1 иллюстрирует оптимальный метод для подготовки дрозофилы куколки в vivo изображений. Дрозофилы , собранные белый «prepupae» '0 h» после формирования puparium (АТФ), как обход личинки перестают моторики и принять стереотипных куколки форму с вывернута дыхание придатков (дыхальца) видны в конце их передней большинстве ( Рисунок 1A). Белый 0 h НПФ prepupae разрешается разрабатывать для 18 ч при 25 ° C, когда puparium стал Браун (Рисунок 1B) и которые затем расчлененный с помощью тонкой щипцами или microscissors (рис. 1 c, чтобы удалить защитный куколки) выявить оптически прозрачный куколки внутри (рис. 1 d). После вскрытия куколки крылья будут видны на боковых гранях куколки грудной клетки (изложенные в синем, Рисунок 1 c-D). На данном этапе другие части тела куколки также легко заметной, включая глаз, ног и живота (помечены в Рисунок 1 d). Ноги также подходят для исследования воспаление раны и может быть ранен, используя тот же метод лазерной, описанных выше. Несколько 18 h НФА куколки могут быть установлены одновременно в пределах изображений блюдо (Рисунок 1E, используя Гептан клей и водянистыми фильтровальная бумага для сведения к минимуму обезвоживания) с плоской части крыла (изложил голубой) при контакте с coverslip ( Рисунок 1F); Это особенно выгодно, если изображения микроскопа оснащены моторизованного столика разрешить несколько куколок быть записаны во время одного периода одного изображения. Куколок, которые были повреждены во время вскрытия или монтажа должны быть отброшены (например куколки находится третий в последовательности, стрелка в Рисунок 1E). Другие части тела (например глаза и ноги, изложенные розовый) могут также связаться с coverslip и доступны для ранения и последующей обработки изображений (рис. 1F). Для экспериментов, изучение одной раны лазерно индуцированным убытков являются обычно лучше всего нанес централизованно в крыло (звездочка, Рисунок 1F), хотя других местах может быть использован, если множественные раны должны быть изучены.
Стерильные ранив активирует надежные воспалительной реакции в куколки крыло дрозофилы
Для того, чтобы следовать ремонт раны и сопровождающих воспалительной реакции в естественных условиях, раненых крыльев 18 h НФА дрозофилы куколок были образы с помощью покадровой confocal микроскопии (рисунок 2A-H). На этой стадии куколки крыло эпителия, простые плоские листы клеток (помечены здесь, с помощью GFP-меткой E-Кадгерины для обозначения границ отдельных клеток, крыло маржа изложенные в рисунке 2A). Даже в разматывать крылья (низкий масштаб, рисунки 2A и 2A'), большое количество мигрирующих innate иммунных клеток (hemocytes, помечены с помощью srp-Gal4 основе цитоплазмы GFP, зеленый и ядерной ППП, пурпурный) находятся в пределах (гемолимфа насекомых крови) промежуточные внеклеточное пространство (рисунок 2A и 2A'). Лазерно индуцированным повреждения эпителия куколки крыла (рана маржа, изложенные в белом, Рисунок 2B-D) стимулирует быстрой миграции hemocytes к месту раны (Рисунок 2B-D и иммунных клеток ядра в Рисунок 2B '-D'). Маркировки hemocytes с обоими ядерной маркер (например ядерных ППП «красно жало») в сочетании с цитоплазматических или цитоскелета маркер (например цитоплазматических GFP или GFP-меткой Moesin) является особенно выгодным, поскольку она позволяет одновременное отслеживание кровяные ядра (для автоматизированного анализа кровяные поведение например скорость миграции и направленности) и визуализация кровяные морфологии. Последний имеет важное значение, поскольку она позволяет нам определить, ли hemocytes phagocytosing некротических мусора (рис. 2 c, вставка) в края раны (или микробов в случае инфекции)12,23 , а также позволяет нам следовать их выступающем поведение как они расширяют тонкой filopodia или lamellipodia на их передовые, как они мигрируют к или от раны.
Простое отслеживание кровяные ядерной траекторий с использованием соответствующего программного обеспечения анализа изображений32 (Таблица материалов) демонстрирует сложной пространственно временной динамики воспалительной реакции, подобно тому, как сообщалось ранее, для ранен эмбрионов9,36 (разноцветных дорожек, рис. 2 c' и D'). В течение всего 30 мин ранения, hemocytes, расположенный ближе всего к месту травмы режиссер перехода к ране (рис. 2 c'). Однако, с увеличением времени после травмы, hemocytes, постепенно расположен далее вдали от места повреждения также начать режиссер миграции к ране (Рисунок 2D'). Таким образом наблюдается «волна» оперативность иммунных клеток, что распространяется наружу от края раны, которые мы предполагаем, чтобы отразить диффузии хемотаксического рану от места повреждения. Эти динамики пространственно временных иммунных клеток условии полезной отправной точкой для нашего недавнего исследования, которые используются сложные математического моделирования («выводы Байеза») анализ вывести Роман свойства рану аттрактанта сигнала (подробные методы Опубликовано в23). По калибровке наши вычислительные модели (которые связаны градиент аттрактанта рану кровяные предвзятости) с учетом наблюдаемых в естественных условиях иммунные траекторий, один может извлечь подробные характеристики приманки рану от нашего кровяные траектории данные (например, уровень распространения сигнала, источник и продолжительность сигнала производства)23.
Кроме того при движении выражение photoconvertible Флюорофор Kaede в пределах линии иммунных клеток, используя srp-Gal4 (зеленый, Рисунок-2E) мы также имели возможность выборочно ярлык субпопуляция этих миграционных крыла hemocytes (такие, как тех, кто нанят к месту раны; E, перед УФ индуцированной photoconversion и F, пост photoconversion). Мы можем следовать поведение этих hemocytes, со временем (пурпурный, Рисунок 2 g-H) как они разрешения от сайта раны (стрелки, Рисунок 2 g и H) и сравнить, как их поведение отличается от этих не photoconverted клетки, которые не доходят до места повреждения. Мы использовали это в естественных условиях маркировки технику для демонстрации, что hemocytes, набранных к первоначальной раны временно десенсибилизированные второй ране, созданный 90 минут позже23, хотя этот метод дифференциальной маркировки может также у многих других глубокий приложений в будущем (см. обсуждение).
Используя этот подход, мы можем также одновременно следить за пространственно временной динамики ремонта раны или ты epithelialisation' (Рисунок 2B-D). Здесь повсеместно выразил GFP-меткой E-Кадгерины этикетки сотовой adherens развязок по всей крыло эпителия и позволяет формы отдельных эпителиальных клеток для подражания со временем. Края раны легко идентифицируется как стыке нетронутыми GFP-меченых эпителиальных клеток и непомеченного мусора (белая пунктирная линия, Рисунок 2B-D). Для большинства из раны рана начинает повторно epithelialize в течение 1 ч травмы и внутрь достижения края раны (Рисунок 2D); раны этот размер будет обычно заживают в течение 2-3 ч травмы23. Закрытие раны в эмбрионов и куколки управляется сократительной кабеля actomyosin вместе с переднего края актин богатых filopodia23,37; Эти цитоскелета динамики могут быть визуализированы непосредственно во время ремонта раны, используя соответствующие в vivo репортеров, например GFP-тегами спагетти сквош (регулирования легкие цепи миозина) или GFP-тегами привязки актина Moesin23. Для некоторых особенно большие раны однако, не сохраняются actomyosin кабель и передовая filopodia - эти раны становятся «хронических» и повторно epithelialize никогда не полностью23 даже после длительных периодов (более 24 часов) в естественных условиях обработки изображений. Интересно, что воспалительной реакции, связанные с этими незаживающие раны заметно отличается от связанных с обычной острой раны23 предполагая, что поведение ненормальным иммунных клеток может быть полезным прогностическим маркером в клинике . В будущем далее в естественных условиях анализ хронических ран, с использованием долгосрочное изображений (более 24 ч) в куколки модели может обеспечить важные механистический понимание этой изнурительной условии.
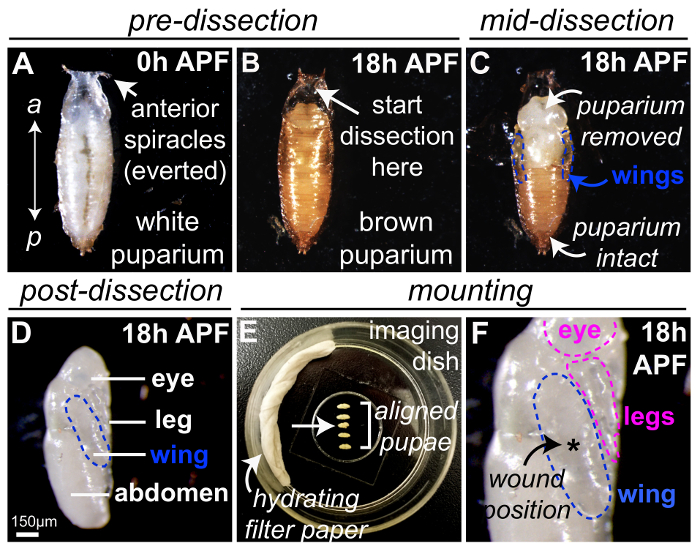
Рисунок 1: Дрозофилы куколки подготовка ранения и жить изображений. (A) дрозофилы белый prepupae собраны в 0 ч НФА, с переднего конца указал на вывернутых дыхание придатков (дыхальца). (B) после поднятия белая 0 h APF-фильтр prepupae для 18 ч при 25 ° C, puparium появляется коричневый. Рассечение куколки дела должно начинаться на передней большинстве региона (стрелка), обозначается everted дыхальца, как куколка надлежащего отсутствует из этого региона и тонкой щипцами или microscissors используется для удаления защитный куколки (C). Куколки крылья будут видны на боковых гранях куколки грудной клетки (синий контуров). (D) куколки дело полностью удалено из 18 h НФА куколки, здесь куколки была развернута 90 ° для отображения боковой, с крылом к записи образа в голубой. (E-F) Пяти 18h НФА куколок монтируется на coverslip стекла внутри изображений блюдо с помощью клея Гептан, с водянистыми фильтровальная бумага для сведения к минимуму обезвоживания (E). Куколки находится третий в последовательности (стрелка) должны быть отброшены как повреждение произошло во время подготовки. Куколки монтируются с плоской части крыла (изложил голубой) при контакте с coverslip (F) и лазерно индуцированным раны создаются централизованно в крыло (звездочка, F), хотя других местах может быть использован, если множественные раны чтобы быть изучены. Изображения в (D) адаптирована с разрешения ткачей et al., 201623. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
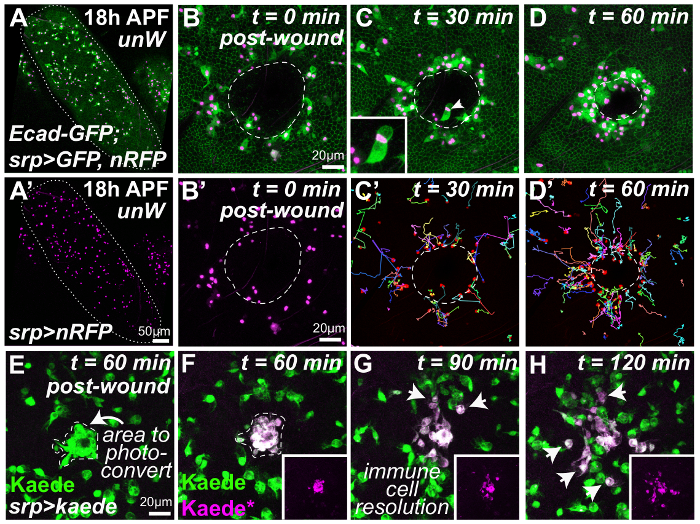
Рисунок 2: Динамические в естественных условиях анализ воспалительной реакции на повреждение тканей. Куколки расчлененный от защитного куколки случаев и смонтирован на стекло coverslip (A) являются ранен и впоследствии образы с помощью конфокальной микроскопии промежуток времени (B-H). Низкий масштаб представления разматывать куколки крыла (A, крыло маржа, изложенные в белой), содержащий большое количество мигрирующих hemocytes (A'). Лазерно индуцированным повреждения эпителия куколки крыла (B-D, границы ячейки помечены с помощью GFP-тегами дрозофилы E-Кадгерины; раны маржа, изложенные в белом) активирует быстрого воспалительной реакции с миграцией нескольких hemocytes ( ПСП Gal4 инициативе выражение ядерной ППП, пурпурного и цитоплазматических GFP, зеленый) к месту раны (B-D; представитель кадры из покадровой фильм, в котором каждый кадр является проекцией 25 фрагменты 3 мкм). Ручного отслеживания траекторий кровяные (разноцветные треков, C' и D') свидетельствуют о сложных пространственно временной динамики воспалительной реакции, аналогичные сообщения для раненых эмбрионов. Hemocytes также фагоцитировать некротические сотовой мусора на месте раны (стрелки, C а также вставкой). Выражение photoconvertible Флюорофор Kaede в линии иммунных клеток (зеленый, E, используя srp-Gal4) позволяет рану на работу hemocytes (стрелка, E) дифференциально помечены (пурпурный, F) и затем со временем как они решить от места повреждения (стрелки, G и H). Были использованы следующие куколки генотипов: w1118(A-D); ubi де cad-GFP, srp-Gal4 > UAS-GFP(II); UAS-nRFP(III) и (E-H) w1118; srp-Gal4(II); UAS-Kaede(III). Изображений, адаптированных с разрешения ткачей et al., 201623. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Острой воспалительной реакции на повреждение тканей является сложным и весьма динамичный процесс, который необходим для ремонта поврежденных тканей, включая разминирование некротические мусора и борьбе против инфекции. Чтобы полностью понять и разгадать фундаментальные аспекты этого ответа, важно, что исследования, выполненные в естественных условиях на 3-мерной живых образцов в порядке для точное поведение и взаимодействие различных мобильных линий для подражания точно с течением времени. В реальном времени анализ динамики этих клеток позволяет более подробная характеристика мутантов фенотипов чем статические единого времени очки от фиксированной образцов с помощью методов классической иммуногистохимия. Традиционно большинство исследований жить изображений с использованием генетически шансов справиться с возникающими дрозофилы модели использовали эмбриональной стадии развития м благодаря своей оптической прозрачности и неподвижность, по сравнению с более поздней стадии развития4 , 5. Однако совсем недавно наша группа и другие разработали дрозофилы куколки как модель Роман высокого разрешения и долгосрочное изображений ремонта раны и воспаления одновременно выполнять в vivo8,22 ,23. Этот формирующийся подход предлагает захватывающие долгосрочный потенциал для разгадке фундаментальные аспекты поведения воспалительных клеток и может быть далее адаптирована к исследовать динамическое поведение других линий клеток (например, адипоциты дрозофилы 38) после повреждения тканей.
Существует ряд важных факторов в процессе подготовки и изображения раненых дрозофилы куколок, которые будут определять качество визуализации результатов, описанных выше. Возможно самый трудный шаг описан протокола является тщательное вскрытие и точного позиционирования куколки до ранения и томографии. Куколки на этой стадии развития чрезвычайно хрупки и даже незначительные случайного повреждения куколки в ходе подготовки этапов будет значительно ухудшить эксперимент; куколок, которые могут непреднамеренного повреждения должно быть отброшено из эксперимента, так как этот ущерб может активировать свой собственный воспалительной реакции, которая может привести к более широкое распространение (или даже системных) воздействие на воспалительные клетки поведение других куколки. Из-за продолжающегося развития куколок, используемых в этих экспериментах (которые переживают значительные ткани перестановок для подготовки тканей взрослой жизни) иногда куколок будет двигаться в течение изображений. Куколки прокатки является, однако, более вероятно, если куколки не установлены правильно с плоской поверхности крыла (или других тканей к записи образа) в прямой контакт с coverglass; Использование гептана клея для стабилизации куколок на Стекло покровное следует свести к минимуму это нежелательные движения. По этой причине необходимо также быть осторожность во избежание выбивании куколки от их тщательно выровненных позиций при перемещении образцов между Микроскопы; в идеале ранив лазер будет придаваться же Микроскоп, чтобы использоваться для последующих покадровой изображений и фото преобразования.
В дополнение к квалификации куколки диссекции и монтажа шаги точное генотип дрозофилы куколки используется будет иметь значительное влияние на качество визуализации данных, полученных. Например количество копий Gal4 водителя и UAS конструкций (например UAS-GFP или UAS-Каэдэ) в рамках отдельных куколки генотип будет определять отношение сигнал шум во время последующей обработки изображений. Как правило больше копий Gal4 или UAS построить настоящее время, тем больше общий уровень флуоресцентный белок (например GFP или Каэдэ) в ткани. Оптимальный уровень флуоресцентный белок однако, будет разумный баланс между подъемным флуоресценции ткани достаточно, чтобы обеспечить высокое качество изображения (Включение использования полномочий нижней лазер, снижение Фотообесцвечивание и изображений в течение длительного времени периоды), но не причинив Флюорофор индуцированной сотовой токсичности; оптимальное количество конструкции Gal4 и UAS в каждом эксперименте будет зависеть от конкретного драйвера и флуорофоров используется. Осторожность следует поднять куколок при 25 ° C (или выше, до 29 ° C), потому что Gal4-Уан система чувствительна к температуре и будет неэффективной при более низких температурах31. Для достижения дополнительных уровней контроля над ткани или время специфика Gal4 -driven выражение, репрессор системы Gal4-Уан Gal80 также могут быть включены внутри куколки генотип39. Gal80 может быть использован для подавления Gal4 деятельность в рамках конкретной ткани (с использованием Gal80 ткани специфические) или в определенное время (с помощью температуры чувствительных Gal80). Системы Gal4-Уан далее сочетаться с другими независимыми бинарных системах (например QF -QUAS систем и LexA -lexAop ) для создания дрозофилы , который имеет несколько конструкций (например флуорофоров, RNAi линии или другие генетические конструкции) одновременно выразили в диапазоне различных тканей39.
Использование этой новой модели куколки дрозофилы предлагает целый ряд преимуществ над более традиционный подход эмбриона. По сравнению с краткосрочными изображений (до 3 ч) в стадии 15 эмбрионов (той стадии, на которой наиболее эмбриональных, ранив исследования выполняются), куколок может отражаться за значительно более длительных периодов времени (в основном до совершеннолетия после 96 h куколки развития ). Кроме того, гораздо большее число hemocytes (дрозофила врожденные иммунные клетки), присутствующих в куколки ткани (и для изображений) по сравнению с более ограниченного числа в эмбрион и это позволило нам собрать значительно больше визуализации данных на кровяные поведение с помощью же общее количество образцов. Самое главное это, в свою очередь, позволило нам применять более сложные математического моделирования для анализа поведения hemocytes и экстракт новизну рану аттрактанты и воспалительной реакции, которая в противном случае остались бы экспериментально недоступные23. Еще одно преимущество куколки модели — это значительно более эффективным, чем что нокдаун гена, опосредованного системой РНК-интерференции на ранее эмбриональных стадиях, позволяя улучшение анализа тканей или инактивации гена конкретных по срокам с помощью бинарных систем таких, как система Gal4-бас 39. эффективность RNAi на данном этапе таким образом открывает потенциал для выполнения больших масштабах (или даже беспристрастные геном wide) RNAi экранов для поиска новых игроков, участвующих в рану ремонт или воспалительных клеток поведение.
Однако, дрозофилы куколок явно не может использоваться для изучения фенотипов, результате генетических мутаций, которые находятся в зачаточном состоянии летально; функциональные и жить томографии исследования генов, которые необходимы для эмбрионального развития таким образом, по-прежнему должны выполняться в эмбрионов, если нокдаун гена, опосредованного системой РНК-интерференции в времени или ткани конкретным образом допускает развитие происходит через стадии куколки. Эмбрион также остается модель выбора учиться и жить изображения некоторые особенности поведения иммунных клеток, в том числе развития разгон иммунных клеток от их происхождения, контакт ингибирование локомоции и фагоцитоз apoptotic трупов созданные во время развития тканей, скульптура8 5,, который еще не наблюдалось в куколки моделей. Хотя исследования у дрозофилы личинок и взрослых предоставили важную информацию в механизмы, лежащие в основе рану воспаления и ремонт40,,4142,43, 44 жить изображений исследования на этих этапах доказали трудным из-за имманентно мобильный характер образцы. Пока личинки могут под наркозом разрешить краткие периоды live-образов, из-за временного характера анестезии, ремонт только короткие снимки живой раны или воспалительной реакции может быть визуализирован45. Недавнее исследование разработал Улучшенный протокол, который позволяет долгосрочных изображений личиночной ранозаживляющее46, хотя подготовка и изображений по-прежнему остаются значительно более сложной, чем в эмбрионов или куколок. В долгосрочной перспективе мы предполагаем, что, используя наиболее подходящие стадии развития каждый конкретный вопрос, исследования во всех четырех этих различных этапов дрозофилы - от эмбрионов через личинки и куколки периодов до совершеннолетия (каждый с свои уникальные преимущества и ограничения) - будет предоставлять дополнительные идеи в молекулярный и клеточный механизм вождения ремонта раны и воспаления.
В будущем этот протокол для ранения и долгосрочное изображений дрозофилы куколок может быть легко адаптирована для изучения ряда явлений, связанных с воспаление и имеет далеко идущие потенциал для выявления роман функций воспалительных рану ответа. Сочетание долгосрочное изображений, наряду с применением photoconvertible флуорофоров (например Каэдэ), имеют большое значение для понимания динамики поведения innate иммунных клеток и в частности, гораздо менее понимает резолюции фазы воспалительный процесс заживления. По специально маркировки или отдельных субпопуляций иммунокомпетентных клеток (например, тех набранных на рану) это можно будет проанализировать, как подверженность одной экологической cue (например, труп или травмы) влияет на последующий ответ иммунной клетки на более позднем Кий. Воспалительные поведение Drosophila hemocytes может быть изменено, предыдущий опыт - например, они нацелены реагировать повреждения тканей путем предварительного фагоцитоз apoptotic трупов во время развития12 , но это еще предстоит увидеть ли другие экологические сигналы вызвать аналогичные события грунтовки. Хотя исследования куколки ран до настоящего времени были сосредоточены на врожденный воспалительной реакции, куколки крыла модель также обеспечивает идеальную возможность для обоих live образ и вскрыть механизмы, лежащие в основе эпителиальных рану ремонт. Кроме того этот метод куколки изображений также могут быть адаптированы к расследованию динамическое поведение других линий клеток в ответ на ткани ущерб38, либо в куколки крыло сам или другие легкодоступные куколки ткани (например, глаз, ног или грудной клетки). Наконец путем сочетания генетических уступчивость дрозофилы вместе с легкостью долгосрочных куколки изображений, Роман эпителиальных ремонт или воспалительных регуляторы могут быть обнаружены путем применения беспристрастной генома общесистемной НОК Даун подходы.
Раскрытие информации
Авторы заявляют, что они имеют не конкурирующие конфликты интересов.
Благодарности
Мы хотели бы поблагодарить членов Мартин, Nobes, Ричардсон и древесины labs за полезной дискуссии. Мы также благодарим Фондом Bioimaging Вольфсон (Бристольский университет, Великобритания), Блумингтон фондовой центр (Университет Индианы, США) и Вене дрозофилы ресурсный центр (для дрозофилы запасов) и Flybase (для до даты дрозофилы гена аннотации). Эта работа была поддержана грантом проекта MRC до вечера и W.W. (MR/J002577/1), стипендию доверять старшим Уэллком W.W. и Добро пожаловать доверять награду следователя до вечера.
Материалы
| Name | Company | Catalog Number | Comments |
| Drosophila stocks | |||
| ubiquitous GFP-tagged E-cadherin ;Ubi-p63E-shg.GFP; (chrII) | Kyoto Stock Center, DGRC | #109007 | Ubi-p63E promoter sequences drive expression of Drosophila E-cadherin (shotgun) tagged at the C-terminal end with GFP. |
| ubiquitous GFP-tagged E-cadherin ;;Ubi-p63E-shg.GFP (III) | Bloomington Drosophila Stock Centre (Indiana University) | #58742 | Ubi-p63E promoter sequences drive expression of Drosophila E-cadherin (shotgun) tagged at the C-terminal end with GFP. |
| ubiquitous GFP-tagged Moesin P{sGMCA}3.1 | Bloomington Drosophila Stock Centre (Indiana University) | #59023 | The ubiquitously expressed sqh promoter/enhancer drives expression of a fragment of Moesin (that includes the actin binding sequences) tagged with GFPS65T. |
| hemocyte specific serpent-Gal4 driver ;srp-Gal4; | Generated by Katja Bruckner | Generated by Katja Bruckner | Expression of Scer\GAL4 fused to a polyA tail is under the control of 2 genomic sequences from upstream of Drosophila serpent. Ref: Brückner, K., Kockel, L., Duchek, P., Luque, C.M., Rørth, P., Perrimon, N. The PDGF/VEGF receptor controls blood cell survival in Drosophila. Dev Cell. 7 (1), 73–84, doi: 10.1016/j.devcel.2004.06.007 (2004). |
| UAS-nuclearRFP w1118;;P{UAS-RedStinger}6 | Bloomington Drosophila Stock Centre (Indiana University) | #8545 or #8547 | UAS regulatory sequences drive expression of the DsRed.T4 form of RFP which is tagged at the C-terminal end with a nuclear localisation signal |
| UAS-cytoplasmicGFP ;;P{UAS-GFP.S65T} | Bloomington Drosophila Stock Centre (Indiana University) | Multiple stocks available (e.g. #1522) | Expression of the S65T version of GFP by UAS regulatory sequences; the S65T variant exhibits increased brightness. |
| UAS-photoconvertibleKaede w1118;; P{UAS-Kaede.A}3 | Bloomington Drosophila Stock Centre (Indiana University) | #26161 | Kaede protein emits bright green fluorescence after synthesis, but changes efficiently to a bright stable red fluorescence on irradiation with UV. |
| GFP-tagged spaghetti squash w1118;;P{sqh-GFP.RLC} | Bloomington Drosophila Stock Centre (Indiana University) | #57145 | The sqh coding region, which is tagged at the C-terminal end with a T:Avic\GFPS65T tag, is expressed under the control of the natural sqh promoter. |
| Name | Company | Catalog Number | Comments |
| Ingredients for fly food media | Fly food media is made according to standard procedures (see Greenspan, R. 1997. Fly Pushing: The Theory and Practice of Drosophila Genetics. Cold Spring Harbor Press. 1-191 pp.) | ||
| maize | Wild Oats, Bristol, UK (or equivalent supplier) | Contact supplier direct | organic |
| soya flour | Wild Oats, Bristol, UK (or equivalent supplier) | Contact supplier direct | organic |
| malt extract | Wild Oats, Bristol, UK (or equivalent supplier) | Contact supplier direct | organic |
| molasses | Wild Oats, Bristol, UK (or equivalent supplier) | Contact supplier direct | organic |
| Difco agar | BD Biosciences, Fisher Scientific | DF0142-15-2 | For preparation of fly food |
| Propionic acid | Sigma | 402907 | For preparation of fly food |
| Nipagen | Sigma | 79721 | For preparation of fly food |
| Dried baker's yeast | Redstar, Dutscher Scientific, UK LTD | Redstar, Dutscher Scientific, UK LTD | For preparation of fly food |
| Name | Company | Catalog Number | Comments |
| Sample preparation and mounting | |||
| Parafilm | Sigma | P7793-1EA | For preparation of heptane glue |
| Fine sable paintbrush | Daler-Rowney (or equivalent) | #0 or 1 | |
| Forceps | Fisher Scientific (or Fine Science Tools) | NC9404145 | Dumont #5 |
| Glass bottomed dishes for imaging | MatTek | P35G-0-10-C | We suggest using 35mm petri dishes, with at least a 10mm Microwell, 0.085-0.13mm cover glass, uncoated. Dishes with larger microwells will enable increasing numbers of pupae to be mounted and imaged in a single experiment. |
| Heptane | Sigma | 51730-5ML | For preparation of heptane glue |
| Double sided sticky tape (e.g. Scotch) | Agar Scientific | AGG263 | For preparation of heptane glue |
| 50ml tube (for heptane glue) | Falcon tubes from Fisher Scientific | 14-432-22 | For preparation of heptane glue |
| Glass microscope slides | Agar Scientific | AGL4244 | For dissection of Drosophila pupae |
| Dissecting stereo microscope with brightfield | Leica (or equivalent) | M50 | For dissection of Drosophila pupae |
| Microscissors | John Weiss International | 103123 | Miniature Research Scissors (straight) |
| Name | Company | Catalog Number | Comments |
| Laser ablation and imaging | |||
| Nitogen ablation laser | Spectra-Physics (or Andor equivalent) | Model VSL-337ND-S | For wounding, this should be attached to a widefield imaging system |
| Multilaser confocal laser-scanning microscope (CLSM) | Leica (or equivalent) | TCS AOBS SP8 or SP5-II attached to a Leica DMi8 inverted epifluorescence microscope (or equivalent) | Ideally including a motorised stage for multi-site and 'mosaic' scanning, plus ‘hybrid’ GaAsP detectors (that offer much greater sensitivity and boosting of low signal) |
| Environmental chamber | Life Imaging Services (or equivalent) | "Microscope Temperature Control System" | Attached to Confocal microscope for temperature control during imaging |
| Name | Company | Catalog Number | Comments |
| Image Analysis Software | |||
| FRAP software module | Leica (or equivalent) | CLSM FRAP software module | For performing photoconversion of photoconvertible fluorophores such as Kaede |
| ImageJ (image analysis software) | National Institutes of Health (NIH) | https://imagej.nih.gov/ij/ | Schneider, C.A., Rasband, W.S., Eliceiri, K.W. "NIH Image to ImageJ: 25 years of image analysis". Nature Methods 9, 671-675, 2012. |
| ImageJ plugin "Manual Tracking" | National Institutes of Health (NIH) | https://imagej.net/Manual_Tracking | |
| ImageJ plugin "TrackMate" | ImageJ, NIH | https://imagej.net/TrackMate | Tinevez, JY.; Perry, N. & Schindelin, J. et al. (2016), "TrackMate: An open and extensible platform for single-particle tracking.", Methods 115: 80-90, PMID 27713081 |
| Volocity (high performance 3D imaging software) | Perkin Elmer | Volocity 6.3 | For image analysis |
| IMARIS (image analysis software) | Bitplane | IMARIS for Cell Biologists | For image analysis |
Ссылки
- Eming, S. A., Wynn, T. A., Martin, P. Inflammation and metabolism in tissue repair and regeneration. Science. 356 (6342), 1026-1030 (2017).
- Crusz, S. M., Balkwill, F. R. Inflammation and cancer: advances and new agents. Nature Reviews Clinical Oncology. 12 (10), 584-596 (2015).
- Martin, P., Nunan, R. Cellular and molecular mechanisms of repair in acute and chronic wound healing. British Journal of Dermatology. 173 (2), 370-378 (2015).
- Razzell, W., Wood, W., Martin, P. Swatting flies: modelling wound healing and inflammation in Drosophila. Disease Model and Mechanism. 4 (5), 569-574 (2011).
- Wood, W., Martin, P. Macrophage Functions in Tissue Patterning and Disease: New Insights from the Fly. Development Cell. 40 (3), 221-233 (2017).
- Mohr, S. E., Smith, J. A., Shamu, C. E., Neumüller, R. A., Perrimon, N. RNAi screening comes of age: improved techniques and complementary approaches. Nature Reviews Molecular Cell Biology. 15 (9), 591-600 (2014).
- Muñoz-Soriano, V., López-Domenech, S., Paricio, N. Why mammalian wound-healing researchers may wish to turn to Drosophila as a model. Experimental Dermatology. 23 (8), 538-542 (2014).
- Weavers, H., Wood, W. Creating a Buzz about Macrophages: The Fly as an In Vivo Model for Studying Immune Cell Behavior. Developmental Cell. 38 (2), 129-132 (2016).
- Stramer, B., et al. Live imaging of wound inflammation in Drosophila embryos reveals key roles for small GTPases during in vivo cell migration. Journal of Cell Biology. 168 (4), 567-573 (2005).
- Wood, W., Faria, C., Jacinto, A. Distinct mechanisms regulate hemocyte chemotaxis during development and wound healing in Drosophila melanogaster. Journal of Cell Biolog. 173 (3), 405-416 (2006).
- Razzell, W., Evans, I. R., Martin, P., Wood, W. Calcium flashes orchestrate the wound inflammatory response through DUOX activation and hydrogen peroxide release. Current Biology. 23 (5), 424-429 (2013).
- Weavers, H., Evans, I. R., Martin, P., Wood, W. Corpse Engulfment Generates a Molecular Memory that Primes the Macrophage Inflammatory Response. Cell. , (2016).
- Stramer, B., Winfield, M., Shaw, T., Millard, T. H., Woolner, S., Martin, P. Gene induction following wounding of wild-type versus macrophage-deficient Drosophila embryos. EMBO Reports. 9 (5), 465-471 (2008).
- Matsubayashi, Y., Coulson-Gilmer, C., Millard, T. H. Endocytosis-dependent coordination of multiple actin regulators is required for wound healing. Journal of Cell Bioliogy. 210 (3), 419-433 (2015).
- Evans, I. R., Rodrigues, F. S. L. M., Armitage, E. L., Wood, W. Draper/CED-1 Mediates an Ancient Damage Response to Control Inflammatory Blood Cell Migration In Vivo. Current Biology. 25 (12), 1606-1612 (2015).
- Zanet, J., Stramer, B., Millard, T., Martin, P., Payre, F., Plaza, S. Fascin is required for blood cell migration during Drosophila embryogenesis. Development. 136 (15), 2557-2565 (2009).
- Bainbridge, S. P., Bownes, M. Staging the metamorphosis of Drosophila melanogaster. Journal of Embryology and Experimental Morphology. 66, 57-80 (1981).
- Ninov, N., Martín-Blanco, E. Live imaging of epidermal morphogenesis during the development of the adult abdominal epidermis of Drosophila. Nature Protocols. 2 (12), 3074-3080 (2007).
- Gho, M., Bellaïche, Y., Schweisguth, F. Revisiting the Drosophila microchaete lineage: a novel intrinsically asymmetric cell division generates a glial cell. Development. 126 (16), 3573-3584 (1999).
- Puah, W. C., Wasser, M. Live imaging of muscles in Drosophila metamorphosis: Towards high-throughput gene identification and function analysis. Methods. 96, 103-117 (2016).
- Berh, D., Scherzinger, A., Otto, N., Jiang, X., Klämbt, C., Risse, B. Automatic non-invasive heartbeat quantification of Drosophila pupae. Computers in Biology and Medicine. 93, 189-199 (2018).
- Sander, M., Squarr, A. J., Risse, B., Jiang, X., Bogdan, S. Drosophila pupal macrophages--a versatile tool for combined ex vivo and in vivo imaging of actin dynamics at high resolution. European Journal of Cell Biology. 92 (10-11), 349-354 (2013).
- Weavers, H., Liepe, J., Sim, A., Wood, W., Martin, P., Stumpf, M. P. H. Systems Analysis of the Dynamic Inflammatory Response to Tissue Damage Reveals Spatiotemporal Properties of the Wound Attractant Gradient. Current Biology. 26 (15), 1975-1989 (2016).
- Fristrom, D., Wilcox, M., Fristrom, J. The distribution of PS integrins, laminin A and F-actin during key stages in Drosophila wing development. Development. 117 (2), (1993).
- Brückner, K., Kockel, L., Duchek, P., Luque, C. M., Rørth, P., Perrimon, N. The PDGF/VEGF receptor controls blood cell survival in Drosophila. Development Cell. 7 (1), 73-84 (2004).
- Diehl, H., Ihlefield, H., Schwegler, H. . Physik fur Biologen. , (1991).
- Stewart, P. S., McFeters, G. A., Huang, C. T. Biofilm control by antimicrobial agents. Biofilms II Process Analysis and Application. , 373-405 (2000).
- . Cell Biology by the Numbers Available from: https://books.google.com/books?id=9NPRCgAAQBAJ&pgis=1 (2015)
- Ando, R., Hama, H., Yamamoto-Hino, M., Mizuno, H., Miyawaki, A. An optical marker based on the UV-induced green-to-red photoconversion of a fluorescent protein. Proceeding of National Academy of Science U S A. 99 (20), 12651-12656 (2002).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Tinevez, J. -. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Grueber, W., et al. Projections of Drosophila multidendritic neurons in the central nervous system: links with peripheral dendrite morphology. Development. 134 (1), 55-64 (2007).
- Wood, W., Faria, C., Jacinto, A. Distinct mechanisms regulate hemocyte chemotaxis during development and wound healing in Drosophila melanogaster. Journal of Cell Biology. 173 (3), 405-416 (2006).
- Wood, W., et al. Wound healing recapitulates morphogenesis in Drosophila embryos. Nature Cell Biology. 4 (11), 907-912 (2002).
- Franz, A., Wood, W., Martin, P. Fat Body Cells Are Motile and Actively Migrate to Wounds to Drive Repair and Prevent Infection. Developmetal Cell. 44 (4), 460-470 (2018).
- del Valle Rodríguez, A., Didiano, D., Desplan, C. Power tools for gene expression and clonal analysis in Drosophila. Nature Methods. 9 (1), 47-55 (2012).
- Losick, V. P., Fox, D. T., Spradling, A. C. Polyploidization and Cell Fusion Contribute to Wound Healing in the Adult Drosophila Epithelium. Current Biology. 23 (22), 2224-2232 (2013).
- Babcock, D. T., et al. Circulating blood cells function as a surveillance system for damaged tissue in Drosophila larvae. Proceedings of National Academy of Science U S A. 105 (29), 10017-10022 (2008).
- Galko, M. J., et al. Cellular and Genetic Analysis of Wound Healing in Drosophila Larvae. PLoS Biology. 2 (8), e239 (2004).
- Brock, A. R., et al. Transcriptional regulation of Profilin during wound closure in Drosophila larvae. Journal of Cell Science. 125 (23), (2013).
- Wu, Y., Brock, A. R., Wang, Y., Fujitani, K., Ueda, R., Galko, M. J. A blood-borne PDGF/VEGF-like ligand initiates wound-induced epidermal cell migration in Drosophila larvae. Current Biology. 19 (17), 1473-1477 (2009).
- Burra, S., Wang, Y., Brock, A. R., Galko, M. J. Using Drosophila Larvae to Study Epidermal Wound Closure and Inflammation. Methods in Molecular Biology. 1037, 449-461 (2013).
- Kakanj, P., et al. Insulin and TOR signal in parallel through FOXO and S6K to promote epithelial wound healing. Nature Communications. 7, 12972 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены