Method Article
Дизайн, синтез и фотохимические свойства clickable Caged соединений
В этой статье
Резюме
Представлен протокол синтеза и измерения фотохимических свойств модульных соединений в клетке с помощью кликабельных муати.
Аннотация
Клетки соединений позволяют фото-опосредованные манипуляции физиологии клеток с высоким пространствентемспоральным разрешением. Тем не менее, ограниченное структурное разнообразие имеющихся в настоящее время кэш-групп и трудности в синтетической модификации без ущерба для их фотолиза эффективности являются препятствиями для расширения репертуара клетки соединений для живых клеток Приложений. Поскольку химическая модификация фото-кэширующих групп типа кумарин является перспективным подходом для подготовки клетчатых соединений с разнообразными физическими и химическими свойствами, мы сообщаем о методе синтеза кликабельных соединений, которые могут быть изменены легко с различными функциональными блоками через медь (I)-катализированная циклизация Huisgen. Молекула модульной платформы содержит (6-бромо-7-гидроксикумарин-4-ил) метил (Bhc) группу в качестве фото-группы, которая демонстрирует высокую эффективность фотолиза по сравнению с обычными 2-нитробензилами. Представлены общие процедуры приготовления кликабельных соединений, содержащих амины, спирты и карбоксилаты. Дополнительные свойства, такие как растворимость воды и способность таргетинга клеток, могут быть легко включены в кликабельные соединения в клетке. Кроме того, были измерены физические и фотохимические свойства, включая квантовый выход фотолиза, которые, как было установлено, превосходят соответствующие соединения ВХК. Поэтому описанный протокол можно рассматривать в качестве потенциального решения проблемы отсутствия структурного разнообразия в имеющихся соединениях, содеяненные в клетках.
Введение
Клетчатые соединения предназначены синтетические молекулы, первоначальные функции которых временно маскируются коваренными фото-съемными группами защиты. Интересно, что клетки соединений биологически значимых молекул обеспечивают незаменимый метод для пространственно-временного контроля клеточной физиологии1,2,3,4,5 ,6. В 1977 году Энгельс и Schlaeger сообщили 2-нитробензил эстер CAMP как мембраны проницаемой и фотолабильной производной cAMP7. В следующем году Каплан сообщил 1-(2-нитрофенил) этиловый эфир АТФ (NPE-ATP) и назвал это соединение "клеткой" АТФ8. С тех пор, ряд фотохимически съемных групп защиты, таких как 2-нитробензилы, р-гидроксифенациклы9, 2-(2-нитрофенил) этил10,11, 7-нитроиндолин-1-yls12 , 13, и (кумарин-4-ил) метилов14,15,16 были использованы для подготовки клеточных соединений.
Ожидается, что синтез соединений в клетке с желательными дополнительными свойствами, такими как проницаемость мембраны, растворимость воды и способность клеточного таргетинга, облегчат лечебное биологическое применение. Поскольку физические и фотохимические свойства этих молекул зависят в первую очередь от химической структуры фотохимически съемных защитных групп, используемых для их подготовки, требуется разнообразный репертуар фото-групп. Однако структурное разнообразие имеющихся в настоящее время кэш-групп, демонстрирующих высокую эффективность фотолиза, ограничено. Это может стать препятствием для увеличения использования соединений, налетемых в клетках.
Для решения этой проблемы репертуар фото-групп пополнился химической модификацией существующих фоторедвижутных защитных групп или дизайном новых фотолабильных хромофор с превосходными фотофизическими и фотохимическими свойствами. Примеры включают нитродибензоврана (NDBF)17, No 3-(4,5-диметокси-2-нитрофенил)-2-бутил" (DMNPB)18,19, кальций чувствительных 2-nitrobenzyl фотоклетка20, заменить coumarinylmethyls (DEAC45021 , DEAdcCM22, 7-азетидинил-4-метилкумарин23, и styryl coumarins24), цианина производных (CyEt-пан)25, и БОДИПИ производные26,27.
Кроме того, мы ранее разработали (6-бромо-7-гидроксикумарин-4-ил) метил (Bhc) группы и успешно синтезировали различные клетки соединений нейротрансмиттеров28, второй посланников29,30, и oligonucleotides31,32,33 выставке больших одно- и двухфотонных возбуждения поперечных сечений. Если дополнительные свойства могут быть легко установлены в кэш-группы без ущерба для их фоточувствительности, то репертуар клетчатых соединений может быть расширен34,35,36, 37,38,39. Поэтому мы разработали модульные соединения в клетке, которые состоят из трех частей, а именно группы Bhc в качестве фото-реакционный ядро, химические ручки для установки дополнительных функций, и молекулы, которые должны быть замаскированы40, 41.
Таким образом, данная статья предоставляет практический метод для подготовки клеточных соединений биологически значимых молекул. В настоящем протоколе описываются методы подготовки кликабельной платформы для фото-групп, внедрения дополнительных функций для расширения репертуара соединений в клетке, измерения их физических и фотохимических свойства, и клеточного типа селективного таргетинга кликабельного соединения клетки для дальнейшего применения клеток.
протокол
1. Синтез модульной группы кэширование paBhc для кликабельных соединений в клетке28,41
-
Препарат (6-бромо-7-гидроксикумарин-4-ил) метилхлорид (Bhc-CH2Cl)
- Поместите 4-броморзорцинол (9,742 г, 51,5 ммоль) в колбу с круглым дном 100 мл, оснащенную баром с мешалкой.
- Добавьте conc. H2SO4 (98%, 30 мл) в колбу и перемешайте смесь, чтобы раствориться.
- Добавьте этил 4-хлороацетацетат (10 мл, 74 ммоль) капля.
- Продолжайте перемешивать смесь при температуре окружающей среды в течение 5 дней.
- Отдельно поместите измельченные кубики льда (200 мл) в колбу Erlenmeyer 500 мл.
- Налейте реакционную смесь в лед и энергично перемешайте в течение 30 мин до тех пор, пока не будет получен мелко порошкообразный осадок.
- Соберите осадок с помощью вакуумной фильтрации. Вымойте светло-коричневый осадок водой пять раз.
- Сухой осадок под вакуумом ночь, чтобы дать BhcCH2Cl как светло-коричневый порошок (13,57 г, 46,9 ммоль).
-
Препарат (6-бромо-7-гидроксикумарин-4-ил) метанол (BhcCH2OH)
- Поместите подготовленную bhcCH2Cl (1.1440 г, 3.95 ммоль) и 1 M HCl (300 мл) в колбу с круглым дном 1 л, оснащенную конденсатором Dimroth. Перемешать смесь при 140 градусах по Цельсию в течение 5 дней. После этого времени, охладить смесь до температуры окружающей среды.
- Удалите воду из реакции роторного испарения под вакуумом, чтобы дать BhcCH2OH (1) в виде светло-коричневого порошка (1,0359 г, 3,82 ммоль, 97% урожайности).
ПРИМЕЧАНИЕ: Использование 250 мл 1 М HCl на 1 г BhcCH2Cl дает удовлетворительный результат.
-
Подготовка paBhcCH2OH (2) через реакцию Маннича
- Поместите параформальдегид (446,4 мг, 14,9 ммоль) в колбу с круглым дном 50 мл. Добавьте в колбу анидрационный этанол (5 мл) и N-метилпропаргиламин (1,25 мл, 14,8 ммоль).
- Перемешать смесь при температуре окружающей среды в течение 1 ч под атмосферой Ar.
- Добавьте BhcCH2OH (1) (1.367 г, 5.04 ммоль) в колбу. Нагрейте смесь до 80 градусов по Цельсию с блоком обогревателя аппарата, и продолжать перемешивание смеси при температуре 80 градусов по Цельсию в течение 2 ч под атмосферой Ar.
- Остановите блок нагреватель и охладите реакционную смесь до комнатной температуры.
- Соберите полученный светло-коричневый-желтый осадок путем вакуумной фильтрации. Вымойте осадок дважды с небольшим количеством ангидрационного этанола (1 мл каждый раз).
- Удалите избыток этанола под вакуумом, чтобы дать paBhcCH2OH (2) (1,393 г, 3,96 ммоль).
2. Подготовка кликабельных соединений в клетке
ПРИМЕЧАНИЕ: Следующие процедуры могут быть применены к подготовке других кликабельных соединений, содержащих гидроксила, аминокислоты и карбоксилатфункциональные функциональные группы.
-
Общая процедура 1: Подготовка кликабельного амин в клетке
- Место paBhcCH2OH (2) (709,6 мг, 2,02 ммоль) иN'-карбонил диимидазол (CDI, 397,6 мг, 2,45 ммоль) в колбе с круглым дном 30 мл. Добавьте сухой CH2Cl2 (6 мл) и перемешайте раствор при температуре окружающей среды на 1 ч.
- Добавьте 4-диметиламинопирин (4-DMAP, 324.8 мг, 2.66 ммоль) и терт-бутил(6-аминохэксил)carbamate (533,1 мг, 2,46 ммоль). Перемешать раствор при температуре окружающей среды 3 ч.
- Удалите растворитель и другие летучие материалы с помощью вращающегося испарителя под вакуумом. Очистите остатки непосредственно с помощью кремнезема гель вспышки колонки хроматографии.
-
Общая процедура 2: Подготовка кликабельного алкоголя в клетке
- Место paclitaxel (PTX, 48,7 мг, 0,057 ммоль) в 30 мл круглым дном колбу оснащентрехсторонний стоп-стопкок и Ar воздушный шар. Добавьте сухой CH2Cl2 (1 мл), 4-DMAP (17,1 мг, 0,14 ммоль) и 4-нитрофенил хлороротормат (26,0 мг, 0,13 ммоль).
- Перемешать раствор при температуре окружающей среды в течение 2,5 ч под атмосферой Ar.
- Добавьте в раствор 4-DMAP (15,7 мг, 0,13 ммоль) и paBhcCH2OH (2) (39,1 мг, 0,111 мм). Продолжайте перемешивать смесь при температуре окружающей среды в течение 17 ч.
- Добавьте CHCl3 (10 мл) и 15% aqueous NaHCO3 (5 мл) в смесь. Перемешать смесь энергично в течение примерно 3 мин. Удалите вавочный слой с пипеткой.
- Добавьте 0,5 м лимонной кислоты (5 мл) в колбу, содержащую органический слой. Перемешать смесь и удалить вавный слой, как указано выше.
- Отделите органический слой с помощью столбца фазового разделения. Удалите растворители с помощью роторного испарителя под вакуумом. Очистите продукт с помощью стандартного кремнезема гель вспышки колонки хроматографии.
-
Общая процедура 3: Подготовка кликабельной карбоксиловой кислоты
- Растворите арахидоновой кислоты (33,0 л, 0,100 ммоль), paBhcCH2OH(2)(39,6 мг, 0,112 ммл) и 4-DMAP (14,1 мг, 0,115 ммоль) в сухом CH2Cl2 (2 мл). Добавить N,НЗ-diisopropylcarbodiimide (DIPC, 17,0 л, 0,110 ммоль) и перемешать раствор при температуре окружающей среды в течение 140 мин.
- Удалите растворитель под вакуумом. Очистите остатки непосредственно с помощью кремнезема гель вспышки колонки хроматографии.
3. Установка функционального блока в кликабельные соединения в клетке
- Растворите медь (II) сульфат пентагидрат (249 мг) в ионно-обменной воде (IEW, 10 мл), чтобы дать раствор 0,1 M CuSO4.
- Растворите 2-paBhcmoc-PTX (8,0 мг, 6,5 мкм), трис (3-гидроксипропилтриазолметилметил) амин (THPTA, 17,5 мг, 40,3 моль), натрий l-аскорбат (162,4 мг, 0,825 ммоль) и 15-хлоро-3,6,9-триоксапентадецил азид (3,1 мг, 11 мкм) в смешанном растворителе 0,1 М фосфата буфер (2,5 мл, рН 7,2) и диметилсульфод (DMSO, 0,5 мл).
- Добавьте раствор 0.1 M CuSO4 (81,2 л, 8,1 моль) в реакционную смесь. Перемешать смесь при температуре окружающей среды в течение 80 мин. Следите за ходом реакции с помощью высокопроизводительной жидкой хроматографии (HPLC).
- Растворите осадки, добавив 75% ацетонитрила/водного раствора (3,5 мл). Применить полученный раствор непосредственно к полу-преготовительной системе HPLC для очистки желаемого продукта.
ПРИМЕЧАНИЕ: Растворить реакционную смесь путем добавления терта-бутанола может ускорить прогрессирование реакции.
4. Фотолитический неприкрытый состав соединений, накопивемых в клетке
- Подготовка биржевых решений
- Растворите желаемое соединение в клетке (5 моль) в DMSO (500 мл), чтобы подготовить раствор запаса 10 мМ. Распределите аликвот каждого раствора (10 л) в микроцентрифугную трубку мощностью 1,5 мл и храните в морозильной камере (20 градусов по Цельсию) до непосредственно перед использованием.
- 6 мМК K3(C2O4)3( 100 мл): Растворите рекристаллизованный калиоксалат калиоксалат (0,295 г, 0,675 ммоль) в 80 мл воды. Добавьте 0,5 МН2SO4 (10 мл) и соответствующее количество IEW, чтобы составить объем до 100 мл.
ПРИМЕЧАНИЕ: Хорриоксалат калия следует очищать путем рекристаллизации из горячей воды и хранить в темноте. Рекристаллизованный ферриоксалат калия получается в качестве тригидрата; Таким образом, его формула K3(C2O4)3Х3H2O и вес формулы 491.24 должны быть рассмотрены при подготовке акционерного решения. Проверьте чистоту раствора 6 мМ, измерив его абсорбцию на уровне 510 нм. Если абсорбция составляет 0,02 евро, она подходит для использования в эксперименте. - 0,1% Буфер-фен (30 мл): Растворите NaOAc-3H2O (7,35 г), 1,10-фенантропин (фен) H2O (30 мг) и conc. H2SO4 (0,9 мл) в IEW (20 мл). Добавьте IEW, чтобы составить объем до 30 мл.
ПРИМЕЧАНИЕ: Решение содержит 1,8 М NaOAc, 0,54 МН2SO4,и 0,1% 1,10-фенанхролин.
- Измерение количества фотонов с помощью актинометрии ферриоксалата
- Поместите 6 мМ К3(C2O4)3(V1 L) в кварцевом кювете. Обывать раствор 350 нм света на 5 с.
- Перенесите облученный раствор в кювет Pyrex с длиной пути l.cm.
- Добавьте 0,1% Буфер-фен(V2 L) в облученный образец раствора и хорошо перемешайте путем пипетки. Измерьте абсорбцию образца на уровне 510 нм. Рассчитайте среднее изменение поглощения на единицу времени(No 510 no1).
- Рассчитайте количество родинок генерируемых ионов Fe2 "на единицу времени в соответствии со следующим уравнением:
nFe 2"мол с1"((V1 q V2) »L» » » » »510 »s 1»/(l »см»
где(V1 и V2) - это объем образца для измерения поглощения, л - оптическая длина пути кветки, а No510 - молярная абсорбция Fe 2" фен-комплекс на 510 нм.
ПРИМЕЧАНИЕ: В типичных экспериментальных условиях, значения V1 2,0 и 10 х3 л, V2 0,33 й 10й3 L, л 1,0 см, иNo 510 смNo1 были использованы. - Рассчитайте количество родинок фотонов, достигающих образца(I0)с помощью следующей формулы:
Я0 (Эйнштейн см)No2 сNo1- nFe2 /350 евро
где 350 является квантовой эффективности фотоreduction ферриоксалата на 350 нм.
ПРИМЕЧАНИЕ: Хотя квантовая эффективность актинометра термокисла калия на 350 нм не сообщается, сообщили значение 1,2542 на 358 нм был использован.
- Измерения квантовой эффективности на 350 нм
- Разбавить образец запасного раствора (в DMSO, 10 л) с буфером K-MOPS (pH 7.2, 10 мл), чтобы дать раствор 10 мкм в K-MOPS, содержащий 0,1% DMSO.
ПРИМЕЧАНИЕ: K-MOPS буфер состоял из 100 мм KCl и10 мМ 3-(N-morpholino)пропанесульфоновой кислоты (Mops) тистрированный рН 7.2 с KOH. - Перенесите аликот раствора(V1 L) в тот же кювет, используемый в фотореакции химического актинометра. Излучайте выборку решения, используя ту же установку, что и описано в шаге 4.2.1.
- Периодически удаляйте аликот (50 qL) из облученного раствора и проанализируйте с помощью HPLC.
- Определите время облучения, в секундах, в которых 90% исходного материала отреагировали(t90%)путем установки участков зависящих от времени исчезновения исходного материала.
ПРИМЕЧАНИЕ: Поглощение облученного образца должно поддерживаться на уровне 0,0,1, чтобы внутренняя фильтрация излучения была проигнорирована. Хочется, чтобы фотолитическое потребление исходного материала можно было приблизить к одноэкспоненциальному распаду, чтобы не было нежелательного вторичного эффекта, который мешал бы процессу фотолиза. - Рассчитайте квантовую доходность исчезновения (-dis) с помощью следующего уравнения28:
Nodis 1/(т90%
где t90% s – это время облучения, в котором было употреблено 90% исходного материала, я0 »Эйнштейн см 2 см no1» — это количество родинок фотонов, и350 см. 2 молNo 1- это декадический коэффициент вымирания образца на уровне 350 нм.
ПРИМЕЧАНИЕ: 350 йсм2 молno 1- 103350 М1 см.
- Разбавить образец запасного раствора (в DMSO, 10 л) с буфером K-MOPS (pH 7.2, 10 мл), чтобы дать раствор 10 мкм в K-MOPS, содержащий 0,1% DMSO.
5. Нацеливание на кликабельное соединение в клетке с помощью лиганда HaloTag
ПРИМЕЧАНИЕ: До использования, поддерживать клетки HeLa в Dulbecco в модифицированной среде Eagle (DMEM, низкий уровень глюкозы, пируват натрия, l-глютамин) дополнен 10% фетальной сыворотки крупного рогатого скота (FBS), содержащие 1% антибиотиков (стрептомицин сульфат, пенициллин G, и амфотерицин) на 37 кс и 5% CO2.
- Удалите среду и trypsinize клеток путем лечения с трипсин-этилендениемиаминтетраацетической кислоты (ЭДТА, 1 мл) при 37 кв С в течение 1 мин. Добавить DMEM (4 мл) в клетки и повторно приостановить клетки пайпеттинг мягко. Семя примерно 5 и 105 ячеек на блюдо в 35 мм стеклянные блюда нижней в DMEM (2 мл) 24 ч до трансфекции.
- Для четырех блюд, в 1,5 мл микроцентрифуговой трубки, разбавить плазмид ДНК (pcDNA3-Halo-EGFR, 14 мкг) в уменьшенной среде сыворотки (700 л). Отдельно разбавить липофекционный реагент (5 л) в пониженной среде сыворотки (150 л) в каждую из четырех трубок и дать им возможность стоять при температуре окружающей среды в течение 5 минут.
- Добавьте часть разбавленной плазмидной ДНК (150 л) к каждому из разбавленных образцов реагента липотекции. Инкубировать при температуре окружающей среды 5 мин.
- После поддержания клеток на уровне 37 градусов по Цельсию и 5% CO2 на 24 ч, аспирировать DMEM и промыть клетки с фосфат-буфером сольников (PBS, 2 мл). Добавьте пониженную среду сыворотки (1,5 мл).
- Добавьте к каждому блюду комплекс плазмидно-липофэктционного реагента (150 л). Поддерживайте клетки при 37 градусах по Цельсию и 5% CO2 на 48 ч.
- Аспирируй среду, добавляйте порцию свежеприготовленного DMEM (1 мл), содержащую 2 мкм paBhc-hex-FITC/Halo, и инкубировать клетки при 37 градусах Цельсия и 5% CO2 в течение 30 мин.
- Аспирировать среду, содержащую в клетке соединения и промыть клетки в два раза с PBS (1 мл на полоскать), чтобы удалить любые несвязанные соединения. Добавьте пониженную среду сыворотки (500 л) и инкубировать клетки при 37 градусах Цельсия и 5% CO2 в течение 30 минут, чтобы удалить соединения, которые вошли в клетки.
ПРИМЕЧАНИЕ: ПБСЗ является фосфат-буферный солен дополняется 2 мМ CaCl2 и 1 мМ MgCl2. - Удалите среду и промыть клетки дважды с помощью PBS (1 мл). Добавьте часть среды (1 мл), которая не содержит фенола красного цвета. Запись флуоресценции изображения лазерного сканирования конфокальной флуоресценции микроскопии.
6. Фотопосредованный модуляция локализации киназы с использованием кликабельного соединения в клетке
ПРИМЕЧАНИЕ: Перед использованием, поддерживать CHO-K1 клетки в фарме F-12 ветчины дополнены 10% FBS при 37 C и 5% CO2.
- Подготовьте рабочее решение на 100 см (1 мМ) paBhc-AA(5)в DMSO.
ПРИМЕЧАНИЕ: 10 мМ бульонный раствор соединения готовится и хранится в морозильной камере (-20 градусов по Цельсию). - Семя примерно 5 и 105 ячеек на блюдо в 35 мм стеклянные блюда нижней в DMEM (2 мл) 24 ч до трансфекции.
- Трансфектные клетки CHO-K1 с плазмидным кодированием для GFP-DGK 48 h перед невыяснениями экспериментов.
ПРИМЕЧАНИЕ: Трансфекция выполняется в соответствии с шагами 5.2-5.5. - Замените среду уменьшенной сывороткой (2 мл). Добавьте рабочее решение 100 paBhc-AA (20 л) и инкубифицировать клетки при 37 градусах Цельсия и 5% CO2 в течение 5 мин и 1 ч.
ПРИМЕЧАНИЕ: Время загрузки зависит от используемого соединения. - Поместите клетки на объективную стадию перевернутого флуоресцентного микроскопа, оснащенного двойным светомоторным флуоресцентным иллюминатором.
- Возьмите флуоресцентное изображение каждые 10 с. Облучите клетки 330-385 нм света через микроскоп цели в течение соответствующего времени. Кроме того, облучать клетки с 405 нм света с помощью лампы Xe через гибкие кварцевые волокна.
- Продолжайте записывать флуоресцентные изображения в течение 10 мин.
Результаты
Кликабельные клетки соединений некоторых биологически интересных молекул, в том числе арахидоновой кислоты и паклитакселя, были успешно синтезированы(Рисунок 1)28,41. Дополнительные свойства, такие как растворимость воды и клеточной способности ориентации были введены в paBhcmoc-PTX через медь (I)-катализированная циклизация Huisgen ("Нажмите" реакция) (Рисунок 2). Эти кликабельные клетки PTXs были затем photolyzed производить их родителей PTXs при облучении на 350 нм (Рисунок 3), и физические и фотохимические свойства кликабельных соединений клетке суммируются в таблице 1. Квантовые урожаи кликабельных соединений в клетке 2'-glc-paBhcmoc-PTX(Nodis 0.14) и paBhc-AA(Nodis 0.083) были более чем в два раза выше, чем у обычных соединений Bhc в клетке 2'-Bhcmoc-PTX( 0.040) и Bhc-AA(Nodis 0.038)43. Кроме того, улучшение растворимости воды наблюдалось в течение 2-глк-paBhcmoc-PTX, который содержит глюкозу moiety.
В экспериментах с живыми клетками, ориентация paBhc-hex-FITC/Halo к культивированным клеткам млекопитающих преходяще выражая протеин сплавливания протеина HaloTag и приемного устройства фактора роста эпидермального (EGFR) была достигнута успешно. Зеленая флуоресценция флуоресценции moiety paBhc-hex-FITC/Halo наблюдалась на клеточной мембране(рисунок 4). Фото-опосредовано модуляция субклеточной локализации киназы была достигнута с помощью paBhc клетке соединения. Сообщается, что транслокация диацилицерол киназы (ДГКЗ) активируется при наличии арахидоновой кислоты (АА)44. Клетки CHO-K1, временно выражающие GFP-DGK, лечились либо АА, либо paBhc-AA(5). Добавление АА вызвало модуляцию субклеточной локализации ДГКЗ(рисунок 5A,B). Аналогичные изменения в локализации ДГКЗ наблюдались в клетках, обработанных paBhc-AA, после воздействия УФ-излучения(рисунок 5C,D).
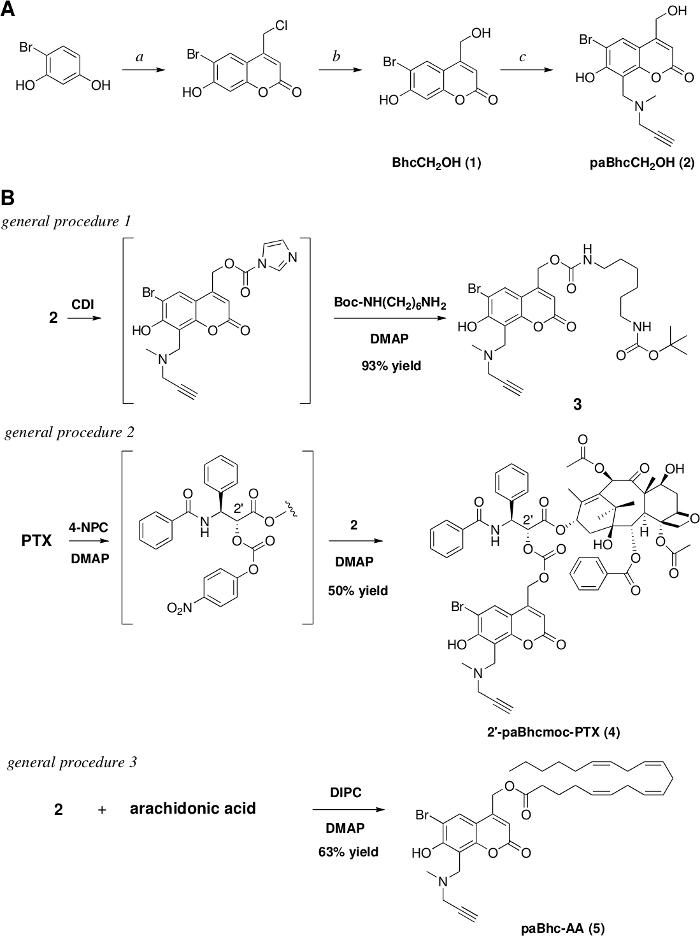
Рисунок 1: Подготовка кликабельных соединений в клетке.
(A) Реагенты и условия: a. этил 4-хлороацетоацетат/конк. H2SO4/rt/7 дней/91% урожайность, b. 1 M HCl/reflux/3 дня/97% урожайность. c. N-метилпропаргиламин /HCHO/EtOH, затем добавить (1) и тепла при рефлюксе для 17 h/79% урожайности. (B) Синтезы кликабельных клетке амина, PTX, и арахидоновой кислоты. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
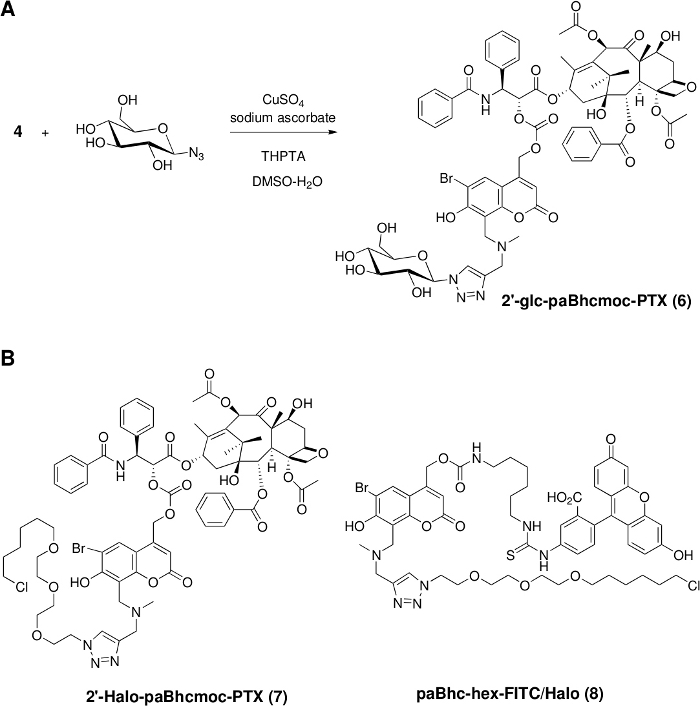
Рисунок 2: Установка функциональных блоков в кликабельные соединения в клетке.
(A) Синтез водорастворимых клетке PTX через медь (I)-катализированный циклизации Huisgen. (B) Структуры кликабельных соединений клетке, содержащей лиганд HaloTag для клеточного таргетинга. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
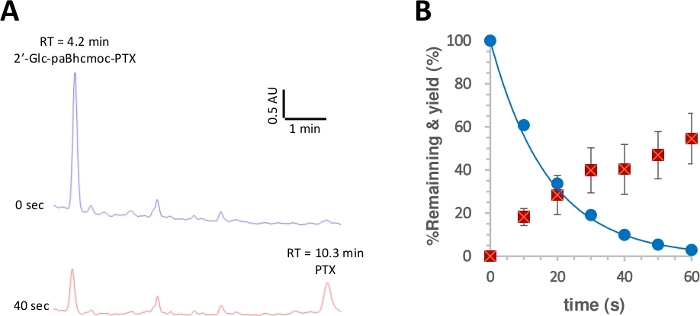
Рисунок 3: Фотолиз 2-glc-paBhcmoc-PTX (6).
Образцы (10 мкм) в растворе K-MOPS (pH 7.2) были облучены на 350 нм. (A) Типичные следы HPLC для фотолизиса 6 (измеряется на 254 нм). Образцы были проанализированы в указанное время облучения. (B) Курс времени для фотолиза 6. Синие круги показывают потребление 6. Твердая линия показывает наименее квадратов кривой подходит для простого распадающихся экспоненциальных для 6. Красные квадраты показывают доходность PTX. Бары ошибок представляют собой стандартное отклонение (SD). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
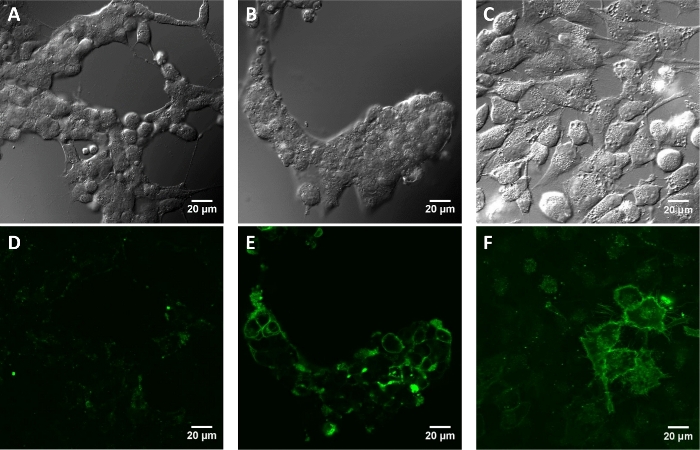
Рисунок 4: Флуоресценция изображения культивированных клеток млекопитающих, инкубированных paBhc-hex-FITC/Halo (8).
Клетки, трансфицированные pcDNA3-Halo-EGFR, были инкубированы раствором 2 мкм соединения 8 при 37 градусах По цельсии в течение 30 мин. Изображения были получены после повторного мытья с помощью PBS. Mock-обработанные клетки HEK293T (A:дифференциальный контраст интерференции (DIC) изображение и D: изображение флуоресценции). HeK293T клетки(B и E)и Клетки HeLa(C и F)преходяще выражая Halo-EGFR (B и Cизображения DIC и E и F: изображения флуоресценции). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
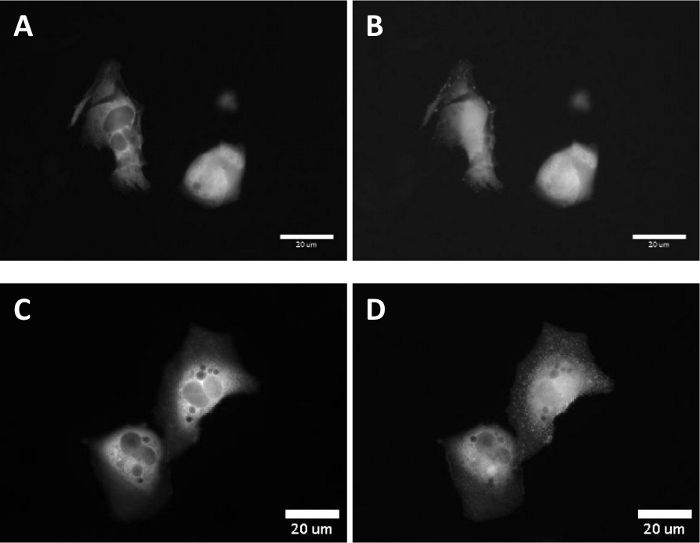
Рисунок 5: Флуоресценция изображения после УФ облучения cho-K1 клеток инкубировали с Bhc клетке арахидоновой кислоты. Клетки ЧО-К1 были трансфицированы синтезированным белком ДГКЗ-ЭГПп.
(A) Флуоресценция изображение трансинфицированных клеток. (B) 100 с после добавления раствора 10 км арахидоновой кислоты. (C) Клетки были инкубированы с раствором 10 км paBhc-AA (5) при 37 КК в течение 5 мин. (D) 100 с после 20-х УФ облучения (330-385 нм). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Соединений | макс (нм)a | макс (M-1 см-1)b | вопросо дис-с | d-d | Растворить (ММ)e |
| Ptx | 1.0 | ||||
| 2'-Bhcmoc-PTX | 340 | 10500 | 0.040 | 400 | 55 |
| 2'-paBhcmoc-PTX | 359 | 9300 | 0.059 | 670 | 8.3 |
| 2'-glc-Bhcmoc-PTX | 373 | 12300 | 0.14 | 1280 | 650 |
| Бхк-АА | 341 | 10800 | 0.038 | 390 | |
| paBhc-AA | 366 | 10300 | 0.083 | 750 |
Таблица 1: Физические и фотохимические свойства кликабельных соединений в клетке.
a. Максимум абсорбции (нм), b. Молярная абсорбтивность на уровнемакс (M1 смNo1),c. Квантовая урожайность исчезновения исходных материалов при 350 нм, д. Продукт молярной абсорнтивности и квантовой урожайности исчезновения на уровне 350 нм, э. Концентрация насыщенного раствора в K-MOPS (pH 7.2) (мкгмлЛ No1).
Обсуждение
Ранее мы разработали Bhc клетке соединений различных биологически активных молекул, которые демонстрируют высокую фотолитической эффективности28,45,46,47. С целью расширения репертуара Bhc кэширования групп, мы также сообщили платформ модульных соединений клетке, которые могут быть легко изменены путем введения различных функциональных единиц32,40,41. Таким образом, настоящий протокол представляет собой метод синтеза кликабельного предшественника групп кэширования Bhc, которые могут быть изменены с помощью меди (I)-катализированной циклизации Huisgen. Синтез кликабельного предшественника, paBhcCH2OH (2), был достигнут с помощью четырехступенчатой последовательности реакции, начиная с коммерчески доступного 4-броморзорсинола(рисунок 1A). Преимущество настоящего протокола заключается в том, что не требуется никаких трудоемких шагов очистки (например, хроматографических сечения столбцов).
Как кликабельный предшественник paBhcCH2OH (2) может быть использован для маскировки различных функциональных групп, кликабельные клетки соединений аминов, спиртов и карбоксиловатых кислот были синтезированы с помощью 2 в качестве предшественника (Рисунок 1B). Амины были изменены как их carbamates в то время как спирты были изменены как их карбонаты. В общих процедурах 1 и 2 CDI использовался для приготовления кликабельных карбаматов, а для приготовления карбонат использовался 4-нитрофениловый хлоророформат. Как указывается в механизме реакции, оба реагента могут быть использованы для приготовления карбаматов и карбонат. Следует также отметить, что выход желаемого соединения в клетке зависит от химической структуры молекулы, которая будет в клетке. Другие примеры можно увидеть в наших предыдущих докладах28,30,33,48.
Нажмите модификация была выполнена с использованием небольшой модификации сообщили процедуры49. Добавление трис (триазолметил) амин основе лиганды необходимо для получения желаемых продуктов в хорошем к высоким урожаям. Поскольку различные азиды легко доступны как из коммерческих источников, так и из литературных процедур, мы можем подготовить различные модульные соединения клетке с дополнительными свойствами, такими как растворимость воды и клеточной способности ориентации (Рисунок 2).
Квантовый выход фотолиза затем измеряется в соответствии с процедурой28,50. На рисунке 3 показано, что фотолитическое потребление 2-glc-paBhcmoc-PTX и выпуск PTX были приближены к одноэкспоненциальному распаду и росту, соответственно, предполагая отсутствие внутренней фильтрации радиации или нежелательных вторичных эффектов. Улучшенный фотолиза квантовых урожаев() и фотолиза эффективности() были отмечены для кликабельных paBhc клетке соединений по сравнению с ранее сообщалось Bhc клетке соединений (Таблица 1)41, 43. Так как эффективность фотолиза() из Bhc клетке соединений более чем в сто раз выше, чем у 2-nitrobenzyl типа клетчатых соединений48, заметное улучшение в связи с наличием paBhc caging группы явно преимущество для этой системы.
В качестве доказательства концепции эксперимента, гидрофильные moiety был введен в 2 "-paBhcmoc-PTX (4) и клеточного таргетинга лиганд был введен в соединение 3 (Рисунок 2). Растворимость воды 2'-glc-paBhcmoc-PTX была в 650 раз выше, чем у материнского PTX(таблица 1). Селективная клеточная ориентация была достигнута с помощью системы тегов-зондов, и paBhcmoc-hex-FITC/Halo (8)подшипник лиганд HaloTag был успешно направлен на клеточную мембрану культивированных клеток млекопитающих, выражающих белок синтеза HaloTag/EGFR ( Рисунок 4). Фото-опосредованный модуляции субклеточной локализации киназы также была достигнута с помощью кликабельного соединения клетки 5 (рисунок 5).
В заключение мы успешно продемонстрировали метод подготовки кликабельных платформ для фотоклеточных соединений биологически интересных молекул, которые могут быть легко модифицированы с дополнительными свойствами, такими как растворимость воды и клеточная ориентируясь на способность. Так как группа кэша paBhc может быть использована для подготовки любых молекул с изменяемыми функциональными группами, применение настоящего протокола не ограничивается молекулами, описанными в настоящем. Используя модульную платформу, а именно группу кэша paBhc, нужные соединения в клетке могут быть легко подготовлены, а их физические и химические свойства можно модулировать с помощью изменения кнопки.
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Эта работа была поддержана JSPS KAKENHI грант номер JP16H01282 (TF), Грант-в-помощь для научных исследований по инновационным областям "Память Динамизм", и JP19H05778 (TF), "MolMovies".
Материалы
| Name | Company | Catalog Number | Comments |
| acetonitrile, EP | Nacalai | 00404-75 | |
| acetonitrile, super dehydrated | FUJIFILM Wako | 010-22905 | |
| Antibiotic-Antimycotic, 100X | Thermo Fisher | 15240062 | |
| 4-bromoresorcinol | TCI Chemicals | B0654 | |
| N,N’-carbonyldiimidazole | FUJIFILM Wako | 034-10491 | |
| chloroform | Kanto | 07278-71 | |
| Copper (II) Sulfate Pentahydrate, 99.9% | FUJIFILM Wako | 032-12511 | |
| dichloromethane, dehydrated | Kanto | 11338-05 | |
| N,N'-Diisopropylcarbodiimide (DIPC) | TCI Chemicals | D0254 | |
| 4-dimethylaminopyridine | TCI Chemicals | D1450 | |
| dimethylsulfoxide, dehydrated -super- | Kanto | 10380-05 | |
| DMEM - Dulbecco's Modified Eagle Medium | Sigma | D6046-500ML | |
| dual light source fluorescence illuminator, IX2-RFAW | Olympus | ||
| Ethanol (99.5) | FUJIFILM Wako | 054-07225 | |
| Ethyl 4-Chloroacetoacetate | TCI Chemicals | C0911 | |
| Ham's F-12 with L-Glutamine and Phenol Red | FUJIFILM Wako | 087-08335 | |
| hydrochloric acid | FUJIFILM Wako | 087-01076 | |
| inverted fluorescent microscope IX-71 | Olympus | ||
| ISOLUTE Phase Separator, 15 mL | Biotage | 120-1906-D | |
| L-(+)-Ascorbic Acid Sodium Salt | FUJIFILM Wako | 196-01252 | |
| laser scanning fluorescence confocal microscopy, FLUOVIEW FV1200/IX-81 | Olympus | ||
| Lipofectamine 2000 Transfection Reagent | Thermo Fisher | 11668027 | lipofection reagent |
| 3-(N-morpholino)propanesulfonic acid | Dojindo | 345-01804 | MOPS |
| 4-nitrophenylchloroformate (4-NPC) | TCI Chemicals | C1400 | |
| Opti-MEM I Reduced Serum Medium, no phenol red | Thermo Fisher | 11058021 | reduced serum medium contains no phenol red |
| 1,10-Phenanthroline Monohydrate | Nacalai | 26707-02 | |
| Photochemical reactor with RPR 350 nm lamps | Rayonet | ||
| Potassium Trioxalatoferrate (III) trihydrate | FUJIFILM Wako | W01SRM19-5000 | |
| Sodium Acetate Trihydrate | Nacalai | 31115-05 | |
| Sodium Bicarbonate | FUJIFILM Wako | 199-05985 | |
| Sulfuric Acid, 96-98% | FUJIFILM Wako | 190-04675 | |
| Tris(3-hydroxypropyltriazolylmethyl)amine (THPTA) | ALDRICH | 762342-100MG | |
| tri-Sodium Citrate Dihydrate | Nacalai | 31404-15 | |
| Xenon light source, MAX-303 | Asahi Spectra |
Ссылки
- Mayer, G., Heckel, A. Biologically active molecules with a "light switch". Angewandte Chemistry International Edition. 45 (30), 4900-4921 (2006).
- Bort, G., Gallavardin, T., Ogden, D., Dalko, P. I. From One-Photon to Two-Photon Probes: Caged” Compounds, Actuators, and Photoswitches. Angewandte Chemistry International Edition. 52 (17), 4526-4537 (2013).
- Klan, P., et al. Photoremovable Protecting Groups in Chemistry and Biology: Reaction Mechanisms and Efficacy. Chemical Reviews. 113 (1), 119-191 (2013).
- Abe, M., et al. Design and Synthesis of Two-Photon Responsive Chromophores for Near-Infrared Light-Induced Uncaging Reactions. Synthesis-Stuttgart. 49 (15), 3337-3346 (2017).
- Ankenbruck, N., Courtney, T., Naro, Y., Deiters, A. Optochemical Control of Biological Processes in Cells and Animals. Angewandte Chemistry International Edition. 57 (11), 2768 (2018).
- Hou, Y., Zhou, Z., Huang, K., Yang, H., Han, G. Long Wavelength Light Activated Prodrug Conjugates for Biomedical Applications. ChemPhotoChem. 2, 1005 (2018).
- Engels, J., Schlaeger, E. J. Synthesis, structure, and reactivity of adenosine cyclic 3',5'-phosphate benzyl triesters, Rapid photolytic release of adenosine 5'-triphosphate from a protected analogue: utilization by the Na:K pump of human red blood cell. Journal of Medicinal Chemistry. 20 (7), 907-911 (1977).
- Kaplan, J. H., Forbush, B., Hoffman, J. F. Rapid photolytic release of adenosine 5'-triphosphate from a protected analogue: utilization by the Na:K pump of human red blood cell ghosts. Biochemistry. 17 (10), 1929-1935 (1978).
- Park, C. H., Givens, R. S. New Photoactivated Protecting Groups. 6. p-Hydroxyphenacyl: A Phototrigger for Chemical and Biochemical Probes. Journal of the American Chemical Society. 119 (10), 2453-2463 (1997).
- Hasan, A., et al. Photolabile protecting groups for nucleosides: synthesis and photo-deprotection rates. Tetrahedron. 53 (12), 4247-4264 (1997).
- Heckel, A., Mayer, G. Light regulation of aptamer activity: an anti-thrombin aptamer with caged thymidine nucleobases. Journal of the American Chemical Society. 127 (3), 822-823 (2005).
- Papageorgiou, G., Corrie, J. E. T. Effects of aromatic substituents on the photocleavage of 1-acyl-7-nitroindolines. Tetrahedron. 56 (41), 8197-8205 (2000).
- Matsuzaki, M., Ellis-Davies, G. C., Nemoto, T., Miyashita, Y., Iino, M., Kasai, H. Dendritic spine geometry is critical for AMPA receptor expression in hippocampal CA1 pyramidal neurons. Nature Neuroscience. 4 (11), 1086-1092 (2001).
- Givens, R. S., Matuszewski, B. Photochemistry of phosphate esters: an efficient method for the generation of electrophiles. Journal of the American Chemical Society. 106 (22), 6860-6861 (1984).
- Furuta, T., Torigai, H., Sugimoto, M., Iwamura, M. Photochemical Properties of New Photolabile cAMP Derivatives in a Physiological Saline Solution. Journal of Organic Chemistry. 60 (13), 3953-3956 (1995).
- Hagen, V., Frings, S., Wiesner, B., Helm, S., Kaupp, U. B., Bendig, J. 7-(Dialkylamino)coumarin-4-yl]methyl-Caged Compounds as Ultrafast and Effective Long-Wavelength Phototriggers of 8-Bromo-Substituted Cyclic Nucleotides. ChemBioChem. 4 (5), 434-442 (2003).
- Momotake, A., Lindegger, N., Niggli, E., Barsotti, R. J., Ellis-Davies, G. C. The nitrodibenzofuran chromophore: a new caging group for ultra-efficient photolysis in living cells. Nature Methods. 3 (1), 35-40 (2006).
- Specht, A., et al. New photoremovable protecting groups for carboxylic acids with high photolytic efficiencies at near-UV irradiation. Application to the photocontrolled release of L-glutamate. ChemBioChem. 7 (11), 1690-1695 (2006).
- Petersen, S., Alonso, J. M., Specht, A., Duodu, P., Goeldner, M., del Campo, A. Phototriggering of cell adhesion by caged cyclic RGD peptides. Angewandte Chemistry International Edition. 47 (17), 3192-3195 (2008).
- Heckman, L. M., et al. Design and Synthesis of a Calcium-Sensitive Photocage. Angewandte Chemistry International Edition. 55 (29), 8363-8366 (2016).
- Olson, J. P., Banghart, M. R., Sabatini, B. L., Ellis-Davies, G. C. Spectral Evolution of a Photochemical Protecting Group for Orthogonal Two-Color Uncaging with Visible Light. Journal of the American Chemical Society. 135 (42), 15948-15954 (2013).
- Gandioso, A., et al. Sequential Uncaging with Green Light can be Achieved by Fine-Tuning the Structure of a Dicyanocoumarin Chromophore. ChemistryOpen. 6 (3), 375-384 (2017).
- Bassolino, G., Nancoz, C., Thiel, Z., Bois, E., Vauthey, E., Rivera-Fuentes, P. Photolabile coumarins with improved efficiency through azetidinyl substitution. Chemical Science. 9 (2), 387-391 (2018).
- Lin, Q. N., et al. Coumarin Photocaging Groups Modified with an Electron-Rich Styryl Moiety at the 3-Position: Long-Wavelength Excitation, Rapid Photolysis, and Photobleaching. Angewandte Chemistry International Edition. 57 (14), 3722-3726 (2018).
- Nani, R. R., et al. In Vivo Activation of Duocarmycin-Antibody Conjugates by Near-Infrared Light. ACS Central Science. 3 (4), 329-337 (2017).
- Umeda, N., et al. Boron Dipyrromethene As a Fluorescent Caging Group for Single-Photon Uncaging with Long-Wavelength Visible Light. ACS Chemical Biology. 9 (10), 2242-2246 (2014).
- Slanina, T., et al. In Search of the Perfect Photocage: Structure–Reactivity Relationships in meso-Methyl BODIPY Photoremovable Protecting Groups. Journal of the American Chemical Society. 139 (42), 15168-15175 (2017).
- Furuta, T., et al. Brominated 7-hydroxycoumarin-4-ylmethyls: Photolabile protecting groups with biologically useful cross-sections for two photon photolysis. Proceedings of the National Academy of Sciences of the United States of America. 96 (4), 1193-1200 (1999).
- Furuta, T., et al. Bhc-cNMPs as either water-soluble or membrane-permeant photoreleasable cyclic nucleotides for both one- and two-photon excitation. ChemBioChem. 5 (8), 1119-1128 (2004).
- Suzuki, A. Z., et al. Coumarin-4-ylmethoxycarbonyls as phototriggers for alcohols and phenols. Organic Letters. 5 (25), 4867-4870 (2003).
- Ando, H., Furuta, T., Tsien, R. Y., Okamoto, H. Photo-mediated gene activation using caged RNA/DNA in zebrafish embryos. Nature Genetics. 28 (4), 317-325 (2001).
- Teraoka, A., Murakoshi, K., Fukamauchi, K., Suzuki, A. Z., Watanabe, S., Furuta, T. Preparation and affinity-based purification of caged linear DNA for light-controlled gene expression in mammalian cells. Chemical Communications. 50 (6), 664-666 (2014).
- Watanabe, T., et al. Synthesis of nucleobase-caged peptide nucleic acids having improved photochemical properties. Organic and Biomolecular Chemistry. 12 (28), 5089-5093 (2014).
- Horinouchi, T., Nakagawa, H., Suzuki, T., Fukuhara, K., Miyata, N. A novel mitochondria-localizing nitrobenzene derivative as a donor for photo-uncaging of nitric oxide. Bioorganic & Medicinal Chemistry Letters. 21 (7), 2000-2002 (2011).
- Leonidova, A., et al. Photo-induced uncaging of a specific Re(I) organometallic complex in living cells. Chemical Science. 5 (10), 4044-4056 (2014).
- Nadler, A., et al. Exclusive photorelease of signalling lipids at the plasma membrane. Nature Communications. 6, 10056 (2015).
- Feng, S. H., et al. Mitochondria-specific photoactivation to monitor local sphingosine metabolism and function. Elife. 7, e34555 (2018).
- Wagner, N., Stephan, M., Hoglinger, D., Nadler, A. A Click Cage: Organelle-Specific Uncaging of Lipid Messengers. Angewandte Chemistry International Edition. 57 (40), 13339-13343 (2018).
- Feng, S., Harayama, T., Chang, D., Hannich, J. T., Winssinger, N., Riezman, H. Lysosome-targeted photoactivation reveals local sphingosine metabolism signatures. Chemical Science. 10 (8), 2253-2258 (2019).
- Furuta, T., Manabe, K., Teraoka, A., Murakoshi, K., Ohtsubo, A., Suzuki, A. Design, synthesis, and photochemistry of modular caging groups for photoreleasable nucleotides. Organic Letters. 14 (24), 6182-6185 (2012).
- Suzuki, A. Z., et al. A clickable caging group as a new platform for modular caged compounds with improved photochemical properties. Chemical Communications. 55 (4), 451-454 (2019).
- Hatchard, C. G., Parker, C. A. A new sensitive chemical actinometer - II. Potassium ferrioxalate as a standard chemical actinometer. Proceedings of the Royal Society A. 235 (1203), 518-536 (1956).
- Furuta, T., Nishiyama, K., Manabe, A., Fukuoka, M., Iwamura, M. Design, synthesis and photochemical properties of caged compounds of lipid mediators. Proceedings of the ISBC. , 124-125 (2003).
- Shirai, Y., Segawa, S., Kuriyama, M., Goto, K., Sakai, N., Saito, N. Subtype-specific Translocation of Diacylglycerol Kinase ? and ? and Its Correlation with Protein Kinase C. The Journal of Biological Chemistry. 275 (32), 24760-24766 (2000).
- Furuta, T., Noguchi, K. Controlling cellular systems with Bhc-caged compounds. TrAC, Trends in Analytical Chemistry. 23 (7), 511-519 (2004).
- Furuta, T. Designing caged compounds for spatiotemporal control of cellular chemistry. Journal of the Synthetic Organic Chemistry Japan. 69 (11), 1164-1169 (2012).
- Furuta, T., Goeldner, M., Givens, R. S. Coumarin-4-ylmethyl Phototriggers. Dynamic Studies in Biology: Phototriggers, Photoswitches and Caged Biomolecules. , 29-55 (2005).
- Furuta, T., Watanabe, T., Tanabe, S., Sakyo, J., Matsuba, C. Phototriggers for Nucleobases with Improved Photochemical Properties. Organic Letters. 9 (23), 4717-4720 (2007).
- Manova, R., van Beek, T. A., Zuilhof, H. Surface Functionalization by Strain-Promoted Alkyne–Azide Click Reactions. Angewandte Chemistry International Edition. 50 (24), 5428-5430 (2011).
- Adams, S. R., Kao, J. P. Y., Grynkiewicz, G., Minta, A., Tsien, R. Y. Biologically Useful Chelators That Release Ca2+ Upon Illumination. Journal of the American Chemical Society. 110 (10), 3212-3220 (1988).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены