Method Article
Анализ проницаемости барьера кровяных мозговых клеток микробным обходом через микрососудистые эндотелиальные клетки
В этой статье
Резюме
Человеческий гематоэнцефалический барьер избирательно предотвращает проникновение в мозг гидрофильных молекул и патогенов. Несколько патологий, в том числе менингит и послеоперационный бред, связаны с повышенной проницаемостью гематоэнцефалического барьера. Здесь мы описываем модель эндотелиальной культуры клеток, чтобы проверить проницаемость барьера микробным обходом.
Аннотация
Человеческий гематоэнцефалический барьер (BBB) характеризуется очень низкой проницаемостью для биомолекул для того, чтобы защитить и регулировать метаболизм мозга. BBB в основном формируется из эндотелиальных клеток, встроенных в коллаген IV и фибронектин богатых мембраны подвала. Несколько патологий являются результатом дисфункции BBB следуют микробные обхода, вызывая такие заболевания, как менингит. Для того, чтобы проверить влияние нескольких параметров, в том числе различных препаратов и анестезии, на проницаемость BBB мы создали новую модель культуры клеток человека, имитирующую BBB с микрососудистыми эндотелиальными клетками мозга человека. Эндотелиальные клетки выращиваются на коллагена IV и фибронектина покрытием фильтр единиц до слияния, а затем могут быть обработаны с различными соединениями интереса. Для того, чтобы продемонстрировать микробный обход, верхняя камера с актической поверхностью эндотелиальных клеток привитается бактериями. После инкубационного периода образцы нижней камеры покрываются на агарных пластинах и подсчитываютполученныеся колонии, в результате чего количество колоний коррелирует с проницаемостью BBB. Эндогенные клеточные факторы могут быть проанализированы в этой экспериментальной настройки для того, чтобы выяснить основные клеточные механизмы эндотелиальных клеток, способствующих BBB. Кроме того, эта платформа позволяет выполнять экран для соединений, которые могут повлиять на проницаемость эндотелиальных клеток. Наконец, бактериальный обход может быть изучен и связан с различными патологиями, такими как менингит. Это может быть возможным, чтобы расширить модель и проанализировать пути бактерий через BBB. В этой статье мы предоставляем подробный протокол описанного метода для исследования проницаемости BBB.
Введение
Человеческий BBB является уникальной границей мозговой ткани, отделяющей мозг от крови. Он строго регулирует прохождение более крупных и гидрофильных молекул, блокирует параклеточное диффузию и поддерживает гомеостаз мозга. Он также защищает мозг от плазменных колебаний, токсинов, микробов и направляет воспалительные клетки как часть иммунитета центральной нервной системы (ЦНС). С момента своего открытия сто лет назад1, многие исследования были проведены, чтобы понять структуру и функцию BBB. Сложные взаимодействия клеток, протеинов, и сигналов от мозга и крови требуют все еще более дальнеишее исследование и модели.
БББ человека состоит из трех типов клеток: микрососудистые эндотелиальные клетки мозга (БМЭК), перициты и астроциты2,3. BMECs отличаются от большинства эндотелиальных клеток в организме в том, что они обладают большим количеством плотных узлов и придерживается узлов4, низкая пиноцитотическая активность2,5, и непрерывный подвал мембраны6,7 блокировать параклеточной диффузии. Малые липофильные молекулы могут рассеиваться и проходить BBB после их градиента концентрации; более большие и гидрофильные молекулы входят или выходят мозг только через поляризованные выраженные селективные транспортные системы8. Эта регулировка приводит к высокой трансэндотелиальной электрической резистентности (TEER) в размере 1500-2000 см2, что наоборот коррелирует с проницаемостью9,10. Хотя BMECs построить жесткий барьер, они могут реагировать на местные и периферийные сигналы11,12. Существует тесное взаимодействие между BMECs и астроцитов13; астроцитов конца ноги построить слой вокруг судов и вызвать формирование плотных узлов13,14. Они участвуют в созревании BBB с различными факторами, втом ными преобразованиями фактора роста -15,16. Кроме того, перициты играют ключевую роль в регуляции ангиогенеза17 и предотвращении апоптоза эндотелия в клеточной дифференциации18 (Рисунок 1). Они встроены в мембрану подвала и обеспечивают структурную устойчивость стенки сосуда19.
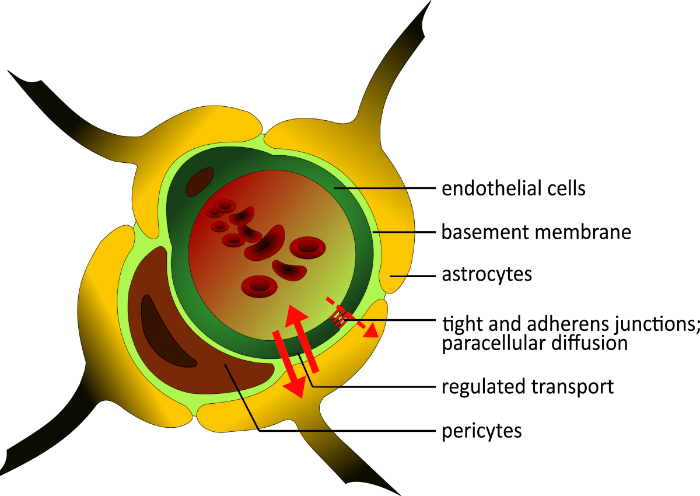
Рисунок 1: Схематическая структура гематоэнцефалического барьера. Уникальная структура человека BBB состоит из трех различных типов клеток. Просвет микрососуд окружен эндотелиальными клетками, которые обогащаются в тесных узлах и не являются fenestrated. Они встроены в мембрану подвала, как перициты. Эти клетки важны для структурной устойчивости стенки сосуда и играют роль в развитии BBB рядом с астроцитами. Их конечные ноги построить тесный слой вокруг судна и поддерживать строительство плотных узлов. Все компоненты BBB важны для физиологической функциональности. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Много различных патологий связано с коллапсом BBB (например, септической энцефалопатии). Пострадавшие пациенты имеют повышенный уровень белка в спинномозговой жидкости20, и мозг паренхима у пораженных грызунов показывает увеличение поглощения отмеченных коллоидных оксида железа и аминокислот21,22. Эти результаты указывают на повышенную проницаемость BBB, что происходит наряду с увеличением пиноцитоз в BMECs21 и эндотелиальной активации23. Другой связанной патологией, связанной с измененным BBB является менингит, неотложная медицинская помощь и комплексное воспаление сопровождается отеками головного мозга, что может привести к гибели нейрональных клеток. Основным местом входа циркулирующих бактерий, как предполагается, являются микрососуды24; однако, BBB предотвращает вход бактерий. Проницаемость BBB не всегда связана с увеличением экспериментального гематогенного менингита25 и механизмы могут быть многофакторными. Совпадение сепсиса с послеоперационным бредом (POD)26 и связь с предоперационными инфекциями27,28 указывает на необходимость модели BBB, которая позволяет прямое воздействие бактерий, чтобы получить лучшее понимание бактериального патогенеза.
Есть много пробелов в понимании и количественной оценки микробных обхода через BBB. Поэтому мы разработали модель, которая позволяет удобно тестировать различные факторы и условия с прямой корреляцией между бактериальным обходом и влиянием на проницаемость BBB. Предыдущая работа была сосредоточена на параклеточной проницаемости и включала измерения TEER и поток трассировщика. Кроме того, был проанализирован перенос макромолекулы с помощью конъюгированных молекул или антител, в которых разрабатывались различные модели, использующие только эндотелиальные клетки или комбинации с астроцитами и перицитами. Из-за трудностей в получении человеческих тканей на регулярной основе, многие животные модели используются. Мозг эндотелиальных клеток быка и свиного происхождения образуют плотные монослои с высоким TEER, которые образуют хорошо сформированную атикально-базальную полярность и подходят для исследования малых молекул транспорта через BBB. Белки отличаются по последовательности от своих человеческих homologues29,30, что делает исследование терапевтических антител трудно. По этой причине предпочтительнее может быть моделя мурина или человеческой культуры. Мышь или крысы в качестве образец источников имеют то преимущество, что получают от хорошо охарактеризованных видов, но дают несколько клеток для учебных целей. Это может быть обойден с помощью увековеченной мыши мозга эндотелиомы (END) клеточные линии bEND.3, bEND.5 или CEND31,32,33.
Первичные культивированные клетки из тканей человека трудно получить и обрабатывать на регулярной основе. Таким образом, большинство человеческих клеточных моделей, используемых в исследованиях, исследующих человеческий BBB являются увековеченными эндотелиальных клеточных линий. Опубликованная клеточная линия является микрососудистой эндотелиальной клеточной линией человека hCMEC/D3, которая хорошо подходит для изучения употребления наркотиков и проста в обращении. Клетки строят монослой и выражают характерные плотные белки соединения BBB34,тогда как уровень экспрессии claudin-5 сообщено, что более низок, чем в неповрежденных микрососудах35 и много специфических транспортеров были обнаружены на уровне транскрипта36 также, как в протеомических изучениях34. Относительно низкий TEER в диапазоне 30-50 х см2 по-прежнему является проблемой37. Другим источником эндотелиальных клеток мозга являются человеческие плюрипотентные стволовые клетки (HPSCs)38 и стволовые клетки из пуповинной крови, полученные от циркулирующих эндотелиальных прародителей и гематопоиетических линий39,40. Оба протокола дифференциации приводят к плотным клеточным монослоям и высоким значениям TEER (например, 1450 х см2 в со-культурах)38. Эти модели стволовых клеток требуют крайней осторожности для выращивания, но предлагают возможность изучить влияние регулирования гормонов41 или заболеваний с генетическим фоном42 на развитие BBB.
В этом исследовании мы установили увековеченную трансинфицированную микрососудистую эндотелиальную линию мозга человека, THBMEC43,для имитации BBB и изучения бактериального обхода. Клетки посеяны на фильтре и выросли до 100% стопроцентной в этой модели клеточной культуры. Бактерии прививаются в верхней части камеры клеточной культуры. Мы используем Escherichia coli (E. coli) в нашем выборке исследования из-за высокой заболеваемости менингитом кишечной палочки 44. Было показано, что низкая проницаемость клеточного монослой происходит между днем 13 и днем 15 после посева45. Поэтому после этого проводится обработка монослойthTH THBMEC, и бактерии затем прививаются в среде на апической поверхности монослойной поверхности. После инкубационного времени, бактерии, которые смогли пересечь барьер количественно с помощью покрытия среды с бактериями на агар пластин и подсчета колоний. Увеличение числа колоний коррелирует с более высоким бактериальным обходом через BBB. TEER составляет около 70 см246. Однако нет необходимости измерять TEER в описанном методе. Хотя это устоявленное значение для проницаемости BBB, кажется, не влияет на прохождение бактерий через BBB. Необработанные клетки служат контролем герметичности в нашей модели. В предыдущей работе было показано, что клетки способны реагировать на провоспалительные цитокины и выражать типичные плотные соединения белков47. Это позволяет для комплексного скрининга и проверки большего набора транспортер субстратов и рецепторов.
протокол
1. Подготовка буфера и реагентов
- Подготовка 10x фосфат буфера солевым раствором (10x PBS), добавив 80 г хлорида натрия (NaCl), 2 г хлорида калия (KCl), 14,4 г динатрия-водородно-фосфатного дигидрата (Na2HPO4 - 2H2O) и 2 г фосфаткалия калия-дигидрогена (KH2PO4) в 1 l стеклянной колбе в 1 л двойной дистиллированной H2O. Автоклав 10x PBS раствор и разбавить 100 мл этого раствора в 900 мл двойной дистиллированной воды, чтобы получить 1x PBS.
- Используйте автоклав для стерилизации растворов. Положите стеклянную колбу в корзину, закройте крышку и стерилизуйте ее в течение 15 мин при 121 и 98,9 кПа.
ПРИМЕЧАНИЕ: Этот протокол всегда используется для автоматического решения в дальнейших шагах.
- Используйте автоклав для стерилизации растворов. Положите стеклянную колбу в корзину, закройте крышку и стерилизуйте ее в течение 15 мин при 121 и 98,9 кПа.
- Приготовьте коллаген IV и 10 мкг/мЛ фибронектина, разбавив раствор фибронектин 0,5 мг/мл и раствор коллагена IV 0,3 мг/мл каждый с 1x PBS до 100 мг/мл аликотов в 1,5 мл микротрубки. После этого смешайте 100 кЛ обоих аникотов с 1800 л 1x PBS в микротрубках 2 мл и храните их при -20 градусов по Цельсию.
- Подготовка DMEM / F-12 среды, добавив 4% плода крупного рогатого скота сыворотки и 2 мМ L-глютамин и 100 мг / l пенициллин / стрептомицин к среде и хранить его при 4 градусах Цельсия.
- Приготовьте раствор 1x trypsin-EDTA, разбавив 5 мл 10-кратного концентрированного раствора трипсин-ЭДТА с 45 мл 1x PBS в трубке 50 мл и храните его при 4 градусах Цельсия.
- Приготовьте 500 мл среды LB весом 10 г бульонной основы LB в стеклянной колбе 500 мл. Добавьте 500 мл стерилизованной воды и автоматически его.
- Приготовьте LB-агар весом 10 г бульонной основы LB и 7,5 г агар-агара в стеклянной колбе 500 мл. Добавьте 500 мл стерилизованной воды перед автоклавированием и не закрывайте крышку колбы. Автоклав и оставить раствор остыть, пока он не тепло на ощупь.
- Подготовка без антибиотиков среды, добавив 4% плода крупного рогатого скота сыворотки и 2 мМ L-глютамин, но не пенициллина / стрептомицина в DMEM / F-12 среды и хранить его при 4 c как в шаге 1.3.
2. Рост кроветчебного барьера, мимикрирующего клетки
- Чтобы собрать 12 хорошо пластины, положить клеточной культуры вставки в колодцы(Рисунок 2A).
- Распакуйте пластину и каждую вставку в шкаф биологической безопасности и выполните дальнейшие шаги там. Используйте стерилизованные щипцы, чтобы захватить вставку на ее широкой основе, чтобы переместить его.
- Пальто пористой мембраны каждой вставки с 90 мкг /мл коллагена IV и 10 мкг /мЛ фибронектин смеси. Инкубировать 12 хорошо пластины для 24 ч при 37 КС в инкубаторе клеточной культуры(рисунок 2B).
- Вымойте вставки дважды, пайпетик 1 мл 1x PBS в каждой вставке и аспирации раствор с вакуумным насосом для клеточных культур.
- Уравновесить мембраны путем трубоукладки 0,5 мл предварительно разогретой среды DMEM/F-12 в верхней и 1,5 мл в нижней камере. Инкубировать пластину в течение 30 мин при 37 градусах По Цельсию в инкубаторе клеточной культуры с 5% CO2 атмосферой(рисунок 2C).
- Семена 2 х 105 человека микрососудистых эндотелиальных клеток в каждой верхней камере и инкубировать 12 хорошо пластины при 37 градусов по Цельсию в инкубаторе клеточной культуры(Рисунок 2D).
- Аспирировать среду из колбы клеточной культуры с помощью вакуумного насоса для клеточных культур и мыть монослой путем pipetting 10 мл 1x PBS и аспирации раствора потом с вакуумным насосом.
- Обложка клетки полностью с 1x концентрированный трипсин-EDTA путем pipetting 5 мл раствора в колбу клеточной культуры. Инкубировать колбу в течение 3-5 мин при 37 градусах По Цельсию в инкубаторе клеточной культуры.
ПРИМЕЧАНИЕ: Если клетки не разобщены, твердо коснитесь колбу на ладони, чтобы выбить клетки. - Возьмите 5 мл с пипеткой в качестве аликота из клеточной подвески в трубке 15 мл и добавьте 5 мл fcS-содержащей среды, чтобы остановить ферментативную реакцию.
- Centrifuge подвески в течение 3 мин на 210 х г,удалить супернатант с вакуумным насосом, и resuspend гранулы в 5 мл среды с пипеткой.
- Используйте счетчик клеток, смешивая 10 л клеточной подвески с 10 зл 0,4% пробивной синий пятно в 1,5 мл микро трубки. Добавьте 10 кЛ смеси в слайд счетной камеры, положите его в счетчик ячейки и начните считать.
- Сосредоточьте счетчик на клетках так, чтобы их край был темно-синим и средним белым. После этого начните соответствующую программу для подсчета клеток.
- Чтобы рассчитать объем для каждой вставки, разделите полученные 2 х 105 ячеек на вставку с расчетной концентрацией клеточной подвески.
3. Культивирование модели барьера кровеносного мозга
- Инкубировать 12 хорошо пластины в течение 14 дней при 37 градусов по Цельсию.
- Изменение 0,5 мл среднего для верхней камеры и 1,5 мл среднего для нижней каждые 2-3 дня. Разогрейте среду, прежде чем положить его в клеточной колбе. Аспират с вакуумным насосом(Рисунок 2E).
ПРИМЕЧАНИЕ: Работайте тщательно, чтобы не касаться мембраны. - Проверьте состояние клеток, визуав их с помощью микроскопа и определите выпуклость. Убедитесь, что выпуклость составляет 100% через 14 дней.
4. Подготовка бактерий
- За день до измерения, положить колонии штамма кишечной палочки GM2163 в LB среды. Инкубировать культурную трубку на 24 ч при 37 градусах по Цельсию с 180 об/мин в инкубационном шейкере(рисунок 2F).
- Культивировать E. coli нагрузку на LB агар пластины при 4 градусах Цельсия. Возьмите одну колонию со стерилизованные забрать и положить забрать в подготовленной культуры трубки с 3 мл среды LB.
- Приготовьте тарелку агара LB для каждой вставки с теплым раствором агара LB и заполните блюда Петри до половины их общего объема. Пусть они становятся твердыми и хранить их при 4 градусах Цельсия.
5. Лечение клеток
- На 14 день после посева, лечить клетки с соединениями или измерить трансэндотелиальной электрической устойчивости (TEER), если планируется(Рисунок 2G).
ПРИМЕЧАНИЕ: Всегда есть некоторые необработанные клетки в качестве контроля.- Для лечения клеток с составом интереса, разбавить соединение до конечной концентрации в DMEM /F-12 среды. Добавьте 0,5 мл этой смеси в верхнюю камеру и 1,5 мл в нижнюю палату. Инкубировать пластину в инкубаторе клеточной культуры на нужное время.
- После этого, обмен полной среде с антибиотиками свободной среде, аспирируя с вакуумным насосом и пипеттинг(Рисунок 2H).
6. Измерение проницаемости
- Чтобы получить постоянную концентрацию бактерий, измерьте оптическую плотность с помощью фотометра на длине волны 600 нм. Разбавить ночной раствор бактерий с помощью носителя LB в соколиной трубке 50 мл до OD600 из 0,5 и 0,05. Работа на льду.
- Заполните 1 мл среднего LB в кювет. Запустите фотометр и положите кювет в, отмеченную сторону вперед. Нажмите на дно "Пустой" для измерения пустой стоимости после этого.
- Измерьте плотность бактериального раствора, заполнив его в кювет, поместив его в, и нажав на нижний образец. Повторите измерение во время разбавления до получения окончательной концентрации.
- Работа в биологическом шкафу безопасности, где бактерии могут быть обработаны с подготовленными 12 хорошо пластины и бактериального раствора на OD600 и 0,5. Добавить 450 л бактериального раствора только в каждую верхнюю камеру, содержащую 0,5 мл среднего(рисунок 2I).
- Инкубировать 12 хорошо пластины для 6 ч при 37 градусов по Цельсию в инкубаторе.
ПРИМЕЧАНИЕ: Протокол диктует сделать паузу здесь. - Образец 50 зл и носителя с пипеткой из каждой нижней камеры, удалив вставку с щипками(рисунок 2J). Позаботьтесь, чтобы не пролить среду из верхних камер в нижние.
- Плита каждого образца на отдельной агар-пластине(рисунок 2K). Бросьте образец на тарелку и вычеркните раствор с помощью клеточного распределителя.
- Инкубировать агар пластины для 24 ч при 37 градусов по Цельсию в инкубаторе.
- Подсчитайте колонии в каждой пластине(рисунок 2L).
7. Анализ данных
- Напишите данные в таблице и вычислите среднее и стандартное отклонение наблюдаемых колоний обработанных и необработанных клеток.
- Отобразите среднее количество колоний.
- Чтобы нормализовать результаты, вычислите относительное количество колоний, разделив все результаты с контрольным значением.
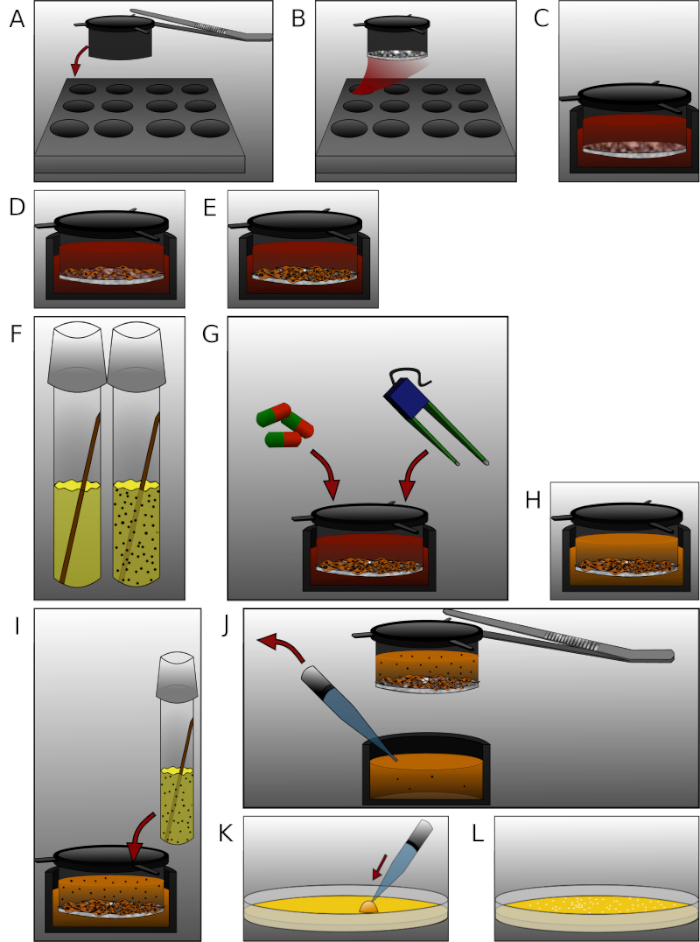
Рисунок 2: Детальное представление отдельных шагов в протоколе. (A) Положите вставки со стерилизованные щипцы в 12 хорошо пластины. (B) Пальто каждой вставки с 90 QL фибронектина и коллагена IV смеси и инкубировать на 24 ч. (C) Equilibrate мембраны с предварительной среде в течение 30 мин. (D) Семена 2 х 105 мозга человека микрососудистых эндотелиальных клеток на вставку. (E) Культивировать пластины для соответствующего количества времени. (F) За день до измерения, положить e. coli колонии в LB средней культуры трубки и инкубировать на 24 ч. (G) Лечить клетки или измерения TEER. (H) Обмен полной среде с антибиотиками свободной среде. (Я) Добавить 450 л бактериального раствора (OD600 и 0,5) в каждой верхней камере и инкубировать в течение 6 ч. (J) Образец 50 qL среды от каждой нижней камеры удаления вставки с щипточками. (K) Плита образец на агар пластин и инкубировать на 24 ч. (L) Рассчитывать колоний и анализировать данные. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Результаты
Следуя протоколу, ячейки были посеяны, и была построена модель BBB. На 14-й день после посева клетки лечились глиоксалом как реактивным альдегидом. Целью эксперимента было исследование корреляции между возрастом и диабетом в POD27 и высокой заболеваемости менингитом у пожилых пациентов48. Повышенные уровни передовых конечных продуктов гликации (AGEs) как в возрасте, так и в диабете49 требуют дальнейшего изучения влияния гликации в патогенеза микробного обхода через BBB. Гликация является неферментатической реакцией свободных аминокислотных групп в белках с карбоновыми группами, уменьшающих углеводы или другие соединения карбонила. Глюкоза хорошо известна как донор групп углерода; однако, есть более реактивные известные. После создания нестабильной базы Шиффа, они перестраиваются на более стабильные и реактивные дикарбониловые соединения, такие как глиоксал. AGEs, конечные продукты, может вызвать перекрестные связи между белками50. Они могут повредить клеточные структуры и изменить клеточную функцию путем взаимодействия с рецептором AGEs (RAGE)51.
Клетки лечились раствором глиоксала 0,05 и 0,15 мм (GO) на 1 ч, а необработанные клетки служили элементом контроля. Гликация была обнаружена с помощью иммуноблоттинга и обнаружения с анти-AGE антитела(рисунок 3). Полученные бактериальные колонии были подсчитаны и представлены как абсолютное число колоний(рисунок 4A) или относительное число колоний, нормализованных для контроля(рисунок 4B). Среда, взятая из скважин с необработанными клетками, образовала очень мало колоний. Этот результат показал, что необработанные клетки способны построить барьер и могут служить в качестве контроля. Образцы, обработанные глиоксалом, показали увеличение количества колоний, что привело к выводу, что есть влияние глиоксала на THBMECs и плотность клеточного барьера, потому что количество колоний продемонстрировало существенную разницу между необработанными и обработанными клетками. Увеличение бактериального скрещивания барьера после лечения глиоксалом может объяснить, почему диабет коррелирует с заболеваниями с распадом BBB.
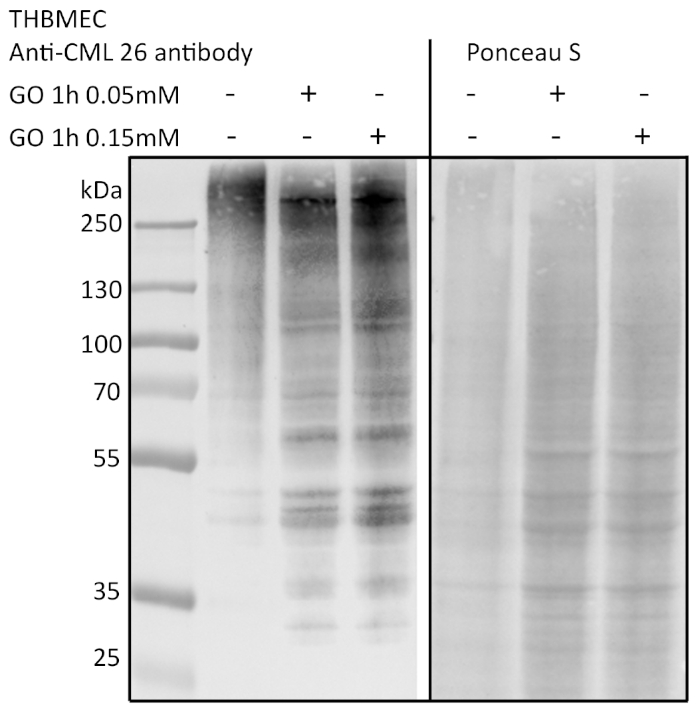
Рисунок 3: Обнаружение гликации белка с помощью иммуноблоттинга. THBMECs лечились GO в разных концентрациях на 1 ч. Общий белок был выделен и отделен с помощью SDS-PAGE. Гликирование белков было обнаружено с помощью иммуноблоттинга с помощью анти-AGE-антитела (CML-26). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
В другой обстановке, гликирование белка THBMECs было индуцировано глюкозой. Стерилизованная глюкоза была добавлена в среду DMEM/F-12 для повышения концентрации глюкозы от нормальной среды глюкозы (NG) с 17,5 мм до высокой среды глюкозы (HG) с 42,5 мм. THBMECs культивировались в двух различных колбах клеточной культуры: один в нормальной среде глюкозы (NG), а другой в среде с высоким содержанием глюкозы (HG). Эти два различных носителя были также использованы для роста BBB на фильтрах в 12 скважинных пластинах. Клетки, культивируемые в среде NG, служили элементом контроля. Полученные колонии представлены как абсолютное число колоний(рисунок 4С)или относительное количество колоний, нормализованных для контроля(рисунок 4D). Результаты не показывают существенного влияния на прохождение бактерий через человека BBB, что привело к выводу, что эффект НГ против HG не был достаточно серьезным, чтобы повлиять на целостность BBB. Различные сценарии были разработаны, чтобы доказать модель и целостность клеток, имитирующих BBB.
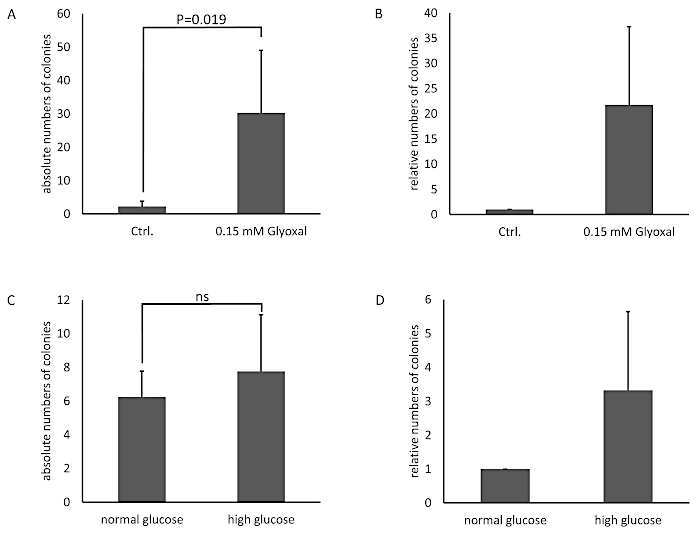
Рисунок 4: Абсолютное и относительное число подсчитанных бактериальных колоний в модели BBB с THBMECs. THBMECs лечили с 0,15 мМ GO на 1 ч, необработанные клетки служили в качестве контроля. В общей сложности в каждой верхней камере было добавлено 450 суспензий кишечной палочки (OD600 и 0,5). Средний из нижних камер был покрыт на агар пластин после 6 ч. (A) График показывает среднее среднее значение /- SEM подсчитанных колоний. (B) График показывает подсчитанные колонии, нормализованные к необработанным клеткам в качестве контроля no/- SEM (n No 4). В (C) и (D, THBMECs были культивированы в NG и HG среде. В общей сложности в каждой верхней камере было добавлено 450 суспензий кишечной палочки (OD600 и 0,5). Средний из нижней камеры был покрыт на агар пластин после 6 ч. (C) График показывает среднее среднее значение /- SEM подсчитанных колоний. (D) График показывает подсчитанные колонии, нормализованные к необработанным клеткам в качестве контроля no/- SEM (n No 3). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Ограниченное понимание патогенеза микробных ограничений по обходу способствует дальнейшему развитию методов лечения POD или менингита. Смертность и заболеваемость этих заболеваний требуют более эффективного лечения пациентов, требуют исследования основных механизмов и нуждаются в надежной платформе для комплексного скрининга. Многофакторные события можно изучать с помощью бМЭК человека. Несколько успешных отчетных процедур изоляции БМЭК от ряда видов показали потерю характеристик клеток молекулярной сигнатурой52,53. Описанные THBMECs в этой процедуре были трансфицированы в очень ранних проходах, где они проявляли специфические характеристики эндотелиальных клеток мозга и сохранили их43. Это важно, потому что не все шаги в пострадавших путей были обнаружены до сих пор, и эта модель, кажется, имитирует обычные BMECs. Наша представленная модель показывает прямое влияние на BMECs и микробных обхода через BBB.
Обработка клеток THBMEC проста, и необходимое техническое оборудование существует в большинстве лабораторий науки о жизни. Наша модель позволяет немедленно начать следственные процедуры после того, как THBMECs построили плотный монослой. Поле применения может быть обширным из-за возможных комбинаций между новыми испытаниями и обычными assays such as измерение TEER или маркировка с трассерами54. Также можно добавить астроциты или перициты, чтобы сделать модель совместной или тройной культуры. Влияние наркотиков на микробные обходы также может быть проверено в нашей модели путем лечения THBMECs с соединениями, прежде чем привить верхней камеры с бактериями. На самом деле можно приобрести вставки с фильтрами для 96 колодцев, что позволяет автоматизировать процедуру. Это может способствовать внедрению высокопроизводительных систем скрининга лекарственных средств для ускорения обнаружения лекарств против упомянутых заболеваний и уменьшения побочных эффектов на BBB во время разработки лекарств.
Критическим шагом в представленном методе является время инкубации после добавления бактерий в верхнюю камеру. Важно использовать часы в качестве сроков в протоколе, потому что время генерации кишечной палочки составляет всего 20 мин55. В противном случае использование различных временных точек может привести к вводящим в заблуждение результатам. Существует также возможный риск загрязнения между верхней и нижней камерой во время бактериального воздействия, если пластины не обрабатываются с осторожностью. Любые изменения в 12 скважин пластины на данный момент может загрязнять среду в нижней камере.
E. coli является одной из известных, очень распространенной причиной бактериального менингита. Дальнейшие исследования должны проверить различные бактерии, которые также связаны с менингитом, такие как Neisseria meningitidis56 или Streptococcus pneumoniae57. Они, кажется, используют различные механизмы, чтобы пересечь BBB и должны быть лучше поняты для лечения пациентов. У пожилых пациентов, заболеваемость POD увеличивается26, а также число происходящих сопутствующих заболевания. Известно, что существуют взаимодействия между различными заболеваниями, особенно системными, как диабет. В нашей модели, можно смоделировать эти условия или лечить клетки, прежде чем добавлять бактерии.
Модель ограничена непосредственным контактом THBMECs и бактерий, и необходимы дальнейшие исследования для исследования потенциальных механизмов контакта для обнаружения соответствующих путей и белков. Тем не менее, можно удалить вставки и урожай клеток для дальнейшего анализа. TEER модели ниже по сравнению с моделями стволовых клеток38,39,40. Мы подтвердили это с помощью бактериальной концентрации, которая не пересекла BBB в необработанных клетках после 6 ч.
Таким образом, этот метод представляет собой надежную платформу для анализа обхода бактерий через BBB с потенциалом, чтобы расширить его для высокой пропускной связи наркотиков скринингов.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы признают д-ра Марьям Хусейн за предыдущую работу над этим методом, группу PD д-р Керстин Данкер (Шарите-Университет,Университет, Берлин) для предоставления THBMECs и Джулиан Вебер для критическиго чтения рукописи. Это исследование было поддержано RTK 2155 (ProMoAge).
Материалы
| Name | Company | Catalog Number | Comments |
| Agar - Agar | Carl Roth | 6494.3 | BioScience-Grade |
| Autoclave | Systec | VX-150 | |
| Bacteria E.coli strain GM2163 | Fermentas Life Sciences, Lithuania | ||
| Photometer | Eppendorf | 6131 | |
| Cells THBMEC | Group of M. F. Stins | ||
| Cell culture flasks | Greiner Bio-One | 658175 | |
| Centrifuge Universal 320 | Hettrichlab | 1401 | |
| Collagen IV | SIGMA Aldrich | C6745 | from human cell culture |
| Countess Automated Cell Counter with cell counting chamber slides and Trypan Blue stain 0.4% | Invitrogen | C10311 | |
| Culture tubes | Greiner Bio-One | 191180 | |
| Cuvettes | BRAND | 759015 | |
| Di sodium hydrogen phosphate di hydrate | MERCK | 1065800500 | |
| DMEM/F-12 | GIBCO/ Thermo Sc. | 11330032 | HEPES |
| Falcon tubes 15 ml | Greiner Bio-One | 188271 | |
| Falcon tubes 50 ml | Greiner Bio-One | 227261 | |
| Fetal Bovine Serum | GIBCO/ Thermo Sc. | 10270 | value FBS -Brazil |
| Fibronectin | SIGMA Aldrich | F0556 | solution human fibroblasts |
| Heracell 150 CO2 Incubator | Heraeus | 50116047 | |
| Incubator shaker I 26 New Brunswick | Eppendorf | M1324-0000 | |
| Inoculation loop | Dr. Ilona Schubert - Laborfachhandel | 641000 | |
| LB Broth Base | GIBCO/ Thermo Sc. | 12780029 | |
| L-Glutamine | GIBCO/ Thermo Sc. | 25030-081 | |
| Microbial incubator B 6200 | Heraeus | 51015192 | |
| Microbiological Safety Cabinet AURA 2000 M.A.C. Class II | BIOAIR | 12469 | |
| Microscope inverse | Zeiss | TELAVAL 31 | |
| Micro tubes 2 ml | Sarstedt | 72,695,400 | |
| Micro tubes 1,5 ml | Sarstedt | 72,706,400 | |
| Penicillin / Streptomycin | GIBCO/ Thermo Sc. | 15140122 | |
| Petri dish | Dr. Ilona Schubert - Laborfachhandel | 464-800 | |
| Potassium chloride | Roth | HN02.3 | |
| Potassium-di-hydrogen phosphate | Roth | P018.2 | |
| Sodium chloride | Roth | 9265.2 | |
| ThinCerts + Multiwell Plates | Greiner Bio-One | 665631 | 12 well, pore size 3.0 µm |
| Trypsin - EDTA | GIBCO/ Thermo Sc. | 15400054 | |
| Vacuumpump Laboport | KNF | N 86 KT.18 |
Ссылки
- Goldmann, E. E. . Vitalfärbung am Zentralnervensystem: Beitrag z. Physio-Pathologie d Plexus chorioideus ud Hirnhäute. , (1913).
- Reese, T. S., Karnovsky, M. J. Fine structural localization of a blood-brain barrier to exogenous peroxidase. Journal of Cell Biology. 34 (1), 207-217 (1967).
- Risau, W., Dingler, A., Albrecht, U., Dehouck, M. P., Cecchelli, R. Blood-brain barrier pericytes are the main source of gamma-glutamyltranspeptidase activity in brain capillaries. Journal of Neurochemistry. 58 (2), 667-672 (1992).
- Brightman, M. W., Reese, T. S. Junctions between intimately apposed cell membranes in the vertebrate brain. Journal of Cell Biology. 40 (3), 648-677 (1969).
- Coomber, B. L., Stewart, P. A. Morphometric analysis of CNS microvascular endothelium. Microvascular Research. 30 (1), 99-115 (1985).
- Tilling, T., Korte, D., Hoheisel, D., Galla, H. J. Basement membrane proteins influence brain capillary endothelial barrier function in vitro. Journal of Neurochemistry. 71 (3), 1151-1157 (1998).
- Morris, A. W., et al. Vascular basement membranes as pathways for the passage of fluid into and out of the brain. Acta Neuropathologica. 131 (5), 725-736 (2016).
- Betz, A. L., Goldstein, G. W. Polarity of the blood-brain barrier: neutral amino acid transport into isolated brain capillaries. Science. 202 (4364), 225-227 (1978).
- Butt, A. M., Jones, H. C., Abbott, N. J. Electrical resistance across the blood-brain barrier in anaesthetized rats: a developmental study. Journal of Physiology. 429, 47-62 (1990).
- Calabria, A. R., Weidenfeller, C., Jones, A. R., de Vries, H. E., Shusta, E. V. Puromycin-purified rat brain microvascular endothelial cell cultures exhibit improved barrier properties in response to glucocorticoid induction. Journal of Neurochemistry. 97 (4), 922-933 (2006).
- O'Carroll, S. J., et al. Pro-inflammatory TNFalpha and IL-1beta differentially regulate the inflammatory phenotype of brain microvascular endothelial cells. Journal of Neuroinflammation. 12 (131), (2015).
- Simi, A., Tsakiri, N., Wang, P., Rothwell, N. J. Interleukin-1 and inflammatory neurodegeneration. Biochemical Society Transactions. 35 (Pt 5), 1122-1126 (2007).
- Janzer, R. C., Raff, M. C. Astrocytes induce blood-brain barrier properties in endothelial cells. Nature. 325 (6101), 253-257 (1987).
- Tao-Cheng, J. H., Nagy, Z., Brightman, M. W. Tight junctions of brain endothelium in vitro are enhanced by astroglia. Journal of Neuroscience. 7 (10), 3293-3299 (1987).
- Utsumi, H., et al. Expression of GFRalpha-1, receptor for GDNF, in rat brain capillary during postnatal development of the BBB. American Journal of Physiology and Cell Physiology. 279 (2), (2000).
- Tran, N. D., Correale, J., Schreiber, S. S., Fisher, M. Transforming growth factor-beta mediates astrocyte-specific regulation of brain endothelial anticoagulant factors. Stroke. 30 (8), 1671-1678 (1999).
- Balabanov, R., Washington, R., Wagnerova, J., Dore-Duffy, P. CNS microvascular pericytes express macrophage-like function, cell surface integrin alpha M, and macrophage marker ED-2. Microvascular Research. 52 (2), 127-142 (1996).
- Ramsauer, M., Krause, D., Dermietzel, R. Angiogenesis of the blood-brain barrier in vitro and the function of cerebral pericytes. Faseb Journal. 16 (10), 1274-1276 (2002).
- Lindahl, P., Johansson, B. R., Leveen, P., Betsholtz, C. Pericyte loss and microaneurysm formation in PDGF-B-deficient mice. Science. 277 (5323), 242-245 (1997).
- Young, G. B., Bolton, C. F., Archibald, Y. M., Austin, T. W., Wells, G. A. The electroencephalogram in sepsis-associated encephalopathy. Journal of Clinical Neurophysiology. 9 (1), 145-152 (1992).
- Carlyle Clawson, C., Francis Hartmann, J., Vernier, R. L. Electron microscopy of the effect of gram-negative endotoxin on the blood-brain barrier. Journal of Comparative Neurology. 127 (2), 183-197 (1966).
- Jeppsson, B., et al. Blood-brain barrier derangement in sepsis: cause of septic encephalopathy?. The American Journal of Surgery. 141 (1), 136-142 (1981).
- Tighe, D., Moss, R., Bennett, D. Cell surface adrenergic receptor stimulation modifies the endothelial response to SIRS. Systemic Inflammatory Response Syndrome. New Horizons (Baltimore, Md). 4 (4), 426-442 (1996).
- Kim, K. S., et al. The K1 capsule is the critical determinant in the development of Escherichia coli meningitis in the rat. Journal of Clinical Investigation. 90 (3), 897-905 (1992).
- Kim, K. S., Wass, C. A., Cross, A. S. Blood-brain barrier permeability during the development of experimental bacterial meningitis in the rat. Experimental Neurology. 145 (1), 253-257 (1997).
- Arshi, A., et al. Predictors and Sequelae of Postoperative Delirium in Geriatric Hip Fracture Patients. Geriatric Orthopaedic Surgery and Rehabililation. 9, 2151459318814823 (2018).
- Smulter, N., Lingehall, H. C., Gustafson, Y., Olofsson, B., Engstrom, K. G. Delirium after cardiac surgery: incidence and risk factors. Interactive CardioVascular and Thoracic Surgery. 17 (5), (2013).
- Kratz, T., Heinrich, M., Schlauss, E., Diefenbacher, A. Preventing postoperative delirium. Deutsches Arzteblatt International. 112 (17), 289-296 (2015).
- Uchida, Y., et al. Quantitative targeted absolute proteomics of human blood-brain barrier transporters and receptors. Journal of Neurochemistry. 117 (2), 333-345 (2011).
- Warren, M. S., et al. Comparative gene expression profiles of ABC transporters in brain microvessel endothelial cells and brain in five species including human. Pharmacology Research. 59 (6), 404-413 (2009).
- Omidi, Y., et al. Evaluation of the immortalised mouse brain capillary endothelial cell line, b.End3, as an in vitro blood-brain barrier model for drug uptake and transport studies. Brain Research. 990 (1-2), 95-112 (2003).
- Steiner, O., Coisne, C., Engelhardt, B., Lyck, R. Comparison of immortalized bEnd5 and primary mouse brain microvascular endothelial cells as in vitro blood-brain barrier models for the study of T cell extravasation. Journal of Cerebral Blood Flow and Metabolism. 31 (1), 315-327 (2011).
- Burek, M., Salvador, E., Forster, C. Y. Generation of an immortalized murine brain microvascular endothelial cell line as an in vitro blood brain barrier model. Journal of Visualized Experiments. (66), e4022 (2012).
- Ohtsuki, S., et al. Quantitative targeted absolute proteomic analysis of transporters, receptors and junction proteins for validation of human cerebral microvascular endothelial cell line hCMEC/D3 as a human blood-brain barrier model. Molecular Pharmacolgy. 10 (1), 289-296 (2013).
- Urich, E., Lazic, S. E., Molnos, J., Wells, I., Freskgard, P. O. Transcriptional profiling of human brain endothelial cells reveals key properties crucial for predictive in vitro blood-brain barrier models. PLoS One. 7 (5), e38149 (2012).
- Lopez-Ramirez, M. A., et al. Cytokine-induced changes in the gene expression profile of a human cerebral microvascular endothelial cell-line, hCMEC/D3. Fluid Barrier CNS. 10 (27), (2013).
- Cucullo, L., et al. Immortalized human brain endothelial cells and flow-based vascular modeling: a marriage of convenience for rational neurovascular studies. Journal of Cerebral Blood Flow Metabolism. 28 (2), 312-328 (2008).
- Lippmann, E. S., et al. Derivation of blood-brain barrier endothelial cells from human pluripotent stem cells. Nature Biotechnology. 30 (8), 783-791 (2012).
- Boyer-Di Ponio, J., et al. Instruction of circulating endothelial progenitors in vitro towards specialized blood-brain barrier and arterial phenotypes. PLoS One. 9 (1), e84179 (2014).
- Cecchelli, R., et al. A stable and reproducible human blood-brain barrier model derived from hematopoietic stem cells. PLoS One. 9 (6), e99733 (2014).
- Lippmann, E. S., Al-Ahmad, A., Azarin, S. M., Palecek, S. P., Shusta, E. V. A retinoic acid-enhanced, multicellular human blood-brain barrier model derived from stem cell sources. Science Reports. 4, 4160 (2014).
- Lim, R. G., et al. Huntington's Disease iPSC-Derived Brain Microvascular Endothelial Cells Reveal WNT-Mediated Angiogenic and Blood-Brain Barrier Deficits. Cell Reports. 19 (7), 1365-1377 (2017).
- Stins, M. F., Badger, J., Sik Kim, K. Bacterial invasion and transcytosis in transfected human brain microvascular endothelial cells. Microbiological Pathogens. 30 (1), 19-28 (2001).
- Gaschignard, J., et al. Neonatal Bacterial Meningitis: 444 Cases in 7 Years. Pediatric Infectious Disease Journal. 30 (3), 212-217 (2011).
- Hussain, M. . The Effect of Glycation on the Permeability of an in vitro Blood-brain Barrier Model. , (2015).
- Weber, V. . The effect of glycation on the permeability of human blood-brain barrier. , (2019).
- Hussain, M., et al. Novel insights in the dysfunction of human blood-brain barrier after glycation. Mechanism of Ageing Development. 155, 48-54 (2016).
- Choi, C. Bacterial meningitis in aging adults. Clinical Infectious Disease. 33 (8), 1380-1385 (2001).
- Furth, A. J. Glycated proteins in diabetes. British Journal of Biomedical Science. 54 (3), 192-200 (1997).
- Sajithlal, G. B., Chithra, P., Chandrakasan, G. Advanced glycation end products induce crosslinking of collagen in vitro. Biochimica and Biophysica Acta. 1407 (3), 215-224 (1998).
- Ray, R., Juranek, J. K., Rai, V. RAGE axis in neuroinflammation, neurodegeneration and its emerging role in the pathogenesis of amyotrophic lateral sclerosis. Neuroscience and Biobehavior Reviews. 62, 48-55 (2016).
- DeBault, L. E., Cancilla, P. A. Gamma-Glutamyl transpeptidase in isolated brain endothelial cells: induction by glial cells in vitro. Science. 207 (4431), 653-655 (1980).
- Diglio, C. A., Grammas, P., Giacomelli, F., Wiener, J. Primary culture of rat cerebral microvascular endothelial cells. Isolation, growth, and characterization. Laboratory Investigation. 46 (6), 554-563 (1982).
- Buchert, M., Turksen, K., Hollande, F. Methods to examine tight junction physiology in cancer stem cells: TEER, paracellular permeability, and dilution potential measurements. Stem Cell Reviews. 8 (3), 1030-1034 (2012).
- Gibson, B., Wilson, D. J., Feil, E., Eyre-Walker, A. The distribution of bacterial doubling times in the wild. Proceedings of the Royal Society B: Biological Sciences. 285 (1880), (2018).
- Pron, B., et al. Interaction of Neisseria maningitidis with the components of the blood-brain barrier correlates with an increased expression of PilC. Journal of Infectious Diseases. 176 (5), 1285-1292 (1997).
- Iovino, F., Orihuela, C. J., Moorlag, H. E., Molema, G., Bijlsma, J. J. Interactions between blood-borne Streptococcus pneumoniae and the blood-brain barrier preceding meningitis. PLoS One. 8 (7), e68408 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены