Method Article
Измерение естественной киллерной клеточной цитотоксичности и миграции в контексте опухолевых клеток печени
В этой статье
Резюме
Уклонение естественного убийцы (NK) клеточной опосредованности рака клетки имеет важное значение для развития рака и прогрессирования. Здесь мы представляем два протокола, основанные на нерадиоактивности, для оценки цитотоксичности, опосредованной клетками НК, к опухолевым клеткам печени. Кроме того, представлен третий протокол для анализа миграции ячейки НК.
Аннотация
Естественные клетки-убийцы (НК) являются подмножеством популяции цитотоксических лимфоцитов врожденной иммунной системы и участвуют в качестве первой линии защиты, очищая патогенные, злокачественные и подчеркнутые клетки. Способность НК-клеток искоренить раковые клетки делает их важным инструментом в борьбе с раком. Несколько новых иммунных терапии находятся под следствием для лечения рака, которые полагаются либо на повышение активности клеток НК или повышение чувствительности раковых клеток к НК клеточной опосредованной ликвидации. Однако для эффективного развития этих терапевтических подходов необходимы также экономически эффективные анализы in vitro для мониторинга цитотоксичности и миграции, опосредоченной клетками НК. Здесь мы представляем два протокола in vitro, которые могут надежно и воспроизводно контролировать влияние цитотоксичности НК-клеток на раковые клетки (или другие клетки-мишени). Эти протоколы не основаны на радиоактивности, просты в настройке и могут быть масштабированы для скрининга с высокой пропускной связью. Мы также представляем протокол на основе цитометрии потока для количественного мониторинга миграции нк-клеток, который также может быть масштабирован для скрининга высокой пропускной силы. В совокупности эти три протокола могут быть использованы для мониторинга ключевых аспектов активности НК-клеток, которые необходимы для способности клеток искоренить дисфункциональные целевые клетки.
Введение
Способность человеческого организма выявлять несамостоятельно и искоренять посторонние предметы является ключом к выживанию человека против патогенных микроорганизмов и злокачественных новообразований1. Иммунный ответ человека играет самую важную роль в этом процессе2,3,4. Основываясь на ключевых характеристиках и функциях, иммунная система человека может быть широко классифицирована на две основные функциональные группы: адаптивную иммунную систему и врожденную иммунную систему. Адаптивная иммунная система, как правило, специфична для данного патогена и имеет иммунологическую память и, таким образом, является длительной и реагировать на будущие повторной инфекции тем же патогеном5,6,7,8,9. В отличие от этого, врожденный иммунитет гораздо шире в своем целевом искоренении и относительно неспецифический. Поэтому, как правило, врожденный иммунный ответ служит первой линией иммунологической защиты10. Естественные клетки-убийцы (НК) принадлежат к врожденной иммунной системе и составляют 10-15% от общего числа циркулирующих лимфоцитов11. НК-клетки искореняются через два основных механизма. Во-первых, при связывании к клеткам-мишеням, выражающим активизирующие лиганды, НК-клетки высвобождают мембранно-разрушающий белок перфорин и сывороточный протеина гранзимы через экзоцитоз, которые совместно вызывают апоптоз в клетках-мишенях12,13,14,15. Кроме того, НК-клетки, выражающие FasL и некроз опухоли некроз фактора, связанного с апоптозом,индуцирующих лиганд (TRAIL) взаимодействуют с клетками-мишенями, выражающими рецепторы смерти (Fas/CD95), что приводит к caspase-зависимый апоптоз16. Самое главное, НК-клетки не требуют предварительной стимуляции, такие как антиген презентации, для искоренения патогенных инфицированных или злокачественных клеток; таким образом, они, как правило, в состоянии готовых к убийству17,18. Для того, чтобы ингибировать развитие опухоли и прогрессирование и искоренить раковые клетки, НК-клетки должны мигрировать в место опухоли и, оказавшись в микроокружении опухоли, определить и атаковать клетки-мишени.
В прошлом функции эффектора НК-клеток в основном контролировались дегрануляцией и цитотоксичностью19,20,21. Цитотоксичность клеток НК также может быть измерена 51хромом высвобождение асссы22,23,24,25. Однако этот асси имеет некоторые специфические требования, включая необходимость в счетчике гамма-накидк, и основан на радиоактивности, что требует обучения обращению и утилизации радиоактивных материалов и представляет уровень риска для пользователя. Таким образом, было разработано и использовано несколько новых анализов, не связанных с радиоактивностью, для изучения активности НК-клеток.
Здесь мы описываем два таких протокола, колористая молочная дегидрогеназа (LDH) измерения на основе НК клеточной опосредованной цитотоксичности анализ и кальцийна ацетометил (AM) окрашивания основе микроскопического метода для измерения НК клеточной опосредованной рака ячейки искоренения. Эти анализы не требуют использования радиоизотопов, являются простыми, чувствительными и воспроизводимыми факторами, модулирующих функцию нк-клеток. Кроме того, поскольку функция ячейки НК не может быть полностью оценена без мониторинга изменений в миграции нк-клеток, мы также представляем количественный метод на основе цитометрии потока для мониторинга миграции нк-клеток.
протокол
1. Подготовка культуры Средний для NK клеток и печенок опухолевых клеток
- Используйте естественные клетки-убийцы человека (например, NK92MI) и линию клеток рака печени человека (например, SK-HEP-1).
- Подготовка NK клеточной культуры среды для NK92MI человеческих клеток НК, добавив следующие компоненты до 500 мл минимальной существенной средней альфа Орла без рибонуклеозидов и дезсирибонуклеозидов к указанным конечным концентрациям: 0,02 мМ фолиевой кислоты (100 л 100 мм фолиевой кислоты), 0,2 мМ миоиноситол (500 м00 м/ 0,1 мМ-меркаптоэтанол (3,5 л из 14,3 М-меркаптоэтанол), 2 мМ Л-глютамин (5 мл 200 мм L-глутамина), 1% пенициллин/стрептомицин (5 мл 100x пеникиллин/streptomycin сыворотки (FBS), и 12,5% лошадиной сыворотки. Смешайте и процедите стерилизовать с помощью 0,22 мкм стерильной фильтрации единицы, и хранить при 4 градусах Цельсия.
- Подготовка среды среды для печеночной линии опухолевых клеток SK-HEP-1, добавив 10% FBS и 1% пенициллин / стрептомицин с высоким содержанием глюкозы Dulbecco в модифицированных Eagle среды (DMEM), содержащий 2 мМ L-глутамамин.
2. Колориметрические LDH Измерения на основе НК Клеточной опосредованной цитотоксичности Анализ
- Выращивайте SK-HEP-1 до 70-80% в 100-мм клеточной культуре Петри блюдо в 5% CO2 при 37 градусах По Цельсию в инкубаторе CO2. Создание одноклеточной подвески с помощью первых стиральных клеток с 5 мл 1x фосфат-буферного соления (PBS) с последующим инкубации с 1 мл 0,25% трипсин-ЭДТА в 5% CO2 при 37 градусах По Цельсия в инкубаторе CO2 до тех пор, пока не будет создана подвеска одной клетки.
ПРИМЕЧАНИЕ: Активность клеток НК может быть вызвана подчеркнул раковых клеток из-за изменений в экспрессии НК клеточной активации лиганд в раковых клетках. Таким образом, здоровые и суб-слияние раковых клеток должны быть использованы для точных результатов. Важно также отметить, что рецепторы и лиганды НК-клеток могут быть чувствительны к трипсиизации26,27. Таким образом, протокол протрипсинации должен быть тщательно оптимизирован и следует избегать чрезмерной трипсинизации. - После trypsinization, добавить 10 мл SK-HEP-1 культуры среднего и центрифуги на 160 х г в течение 3 мин в 15 мл стерильной конической центрифуги трубки. Вымойте клеточные гранулы с 5 мл 1x PBS и повторно в 5 мл культуры среды.
- Параллельно центрифуга NK92MI клеток на 160 х г в течение 3 мин в 15 мл стерильной центрифуги трубки. Вымойте клеточные гранулы с 5 мл 1x PBS и повторно в 5 мл NK92MI клеточной культуры среды.
ПРИМЕЧАНИЕ: NK92MI клетки выращиваются в среде культуры клеток НК и получены аналогичным образом, как описано в шаге 2.1. - Подсчитайте клетки SK-HEP-1 и NK92MI с помощью гемоситометра или любого доступного автоматизированного счетчика клеток.
- Добавьте клетки SK-HEP-1 (целевые ячейки) (1 x 104/100 л/ну) и NK92MI (эффекторные клетки) (1 х 105/100 Л/ну) в соотношении 1:10 target:effector и семян в тройных колодцах в 96 хорошей пластине.
- Инкубировать 96 хорошо пластины при 37 градусов по Цельсию в атмосфере 95% воздуха и 5% CO2 на 3 ч. После инкубации, центрифуга пластины на 450 х г в течение 5 минут при комнатной температуре.
- Не нарушая клеточные гранулы, соберите 100 злител с каждой скважины и перенесите в колодец в новой пластине 96 колодцев.
- Добавьте 50 кЛ субстрата ЛДГ, хорошо перемешайте и инкубируйте тарелку в течение 20 минут при комнатной температуре в темноте.
- Остановите реакцию, добавив 50 л стоп-раствора (50% диметилформамид и 20% сульфат натрия додецил при рН 4,7). Немедленно измерьте поглощение плиты на 490 nm и 680 nm используя считыватель плиты.
- Вычесть абсорбцию на 680 нм от абсорбции на 490 нм. Рассчитать процент (%) Цитотоксичность клеток НК с использованием формулы ниже.

где LDH экспериментальных (эффектор и целевые клетки) является поглощение NK92MI клеток и SK-HEP-1 клетки, LDH эффектор ныеклетки является поглощение NK92MI клеток в одиночку, LDH спонтанной является поглощение SK-HEP-1 клеток в одиночку, и LDH максимальный является поглощение SK-HEP-1 ячейки с буфером излишний.
ПРИМЕЧАНИЕ: Чтобы уменьшить помехи сыворотки, всегда используйте следующие элементы управления: целевые клетки в одиночку (SK-HEP-1), только клетки-эффекторы (NK92MI), целевые клетки с буфером лиза в качестве полного контроля лиза, целевая ячейка среды, NK92MI среды, а также целевой среды ячейки и NK92MI среда в соотношении 1:1.
3. Calcein AM окрашивания основе микроскопический метод для измерения NK клеточной опосредоченной цитотоксичности
- Культура SK-HEP-1 ячейки до 70-80% confluency. Создание одноклеточной подвески с помощью первых стиральных клеток с 5 мл 1x PBS с последующей инкубации с 1 мл 0,25% трипсин-EDTA.
- Центрифуги SK-HEP-1 в стерильной центрифуге 1 мл при 160 х г в течение 3 мин. Отрежь гранулу в 3 мл безсыворотки DMEM.
- Добавьте 1,5 л раствора кальцина AM (10 мМ) в клетки SK-HEP-1 и инкубируйте в течение 30 минут при комнатной температуре. Centrifuge calcein AM-маркированных SK-HEP-1 клеток на 160 х г в течение 3 мин в 15 мл стерильной центрифуги трубки.
- Вымойте клетки дважды с 5 мл 1x PBS для удаления избыточного кальцеина AM красителя.
- Параллельно, центрифуги NK92MI клетки на 160 х г в течение 3 мин в 15 мл стерильной центрифуги трубки. Вымойте клеточные гранулы один раз с 5 мл 1x PBS и повторно в 5 мл NK92MI клеточной среды.
- Подсчитайте calcein AM-помеченные SK-HEP-1 клетки и NK92MI клетки с помощью гемоцитометра или автоматизированного счетчика клеток.
- Resuspend SK-HEP-1 клетки в среде культуры на 1 х 105 ячеек/мл и NK92MI клеток на 1 х 106 клеток / мл в НК ячейки среды.
- Плита calcein AM-помечены SK-HEP-1 клетки (целевые клетки) (1 х 104/100 Л /хорошо) с NK92MI клеток (эффекторные клетки) (1 х10 5/100 Л / хорошо) (1:10 цель: коэффициент эффектора) в хорошо в тройной скважины в 96 хорошо пластины.
- Инкубировать 96 хорошо пластины при 37 градусов по Цельсию в атмосфере 95% воздуха и 5% CO2 на 4 ч. После инкубации, захват флуоресценции изображения кальцийна AM помечены клетки с помощью флуоресцентного микроскопа при 10x увеличение. Захват по крайней мере 10 различных полей каждого репликации для каждого условия лечения.
- Случайно выберите 10 изображений для каждого репликации и подсчитайте кальцийн AM-положительные помеченные целевые клетки, инкубированные с или без клеток NK92MI. Рассчитайте% цитотоксичность с помощью формулы ниже.

ПРИМЕЧАНИЕ: В качестве контроля, использовать целевые клетки без NK92MI клеток и полностью лисиц целевых клеток в качестве полного контроля лиза. Для полного лисиса инкубировать клетки в 0,5% Triton X-100 на 1 ч (20 л 5% Triton X-100 в 200 ЗЛ культурных носителей).
4. NK Сотовый миграционный контроль
- Выращивайте клетки NK92MI и центрифуги на уровне 160 х г в течение 3 мин в стерильной центрифуге 15 мл.
- Вымойте клетки гранулы дважды с 5 мл 1x PBS и повторной работы клеток в 3 мл сыворотки свободной NK92MI клеточной среде. Подсчитайте клетки NK92MI с помощью гемоцитометра или автоматизированного счетчика клеток.
- Плита NK92MI клетки (2,5 х 105 ячеек/100 л/ну) в верхнем отсеке трансвелл проницаемой камеры (6,5 мм диаметр вставки и 5 мкм размер пор).
- В нижнюю камеру добавить 0,6 мл среды, свободной от сыворотки, содержащей материал для проверки на свойства хемоатантанта НК-клеток (например, кондиционируемая среда, хемокины, цитокины).
ПРИМЕЧАНИЕ: При подготовке кондиционированной среды, использовать уменьшенную сыворотку среды без добавления сыворотки для устранения вмешательства из сывороточных белков в миграции анализ. - Инкубировать 24 хорошо проницаемые камеры при 37 градусах по Цельсию на 4 ч. После 4 ч соберите непридерживающихся и мигрировали nk92MI клетки из нижней камеры и передать их флуоресценции активированных клеток сортировки (FACS) трубки для дальнейшего анализа.
ПРИМЕЧАНИЕ: Время культуры может варьироваться в зависимости от типа целевых ячеек, а также количества и кинетики хемокинов, производимых клетками-мишенями. Таким образом, это время должно быть эмпирически определены для каждого типа клеток, хемокин, и эксперимент. - Добавьте предопределенное количество подсчитывающих бусин для цитометрии потока в объеме 50 Зл в каждую трубку, содержащую мигрированные НК-клетки. Оцените объем 300 Л/ хорошо клеточной подвески с помощью любого цитометра потока, способного автоматизированного подсчета клеток на основе FACS.
ПРИМЕЧАНИЕ: Смешайте или вихрь-смешать подсчет абусы для потока цитометрии тщательно каждый раз перед использованием, чтобы обеспечить постоянное количество шариков используется для сведения к минимуму экспериментальной изменчивости. Обратный пипеттинг рекомендуется с кол-бисером для поддержания точности. Используйте только НК-клетки и подсчета бусин для потока цитометрии в качестве контроля анализа FACS. Авторы рекомендуют читать по крайней мере 10000 шариков и НК-клеток вместе взятых, количество, которое работало хорошо. Однако это число может варьироваться в зависимости от экспериментальных условий. Таким образом, комбинированное количество шариков и НК-клеток должно быть эмпирически определено для каждого типа эксперимента. Кроме того, важно проводить эксперименты с использованием биологических трипликетов для достижения статистически значимых результатов и учета изменчивости между различными клетками. - Рассчитайте абсолютное число мигрированных клеток NK92MI с помощью этой формулы:
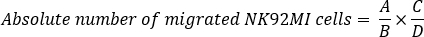
где A - количество ячеек, B - количество шариков, C - назначено количество шариков лота (количество подсчитывающих шариков для цитометрии потока/50 qL; в этом примере 49,500), и D- объем выборки (КЛ).
ПРИМЕЧАНИЕ: Если 300 qL объема выборки (мигрированных клеток) используется для анализа FACS с 50 qL подсчета шариков для потока цитометрии, абсолютное количество мигрированных клеток - 1700 клеток /3300 событий шариков х 49500 бусин/300 л и 84,975 клеток/ л. Расчет должен быть исправлен, если образец разбавлен или если используется другой объем шариков подсчета FACS.
Результаты
Анализы цитотоксичности клеток НК и анализ миграции нк-клеток были выполнены с использованием линии печеночных опухолевых клеток SK-HEP-1 в качестве модельной системы. Для измерения цитотоксичности нк-клеток с помощью ассссы LDH, SK-HEP-1 клетки, выражающие либо неспецифические (NS) shRNA или shRNA ориентации активации транскрипции фактор 4 (ATF4) были инкубированы с nk92MI клеток в 96 хорошо пластины для 3 ч (Рисунок 1A). Ранее было показано, что ATF4 регулирует цитотоксичность клеток НК путем upregulating активирующего лигандul ULBP128. Активность LDH, связанная с убийством целевых ячеек, опосредованных клетками НК, измерялась колориметрически, а процент цитотоксичности рассчитывался с использованием формулы, описанной в протоколе 1. AtF4 нокдаун значительно снизил NK клеточной цитотоксичности по сравнению с НК клетки, выражающие NS shRNA(Рисунок 1B-D). Мы также измерили цитотоксичность клеток НК с помощью кальцийна AM окрашивания основе ассе. С этой целью, SK-HEP-1 клетки, выражающие NS shRNA или ATF4-таргетингаshRNAs были помечены кальцийн AM и инкубируется с NK92MI клеток в 96 пластин хорошо для 4 ч, как показано на рисунке 2A. После инкубации изображения кальциева AM-позитивных клеток были получены флуоресценцией с помощью фильтра FITC/GFP. Клетки, убитые КЛЕТКами НК, не обнаруживаются этим подходом, потому что они больше не сохраняют красителя кальцина AM. Как показано на рисунке 2B, C, количество кальцийна AM-положительных SK-HEP-1 клеток уменьшается после совместной культуры с клетками NK92MI по сравнению с SK-HEP-1 клетки, выращенные без клеток NK92MI. Однако, как и ожидалось, ATF4 нокдаун через shRNA сократили НК ячейки опосредованного убийства SK-HEP-1 клеток, наблюдается большее количество кальцийна AM-положительных клеток (Рисунок 2B, C). Таким образом, как LDH основе и кальцийн AM анализы показали последовательные результаты и подтвердил, что ATF4 нокдаун снижает NK-опосредованного цитотоксичности раковых клеток. Любой из этих анализов достаточно для оценки НК клеточной цитотоксичности; однако, мы рекомендуем использовать оба метода для повышения как строгости, так и уверенности в результатах.
Мы также представляем результаты 24 хорошо НК ячейки миграции комитета. Клетки NK92MI были перевешены в среду NK92MI в сыворотке крови, а в нижнюю проницаемую камеру были добавлены хемокин, мотив CC, лиганд 2 (CCL2). Миграция нк-клеток была происирована, как описано в разделе 3(Рисунок 3A). Количество мигрированных клеток NK92MI было количественно оценено путем добавления подсчитывающего бисера для цитометрии потока и после анализа FACS. Как показано на рисунке 3B-C, произошло значительное увеличение числа клеток NK92MI, которые мигрировали в сторону CCL2-содержащей среды по сравнению с контрольной средой.

Рисунок 1: Колориметрический LDH деятельности на основе НК клеточной цитотоксичности анализ. (A) Схема, изображающая ключевые шаги колоритной активности LDH на основе NK клеточной цитотоксичности анализ. (B, C) Выражение ATF4 анализировалось в ячейках SK-HEP-1, выражающих либо неспецифическую (NS) shRNA, либо шРНК, нацеленную на ATF4 по количественным ПОКАЗАТЕЛЯМ РТ-ПЦР и западным промотированием. (B) Относительный уровень ATF4 мРНК показан после нормализации до уровня ACTINB в SK-HEP-1 клеток, выражающих NS shRNA или ATF4 shRNAs. (C) уровни белка ATF4 и ACTINB в клетках SK-HEP-1, выражающие NS shRNA или ATF4 shRNAs. (D) NK клеточной цитотоксичности был проанализирован в SK-HEP-1 клеток, выражающих либо NS shRNA или ATF4 shRNAs методом LDH. Процент (%) Показана цитотоксичность, опосредоваваемый клетками НК. Данные представлены в виде средних - SEM; ns, не значительные; Злт; 0,01, зюп-л; 0,001. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
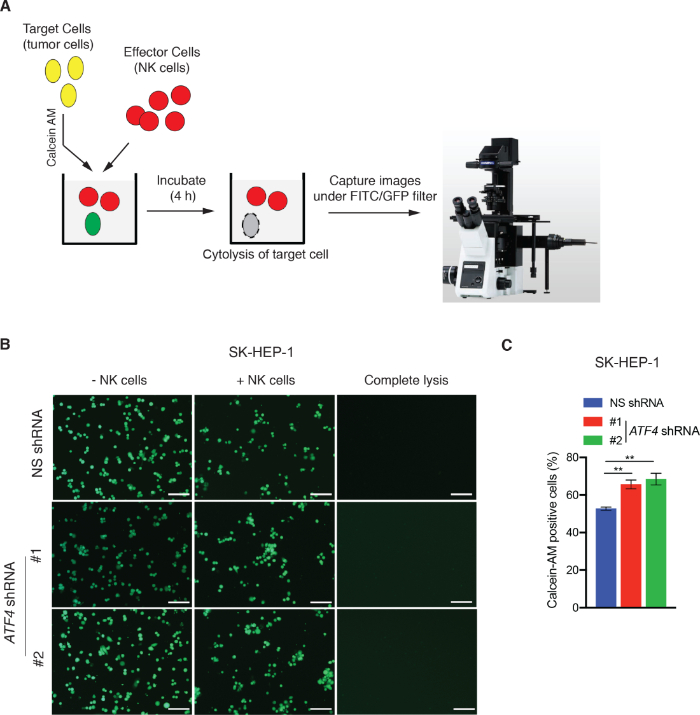
Рисунок 2: Calcein AM окрашивания на основе микроскопического метода для измерения НК клеточной цитотоксичности. (A) Схема, изображающая ключевые шаги кальциена AM окрашивания на основе микроскопического метода для измерения НК клеточной цитотоксичности. (B) NK клеточной опосредованной цитотоксичности был проанализирован в SK-HEP-1 клеток, выражающих либо NS shRNA или ATF4 shRNAs с использованием метода calcein AM. Отображаются репрезентативные изображения. Шкала бар 200 мкм. (C) Процент кальциев AM-положительных ячеек для эксперимента, представленного в панели B. З.п. Злт; 0,01. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
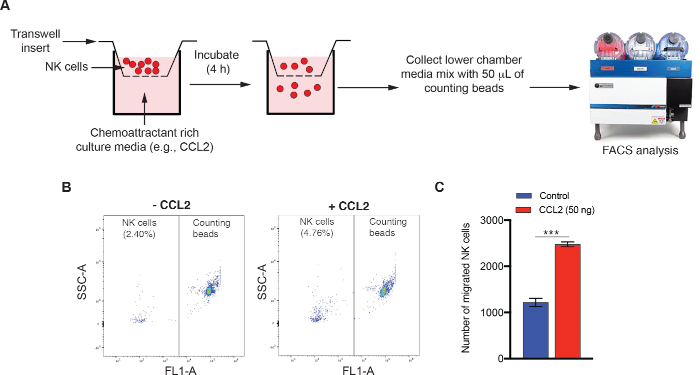
Рисунок 3: На основе FACS количественный контроль миграции НК-клеток. (A) Схема, изображающая ключевые шаги на основе FACS НК-ячейки миграции асссе. (B, C) НК ячейки миграции ассебыл был проведен после добавления 50 нг CCL2 в нижней камере 24 хорошо пластины. (B) Представитель NK ячейки миграции точка участков для контроля или CCL2-обработанных среды культуры показаны. (C) данные миграции ячейки НК (средний - SEM) представлены для эксперимента, показанного в панели B. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Цитотоксичность и методы миграции, описанные здесь, могут быть использованы для оценки цитотоксичности клеток НК к раковым клеткам и опосредованным клетками НК механизмами иммунного уклонения при злокачественных опухолях, а также для выявления терапевтических агентов, которые улучшат активность/функцию НК-клеток. Протоколы являются простыми, чувствительными, воспроизводимыми и предпочтительными альтернативами классической радиоактивности на основе 51анализ умного хрома. Протоколы были специально разработаны, чтобы быть легко адаптируемыми для использования в большинстве лабораторий, с простыми колористическими, микроскопическими или FACS основе считывания, которые легко интерпретировать, что позволяет исследователям прийти к надежным выводам. Все они масштабируемы для высокопроизводительных подходов к скринингу. Хотя протоколы представлены в контексте одной печеночной линии опухолевых клеток, они могут быть легко адаптированы к другим типам раковых клеток и /или другим нераковым целевым клеткам.
В то время как все представленные методы являются надежными и воспроизводимыми, межэкспериментальные изменения могут происходить с различными партиями раковых клеток и НК-клеток. Для того, чтобы результаты точно поддержили выводы экспериментов, желательно повторить эксперимент не менее двух раз с помощью биологических триплики.
Ограничение этого метода заключается в том, что темпы роста клеток NK92MI могут быть медленными. Поэтому для экспериментов с 50 или более проб необходимо заранее вырастить достаточное количество NK92MI, чтобы предотвратить задержки. Кроме того, все элементы контроля, описанные в протоколах, должны быть реализованы, чтобы избежать ложных и невоспроизводимых результатов. Еще одно ограничение анализ цитотоксичности НК является то, что отношение НК к раковым клеткам, а также время инкубации, должны быть оптимизированы для каждой целевой клетки. Например, мы протестировали различные соотношения раковых клеток к НК-клеткам (1:5, 1:10, 1:20, 1:40 и 1:80) для линий клеток печеночной рака, а также несколько инкубационных раз (2, 3, 4, 5 и 6 ч). На основе наших результатов мы наблюдали наиболее последовательные результаты с 1:10 и 1:20 соотношения раковых клеток к НК-клеток и инкубации в течение 3 ч.
Кроме того, раковые клетки, полученные из твердых опухолей, будут прикрепляться и расти на поверхности культурной пластины, в то время как клетки НК растут в суспензии. Если время инкубации больше 3 ч, желательно использовать ультранизкое крепление 96 скважин, что улучшит консистенцию и воспроизводимость между экспериментами и биологическими репликациями. Важно также отметить, что АНАЛИЗы цитотоксичности, индуцированной клетками НК, также могут быть выполнены с использованием первичных НК-клеток, изолированных от периферических моноядерных клеток крови (ПБМК). Однако, Есть несколько ограничений с такими экспериментами. Во-первых, эти эксперименты не могут быть так же легко масштабироваться, как с клетками NK92MI. Во-вторых, вариант пакетной к пакетной цитотоксикической активности НК-клеток, изолированных от ПМБК, может быть проблематичным с точки зрения воспроизводимости и интерпретации результатов. Аналогичным образом, другие человеческие линии клеток НК описаны в литературе и могут быть использованы в этих типах экспериментов, в том числе NKL клетки29; однако, в отличие от клеток NK-92MI, клетки NKL зависят от IL-2 и не доступны на коммерческой основе.
При рассмотрении calcein AM эксперименты описаны, важно отметить, что кальцийн AM остается в апоптотические тела после клеточной смерти30. Поэтому следует тщательно проводить количественную оценку окрашивания кальцина AM, так как это может привести к недооценке цитотоксичности НК.
Подобно цитотоксичности, опосредованной от НК, модуляция миграции клеток НК цитокинов и других хемоатантантантантов играет важную роль в регуляции функции клеток НК. Анализ миграции клеток НК, описанный здесь, предоставляет простую платформу для оценки миграции клеток НК в контексте стимула, такого как хемокин или химиоатантант. Этот ассес может быть использован для оценки агентов, которые могут либо способствовать или вмешиваться в миграцию ячейки НК - таким образом, выявление усилителей и репрессаторов миграции ячейки НК. Этот метод также может быть полезен для изучения регулятивного потенциала миграции клеток НК в результате генетических/эпигенетических изменений (упругой или низшую часть регулирования) или возникающих в результате лечения наркоманией.
Для точного измерения миграции нк-клеток необходимо предпринять несколько критических шагов. Для всех экспериментов с использованием условной среды, важно, чтобы эквивалентная кондиционированная среда будет использоваться как из условий контроля, так и для обработки для получения точных измерений. Время инкубации будет меняться с очищенными химиоаттантами и кондиционированной средой. Наконец, анализы трансвелл миграции хорошо зарекомендовали себя и считаются отличным методом оценки миграции нк-клеток; однако, однородные монокультуры, используемые в анализах, не имеют сложной физиологии тканей или даже 3D культур, которые могли бы более точно имитировать микроокружение опухоли.
Таким образом, хотя есть некоторые ограничения на НК клеточной цитотоксичности анализы и НК миграции анализ представлен в этой статье, эти анализы применимы к широкому спектру иммунологических исследований и, таким образом, обеспечивают важные и надежные методы для оценки НК ячейки функции и НК модуляторной иммунной терапии.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы с благодарностью отмечаем гранты от Национальных институтов здравоохранения: R01CA195077-01A1 (NW), R01CA200919-01 (NW) и 1R01 CA218008-01A1 (NW). Мы также признаем Министерство обороны финансирования W81XWH1910480 и W81XWH-18-1-0069 на северо-запад.
Материалы
| Name | Company | Catalog Number | Comments |
| Absolute counting beads | Thermo Fisher Scientific | C36950 | |
| Alpha-MEM | Sigma-Aldrich | M4256 | |
| Amicon ultra Centrifugal filters | Millipore | UFC900324 | |
| Calcein AM dye | Sigma-Aldrich | 17783 | |
| DMEM | Gibco | 11965-092 | |
| Fetal Bovine Serum | Gibco | 26140079 | |
| Folic Acid | Sigma-Aldrich | F8758 | |
| Horse Serum | Gibco | 16050114 | |
| L-Glutamine (200 mM) | Gibco | 2530081 | |
| LDH cytotoxic assay Kit | Thermo Fisher Scientific | 88953 | |
| myo-Inositol | Sigma-Aldrich | I5125 | |
| NK92MI cells | ATCC | CRL-2408 | |
| Opti-MEM | Gibco | 31985070 | |
| Phosphate Buffer Saline (PBS) | Sigma-Aldrich | P4417 | |
| SKHEP-1 Cells | ATCC | HTB-52 | |
| Transwell permeable chambers | Costar | 3241 | |
| Trypsin EDTA solution | Gibco | 25200056 |
Ссылки
- Chiossone, L., Dumas, P. Y., Vienne, M., Vivier, E. Natural killer cells and other innate lymphoid cells in cancer. Nature Reviews Immunology. 18 (11), 671-688 (2018).
- Borghaei, H., Smith, M. R., Campbell, K. S. Immunotherapy of cancer. European Journal of Pharmacology. 625 (1-3), 41-54 (2009).
- Kalbasi, A., Ribas, A. Tumour-intrinsic resistance to immune checkpoint blockade. Nature Reviews Immunology. , (2019).
- Zhang, Q., Cao, X. Epigenetic regulation of the innate immune response to infection. Nature Reviews Immunology. 19 (7), 417-432 (2019).
- Janeway, C. A. The immune system evolved to discriminate infectious nonself from noninfectious self. Immunol Today. 13 (1), 11-16 (1992).
- Natoli, G., Ostuni, R. Adaptation and memory in immune responses. Nature Immunology. 20 (7), 783-792 (2019).
- Cooper, M. D., Alder, M. N. The evolution of adaptive immune systems. Cell. 124 (4), 815-822 (2006).
- Riera Romo, M., Perez-Martinez, D., Castillo Ferrer, C. Innate immunity in vertebrates: an overview. Immunology. 148 (2), 125-139 (2016).
- Sonnenberg, G. F., Hepworth, M. R. Functional interactions between innate lymphoid cells and adaptive immunity. Nature Reviews Immunology. 19 (10), 599-613 (2019).
- Vivier, E., et al. Innate or adaptive immunity? The example of natural killer cells. Science. 331 (6013), 44-49 (2011).
- Shi, F. D., Ljunggren, H. G., La Cava, A., Van Kaer, L. Organ-specific features of natural killer cells. Nature Reviews Immunology. 11 (10), 658-671 (2011).
- Trapani, J. A., Davis, J., Sutton, V. R., Smyth, M. J. Proapoptotic functions of cytotoxic lymphocyte granule constituents in vitro and in vivo. Current Opinion in Immunology. 12 (3), 323-329 (2000).
- Krzewski, K., Strominger, J. L. The killer's kiss: the many functions of NK cell immunological synapses. Current Opinion in Cell Biology. 20 (5), 597-605 (2008).
- Berke, G. The binding and lysis of target cells by cytotoxic lymphocytes: molecular and cellular aspects. Annual Review of Immunology. 12, 735-773 (1994).
- Abel, A. M., Yang, C., Thakar, M. S., Malarkannan, S. Natural Killer Cells: Development, Maturation, and Clinical Utilization. Frontiers in Immunology. 9, 1869 (2018).
- Zamai, L., et al. Natural killer (NK) cell-mediated cytotoxicity: differential use of TRAIL and Fas ligand by immature and mature primary human NK cells. Journal of Experimental Medicine. 188 (12), 2375-2380 (1998).
- Marcus, A., et al. Recognition of tumors by the innate immune system and natural killer cells. Advances in Immunology. 122, 91-128 (2014).
- Vesely, M. D., Kershaw, M. H., Schreiber, R. D., Smyth, M. J. Natural innate and adaptive immunity to cancer. Annual Review of Immunology. 29, 235-271 (2011).
- Alter, G., Malenfant, J. M., Altfeld, M. CD107a as a functional marker for the identification of natural killer cell activity. Journal of Immunological Methods. 294 (1-2), 15-22 (2004).
- Bryceson, Y. T., et al. A prospective evaluation of degranulation assays in the rapid diagnosis of familial hemophagocytic syndromes. Blood. 119 (12), 2754-2763 (2012).
- Shabrish, S., Gupta, M., Madkaikar, M. A Modified NK Cell Degranulation Assay Applicable for Routine Evaluation of NK Cell Function. Journal of Immunology Research. 2016, 3769590 (2016).
- Pietra, G., et al. Melanoma cells inhibit natural killer cell function by modulating the expression of activating receptors and cytolytic activity. Cancer Research. 72 (6), 1407-1415 (2012).
- Fehniger, T. A., et al. Potential mechanisms of human natural killer cell expansion in vivo during low-dose IL-2 therapy. Journal of Clinical Investigation. 106 (1), 117-124 (2000).
- Brunner, K. T., Mauel, J., Cerottini, J. C., Chapuis, B. Quantitative assay of the lytic action of immune lymphoid cells on 51-Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology. 14 (2), 181-196 (1968).
- Roder, J. C., et al. A new immunodeficiency disorder in humans involving NK cells. Nature. 284 (5756), 553-555 (1980).
- Byrd, A., Hoffmann, S. C., Jarahian, M., Momburg, F., Watzl, C. Expression analysis of the ligands for the Natural Killer cell receptors NKp30 and NKp44. PLoS One. 2 (12), e1339 (2007).
- Nitahara, A., et al. NKG2D ligation without T cell receptor engagement triggers both cytotoxicity and cytokine production in dendritic epidermal T cells. Journal of Investigative Dermatology. 126 (5), 1052-1058 (2006).
- Gowen, B. G., et al. A forward genetic screen reveals novel independent regulators of ULBP1, an activating ligand for natural killer cells. Elife. 4, e08474 (2015).
- Robertson, M. J., et al. Characterization of a cell line, NKL, derived from an aggressive human natural killer cell leukemia. Experimental Hematology. 24 (3), 406-415 (1996).
- Somanchi, S. S., McCulley, K. J., Somanchi, A., Chan, L. L., Lee, D. A. A Novel Method for Assessment of Natural Killer Cell Cytotoxicity Using Image Cytometry. PLoS One. 10 (10), e0141074 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены