Method Article
Спецификация печеночного прародителя из плюрипотентных стволовых клеток с использованием определенной системы дифференцировки
В этой статье
Резюме
Целью данной статьи является обеспечение стандартизированного подхода к индуцированию дифференцировки гениатора печенки человека из плюрипотентных стволовых клеток. Разработка этой процедуры с готовыми к использованию составами сред предлагает пользователю факционную систему для генерации клеток печени человека для биомедицинских исследований и перевода.
Аннотация
Заболевания печени — это обостряющаяся глобальная проблема здравоохранения. В то время как трансплантация печени является эффективным способом терапии, смертность пациентов увеличилась из-за нехватки донорских органов. Дефицит органов также влияет на рутинное снабжение человека гепатоцитами для фундаментальных исследований и клиники. Поэтому разработка возобновляемых источников клеток-прогениторов печени человека желательна и является целью данного исследования. Чтобы иметь возможность эффективно генерировать и развертывать прародителей печени человека в больших масштабах, была разработана воспроизводимая система дифференциации печеночных прародителей. Этот протокол способствует экспериментальной воспроизводимости между пользователями в различных форматах клеточных культур и позволяет дифференцировать как эмбриональные, так и индуцированные линии плюрипотентных стволовых клеток человека. Это важные преимущества по сравнению с современными системами дифференциации, которые улучшат фундаментальные исследования и могут проложить путь к разработке клинических продуктов.
Введение
Заболевания печени представляют собой глобальную проблему в области здравоохранения, вызывая примерно 2 миллиона смертей в год во всем мире1. Хотя существует ряд модельных систем для изучения заболеваний печени и клинического вмешательства, рутинное использование клеточных систем ограничено значительными недостатками (для обзора см. Szkolnicka et al.2). Передовые методы культуры плюрипотентных стволовых клеток человека (hPSC) и дифференцировки соматических клеток представляют собой перспективные технологии для разработки инструментов фундаментальных биомедицинских исследований и возобновляемых источников дифференцированных клеток дляклиники 3,4.
На сегодняшний день разработаны множественные протоколы дифференцировки гепатоцитоподобных клеток (ГЛК)5,6,7,8. Эти протоколы пытаются воссоздать аспекты развития печени человека с помощью комбинации малых молекул и факторов роста9,10. Большинство протоколов состоят из ступенчатого процесса дифференциации, где гПСК загрунтуются до окончательной эндодермы, за которой следует спецификация печеночных прародителя11,12,13и заканчивающаяся спецификацией HLC. CLC, производимые этими протоколами, демонстрируют смесь фенотипов плода и взрослых. Это включает экспрессию альфа-фетопротеина (АФП), такого как маркеры гепатоцитов, такие как HNF4α и альбумин (ALB), а также метаболизирующая способность препарата14,15,16. Между лабораториями дифференциация ГЛК может варьироваться; поэтому необходима разработка стандартизированных протоколов. Это позволит исследователям эффективно генерировать и применять CLC, полученные из стволовых клеток, в больших масштабах для фундаментальных и клинических исследований.
Была разработана система дифференцировки печеночных прародителя, которая может быть применена как к эмбриональным, так и к индуцированным плюрипотентным линиям стволовых клеток с использованием простых в использовании руководящих принципов. Эта процедура дает однородные популяции печеночных прародителей в различных форматах культуры, начиная от колбы для клеточных культур до 96 пластин колодца. Ниже приведен протокол получения печеночных прародителей, полученных из стволовых клеток, в форматах 24 и 96 скважин.
Плотность ячеек, используемая в протоколе, представленном ниже, указана для одной скважины из 24 и 96 скважин соответственно (см. таблицу 1). Оптимизация начального номера ячейки требуется для различных форматов пластин клеточной культуры и клеточных линий. Рекомендуемая начальная плотность ячейки для оптимизации протокола составляет 2 x 105 ячеек/см2. Для оптимизации плотности можно проверить несколько плотностей ячеек, добавив ± 50 000 ячеек/см2 одновременно.
протокол
1. Поддержание плюрипотентных стволовых клеток человека (hPSC) на ламинине-521
- Поддерживать плюрипотентные клетки человека (hPSCs) при 37 °C и 5% CO2 в 6-скважинной пластине на ламинине-521 (LN-521). Ежедневно подкармливайте клетки 2 мл поддерживающей среды стволовых клеток (т.е. среды mTeSR1) на 1лунку 6-й колодезной пластины до выбранного дня посева для дифференцировки (день 0).
- Убедитесь, что желаемая клеточная конфлюентность 70–80% достигнута до сбора клеток.
2. Многоскровневая подготовка Laminin-521 и посев hPSC для дифференцировки
ПРИМЕЧАНИЕ: Для гПСК, не поддерживаемых на LN-521 (например, матригеля или фибронектина), расщепляйте ХПСК на LN-521 и культивирование в течение 1 недели до прохождения и получения дифференцировки для повышения эффективности процесса15,17,18.
- Приготовление пластин с ламининым покрытием
- Разморозить флакон рекомбинантного LN-521 (100 мкг/мл) при 4 °C в течение 2 ч или на ночь.
- Приготовьте раствор 8 мкг/мл, разбавляя размороженный LN-521 в ледяном 1x DPBS с Ca2+/ Mg2+.
- Добавьте 0,25 мл раствора LN-521 8 мкг/мл в каждую скважину из 24 скважин или 0,05 мл в каждую скважину из 96 скважин. Аккуратно покачайте плиту из стороны в сторону, чтобы равномерно покрыть скважины раствором LN-521.
ПРИМЕЧАНИЕ: Для формата пластины из 96 скважин дозирование объема, посев клеток и изменение среды могут быть выполнены с использованием полуавтоматического трубопровода. Meseguer-Ripolles et al.19. - Запечатайте пластины с покрытием LN-521 полупрозрачной гибкой пленкой и храните при 4 °C в течение ночи перед использованием.
ПРИМЕЧАНИЕ: Пластины с покрытием LN-521 можно использовать до 2 недель при хранении при 4 °C. Избегайте высыхания колодцев, покрытых ламинином.
- В день посева клеток разогрейте предварительно покрытые пластины в инкубаторе клеточных культур при 37 °C в течение 30–60 мин.
- Аспирировать раствор LN-521.
ПРИМЕЧАНИЕ: Избегайте прямого контакта аспиратора с дном скважины, чтобы предотвратить повреждение покрытия LN-521. - Дозировать 0,5 мл поддерживающей среды стволовых клеток со свежеприготовленным ингибитором 10 мкМ Rho-ассоциированной киназы (ROCK) Y27632 в каждую скважину из 24-скважинной пластины или 0,05 мл в каждую скважину из 96-скважинной пластины. Поместите пластину в инкубатор до готовности к посеву клеток.
- В запланированный посевной день (день 0) и при стечении hPSC в 70–80% отмечают любые области спонтанной дифференциации на дне скважин 6 плиты скважины.
ПРИМЕЧАНИЕ: Спонтанная дифференцировка может быть визуализирована грубым изменением размера клетки и/или наличием различных морфологий клеток с помощью фазово-контрастной микроскопии. - Аспирировать и выбрасывать отмеченные области дифференцировки и отработанного медиума из скважин. Промыть каждую скважину 1 мл DPBS без Ca2+/ Mg2+ при комнатной температуре (RT).
- Добавьте 1 мл безферментного диссоциационного реагента (см. Таблицу материалов)в каждую скважину и инкубируйте при 37 °C в течение 8–10 мин до тех пор, пока клетки не отсоединятся от пластины.
- Используйте скребок для клеток, чтобы аккуратно отсоедовать ячейки от колодцев. Пипетка содержимого каждой скважины вверх и вниз 2–4x с пипеткой P1000 для получения одноэлементной суспензии. Для каждой клеточной линии объединяют ячейки из всех ремонтных колодцев в стерильную трубку 50 мл.
- Промыть каждую опорожненную хорошо 1 мл поддерживающей среды стволовых клеток. Добавьте промывки в соответствующую трубку, содержащую объединенные ячейки из соответствующей клеточной линии.
- Для каждой клеточной линии выполните три подсчета жизнеспособных клеток на объединенных образцах. Вычислите среднее количество живых ячеек (живых ячеек/мл) для каждой линии ячейки.
- Центрифугируют объединенные образцы при 250 х г в течение 5 мин при RT. Аспирируют супернатант, затем повторно суспендируют гранулу клетки в 1–3 мл поддерживающей среды стволовых клеток RT, только что дополненной ингибитором ROCK 10 мкМ Y27632.
- Для каждой клеточной линии рассчитайте необходимое количество ячеек на количество скважин, подготовленных на шаге 2.4 (см. таблицу 1). Повторное суспендируем необходимое количество клеток средой для поддержания стволовых клеток, только что дополненной ингибитором ROCK 10 мкМ Y27632.
- Добавьте рассчитанный объем (объемы) в колодцы подготовленных и предварительно покрытых плит с этапа 2.4 без удаления объема, добавленного ранее. Общий объем на скважину составит 1 мл для плиты из 24 скважин и 0,1 мл для плиты из 96 скважин. Аккуратно раскачивайте плиты из стороны в сторону и вперед и назад, чтобы обеспечить равномерное рассеивание клеток по всему колодезку.
ПРИМЕЧАНИЕ: Равномерное распределение клеток по скважине является ключом к обеспечению однородного посева клеток и успешной дифференцировки. - Поместите семенные пластины в инкубатор и немедленно раскачайте семенные пластины осторожно вперед и назад и из стороны в сторону, чтобы равномерно распределить клетки и поддерживать культуры при 37 ° C и 5% CO2.
3. Дифференциация гПСК на печеночных прародителей на ламинин-521
- Подготовьте среду для окончательной индукции эндодермы (стадия 1) с использованием базальной среды endoderm, дополненной правильными добавками.
- На 0-й день разморозить бутылку Endoderm Basal Medium на ночь при 4 °C.
- Приготовьте Стадию 1 Среда 1 (для использования на 1-й день) по мере необходимости.
- Добавка для оттаивания MR и добавка CJ на льду.
- Разбавляйте добавку MR и добавку CJ 1:100 в базальной среде endoderm.
- Подготовьте Stage 1 Medium 2 для использования в дни 2–4 по мере необходимости.
- Разбавлять добавку CJ 1:100 в базальной среде эндодермы.
- Подготовьте среду для последующей дифференцировки печеночных клеток-прогениторов (стадия 2) с использованием печеночной прогениторной среды.
- На 4-й день разморозить бутылку печеночных прародителя на ночь при 4 °C.
ПРИМЕЧАНИЕ: Для этого эксперимента использовался 1% пенициллин/стрептомицин (конечные концентрации 100 МЕ/мл и 100 мкг/мл соответственно). Антибиотики не требуются; использование антибиотиков по усмотрению пользователя.
- На 4-й день разморозить бутылку печеночных прародителя на ночь при 4 °C.
- На 1-й день дифференцировки удалите из скважин отработавую поддерживающую среду стволовых клеток с 10 мкм средой ROCKi Y-27632 и замените 0,5 мл полной среды стадии 1 на скважину 24-й скважинной пластины и 0,1 мл на скважину 96-й скважинной пластины.
- На 2, 3 и 4 день удалите отработанный носитель и пополните каждую скважину 0,5 мл среды стадии 2 на скважину для плиты из 24 скважин или 0,1 мл на скважину из плиты из 96 скважин.
- На 5-й день зафиксируйте скважины для окончательного анализа дифференцировки эндодермы с помощью иммуноцитохимии. Для остальных скважин удалите отработавшую среду и пополните каждую скважину 0,5 мл печеночных прогениторных дифференциаторных сред на скважину для плиты из 24 скважин или 0,1 мл на скважину плиты из 96 скважин. Снова обновите среду на 6, 7 и 9 днях.
- На 10-й день собирают колодцы для анализа дифференцировки печеночных прогениторов или приступают к дальнейшей дифференцировки гепатоцитоподобных клеток.
ПРИМЕЧАНИЕ: В этот момент образцы были либо зафиксированы 4% параформальдегидом (PFA) для иммуноцитохимического анализа, либо супернатант был собран для ИФА, и клетки были собраны для количественной оценки белка.
4. Характеристика культур дифференцировки печеночных прародителя, полученных из гПСК на ламинине-521
- На 5-й день обнаруживают экспрессию окончательных эндодерм-специфических маркеров с помощью иммуноокрашивания.
- На 10 день обнаруживают экспрессию печеночных прогенитор-специфических маркеров с помощью иммуноокрашивания.
- На 10-й день измерьте секрецию АФП и ALB с помощью ИФА с помощью набора, следуя инструкциям производителя, и нормализуйте на мг белка, как определено анализом белка бицинхониновой кислоты (BCA).
- Оценить вариабельность печеночных прогениторов пластины 96 скважин путем количественной оценки процента положительных клеток HNF4α на скважину.
5. Иммуноцитохимия и получение изображений
- В 5 и 10 дни дифференцировки промывайте ячейки 3x с 1x DPBS, с 0,5 мл на скважину 24-й плиты скважины и 0,1 мл на скважину 96-й скважинной пластины. Инкубировать тарелку с легким встряхиванием в течение 2–5 мин при РТ.
ПРИМЕЧАНИЕ: Используйте DPSB без Ca2+/ Mg2+ для иммуноцитохимии. - Зафиксируйте клетки 4% параформальдегидом (PFA) на RT в течение 15–30 мин, добавив 0,3 мл PFA на скважину для плиты из 24 скважин и 0,1 мл на скважину из 96 скважин.
- Промывайте 3x с 1x DPBS, как описано в шаге 5.1.
- Пермеабилизируйте мембрану пБСТ с использованием 0,1% анимации, 1x DPBS и инкубируйте в течение 20 мин на RT, добавляя 0,3 мл PBST на скважину 24-й плиты скважины и 0,1 мл на скважину 96-й скважинной пластины.
- Выполняют белковый блок путем инкубации клеток с 10% BSA в PBST в течение 1 ч, добавляя 0,3 мл BSA на скважину 24-й пластины и 0,1 мл BSA на скважину 96-й скважины, осторожно встряхивая с помощью пластинчатого шейкера.
- После блокировки белка замените блокирующий раствор первичным антителом, разведенным в 1% BSA в ПБСТ, и инкубируют при 4 °C с легким встряхиванием в течение ночи.
ПРИМЕЧАНИЕ: Не промывайте между белковым блоком и добавлением антител. - Через 24 ч промыть колодцы 3 раза пбст.
- Добавляют вторичное антитело в 1% BSA в PBST. Инкубировать 1 ч при РТ в темноте с легким встряхиванием.
- После вторичной инкубации антител промыть колодцы 3x с 1x DPBS и дозировать пятно Hoechst согласно инструкции производителя в течение 10 мин при RT в темноте с нежным встряхиванием.
- Стирка 3x с 1x DPBS. Пластины теперь готовы к визуализации.
ПРИМЕЧАНИЕ: Храните пластины при 4 °C в темноте до тех пор, пока не будете визуализированы. - Представьте себе многоязычную пластину с помощью микроскопа с высоким содержанием после иммуногистохимии. Получение изображения нескольких полей зрения рекомендуется для получения истинного представления о скважине. Экспрессия различных маркеров оценивалась с помощью анализа сегментации клеток с использованием коммерческого программного обеспечения (см. Таблицу материалов)(рисунок 1).
ПРИМЕЧАНИЕ: Сегментация клеток также может быть выполнена с использованием программного обеспечения с открытым исходным кодом для анализа изображений, такого как CellProfiler или Fiji20,21.
Результаты
Дифференциация печеночных прародителя от линий hESC (H9) и hiPSC (P106) выполнялась в соответствии с пошаговым протоколом, описанным на рисунке 2. Здесь плюрипотентные стволовые клетки были посеяны как одиночные клетки в пластины, покрытые LN-521, до начала дифференцировки. Слияние клеток является ключом к надежной и воспроизводимой дифференцировки. Как только было достигнуто правильное слияние(рисунок 2),началась дифференциация. На 5-й день окончательная спецификация эндодермы была оценена с помощью экспрессии Sox17. В обеих клеточных линиях Sox17 был высоко экспрессирован с 80% ± 0,5% и 87,8% ± 0,5% SEM Sox17-положительных клеток для H9 и P106 соответственно(Рисунок 3). На 10-й день печеночные прародители показали булыжную морфологию(рисунок 2). Кроме того, спецификация печеночного прародителя оценивалась для экспрессии HNF4α, AFP, ALB и цитокератина-19 (CK19), а также секреции белка AFP и ALB10,15,22 (Рисунок 4). Культуры печеночных прародителей H9 и P106 экспрессировали печеночные маркеры плода, такие как HNF4α (91% ± 0,5% и 90% ± 0,2%), AFP (89,7% ± 1,8% и 86% ± 1,2%) и CK19 (78,5% ± 3,2% и 83,6 ± 1,8%)(Рисунок 4). Секреция АФП была обнаружена на 10-й день в обеих клеточных линиях (32,4 ± 1,6 и 47,8 ± 5,9 нг/мл/мг/24 ч)(рисунок 5). Синтез альбумина наблюдался на более низких уровнях (30,7% ± 1,8% и 27,2% ± 1,1%)(Рисунок 4)и не был обнаружен с помощью ИФА(Рисунок 5).
Протокол позволил стандартизировать добычу печеночных прародителей от 24 скважин до 96 плит скважины. Полуавтоматизированный трубопровод использовался для получения 96 плит печеночных прародителей из клеточных линий H9 и P106, как описаноранее 17. Вариабельность числа клеток и эффективность дифференцировки печеночных прародителя оценивали путем количественной оценки экспрессии HNF4α. Сегментацию клеток проводили для количественной оценки белка с помощью иммунофлуоресценции с использованием инструмента визуализации с высоким содержанием(рисунок 1). На 10-й день печеночные прогениторы не показали значительной изменчивости между рядами с >94% HNF4α-положительных клеток на скважину для H9 и 97% HNF4α-положительных клеток для P106(рисунок 6).

Рисунок 1:Обзор конвейера сегментации клеток. (A) Используя исходное изображение, (B) ядерное окрашивание использовалось для сегментации ядер. (C)Был выполнен этап контроля качества ядерной сегментации на основе формы и размера для количественной оценки только четко сегментированных ядер. (D)После этого были количественно определены положительные ядра, окрашенные HNF4α. (E)Наконец, для идентификации HNF4α-экспрессивных клеток использовался порог интенсивности. В C и Eзеленые ядра представляют выделенные клетки, а пурпурные ядра указывают на выброшенные клетки. Шкала = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2:Дифференциация печеночных прародителя от гПСК. (A) Схематическое представление протокола дифференциации печеночных прародителя. (B) Репрезентативные изображения, подчеркивающие морфологические изменения во время дифференциации. В день 0 (D0) гПСК представляли собой упакованный монослой клеток. После этого на 5-й день (D5) гПСК были введены в окончательную эндодерму. За этим последовала дифференциация печеночных прародителя на 10-й день (D10). Печеночные прародители демонстрировали булыжную морфологиюклеток. Шкала = 75 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
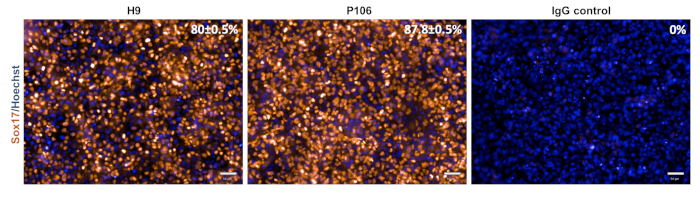
Рисунок 3: Характеристика окончательной спецификации эндодермы. На 5-й день клетки были окрашены для Sox17, окончательного маркера эндодермы. Процент Sox17-положительных клеток составил 80 ± 0,5% для H9 и 87,8 ± 0,5% для P106. Процентная количественная оценка была основана на 10 отдельных скважинах с 6 полями обзора на скважину. Данные показаны как среднее ± SEM. Шкала = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4:Характеристика печеночных прародителя. На 10-й день печеночных прародителей окрашивали на печеночные маркеры(A)HNF4α,(B)AFP и(C)ALB. Для H9 процент положительных клеток составил 91% ± 0,4%, 89,7% ± 1,8% и 30,7% ± 1,8% для HNF4α, AFP и ALB соответственно. Для P106 процент положительных клеток составил 90% ± 0,2%, 86% +/- 1,2% и 27,2% ± 1,1% для HNF4α, AFP и ALB соответственно. (D)Потенциал линии холангиоцитов оценивали с помощью экспрессии CK19; Гениторы печенки, полученные из H9, экспрессировали 78,5% ± 3,2% CK19-положительных клеток, тогда как 83,6% ± 1,8% CK19-положительных клеток наблюдались для печеночных прогениторов P106. Окрашивание иммуноглобулином G (IgG) использовалось в качестве контроля окрашивания. Процентная количественная оценка была основана на 10 отдельных скважинах с 6 полями обзора на скважину. Данные показаны как среднее ± SEM. Шкала = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5:Анализ секреции белка-прогенитора печенки. Секрецию альфа-фетопротеина (АФП) и альбумина (АЛБ) анализировали в культурах-прародителях печенки на 10-й день в Н9 и Р109. Данные представляют собой три биологические реплики, а полосы ошибок представляют SD. Секретируемые белки были количественно определены из 24-часовой питательной среды в виде нанограммов секретируемого белка на мл на мг белка, n = 3; ND = не обнаружено. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
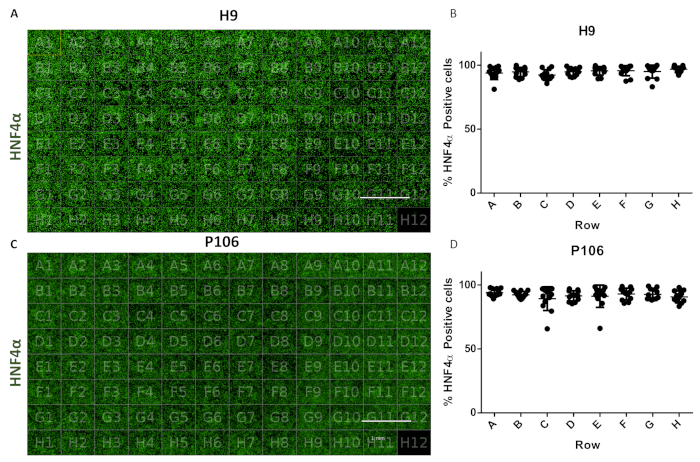
Рисунок 6:Оценка изменчивости скважины к скважине в 96 плитах скважины. (A) Визуализация 96-й пластинчатой пластины печеночных прародителей H9, окрашенных HNF4α. (B) Количественная оценка HNF4α-положительных клеток. Среднее число ячеек на скважину в рядах, от шести полей зрения на скважину, количественно выраженное. Среднее число клеток по всей пластине составило 94,81% ± 0,22 SEM HNF4α-положительных клеток на скважину. Статистически значимых различий между скважинами не наблюдалось. (C)Визуализация 96 листовой пластины скважины печеночных прародителей P106, окрашенных HNF4α. (D)Количественная оценка HNF4α-положительных клеток. Среднее число ячеек на скважину в рядах, от шести полей зрения на скважину и количественное. Среднее число клеток по всей пластине составило 97,7% ± 0,57 SEM HNF4α-положительных клеток на скважину. Статистически значимых различий между строками не наблюдалось. Скважина H12 использовалась в качестве контроля окрашивания иммуноглобулина G (IgG). Шкала = 1 мм. Были использованы односторонние ANOVA с пост-специальными статистическими тестами Туки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Формат пластины | Площадь поверхности (см2) | Ячеек на см2 | Всего ячеек на скважину | Объем дозирования (мл) | Клеточная концентрация (клетки/мл) |
| Плита из 24 скважин | 1.9 | 210526 | 400000 | 0.5 | 800000 |
| 96-скважинная плита | 0.32 | 187500 | 60000 | 0.05 | 1200000 |
Таблица 1:Рекомендуемая плотность ячеек для различных форматов пластин для клеточных линий hPSC, используемых в этом протоколе.
Обсуждение
Генерация печеночных клеток-прародителя из плюрипотентных стволовых клеток в больших масштабах может представлять собой многообещающую альтернативу материалу, полученному из трупов. Стандартизация и воспроизводимость протоколов являются ключом к обеспечению трансляции технологий и воздействия на биомедицинские исследования. Для решения этой проблемы предыдущая работа была сосредоточена на разработке протокола поэтапной дифференциации от hESC и IPSCs с использованием определенных добавок и матриц15,23,24,25,26,27,28. Таким образом, фенотип гепатоцитов и воспроизводимость были улучшены, что позволило полуавтоматизировать процесс дифференцировки19. Представленная система усилена ее сочетанием с готовыми средами клеточных культур и легкой системой дифференцировки гепатоцитов.
Ранее плотность плюрипотентных клеток до начала протокола дифференцировки была выделена в качестве ключевой переменной для достижения однородной популяции печеночных клеток-прогениторов26. Используя эту более совершенную процедуру, можно генерировать большое количество печеночных прародителей, полученных из стволовых клеток, поэтапно, используя диапазон плотностей начальных клеток(таблица 1). На 5-й день окончательная индукция эндодермы была подтверждена окрашиванием Sox17(рисунок 3). Эффективная и надежная дифференциация в окончательную эндодерму была достигнута как с помощью испытанные линии ESC, так и с iPSC, причем более 80% экспрессировали Sox17(рисунок 3). На 10-й день печеночные прародители демонстрировали однородную булыжниковую морфологию, а маркеры стволовых клеток печени были высокообогащены как для AFP, так и для HNF4α (>86%, рисунок 4). Используя комбинацию ручных и полуавтоматических технологий, удалось выполнить дифференциацию в нескольких форматах пластин19.
В своей нынешней форме дифференцировка клеток подходит для экспериментов in vitro. Тем не менее, обогащение клеток, вероятно, потребуется перед клиническим применением, чтобы гарантировать, что однородная популяция печеночных прародителей подготовлена к доставке.
В заключение, протокол, описанный здесь, предоставляет области стандартизированный подход к производству печеночных прародителей в больших масштабах. Будущая работа будет сосредоточена на производстве новой среды для последующей дифференциации, созревания и обслуживания ГХЦ.
Раскрытие информации
Дэвид С. Хей является соучредителем и акционером Stemnovate Ltd. Остальные авторы подтверждают, что у них нет конфликта интересов в предмете или материалах, обсуждаемых в этой статье.
Благодарности
Это исследование было поддержано наградами от MRC Doctoral Training Partnership (MR/K501293/1), Uk Regenerative Medicine Platform (MRC MR/L022974/1 и MR/K026666/1), Главного научного бюро (TCS/16/37).
Материалы
| Name | Company | Catalog Number | Comments |
| DPBS with Calcium and Magnesium | ThermoFisher | 14040133 | |
| Gentle cell dissociation reagent | STEMCELL Technologies | 7174 | |
| Hoechst 33342 Ready Flow Reagent | thermofisher | R37165 | |
| Human Recombinant Laminin 521 | BioLamina | LN521-02 | |
| Human Serum Albumin ELISA | Alpha Diagnostics | 1190 | |
| Human Serum Alpha Fetoprotein ELISA | Alpha Diagnostics | 500 | |
| mTeSR1 medium | STEMCELL Technologies | 5850 | |
| Operetta High-Content Imaging System | PerkinElmer | HH12000000 | |
| PBS, no calcium, no magnesium | ThermoFisher | 14190250 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140122 | |
| Rho-associated kinase (ROCK)inhibitor Y27632 | Sigma-Aldrich | Y0503-1MG | |
| STEMdiff Definitive Endoderm Supplement CJ | STEMCELL Technologies | ||
| STEMdiff Definitive Endoderm Supplement MR | STEMCELL Technologies | ||
| STEMdiff Endoderm Basal Medium | STEMCELL Technologies | ||
| STEMdiff Hepatic Progenitor Medium | STEMCELL Technologies | ||
| TWEEN 20 | Sigma-Aldrich | P9416 | |
| Antibodies | |||
| Albumin | Sigma-Aldrich | A6684 | 1:200 (mouse) |
| Alpha-fetoprotein | Sigma-Aldrich | A8452 | 1:400 (mouse) |
| HNF-4α | Santa Cruz | sc-8987 | 1:400 (rabbit) |
| IgG | DAKO | 1:400 | |
| Sox17 | R&D Systems, Inc. | AF1924 | 1:200 (Goat) |
| Software | |||
| Columbus Image Data Storage and Analysis system | PerkinElmer |
Ссылки
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Szkolnicka, D., Hay, D. C. Concise Review: Advances in Generating Hepatocytes from Pluripotent Stem Cells for Translational Medicine. Stem Cells Dayton Ohio. 34 (6), 1421-1426 (2016).
- Heslop, J. A., Duncan, S. A. The Use of Human Pluripotent Stem Cells for Modeling Liver Development and Disease. Hepatology. 69 (3), 1306-1316 (2019).
- Alwahsh, S. M., Rashidi, H., Hay, D. C. Liver cell therapy: is this the end of the beginning. Cell and Molecular Life Sciences. 75 (8), 1307-1324 (2018).
- Hay, D. C., et al. Efficient differentiation of hepatocytes from human embryonic stem cells exhibiting markers recapitulating liver development in vivo. Stem Cells Dayton Ohio. 26 (4), 894-902 (2008).
- Si-Tayeb, K., et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells. Hepatology. 51 (1), 297-305 (2010).
- Hannan, N. R. F., Segeritz, C. -. P., Touboul, T., Vallier, L. Production of hepatocyte-like cells from human pluripotent stem cells. Nature Protocols. 8 (2), 430-437 (2013).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Meseguer-Ripolles, J., Khetani, S. R., Blanco, J. G., Iredale, M., Hay, D. C. Pluripotent Stem Cell-Derived Human Tissue: Platforms to Evaluate Drug Metabolism and Safety. The AAPS Journal. 20 (1), 20 (2017).
- Si-Tayeb, K., Lemaigre, F. P., Duncan, S. A. Organogenesis and development of the liver. Developmental Cell. 18 (2), 175-189 (2010).
- D'Amour, K. A., et al. Efficient differentiation of human embryonic stem cells to definitive endoderm. Nature Biotechnology. 23 (12), 1534-1541 (2005).
- Shin, D., et al. Bmp and Fgf signaling are essential for liver specification in zebrafish. Development Cambridge England. 134 (11), 2041-2050 (2007).
- DeLaForest, A., et al. HNF4A is essential for specification of hepatic progenitors from human pluripotent stem cells. Development Cambridge England. 138 (19), 4143-4153 (2011).
- Baxter, M., et al. Phenotypic and functional analyses show stem cell-derived hepatocyte-like cells better mimic fetal rather than adult hepatocytes. Journal of Hepatology. 62 (3), 581-589 (2015).
- Cameron, K., et al. Recombinant Laminins Drive the Differentiation and Self-Organization of hESC-Derived Hepatocytes. Stem Cell Reports. 5 (6), 1250-1262 (2015).
- Szkolnicka, D., et al. Reducing Hepatocyte Injury and Necrosis in Response to Paracetamol Using Noncoding RNAs. Stem Cells Translational Medicine. 5 (6), 764-772 (2016).
- Domogatskaya, A., Rodin, S., Boutaud, A., Tryggvason, K. Laminin-511 but Not -332, -111, or -411 Enables Mouse Embryonic Stem Cell Self-Renewal In Vitro. Stem Cells. 26 (11), 2800-2809 (2008).
- Kanninen, L. K., et al. Laminin-511 and laminin-521-based matrices for efficient hepatic specification of human pluripotent stem cells. Biomaterials. 103, 86-100 (2016).
- Meseguer-Ripolles, J., Lucendo-Villarin, B., Wang, Y., Hay, D. C. Semi-automated Production of Hepatocyte Like Cells from Pluripotent Stem Cells. Journal of Visualized Experiments. (137), e57995 (2018).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biology. 7, 100 (2006).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Raven, A., et al. Cholangiocytes act as Facultative Liver Stem Cells during Impaired Hepatocyte Regeneration. Nature. 547 (7663), 350-354 (2017).
- Hay, D. C., et al. Unbiased screening of polymer libraries to define novel substrates for functional hepatocytes with inducible drug metabolism. Stem Cell Research. 6 (2), 92-102 (2011).
- Medine, C. N., et al. Developing High-Fidelity Hepatotoxicity Models from Pluripotent Stem Cells. Stem Cells Translational Medicine. 2 (7), 505-509 (2013).
- Szkolnicka, D., et al. Accurate prediction of drug-induced liver injury using stem cell-derived populations. Stem Cells Translational Medicine. 3 (2), 141-148 (2014).
- Wang, Y., et al. Defined and Scalable Generation of Hepatocyte-like Cells from Human Pluripotent Stem Cells. Journal of Visualized Experiments. (121), e55355 (2017).
- Villarin, B. L., et al. Polymer Supported Directed Differentiation Reveals a Unique Gene Signature Predicting Stable Hepatocyte Performance. Advanced Healthcare Materials. 4 (12), 1820-1825 (2015).
- Wang, Y., et al. Multiomics Analyses of HNF4α Protein Domain Function during Human Pluripotent Stem Cell Differentiation. iScience. 16, 206-217 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены